Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Archivos de la Sociedad Española de Oftalmología
versão impressa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.82 no.1 Jan. 2007
Aplicaciones del suero autólogo en oftalmología
Use of autologous serum in ophthalmic practice
López-García J.S.1, García-Lozano I.2, Rivas L.3, Martínez-Garchitorena J.1
Hospital Central de Cruz Roja. Madrid. España.
1 Doctor en Medicina.
2 Licenciado en Medicina. Instituto de Ciencias Visuales (INCIVI). Madrid.
3 Doctor en Biología. Hospital Ramón y Cajal. Madrid.
Dirección para correspondencia
RESUMEN
Objetivo: Establecer un protocolo razonado para la preparación y manejo de la terapia con suero autólogo en la práctica oftalmológica.
Métodos: Revisión bibliográfica y experiencia personal.
Resultados: La utilización de suero autólogo en colirio ha sido referida por muchos autores como una nueva forma de terapia en el manejo de enfermedades de la superficie ocular. El suero autólogo presenta unas propiedades mecánicas y bioquímicas similares a las de la lágrima, y como ésta contiene componentes como la fibronectina, vitamina A y factores de crecimiento que tienen un efecto epiteliotrófico sobre las células epiteliales de la superficie ocular.
Conclusiones: Los distintos estudios publicados muestran una importante variabilidad tanto en la eficacia de esta terapia como en la metodología de preparación y aplicación.
Palabras clave: Suero autólogo, superficie ocular, ojo seco, epitelio corneal, citología de impresión.
ABSTRACT
Objective: To establish a protocol for the use of autologous serum in the ophthalmic practice.
Methods: Personal experience and a literature review.
Results: The use of autologous serum, in eye drop form, has been reported as a new treatment for several ocular surfaces diseases. These products have biomechanical and biochemical properties similar to normal tears. They contain components such as fibronectin, vitamin A and growth factors that have an epitheliotrophic effect on the ocular surface epithelial cells.
Conclusions: The clinical studies performed showed a variable efficacy, with the preparative process and use of the autologous serum eye drops varying considerably between different studies (Arch Soc Esp Oftalmol 2007; 82: 9-20).
Key words: Autologous serum, ocular surface, dry eye, corneal epithelium, impression cytology.
Introducción
Los efectos beneficiosos de la aplicación de suero autólogo en el tratamiento de pacientes con ojo seco se conoce desde 1984 gracias a los trabajos de Fox et al. (1). Sin embargo, el relativo desconocimiento de su mecanismo de acción, a nivel de la superficie ocular, hizo que su utilización en la práctica clínica fuese muy reducida hasta finales de la última década gracias a los trabajos de Tsubota et al. (2, 3).
La lágrima tiene una gran importancia en la estabilidad y viabilidad del epitelio corneal y conjuntival debido a la interdependencia que existe entre las distintas estructuras que integran la superficie ocular (4). La córnea obtiene sus principales nutrientes (glucosa, electrolitos, etc.) desde el humor acuoso, pero los factores de crecimiento, vitaminas y neuropéptidos responsables de la proliferación, migración y diferenciación de las células del epitelio corneal y conjuntival provienen de la glándula lagrimal y son vertidos a la lágrima (5,6). Además, las lágrimas tienen propiedades antimicrobianas, nutritivas, mecánicas y ópticas (7). En casos de sequedad ocular la toxicidad sobre las células epiteliales está aumentada (8,9), siendo común la presencia de trastornos epiteliales. En estos casos, las lágrimas artificiales por sí solas no son suficientes para promover una adecuada epitelización. Algunos autores han recurrido a distintos procedimientos quirúrgicos para conseguir estimular la producción de lágrimas (10); sin embargo, se suele tratar de técnicas quirúrgicas complejas con frecuentes complicaciones asociadas.
La utilización del suero autólogo en oftalmología viene marcada por la necesidad de encontrar sustitutos lagrimales que, además de humidificar, aporten otros componentes presentes en la lágrima y que se encuentran disminuidos en casos de ojo seco. Con igual finalidad, han sido utilizados el suero fetal bovino y el suero extraído del cordón umbilical (11). Del suero fetal bovino se extraen numerosos factores de crecimiento utilizados para cultivos celulares in vitro (12), además ha sido utilizado para el tratamiento de úlceras corneales en perros (13). En cuanto al suero extraído del cordón umbilical, se piensa que presenta una concentración mayor de factores de crecimiento pero, al igual que con el empleo de suero fetal bovino, hemos de tener en cuenta las posibles alergias así como los riesgos de transmisión de enfermedades infecciosas (11).
En este sentido pensamos que es preferible utilizar fluidos propios como el suero autólogo ya que aporta las mismas ventajas, no existe riesgo de transmisión de enfermedades y además carece de antigenicidad.
Propiedades del suero autólogo
Aunque aún no están totalmente claros los mecanismos finales de actuación del suero autólogo sobre los epitelios oculares (14), cada vez se conoce más sobre ellos. Así, se sabe que contiene algunos componentes implicados en la proliferación, migración y diferenciación de las células epiteliales de la superficie ocular.
Son muchos los componentes del suero que se piensa tienen algún efecto trófico sobre los epitelios de la superficie ocular al actuar sobre la dinámica epitelial modelando la proliferación de células epiteliales del limbo y córnea (15), incluso, en estudios in vitro con células del epitelio conjuntival, se ha demostrado un efecto dosis dependiente del suero autólogo sobre la expresión de mucinas, sobre todo de mucina 1, mediado por receptores para EGF presentes en las células caliciformes (3).
De estos componentes del suero, los que se piensan tienen una mayor importancia son el Factor de Crecimiento Epitelial (EGF), el factor β Transformante del Crecimiento de los Fibroblastos (TGF-β), la vitamina A, la fibronectina, la albúmina, la α2 macroglobulina, el Factor de Crecimiento Derivado de Plaquetas (PDGF-AB), neuropéptidos como la sustancia P y el factor de crecimiento tipo insulina 1. Así, el EGF acelera el proceso de migración de las células epiteliales (16,17), y tiene efectos antiapoptóticos (18,19). Este factor está presente tanto en la secreción lagrimal basal como refleja (20), con una concentración algo inferior a la que presenta en el suero autólogo. El TGF-β está implicado en los procesos de reparación epitelial y estromal (21-24), siendo su concentración en suero casi 3 veces mayor que la encontrada en la lágrima. La vitamina A parece prevenir los procesos de metaplasia escamosa de los epitelios (3). Su concentración en suero es muy superior a la encontrada en la lágrima. Por otro lado, proteínas como la albúmina han demostrado actividad antiapoptótica (25), mientras que la α2 macroglobulina presenta actividad anticolagenasa (26). La fibronectina es uno de los factores más importantes en la migración celular (27,28), siendo su concentración en suero muy superior a la encontrada en la lágrima. Además el suero autólogo contiene factores neuronales como las sustancia P y el factor de crecimiento tipo insulina 1 que parecen estar implicados en la migración y adhesión del epitelio corneal (29). El PDGF-AB es una de las 5 isoformas conocidas de factores de crecimiento derivados de plaquetas. Este factor se activa intracelularmente mientras es secretado por los gránulos alfa de las plaquetas tras su activación y favorece la mitosis y la cicatrización.
Además, el suero autólogo contiene inmunoglobulinas como la IgG, lisozima y factores del complemento que le aportan cierto efecto bactericida y bacterioestático.
En la tabla I se muestra una relación comparada de algunas concentraciones de los principales factores epiteliotróficos encontrados en la lágrima y el suero autólogo (7).
Efectos del suero autólogo
Los efectos del suero autólogo sobre la superficie ocular van a venir determinados por sus numerosas propiedades. En este sentido, el suero presenta unas características muy similares a las de la lágrima en cuanto a pH y osmolaridad. Al igual que ésta, contiene abundantes factores de crecimiento y bactericidas que hacen que el tratamiento con suero autólogo tópico no sólo humidifique la superficie ocular sino que, además, aporta factores nutricionales y de crecimiento, necesarios para mantener la viabilidad celular en los procesos de reparación epitelial, y componentes bactericidas que reducen el riesgo de contaminación e infección (30).
En este sentido, y aunque algunos autores no encuentran diferencias estadísticamente significativas entre el tratamiento con suero autólogo y otras terapias convencionales con lágrimas artificiales o BSS (31,32), la aplicación de suero autólogo supera ampliamente a la terapia sustitutiva con lágrimas artificiales (33). En estudios comparativos realizados con cultivos de células epiteliales, se ha visto que el suero preserva la integridad de las membranas celulares y aumenta los niveles de ATP intracelular más que las lágrimas artificiales (26). Como se ha demostrado previamente en estudios de experimentación, tanto el nivel intracelular de ATP como la estabilidad de las membranas son índices de viabilidad celular (34,35). De igual forma, el suero autólogo ha mostrado un mayor efecto sobre la proliferación celular que el obtenido con las lágrimas artificiales y además incrementa la trascripción de RNA para el Factor de Crecimiento Neuronal así como los receptores del factor de crecimiento transformante beta (36,37).
La terapia con suero autólogo produce un efecto transitorio sobre la superficie epitelial que desaparece una vez que suspendemos su aplicación (33). Los efectos beneficiosos de este tratamiento en los defectos epiteliales persistentes comienzan a notarse a partir de la segunda semana de tratamiento, aunque la mejoría subjetiva de los pacientes empieza prácticamente desde el segundo día (26). En un trabajo nuestro, pendiente de publicación, encontramos como en pacientes con queratopatía por aniridia esta terapia mejoró subjetivamente la clínica de los pacientes hasta el punto de que un 65% de ellos abandonaron la terapia sustitutiva con lágrimas artificiales. De igual forma, en estos pacientes encontramos una mejoría media de casi dos grados de metaplasia escamosa en la citología de impresión corneal. Estos resultados coinciden con los encontrados por Noble et al. (33), estos autores encuentran que el tratamiento con suero autólogo mejora la sintomatología clínica de paciente y el grado de metaplasia conjuntival pero no encuentran efectos estadísticamente significativos sobre la tinción con Rosa de Bengala, Schirmer y aclaramiento de fluoresceína.
Aunque en pacientes con queratopatía por aniridia hemos encontrado un leve efecto beneficioso del suero autólogo en la mejoría de la transparencia corneal y en la regresión de neovasos (resultados no publicados), el mayor efecto con esta terapia se produce a nivel de la epitelización de la superficie ocular, de ahí que su principal aplicación clínica sea en el manejo de trastornos del epitelio corneal.
Con todo no se conoce cuál o cuáles son los factores más beneficiosos ni cuál debe ser, por tanto, la concentración óptima de éstos. Autores como Geerling et al., revisando los resultados publicados en la bibliografía, encuentran que existe una gran variabilidad en cuanto a los efectos del suero autólogo tanto sobre la subjetividad del paciente como sobre la modificación de pruebas como el test de Schirmer, rosa de bengala o el aclaramiento de fluoresceína. Esta diversidad en los resultados puede ser debida a la poca homogeneización de la población estudiada y también por la variabilidad en cuanto al modo de preparación del suero autólogo por los distintos autores (7).
Preparación del suero autólogo
La distribución de productos farmacéuticos es regulada por leyes gubernamentales en la mayoría de los países. En la Unión Europea, y aunque existen unas directrices por parte del Parlamento Europeo, cada país miembro es soberano a la hora de autorizar la comercialización de fármacos. En EEUU, la Food and Drug Administration (FDA) controla la comercialización de los productos farmacéuticos.
Al tratarse de un producto para uso individual, el colirio de suero autólogo no se considera un producto farmacéutico sino una formula magistral y en nuestro país sus normas de elaboración están reguladas por el Real Decreto 175/2001 de 23 de febrero (BOE número 065-2001 de 16/03/2001: 9746-9755).
En otros países como Alemania, el protocolo estándar de preparación sigue las directrices de la guía del Bundesärztekammer (colegio de médicos) y del Instituto Paul Ehrlich para donación y uso de productos hemáticos (7). En Inglaterra y Gales el protocolo estandarizado de preparación sigue los principios recomendados por el Servicio Nacional de la Sangre y la agencia de control de medicamentos de Gran Bretaña y de acuerdo con la guía para predepósito de autodonación de sangre del British Comité for Standard in Haematology (38). En estos protocolos, se aplican los mismos criterios que para la extracción de sangre destinada a donación, es decir, a los pacientes se les realiza un despistaje de enfermedades infecciosas de transmisión parenteral (Sida, hepatitis B y C, sífilis, etc.) de tal forma que si la serología es positiva se excluye al paciente para el tratamiento con suero autólogo al igual que si el paciente presenta anemia o enfermedades cardiovasculares.
Revisando la bibliografía, encontramos como existe una gran variabilidad en la metodología de preparación, almacenaje y dispensación del colirio de suero autólogo. Asimismo, la mayoría de los autores coinciden en la necesidad de unificar criterios mediante estudios randomizados y multicéntricos para optimizar los resultados obtenidos con este tratamiento.
En la preparación del colirio de suero autólogo intervienen los servicios de Hematología (Banco de Sangre) y Farmacia. Mediante venopunción, con tubos de extracción de vacío con gelosa y sin anticoagulante, se extrae sangre al paciente (fig. 1A). La cantidad de sangre extraída varía según los artículos publicados. En nuestro caso extraemos unos 40 cc de sangre que se reparten en cuatro tubos. Posteriormente dejamos los tubos en una rejilla en posición vertical a 22ºC durante unas dos horas para que la sangre coagule. Este tiempo de coagulación varía también según los autores, así los hay que centrifugan la muestra directamente mientras que otros esperan hasta dos días (33). En estudios experimentales realizados en cultivos celulares, se ha visto que un mayor tiempo de coagulación está relacionada con un mayor efecto del suero autólogo sobre la migración y diferenciación de las células epiteliales, recomendando, estos autores, un tiempo de coagulación de al menos dos horas (39). Estos mismos autores encuentran una mayor concentración de todos los factores examinados, siendo significativos para EGF, TGF-β cuando la sangre se dejó en reposo más de dos horas.

Fig. 1. Preparación del suero autológo.
(A) Extracción de sangre mediante venopunción y centrifugación (B)
Una vez coagulada la sangre se procede a su centrifugación para separar el suero del resto de elementos formes (figs. 1 B y C). En este apartado la diversidad en las distintas publicaciones es la norma tanto en la potencia de centrifugación como en el tiempo de ésta. Autores como Tsubota et al. (2), centrifugan durante 5 minutos a 1500 rpm, otros como García et al. centrifugan durante 10 minutos a 5.000 rpm (40), Geerling et al. (7), centrifugan a 3.000 rpm durante 15 minutos, mientras que otros como Malavazzi et al. (32), centrifugan a 1.500 r.p.m durante una hora. En este sentido es importante considerar que la fuerza de centrifugación no sólo depende del número de r.p.m, sino que también depende del diámetro del rotor y éste varía según el tipo de centrifugadora. De esta forma, algunos autores como Poom et al. prefieren hablar de fuerza «g» (26). En este concepto de fuerza «g» se englobaría tanto el número de rpm como el diámetro del rotor, por tanto parece una medida más homogénea y aplicable independientemente del modelo de centrifugadora. En éstas, la fuerza de centrifugación aparece reflejada tanto en una escala en r.p.m como en fuerza «g». El tiempo y la fuerza de centrifugación es importante, así por ejemplo Geerling et al. (7), consideran que a 3.000 rpm durante 15 minutos se produce una cantidad importante de suero y no se produce hemólisis, por el contrario consideran que con menos fuerza de centrifugación o menos tiempo, además de que se consigue menos suero, en este pueden quedar restos de membrana de plaquetas que, si la dosis es lo suficientemente grande, puede producir apoptosis celular. Estos mismos autores comparan sus resultados centrifugando a 4.000 g durante 10 minutos frente a los resultados obtenidos por Tsubota et al. (2), centrifugando a 1.500 rpm durante 5 minutos, y encuentran que ellos obtienen una mayor concentración de EGF pero por el contrario la concentración de TGF-β fue menor. Otros autores como Liu et al. (39), encuentran que aumentando la fuerza de centrifugación de 500 a 3.000 g, aumenta considerablemente en el suero la concentración de EGF y Vitamina A, teniendo esto un efecto menos llamativo sobre el TGF-β.

Fig. 1. Preparación del suero autológo.
(A) Extracción de sangre mediante venopunción y centrifugación (B)
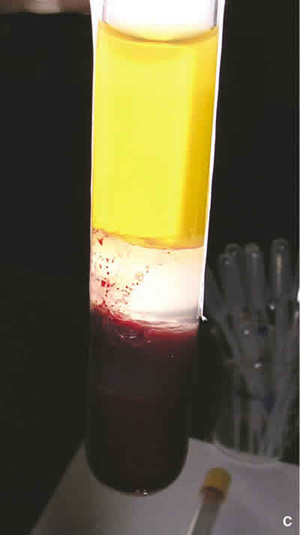
Fig. 1. Preparación del suero autológo. (C) Separación
del suero del resto de elementos formes de la sangre.
En nuestro caso, optamos por una solución intermedia centrifugamos durante 10 minutos a 2.500 rpm que es una velocidad media que no produce lisis y obtenemos unos 5 cc de suero de cada frasco de 10 cc de sangre.
Una vez separado el suero podemos seguir con la preparación del colirio con el suero fresco o almacenarlo en tubos que, protegidos de la luz mediante papel de aluminio y correctamente identificados, se guardan en la nevera a –80ºC hasta su preparación posterior (fig. 1 D). En este paso también existen discrepancias entre los distintos autores. En la mayoría de los casos se prepararan todos los envases de colirio de suero autólogo con suero fresco, dan al paciente el envase o los envases que vayan a utilizar debiéndolos mantener en la nevera a 4ºC y almacenando el resto en nevera a –20ºC o –30ºC (30,33). Algunos estudios demuestran que los componentes del suero autólogo son estables durante un mes a temperaturas de +4ºC y durante tres meses a –20ºC (2). A pesar de esto, autores como Sitaramamma et al. (41), recomiendan guardar las muestras en la nevera mientras no se consuman ya que en algunos fluidos corporales disminuye considerablemente su concentración de proteínas a temperaturas de 4ºC.

Fig. 1. Preparación del suero autológo. (D) Con el suero autólogo
ya separado se puede continuar el proceso de preparación o bien congelarse.
La preparación del colirio se realiza en condiciones asépticas y en una campana de flujo laminar. Tras descongelar la muestra de suero o bien con suero fresco, se separan 2 cc de éste y se introducen, a través de un filtro millipore, en un frasco estéril adaptado para uso oftalmológico. Posteriormente se añaden 8 cc de suero fisiológico para conseguir una concentración final del 20% (figs. 1 E, F y G). El envase se envuelve en papel de aluminio y se identifica con los datos del paciente (fig. 1 H). Al igual que en el resto del proceso, existe gran variabilidad en la bibliografía tanto en la utilización o no de filtros como en la concentración final del producto. La mayoría de los autores no utilizan filtros, sin embargo autores como Fox et al. (1), sí recomiendan el uso de estos filtros para separar del suero autólogo restos de fibrina que parecen reducir los efectos de éste. La utilización de filtros conlleva ventajas importantes como eliminar restos o partículas que estén presentes en el suero y además por el tamaño del poro (0,22 µm) estos filtros añaden un efecto esterilizante no dejando pasar microorganismos como bacterias. Pero por otro lado, estos filtros pueden retener moléculas alterando la composición de este suero. En este sentido, nosotros recomendamos la utilización de filtros millipore como el Durapore® o el Millipore Express. Ambos presentan un poro con un tamaño de 0,22 µm y tienen una baja afinidad por las proteínas, siendo ambos útiles para los volúmenes que manejamos de suero autólogo, sin embargo, el fitro Durapore® se satura y obstruye más fácilmente. El filtro Millipore Express presenta una membrana de poliéster sulfota que la hace especialmente útil para el filtrado de estos productos biológicos. La mayoría de los autores utilizan suero fisiológico para hacer la dilución del suero, sin embargo, autores como Liu et al. encuentran en cultivos de células epiteliales como estas proliferan más cuando la dilución se hace con BSS (39).
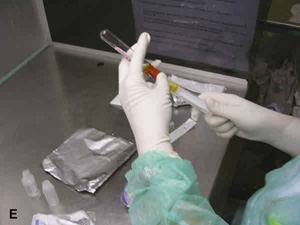

Fig. 1. Preparación del suero autológo. (E). En cámara de flujo laminar
se separan dos cc de suero autólogo y se diluyen con 8 cc de suero fisiológico (F).

Fig. 1. Preparación del suero autológo.
(G). Mezcla final a una concentración del 20%.

Fig. 1. Preparación del suero autológo.(H) Aspecto final
del envase tal y como se da al paciente con sus datos
y protegido de la luz mediante papel de aluminio.
El que se utilice una concentración de suero autólogo del 20% es empírico, de hecho no se han visto diferencias significativas entre la migración de células epiteliales en cultivos in vitro entre preparados al 10 o al 20% (2). Según algunos autores como Poom et al. (26), parece que una mayor concentración tendría más efectos sobre la superficie ocular. Estos autores utilizan concentraciones de 50 y 100%, lo mismo que Noble et al. que lo utilizan al 50% (33). Con todo lo más estandarizado es la utilización del suero autólogo a una concentración del 20% (7). Esta concentración parece suficiente y evita las molestias derivadas de la mayor viscosidad de preparados más concentrados y disminuye considerablemente el número de extracciones de sangre (42).
El colirio de suero autólogo adecuadamente identificado y envuelto en papel de aluminio, que protege el contenido de la luz, se entrega al paciente. Previamente, y tras firmar el consentimiento informado, el paciente es instruido sobre el correcto uso y manejo de estos preparados, sobre todo en lo referente a las medidas de conservación e higiene a la hora de aplicar las instilaciones, así como en la manipulación de estos preparados por otras personas ya que no hemos de olvidar que se trata de fluidos parenterales y por tanto pueden transmitir enfermedades infecciosas. En este sentido, y aunque nosotros no hacemos de forma rutinaria un screening sobre las muestras de sangre, sí es recomendable saber si el paciente presenta alguna enfermedad de transmisión parenteral para desaconsejar el uso de este preparado o en su defecto instruirle sobre los potenciales peligros que de ello se pueden derivar para con terceras personas. Es importante que el colirio esté en la nevera y protegido de la luz ya que algunos de los componentes del suero, como la vitamina A, se degradan fácilmente con la luz. Por otro lado, la correcta utilización del preparado hace que disminuya considerablemente el riesgo de contaminación. Aunque la contaminación de la muestra se puede producir en cualquier momento de la preparación, lo más común es que ésta se produzca por mala manipulación por parte del paciente, de ahí que frecuentemente estas muestras se contaminen sobre todo con S. Epidermidis. Sauer et al. (43), encuentran que un 7,5% de los frascos, conservados a 7ºC, se contaminaron con S. Epidermidis a los 7 días. Al igual que Lagnado et al. (30), no encontraron complicaciones infecciosas importantes en estos pacientes. Algunos autores como Poom et al. (26), utilizan el suero autólogo acompañado de antibióticos como cloranfenicol al 0,5%, sin embargo, otros como Nakamura et al. afirman que el uso de antibióticos reduce los efectos sobre el epitelio del suero autólogo (44).
En cuanto a la aplicación y dispensación de estos colirios varía también según los distintos autores. El número de instilaciones varía desde la aplicación horaria hasta tres veces al día. En cuanto a la dispensación de colirios, algunos autores utilizan un frasco para cada día mientras que otros lo utilizan hasta 10 días (7). En nuestro caso, recomendamos instilaciones cada 3 horas y utilizamos el mismo frasco durante una semana. Se instruye al paciente para que traiga el frasco o los frascos ya utilizados cada vez que viene a consulta para depositarlos en los contenedores de material biocontaminado. No hemos tenido ningún caso de conjuntivitis o infección corneal debida a la aplicación de suero autólogo.
Indicaciones
El suero autólogo ha sido utilizado con mayor o menor éxito en el manejo de numerosas procesos que afectan a la superficie corneal. De entre estos, cabe destacar su aplicación en el tratamiento de:
Defectos epiteliales persistentes (DEP) producidos por diversas etiologías (2,14,45). Podemos definir el DEP como un defecto epitelial que tiene más de 2 mm de diámetro y que dura más de dos semanas sin responder a la terapia convencional con lágrimas, lentes de contacto, etc. Han sido muchas las terapias utilizadas para los DEP entre ellas aporte de lágrimas (46), lentes de contacto terapéuticas (47), tarsorrafia (48), trasplante de membrana amniótica (49), trasplante de limbo (50), fibronectina tópica (51), tetraciclinas (52) o reconstrucción con células epiteliales cultivadas (53). En estos pacientes se ha visto como la terapia con suero autólogo reduce considerablemente la duración de los DEP. Así, el 63% de los DEP tratados con esta terapia curaron en menos de un mes frente a los 7,2 meses de media que tardaron en curar los DEP que fueron tratados con terapia convencional (26). En un trabajo nuestro pendiente de publicación, hemos encontrado como el tratamiento con suero autólogo produjo una mejoría en el 100% de los DEP de nuestra serie, consiguiendo que éstos curasen totalmente en el 70% de los casos tras dos meses de tratamiento.
Ojo seco grave. Ésta fue la primera utilización del suero autólogo en oftalmología (1), habiéndose utilizado también por otros autores posteriormente (3,26). Casi todos los autores reportan una mejoría subjetiva considerable tras sólo 48 horas después de iniciar el tratamiento. Tsubota et al., encuentran una mejoría rápida de los síntomas y de las tinciones con rosa de bengala, fluoresceína y test de Schirmer, y un empeoramiento progresivo de éstos unas 4 semanas después de suspender la aplicación (3). Resultados similares refieren autores como Poom et al. (26). En casos de ojo seco se ha especulado con la posibilidad de que los efectos sean dosis dependientes, así se han encontrado más beneficios en pautas de dosificación que aplicaban gotas 8 veces al día frente a 4 veces al día. En un estudio nuestro realizado en pacientes con ojo seco de diversa gravedad, encontramos como la aplicación de suero autólogo mejoró una media de 3 mm el test de Schirmer y de 4 segundos el BUT. De igual forma mejoró la tinción con fluoresceína y rosa de Bengala, así como la estabilidad de la película lagrimal.
Manejo de la queratopatía neurotrófica (54,55). En el tratamiento de la queratopatía neurotrófica, autores como Matsumoto et al., 2004, encuentran como el defecto epitelial cicatrizó completamente en unos 17,1DS8,0 días, mejorando la sensibilidad de la córnea determinada mediante un estesiometro de Cochet-Bonnet pasando de 11,8DS11,6 mm antes del tratamiento a 30,0DS22,9 mm después del tratamiento (55).
Erosiones corneales recurrentes. En estos pacientes se ha visto como la aplicación de suero autólogo disminuye la tasa de recurrencias (56). En un trabajo nuestro, encontramos como la tasa de recurrencia de erosiones corneales disminuyó en un 87,5% en pacientes tratados con suero autólogo en relación a estos mismo pacientes cuando fueron tratados con terapia convencional mediante lágrimas artificiales.
En ocasiones la aplicación de suero autólogo se ha asociado a cirugías de reconstrucción de la superficie ocular como Trasplante de limbo, trasplante de membrana amniótica, queratopatía penetrante en pacientes con síndrome de Stevens-Johnson o penfigoide ocular cicatricial, contribuyendo a mejorar la estabilidad del epitelio corneal (57).
También ha sido utilizado en el manejo del ojo seco asociado a enfermedad injerto contra huésped (2,58). En estos pacientes se encuentra una mejoría clínica subjetiva muy rápida siendo algo más lenta la desaparición de signos como la queratopatía punteada (59). Asimismo, se ha utilizado como terapia asociada en el tratamiento de la úlcera de Mooren (1) y de la queratoconjuntivitis límbica superior, en la que algunos autores han encontrado una respuesta adecuada al tratamiento en más del 80% de los pacientes (60).
El suero autólogo ha sido también utilizado en clínica para la aplicación sobre puntos de fuga en ampollas de filtración (61), en el tratamiento de agujeros maculares de espesor completo, ya sea aplicado sobre el agujero macular o bien usado en el suero de irrigación para limpiar el verde de indocianina usado para visualizar la membrana limitante interna en la cirugía de agujero macular (62,63), desgarros retinianos (64), en asociación con concentrados de plaquetas se ha utilizado en modelos experimentales de cicatrización retiniana (65).
Nosotros estamos empleando suero autólogo en el manejo de la queratopatía cálcica como terapia de apoyo a los quelantes del calcio. Aunque llevamos pocos casos en nuestro estudio, sí parece que su aplicación tópica disminuye la intensidad de la placa de calcio, apareciendo más espacios traslúcidos sobre ésta y observándose una regresión franca en algunos pacientes. También lo hemos empleado en el postoperatorio tras la extracción quirúrgica de las placas de calcio. De igual forma, estamos empleando suero autólogo en el postoperatorio de pacientes con pterigion. En estos pacientes hemos encontrado que la aplicación de éste durante un mes tras la extirpación del pterigion reduce la tasa de recidivas y los pacientes refieren una importante mejoría sintomática con su utilización. Asimismo, hemos utilizado suero autólogo en el tratamiento de la queratopatía asociada a la aniridia. El 95% de los pacientes presentó una mejoría clínica significativa tras el tratamiento con suero autólogo en relación a terapias previas con lágrimas artificiales. La metaplasia escamosa mejoró unos dos grados de media en todos los niveles de gravedad e independientemente de la gravedad de la queratopatía. El suero autólogo favoreció la epitelización y la estabilidad de la película lagrimal en un 92% de los pacientes, presentando pocos efectos sobre la regresión de neovasos y sobre la transparencia corneal. Estas características hacen especialmente útil el tratamiento con este preparado en los casos de queratopatia leve y moderada. En casos graves de queratopatía asociada a la aniridia, podemos emplearlo como complemento a otros procedimientos terapéuticos como el trasplante de limbo.
Discusión
Podemos concluir diciendo que el tratamiento con suero autólogo es un método eficaz para estimular la viabilidad de las células del epitelio corneal y conjuntival al aportar una serie de factores de crecimiento deficitarios por la sequedad ocular que acompaña a la mayoría de procesos que cursan con defectos epiteliales o trastornos en la epitelización corneal. En este sentido, y aunque algunos autores no encuentren diferencias estadísticamente significativas al comparar este tratamiento con la terapia convencional (31), para la mayoría de los autores, la aplicación de suero autólogo supera ampliamente a la terapia sustitutiva con lágrimas artificiales (33). Incluso, ambos tratamientos pueden suplementarse, reduciendo en este caso la dependencia de las lágrimas artificiales (26).
Por otro lado, su preparación no presenta especiales dificultades técnicas y sale relativamente barato ya que normalmente se dispone en el hospital de los útiles necesarios para su elaboración como la centrifugadora, la campana de flujo laminar etc (7). Además, el hecho de que sea un tratamiento bien tolerado por el paciente nos invita a su cada vez más frecuente utilización.
El principal inconveniente son las frecuentes extracciones de sangre, sobre todo en aquellos grupos que utilizan grandes concentraciones. En estos casos hay que ser cuidadoso ya que no todos los pacientes pueden ser tratados por sus dificultades sistémicas e incluso, en ocasiones, es preciso aportar un suplemento de sulfato ferroso para prevenir la anemia (33).
Aunque se han descrito algunas complicaciones como el depósito de inmunoglobulinas en la córnea y la presencia de infiltrados periféricos corneales en una paciente con artritis reumatoide (66,26), el tratamiento con suero autólogo es muy bien tolerado y tampoco se han descrito efectos adversos cuando éste se utiliza durante largos períodos de tiempo (30). Aunque es muy poco común, algunos pacientes pueden presentar un aumento del disconfort, epiteliopatía leve, conjuntivitis bacteriana o eccema de los párpados como se ha descrito en ocasiones (58,59), pero en estos casos, las complicaciones no tienen porqué deberse a este tratamiento. Aunque es excepcional, Eberle et al. (67), describen el caso de una infección por SIDA transmitida por gotas de suero autólogo. En este sentido, hemos de insistir que este preparado es un fluido corporal y por tanto susceptible de transmitir infecciones, por ello, hemos de realizar a todos los pacientes un despistaje de enfermedades infecciosas e insistir en el correcto uso y manipulación de estos colirios tanto por ellos como por terceras personas.
Como retos para el futuro, y con el fin de evitar las frecuentes extracciones de sangre, se está trabajando en varios campos como utilización de nuevas moléculas para vehiculizar el suero autólogo que permitan una mejor biodisponibilidad del producto, utilización de filtros o conseguir una lágrima universal enriquecida. En este sentido, han habido intentos de crear sustitutos lagrimales lo más perfectos posibles pero estos han ido más dirigidos a la composición iónica y mecánica de la lágrima que a aportar otros componentes de ésta especialmente importantes para el buen funcionamiento de los epitelios de la superficie ocular (68,69). También han fallado en la práctica clínica habitual el uso de componentes aislados como fibronectina, vitaminas o EGF (51, 70).
Bibliografía
1. Fox RI, Chan R, Michelson JB, Belmont JB, Michelson PE. Beneficial effect of artificial tears made with autologous serum in patients with keratoconjunctivitis sicca. Arthritis Rheum 1984; 27: 459-461. [ Links ]
2. Tsubota K, Goto E, Shimmura S, Shimazaki J. Treatment of persistent corneal epithelial defect by autologous serum application. Ophthalmolgy 1999; 106: 1984-1989. [ Links ]
3. Tsubota K, Goto E, Fujita H, Ono M, Inoue H, Saito I, et al. Treatment of dry eye by autologous serum aplicattion in Sjogren`s syndrome. Br J Ophthalmol 1999; 83: 390-395. [ Links ]
4. Tseng SC, Tsubota K. Important concepts for treating ocular surface and tear disorders. Am J Ophthalmol 1997; 124: 825-835. [ Links ]
5. Wilson SE, Liang Q, Kim WJ. Lacrimal gland HGF, KGF and EGF mRNA levels increase after corneal epithelial wounding. Invest Ophthalmol Vis Sci 1999; 40: 2185-2190. [ Links ]
6. Barton K, Nava A, Monroy DC, Pflugfelder SC. Cytokines and tear function in ocular surface disease. Adv Exp Med Biol 1998; 438: 461-469. [ Links ]
7. Geerling G, Maclennan S, Hartwig D. Autologous serum eye drops for ocular surface disorders. Br J Ophthalmol 2004; 88: 1467-1474. [ Links ]
8. Gobbels M, Spitznas M. Corneal epithelial permeability of dry eyes before and after treatment with artificial tears. Ophthalmology 1992; 99: 873-878. [ Links ]
9. Burstein NL. The effects of topical drugs and preservatives on the tears and corneal epithelium in dry eye. Trans Ophthalmol Soc UK 1985; 104: 402-409. [ Links ]
10. Geerling G, Sieg P, Meyer C, Bastian GO, Laqua H. Transplantation of autologous submandibular glands in very severe keratoconjunctivitis sicca. 2 year outcome. Ophthalmologe 1998; 95: 257-265. [ Links ]
11. Vajpayee RB, Mukerji N, Tandon R, Sharma N, Pandey RM, Biswas NR, et al. Evaluation of umbilical cord serum therapy for persistent corneal epithelial defects. Br J Ophthalmol 2003; 87: 1312-1316. [ Links ]
12. Borderie VM, Mourra N, Laroche L. Influence of fetal calf serum, fibroblast growth factors, and hepatocyte growth factor on three-dimensional cultures of human keratocytes in collagen gel matrix. Graefes Arch Clin Exp Ophthalmol 1999; 237: 861-869. [ Links ]
13. Kirschner SE. Persistent corneal ulcers. What to do when ulcers won´t heal. Vet Clin North Am Small Anim Pract 1990; 20: 627-642. [ Links ]
14. Alvarado Valero MC, Martinez Toldos JJ, Borras Blasco J, Alminana Alminana A, Perez Ramos JM. Tratamiento de defectos epiteliales persistentes mediante suero autólogo. Arch Soc Esp Oftalmol 2004; 79: 537-542. [ Links ]
15. Kruse FE, Tseng SC. Serum differentially modulates the clonal growth and differentiation of cultured limbal and corneal epithelium. Invest Ophthalmol Vis Sci 1993; 34: 2976-2989. [ Links ]
16. van Setten GB, Tervo T, Tervo K, Tarkkanen A. Epidermal growth factor (EGF) in ocular fluids: presence, origin and therapeutical considerations. Acta Ophthalmol Suppl 1992; 202: 54-59. [ Links ]
17. Pastor JC, Calonge M. Epidermal growth factor and corneal wound healing. A multicenter study. Cornea 1992; 11: 311-314. [ Links ]
18. Collins MK, Perkins GR, Rodriguez-Tarduchy G, Nieto MA, Lopez-Rivas A. Growth factors as survival factors : regulation of apoptosis. Bioessays 1994; 16: 133-138. [ Links ]
19. Rodeck U, Jost M, Kari C, Shih DT, Lavker RM, Ewert DL, et al. EGF-R dependent regulation of keratinocyte survival. J Cell Sci 1997; 110: 113-121. [ Links ]
20. Ohashi Y, Motokura M, Kinoshita Y, Mano T, Watanabe H, Kinoshita S, et al. Presence of epidermal growth factor in human tears. Invest Ophthalmol Vis Sci 1989; 30: 1879-1882. [ Links ]
21. Gupta A, Monroy D, Ji Z, Yoshino K, Huang A, Pflugfelder SC. Transforming growth factor beta-1 and beta-2 in human tear fluid. Curr Eye Res 1996; 15: 605-614. [ Links ]
22. Fredj-Reygrobellet D, Plouet J, Delayre T, Baudouin C, Bourret F, Lapalus P. Effects of aFGF and bFGF on wound healing in rabbit corneas. Curr Eye Res 1987; 6: 1205-1209. [ Links ]
23. Yoshino K, Garg R, Monroy D, Ji Z, Pflugfelder SC. Production and secretion of transforming growth factor beta (TGF-beta) by the human lacrimal gland. Curr Eye Res 1996; 15: 615-624. [ Links ]
24. Wilson SE, Lloyd SA, Kennedy RH. Basic fibroblast growth factor (FGFb) and epidermal growth factor (EGF) receptor messenger RNA production in human lacrimal gland. Invest Ophthalmol Vis Sci 1991; 32: 2816-2820. [ Links ]
25. Shimmura S, Ueno R, Matsumoto Y, Goto E, Higuchi A, Shimazaki J, et al. Albumin as a tear supplement in the treatment of severe dry eye. Br J Ophthalmol 2003; 87: 1279-1283. [ Links ]
26. Poon AC, Geerling G, Dart JK, Fraenkel GE, Daniels JT. Autologous serum eyedrops for dry eyes and epithelial defects: clinical and in vitro toxicity studies. Br J Ophthalmol 2001; 85: 1188-1197. [ Links ]
27. Nishida T, Ohashi Y, Awata T, Manabe R. Fibronectin. A new therapy for corneal trophic ulcer. Arch Ophthalmol 1983; 101:1046-1048. [ Links ]
28. Phan TM, Foster CS, Shaw CD, Zagachin LM, Colvin RB. Topical fibronectin in an alkali burn model of corenal ulceration in rabbits. Arch Ophthalmol 1991; 109: 414-419. [ Links ]
29. Nishida T, Nakamura M, Ofuji K, Reid TW, Mannis MJ, Murphy CJ. Synergistic effects of substance P with insulin-like growth factor-1 on epithelial migration of the cornea. J Cell Physiol 1996; 169: 159-166. [ Links ]
30. Lagnado R, King AJ, Donald F, Dua HS. A protocol for low contamination risk of autologous serum drops in the management of ocular surface disorders. Br J Ophthalmol 2004; 88: 464-465. [ Links ]
31. Tananuvat N, Daniell M, Sullivan LJ, Yi Q, McKelvie P, McCarty DJ, et al. Controlled study of the use of autologous serum in dry eye patients. Cornea 2001; 20: 802-806. [ Links ]
32. Malavazzi GR, Lake JC, Dantas PE. Effect of honey and autologous serum on corneal epithelial healing in rabbits. Arq Bras Oftalmol 2005; 68: 347-351. [ Links ]
33. Noble BA, Loh RS, MacLennan S, Pesudovs K, Reynols A, Bridges LR, et al. Comparison of autologous serum eye drops with conventional therapy in a randomised controlled crossover trial for ocular surface disease. Br J Ophthalmol 2004; 88: 647-652. [ Links ]
34. Pasternak AS, Miller WM. First-order toxicity assays for eye irritation using cell lines: parameters that affect in vitro evaluation. Fundam Appl Toxicol 1995; 25: 253-263. [ Links ]
35. Wang XM, Terasaki PI, Rankin GW jr, Chia D, Zhong HP, Haardy S. A new microcellular cytotoxicity test based on calcein AM release. Hum Immunol 1993; 37: 264-270. [ Links ]
36. Geerling G, Daniels JT, Dart JK, Cree IA, Khaw PT. Toxicity of natural tear substitutes in a fully defined culture model of human corneal epithelial cells. Invest Ophthalmol Vis Sci 2001; 42: 948-956. [ Links ]
37. You L, Ebner S, Kruse FE. Glial cell-derived neurotrophic factor (GDNF)-induced migration and signal transduction in corneal epithelial cells. Invest Ophthalmol Vis Sci 2001; 42: 2496-2504. [ Links ]
38. Voak D, Cann R, Finney RD, Fraser ID, Mitchell R, Murphy MF, et al. Guidelines for administration of blood products: transfusion of infants and neonates. British Committee for Standards in Haematology Blood Transfusion Task Force. Transfus Med 1994; 4: 63-69. [ Links ]
39. Liu L, Hartwig D, Harloff S, Herminghaus P, Wedel T, Geerling G. An optimised protocol for the production of autologous serum eyedrops. Graefes Arch Clin Exp Ophthalmol 2005; 243: 706-714. [ Links ]
40. Garcia Jimenez V, Veiga Villaverde B, Baamonde Arbaiza B, Cahue Carpintero I, Celemin Vinuela ML, Simo Martinez RM. The elaboration, use and evaluation of eye-drops with autologous serum in corneal lesions. Farm Hosp 2003; 27: 21-25. [ Links ]
41. Sitaramamma T, Shivaji S, Rao GN. Effect of storage on protein concentration of tear samples. Curr Eye Res 1998; 17: 1027-1035. [ Links ]
42. Mukerji N, Sinha R, Vajpayee RB. Role of autologous serum in persistent epithelial defects. Br J Ophthalmol 2002; 86: 832. [ Links ]
43. Sauer R, Bluthner K, Seitz B. Sterility of non-preserved autologous serum drops for treatment of persistent corneal epithelial defects. Ophthalmologe 2004; 101: 705-709. [ Links ]
44. Nakamura M, Nishida T, Mishima H, Otori T. Effects of antimicrobials on corneal epithelial migration. Curr Eye Res 1993; 12: 733-740. [ Links ]
45. Young AL, Cheng AC, Ng HK, Cheng LL, Leung GY, Lam DS. The use of autologuos serum tears in persistent corneal epithelial defects. Eye 2004; 18: 609-614. [ Links ]
46. Pfister RR. Clinical measures to promote corneal epithelial healing. Acta Ophthalmol Suppl 1992; 202: 73-83. [ Links ]
47. Ali Z, Insler MS. A comparison of therapeutic bandage lenses, tarsorrhaphy, and antibiotic and hypertonic saline on corneal epithelial wound healing. Ann Ophthalmol 1986; 18: 22-24. [ Links ]
48. Panda A, Pushker N, Bageshwar LM. Lateral tarsorrhaphy: is it preferable to patching? Cornea 1999; 18: 299-301. [ Links ]
49. Azuara-Blanco A, Pillai CT, Dua HS. Amniotic membrane transplantation for ocular surface reconstruction. Br J Ophthalmol 1999; 83: 399-402. [ Links ]
50. Tan DT, Ficker LA, Buckley RJ. Limbal transplantation. Ophthalmology 1996; 103: 29-36. [ Links ]
51. Gordon JF, Johnson P, Musch DC. Topical fibronectin ophthalmic solution in the treatment of persistent defects of the corneal epithelium. Chiron Vision Fibronectin Study Group. Am J Ophthalmol 1995; 119: 281-287. [ Links ]
52. Ralph RA. Tetracyclines and the treatment of corneal stromal ulceration: a review. Cornea 2000; 19: 274-277. [ Links ]
53. Pellegrini G, Traverso CE, Franzi AT, Zingirian M, Cancedda R, De Luca M. Long-term restoration of damaged corneal surfaces with autologous cultivated corneal epithelium. Lancet 1997; 349: 990-993. [ Links ]
54. Díaz-Valle D, Benítez del Castillo Sánchez JM, Díaz Rodríguez E, Toledano Fernández N, Arteaga Sánchez A, Sayagues Gómez O. Manejo de la queratopatía neurotrófica mediante tarsorrafia con cianoacrilato y suero autólogo. Arch Soc Esp Oftalmol 2003; 78: 119-122. [ Links ]
55. Matsumoto Y, Dogru M, Goto E, Ohashi Y, Kojima T, Ishida R, Tsubota K. Autologous serum application in the treatment of neurotrophic keratopathy. Ophthalmology 2004; 111: 1115-1120. [ Links ]
56. del Castillo JM, de la Casa JM, Sardina RC, Fernandez RM, Feijoo JG, Gomez AC, et al. Treatment of recurrent corneal erosions using autologous serum. Cornea 2002; 21: 781-783. [ Links ]
57. Tsubota K, Satake Y, Ohyama M, Toda I, Takano Y, Ono M, et al. Surgical reconstruction of the ocular surface in advanced ocular cicatricial pemphigoid and Stevens-Johnson syndrome. Am J Ophthalmol 1996; 122: 38-52. [ Links ]
58. Ogawa Y, Okamoto S, Mori T, Yamada M, Mashima Y, Watanabe R, et al. Autologous serum eye drops for the treatment of severe dry eye in patients with chronic graft-versus-host disease. Bone Marrow Transplant 2003; 31: 579-583. [ Links ]
59. Rocha EM, Pelegrino FS, de Paiva CS, Vigorito AC, de Souza CA. GVDH dry eyes treated with autologous serum tears. Bone Marrow Transplant 2000; 25: 1101-1103. [ Links ]
60. Goto E, Shimmura S, Shimazaki J, Tsubota K. Treatment of superior limbic keratoconjunctivitis by application of autologous serum. Cornea 2001; 20: 807-810. [ Links ]
61. Matsuo H, Tomidokoro A, Tomita G, Araie M. Topical application of autologous serum for the treatment of late-onset aqueous oozing or point-leak through filtering bleb. Eye 2005; 19: 23-28. [ Links ]
62. Liggett PE, Skolik DS, Horio B, Saito Y, Alfaro V, Mieler W. Human autologous serum for the treatment of full-thickness macular holes. A preliminary study. Ophthalmology 1995; 102: 1071-1076. [ Links ]
63. Nakamura H, Hayakawa K, Sawaguchi S, Gaja T. Removal of retinal indocyanine green dye by autologous serum irrigation in macular hole surgery. Retina 2005; 25: 736-741. [ Links ]
64. Christmas NJ, Skolik SA, Howard MA, Saito Y, Barnstable CJ, Liggett PE. Treatment of retinal breaks with autologous serum in an experimental model. Ophthalmology 1995; 102: 263-271. [ Links ]
65. Cullinane AB, O´Callaghan P, McDermott K, Keohane C, Cleary PE. Effects of autologous platelet concentrate and serum on retinal wound healing in an animal model. Graefes Arch Clin Exp Ophthalmol 2002; 240: 35-41. [ Links ]
66. McDonnell PJ, Schanzlin DJ, Rao NA. Immunoglobulin deposition in the cornea after application of autologous serum. Arch Ophthalmol 1988; 106:1423-1425. [ Links ]
67. Eberle J, Habermann J, Gurtler LG. HIV-1 infection transmitted by serum droplets into the eye: a case report. AIDS 2000; 14: 206-207. [ Links ]
68. Yokoi N, Komuro A, Nishida K, Kinoshita S. Effectiveness of hyaluronan on corneal epithelial barrier function in dry eye. Br J Ophthalmol 1997; 81: 533-536. [ Links ]
69. Nelson JD, Drake MM, Brewer JT Jr, Tuley M. Evaluation of a physiological tear substitute in patients with keratoconjunctivitis sicca. Adv Exp Med Biol 1994; 350: 453-457. [ Links ]
70. Nelson JD, Gordon JF. Topical fibronectin in the treatment of keratoconjunctivitis sicca. Chiron Keratoconjunctivitis Sicca Study Group. Am J Ophthalmol 1992; 114: 441-447. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
J.S. López García
Servicio de Oftalmología
Hospital Central de Cruz Roja
Avenida Reina Victoria, 26
28003 Madrid
España
E-mail: docsantilopez@hotmail.com
Recibido: 3/1/06.
Aceptado: 18/12/06.















