Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.85 no.5 may. 2010
Comparación de tres instrumentos de tomografía de coherencia óptica, un time-domain y dos Fourier-domain, en la estimación del grosor de la capa de fibras nerviosas de la retina
Comparison of three optical coherence tomography devices, one time-domain and two fourier-domain, for the estimation of the retinal nerve fibre layer thickness
B. Sánchez-Dalmau, V. Llorenç, S. Ortiz y L. Martínez
Unidad de Neuro-Oftalmología, Hospital Clínic i Provincial de Barcelona, Institut Clínic d´Oftalmologia (ICOF), Barcelona, España
Dirección para correspondencia
RESUMEN
Objetivo: Determinar la concordancia entre un sistema de tomografía de coherencia óptica (TCO) time-domain (Stratus) y dos sistemas de TCO Fourier-domain (Cirrus y 3D TCO-1000) en la determinación del grosor de la capa de fibras nerviosas de la retina (CFNR).
Métodos: Se incluyeron 50 ojos de 25 pacientes con patología neurooftalmológica de la vía visual aferente. A todos los pacientes se les realizó en ambos ojos, el mismo día y por el mismo operario, un triple examen de TCO de la CFNR con Stratus, Cirrus y 3D TCO-1000. El grosor medio de la CFNR global, por cuadrantes y por sectores horarios fueron comparados mediante el coeficiente de concordancia de Lin (CCC) y figuras de Bland-Altman.
Resultados: El grosor de la CFNR global, de los cuadrantes temporal y nasal y de los sectores horarios correspondientes estimado mediante 3D TCO-1000 fue el más alto (global, 90,02 µm), en cambio, el grosor de la CFNR en los cuadrantes superior e inferior y en los sectores horarios correspondientes fue mayor con Stratus. El CCC entre Stratus y Cirrus fue alto (0,820), en cambio, la concordancia entre Stratus y 3D TCO-1000 fue moderada globalmente (0,573) y entre Cirrus y 3D TCO-1000 resultó moderada de forma global (0,564), pero muy baja en los cuadrantes nasal y temporal (0,362 y 0,347 respectivamente).
Conclusiones: Los espesores medios de la CFNR obtenidos mediante los TCO Stratus, Cirrus y 3D TCO-1000 no son equivalentes. Aunque la concordancia entre Stratus y Cirrus es alta, entre 3D TCO-1000 y Stratus o Cirrus es muy baja.
Palabras clave: Tomografía de coherencia óptica TCO. Time-domain TCO. Fourier-domain TCO. Retina. Nervio óptico. Capa de fibras nerviosas de la retina CFNR. Neuropatía óptica.
ABSTRACT
Purpose: To assess agreement between one system of time-domain optical coherence tomography (OCT) (Stratus) and two systems of fourier-domain OCT (Cirrus and 3D OCT-1000) for the measurement of the retinal nerve fibre layer thickness (RNFL).
Methods: Fifty eyes from 25 patients with neuro-ophthalmological disorders of the afferent visual pathway were included. A triple RNFL thickness OCT examination with Stratus, Cirrus and 3D OCT-1000 was performed on both eyes of every patient, on the same day and by the same technician. The average RNFL thickness by quadrants and clock sectors were compared with the Lin´s concordance correlation coefficient (CCC) and Bland-Altman plots.
Results: The average RNFL thickness, the temporal and nasal quadrants and corresponding clock sectors, was higher by 3D OCT-1000 (mean 90.02 microns), nevertheless, RNFL thickness of the superior and inferior quadrants and corresponding clock hours was higher when measured by Stratus device. The CCC agreement between Stratus and Cirrus was high (0.820), between Stratus and 3D OCT-1000 was moderate (mean 0.573) and between Cirrus and 3D OCT-1000 was moderate with a mean of 0.564 but too low in the nasal and temporal quadrants (0.362 and 0.347 respectively).
Conclusions: The RNFL thickness measurements by Stratus, Cirrus and 3D OCT-1000 OCT are not equivalent. Although the agreement between Stratus and Cirrus was high, it was too low between 3D OCT-1000 and Stratus or Cirrus.
Key words: Optical coherence tomography OCT. Time-Domain OCT. Fourier-Domain OCT. Retina. Optic nerve. Retinal nerve fibre layer RNFL. Optic neuropathy.
Introducción
La tomografía de coherencia óptica (TCO) es una herramienta no invasiva de alta resolución que nos permite acceder directamente a la retina, como apéndice del sistema nervioso central. Podemos medir el grosor de la capa de fibras nerviosas (CFNR) peripapilares, parámetro que se ha demostrado reproducible y útil para el diagnóstico, pronóstico y seguimiento de la patología del nervio óptico1.
La TCO es una tecnología capaz de medir el tiempo de retraso y la intensidad de la luz reflejada desde las distintas microestructuras que atraviesa. Mediante un interferómetro se compara la luz reflejada desde un espejo de referencia y desde las estructuras oculares en cuestión. Cuando la luz reflejada desde estas estructuras ha recorrido exactamente la misma distancia, se produce la interferencia y la medición por parte del interferómetro. Esto proporciona información sobre la distancia recorrida y la densidad de las estructuras desde donde se refleja y crea una imagen seccional de la retina.
La TCO tipo time-domain (TD-TCO Stratus; Carl Zeiss Meditec, Inc., Dublin, California, EE.UU.) utiliza un láser de 800 nm para explorar un solo punto en un tiempo (400 escáneres axiales por segundo) con una resolución de 10 µm, por lo que tarda cierto tiempo en obtener la imagen seccional del tejido que atraviesa; es prácticamente imposible obtener una imagen tridimensional.
En la TCO tipo spectral-domain (SD-TCO) en cambio, los haces luminosos que regresan desde el tejido y desde el espejo de referencia se combinan en el detector, un espectrómetro resuelve las interferencias de las diferentes profundidades simultáneamente, usando una transformación de Fourier. Esta tecnología permite al SD-TCO obtener imágenes de la retina unas 50 veces más rápido que el TD-TCO (18.000-27.000 escáneres axiales por segundo). Esta mayor rapidez del SD-TCO permite obtener imágenes tridimensionales con una superficie mayor de escaneo, asegurando que el área problema queda incluida. Tanto SD-TCO Cirrus (Carl Zeiss Meditec, Inc., Dublín, California, EE.UU.) como 3D TCO-1000 (Topcon, Inc., Tokio, Japón) utilizan la tecnología spectral-domain2.
Diferentes fabricantes de aparatos de TCO han puesto esta tecnología al alcance de la mayoría de centros oftalmológicos que, en muchas ocasiones, sustituyen unos aparatos por otros más sofisticados. Por otra parte, es frecuente que los pacientes con determinada patología neurooftalmológica sean remitidos a centros de referencia en los que las exploraciones de TCO se repiten con un aparato diferente del del centro remitente.
El objetivo de este trabajo es determinar el grado de concordancia de tres instrumentos distintos: Stratus, Cirrus y 3D TCO-1000 en la determinación del grosor de la CFNR peripapilar de pacientes con patología del nervio óptico.
Sujetos, material y métodos
En este estudio de tipo observacional, transversal y comparativo, se incluyeron un total de 50 ojos de 25 pacientes de los cuales, nueve presentaban síndrome quiasmático; cinco, glaucoma; tres, neuropatía óptica isquémica anterior; tres, esclerosis múltiple; dos, neuropatía óptica hereditaria de Leber; dos, neuropatía óptica compresiva, y un paciente, drusas del nervio óptico. La edad media de los pacientes fue de 53 años (rango de 26 a 79 años). Fueron excluidos aquellos ojos/pacientes con errores refractivos superiores a 6 dioptrías (D) esféricas o 3 D de cilindro y/o con dificultad de fijación.
Los pacientes se reclutaron en la consulta de neurooftalmología del Institut Clínic d´Oftalmologia (ICOF) del Hospital Clínic i Provincial de Barcelona (España) a lo largo de 3 meses (de marzo a mayo de 2009). A cada paciente se le realizó, además de las exploraciones pertinentes, una triple exploración con Stratus, Cirrus y 3D TCO-1000 en cada ojo, por el mismo técnico y en el mismo día. El número de técnicos que realizó la triple prueba fue de seis. Todo el personal tenía amplia experiencia y estaba acreditado para el manejo de esta tecnología. Los protocolos utilizados fueron Fast RNFL Thickness para Stratus, Optic Disc Cube 200 × 200 para Cirrus y 3D 6 × 6 mm 512 × 128 para 3D TCO-1000.
Todos los pacientes dieron su consentimiento informado. Los procedimientos siguieron las normas de la declaración de Helsinki de 1983 y el protocolo de actuación fue aprobado por el comité ético del Hospital Clínic i Provincial de Barcelona.
Examen con Time-domain TCO
Para el TD-TCO (Stratus TCO, Carl Zeiss Meditec, Inc, Dublín, California, EE.UU.), se utilizó la versión 4.0.1 del software y el protocolo Fast RNFL Thickness. Consiste en tres sub-A-scans sucesivos circulares alrededor del disco óptico con 3,4 mm de diámetro y con 256 puntos de medición por revolución, con un tiempo total de 1,92 segundos. Posteriormente se obtiene la media de los 3 sub-A-scans circulares (768 A-scans en un círculo de 3,4 mm de diámetro alrededor del disco) y se utiliza como valor conjunto.
El análisis de la CFNR utiliza un algoritmo computarizado para identificar los márgenes anterior y posterior de la banda de reflectancia que representa la CFNR, y marca estos márgenes con una línea blanca en el visor. La distancia entre los márgenes representa el grosor de la CFNR. El análisis del espesor arroja 17 valores distintos: el grosor medio global de la CFNR alrededor de la papila óptica (global, 360 grados), el espesor medio dentro de los cuatro cuadrantes: temporal (T, 316-45 grados), superior (S, 46-135 grados), nasal (N, 136-225 grados) e inferior (I, 226-315 grados) y el espesor medio en cada uno de los 12 sectores horarios.
Examen con Spectral-domain/Fourier-domain TCO
Para el FD-TCO se utilizaron dos sistemas distintos en cada ojo: SD-TCO Cirrus (Carl Zeiss Meditec, Inc., Dublín, California, EE.UU.) y 3D TCO-1000 (Topcon Corp., Tokio, Japón). Cirrus utiliza como fuente de luz un diodo superluminiscente de 840 nm de longitud de onda y una velocidad de escaneo de 27.000 cortes axiales por segundo; la longitud axial de resolución es de 5 y 15 µm, respectivamente. El Optic Disc Cube 200 × 200 examina 200 líneas horizontales que constan de 200 cortes axiales. Por otra parte, el 3D TCO-1000 obtiene 128 escáneres lineales (B-scans) de 6 mm de distancia, y cubre una distancia vertical de 6 mm. La densidad de escaneo es de 512 × 128 y el tiempo aproximado en realizarlo es de 3,5 segundos (18.000 A-scans/segundo), tiene una resolución axial de 6 µm y lateral de 10 µm. Como todos los ecos luminosos provenientes de las diferentes capas axiales que atraviesa se analizan simultáneamente, la velocidad de escaneo es mucho mayor que con el TD-TCO. El software determina el grosor de la CFNR en el área escaneada de 6 × 6 mm. Posteriormente se interpola una circunferencia alrededor del disco óptico de 3,4 mm de diámetro con 256 puntos de medición del grosor de la CFNR. Los valores que se obtienen: espesor de la CFNR global, por cuadrantes y por sectores horarios son comparables con los que se obtienen mediante Stratus.
Se realizó un centrado óptimo del escáner alrededor de la papila óptica en el momento de la exploración y, en el caso de FD-TCO, se recentró antes del análisis. Además, solo se utilizaron exámenes con una puntuación de señal superior a 5 para su análisis en todos los casos.
Se incorporaron a la base de datos los grosores medios de la CFNR peripapilar global, por cuadrantes (S, T, I y N) y por sectores horarios de cada ojo medidos con cada uno de los tres sistemas para su posterior análisis estadístico.
Análisis estadístico
Se utilizó el software SPSS (SPSS 14.0 SPSS Inc., Chicago, Illinois, EE.UU.) para determinar y representar los coeficientes de concordancia de Lin (CCC) y las figuras de Bland-Altman (diferencia de espesor de la CFNR entre dos aparatos frente al espesor medio de la CFNR) entre Stratus y Cirrus, entre Stratus y 3D TCO-1000 y entre Cirrus y 3D TCO-1000 para el grosor medio global de la CFNR, el grosor medio de cada cuadrante y el grosor medio de cada una de las 12 porciones horarias, teniendo en cuenta que las porciones horarias 9, 10, 11, 12, 1, 2, 3, 4, 5, 6, 7 y 8 del ojo derecho corresponden a las porciones horarias 3, 2, 1, 12, 11, 10, 9, 8, 7, 6, 5 y 4 del ojo izquierdo.
Resultados
El grosor medio de la CFNR global, de los cuadrantes T y N y de los sectores horarios correspondientes, estimado mediante 3D TCO-1000 fue mayor que en los otros dos sistemas. En cambio, el grosor medio de la CFNR en los cuadrantes S e I y en los sectores horarios correspondientes fue mayor en Stratus que en Cirrus y en 3D TCO-1000 (tabla 1).
Para el espesor medio global de la CFNR, el 3D TCO-1000 mostró 9,11 µm de diferencia media con respecto a Cirrus y 5,41 µm con respecto a Stratus. Por cuadrantes, la máxima diferencia media de Stratus con respecto a Cirrus fue en el cuadrante S (6,8 µm). Topcon mostró una diferencia media superior a 14 µm con respecto a Stratus y Cirrus en los cuadrantes T y N, mientras que ésta fue inferior a 5 µm en los cuadrantes S e I (tabla 2).
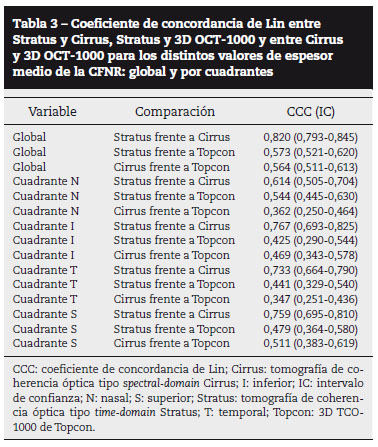
La concordancia entre Stratus y Cirrus fue excelente para el grosor medio global de la CFNR (CCC = 0,820) y alta para los cuatro cuadrantes: N (CCC = 0,614), I (CCC = 0,767), T (CCC = 0,733) y S (CCC = 0,759), mientras que la concordancia entre Stratus y 3D TCO-1000 fue moderada tanto para el grosor medio global de la CFNR como para los cuatro cuadrantes por separado. La concordancia entre Cirrus y 3D TCO-1000 resultó moderada de forma global y en los cuadrantes S e I, pero totalmente discordante en los cuadrantes nasal y temporal (tabla 3).
Las figuras de Bland-Altman representan la diferencia entre el grosor medio global (fig. 1) y por cuadrantes (fig. 2) de la CFNR medida con Stratus y Cirrus frente a la media del grosor de la CFNR medida con ambos instrumentos para cada ojo. Las figuras 3 y 4 representan los mismos parámetros medidos mediante TD-TCO Stratus y 3D TCO-1000 de Topcon, y las figuras 5 y 6 representan los valores obtenidos con el FD-TCO Cirrus frente al 3D TCO-1000 de Topcon. Se ha representado la tendencia de las diferencias medias frente al espesor medio en cada figura.

Figura 1 - Figura de Bland-Altman. Diferencia del espesor frente
al espesor medio de la CFNR estimado mediante Stratus y Cirrus
y tendencia de las diferencias. Abreviaturas: SRATUS, tomografía
de coherencia óptica tipo Time-domain Stratus; CIRRUS, tomografía
de coherencia óptica tipo spectral-domain Cirrus; CFNR, capa
de fibras nerviosas de la retina.

Figura 2 - Figuras de Bland-Altman. Diferencia del espesor frente al espesor medio de la
CFNR estimado mediante Stratus y Cirrus y tendencia de las diferencias por cuadrantes.
Abreviaturas: SRATUS, tomografía de coherencia óptica tipo time-domain Stratus; CIRRUS,
tomografía de coherencia óptica tipo spectral-domain Cirrus; CFNR, capa de fibras nerviosas de la retina.

Figura 3 - Figura de Bland-Altman. Diferencia del espesor frente
al espesor medio de la CFNR estimado mediante Stratus y 3D OCT-1000
y tendencia de las diferencias. Abreviaturas: SRATUS, tomografía de
coherencia óptica tipo time-domain Stratus; TOPCON, tomografía de
coherencia óptica tipo fourier-domain 3D OCT-1000; CFNR, capa
de fibras nerviosas de la retina.

Figura 4 - Figuras de Bland-Altman. Diferencia del espesor frente al espesor medio de la
CFNR estimado mediante Stratus y 3D OCT-1000 y tendencia de las diferencias por cuadrantes.
Abreviaturas: SRATUS, tomografía de coherencia óptica tipo time-domain Stratus; TOPCON,
tomografía de coherencia óptica tipo Fourier-domain 3D OCT-1000; CFNR, capa de fibras
nerviosas de la retina.

Figura 5 - Figura de Bland-Altman. Diferencia del espesor frente
al espesor medio de la CFNR estimado mediante Cirrus y 3D OCT-1000
y tendencia de las diferencias. abreviaturas: CIRRUS, tomografía de
coherencia óptica tipo spectral-domain Cirrus; TOPCON, tomografía
de coherencia óptica tipo Fourier-domain 3D OCT-1000; CFNR,
capa de fibras nerviosas de la retina.

Figura 6 - Figuras de Bland-Altman. Diferencia del espesor frente al espesor medio de la CFNR
estimado mediante Cirrus y 3D OCT-1000 y tendencia de las diferencias por cuadrantes.
Abreviaturas: CIRRUS, tomografía de coherencia óptica tipo spectral-domain Cirrus;
TOPCON, tomografía de coherencia óptica tipo Fourier-domain 3D OCT-1000; CFNR,
capa de fibras nerviosas de la retina.
Discusión
La TCO se ha visto capaz de determinar el espesor de la CFNR peripapilar de una forma bastante fidedigna respecto a su morfología anatómica real, aunque puede haber diferencias cuantitativas entre el espesor de la CFNR medido por TCO y el real. La CFNR peripapilar sigue un patrón en doble "joroba" con un máximo acúmulo de fibras en los cuadrantes S e I y un mínimo en el cuadrante T3.
Se ha demostrado que el grado de adelgazamiento o atrofia de la CFNR estimado mediante TCO en pacientes con esclerosis múltiple se correlaciona bien con el deterioro cognitivo y físico que presentan estos pacientes4. Además, este parámetro, obtenido mediante Stratus en pacientes con neuritis óptica, se ha correlacionado bien con la pérdida de agudeza visual de estos pacientes a los 6 meses de seguimiento (una línea por cada 5,4 µm menos de espesor de la CFNR) y se ha visto que es más sensible que la perimetría automatizada para detectar el daño axonal5. En pacientes con glaucoma y sanos, la TD-TCO Stratus de la CFNR también se ha demostrado más eficaz que el examen del fondo de ojo realizado por un oftalmólogo no experto para detectar la enfermedad6. No obstante, el propio envejecimiento es un factor que disminuye el espesor de la CFNR por sí mismo, especialmente en los cuadrantes superior e inferior y en el sector horario 1, sin necesidad de patología asociada7.
La demostrada utilidad diagnóstica, pronóstica y de seguimiento de la tecnología TCO exige medidas exactas, reproducibles y concordantes entre los diferentes aparatos del mercado.
La reproducibilidad de Stratus y Cirrus en una misma visita, entre visitas sucesivas, entre distintos operarios y entre distintos centros ha sido buena en pacientes con glaucoma estable, con esclerosis múltiple y sanos, especialmente para el valor global medio de espesor de la CFNR peripapilar8-10.
En nuestro estudio hemos utilizado el protocolo Fast RNFL Thickness de Stratus ya que se ha visto que es comparable con el protocolo standard8, aunque puede dar valores ligeramente más bajos en las zonas más finas y valores más altos en las zonas más gruesas de la CFNR11. Por otra parte, hemos analizado los ojos derechos e izquierdos de cada paciente con sus sectores horarios equivalentes, conscientes de que, aunque en individuos sanos los espesores de la CFNR son muy similares, no es así entre diferentes individuos, máxime si presentan alguna patología que afecte al nervio óptico12.
En nuestro caso, Stratus mostró un espesor medio de la CFNR mayor que Cirrus y que 3D TCO-1000 en los cuadrantes S e I, así como un valor medio global mayor que Cirrus pero no que 3D TCO-1000. A pesar de estas diferencias, la concordancia entre Stratus y Cirrus fue, globalmente, casi perfecta (CCC = 0,82; IC, 0,793-0,845) y por cuadrantes, muy alta. En otro estudio con pacientes glaucomatosos y sanos, ya se observaron valores más altos con Stratus que con Cirrus en las zonas más gruesas de la CFNR, mientras que sucedía lo contrario en las zonas más atróficas13. La excelente correlación entre TD-TCO Stratus y FD-TCO Cirrus también ha sido puesta de manifiesto en pacientes sanos y con glaucoma10,13,14. Nosotros creemos que una buena correlación lineal, que es la prueba estadística utilizada en la mayoría de los estudios comparativos, no es sinónimo de buena concordancia. Por este motivo hemos utilizado el coeficiente de concordancia de Lin en lugar de la correlación lineal, ya que éste calcula el grado en que determinaciones diferentes son similares en posición relativa y absoluta y, además, tiene en cuenta tanto la corrección por azar como la inconsistencia entre instrumentos.
Las diferencias en la estimación del espesor de la CFNR entre Stratus y Cirrus en función del grosor de la CFNR se cree que es debido a las diferencias en el algoritmo empleado en la segmentación del grosor de la CFNR y no al tipo de TCO. Parece ser que mientras Stratus toma en cuenta el grosor incluyendo los vasos sanguíneos que recorren la CFNR en los cuadrantes superior e inferior, Cirrus no se ve tan afectado por este "artefacto"14. Las diferencias en los algoritmos de segmentación de las capas entre Stratus y Cirrus también se han puesto de manifiesto en diferentes estudios comparativos del grosor macular en pacientes con esclerosis múltiple, degeneración macular asociada a la edad y sanos. Estos estudios indican que Cirrus determina el grosor foveal unas 43 µm mayor que Stratus en pacientes con sospecha de esclerosis múltiple y que Cirrus tiene muchos menos errores a la hora de fijar las líneas umbral de segmentación15-17.
Stratus mostró un espesor medio de la CFNR mayor que 3D TCO-1000 en los cuadrantes S e I mientras que, globalmente y en los cuadrantes T y N, el espesor medio medido con 3D TCO-1000 fue mayor. La concordancia entre ambos aparatos fue moderada y, por lo tanto, los valores de uno y otro no son comparables de manera aceptable. El hecho de que la diferencia media de espesor de la CFNR sea mucho mayor en los cuadrantes nasal (-15,87; desviación estándar [DE]: 18,87) y temporal (-14,51; DE: 20,96) que en los cuadrantes superior (4,2; DE: 38,53) e inferior (4,56; DE: 38,86), indica que las discrepancias entre ambos aparatos aumentan conforme aumenta el grosor de la CFNR, como puede observarse en las figuras de Bland-Altman (fig. 3 y 4). Por el contrario, en otro estudio en el que se comparó un grupo de pacientes con atrofia en banda con controles sanos, los valores medios globales y por cuadrantes del espesor de la CFNR fueron más altos con Stratus que con 3D TCO-1000 en ambos grupos, por lo que se concluyó que este último sistema no aportaba beneficios diagnósticos con respecto a Stratus18. Es posible que la mayor hetereogeneidad patológica de nuestro grupo de pacientes haya influido en obtener resultados distintos.
En nuestro caso, 3D TCO-1000 mostró los valores más altos de espesor medio de la CFNR tanto de forma global como en los cuadrantes N y T (tabla 1). Respecto a Cirrus, 3D TCO-1000 mostró siempre valores superiores, excepto en el cuadrante I. Por otra parte, la concordancia entre Cirrus y 3D TCO-1000 fue moderada tanto globalmente (CCC = 0,564; IC, 0,511-0,613) como en los cuadrantes S (CCC = 0,511; IC, 0,383-0,619) e I (CCC = 0,469; IC, 0,343-0,578). En cambio, en los cuadrantes T y N, la concordancia entre ambos sistemas fue pésima (CCC = 0,347; IC, 0,251-0,436 y 0,362; IC, 0,250-0,464, respectivamente). Como se puede ver en las figuras 6 A y B, las diferencias entre ambos sistemas aumentan sustancialmente (a favor de 3D TCO-1000) a medida que disminuye el grosor de la CFNR en los cuadrantes T y N; en cambio, aumentan discretamente (a favor de Cirrus) a medida que aumenta el grosor de la CFNR en los cuadrantes superior e inferior, donde la CFNR es más gruesa.
Es posible que las diferencias que aparecen entre Cirrus y 3D TCO-1000 sean debidas, de nuevo, a la diferencia de algoritmo de segmentación entre ambos aparatos, aunque son precisamente los cuadrantes con menos artefactos vasculares los que mayores diferencias de medida producen (temporal y nasal). Seguramente, otros factores como la intensidad de señal, el centrado del disco óptico o diferencias en el análisis de confidencia ([AC], valor aportado por el software del aparato que indica la calidad de los datos) han podido influir en las diferencias observadas19, 20. No obstante, en todos los exámenes se centró el disco óptico al máximo y todas las pruebas tenían una puntuación de AC mayor de 5. Es posible que existan otros factores dependientes de la población estudiada, como el calibre vascular21, y de los propios instrumentos, que influyan en el espesor estimado de la CFNR.
En conclusión, en este estudio los datos obtenidos ponen de manifiesto una buena concordancia entre la ya clásica TDTCO Stratus y la nueva FD-TCO Cirrus, especialmente para el valor medio global del espesor de la CFNR peripapilar. En cambio, los resultados obtenidos mediante 3D TCO-1000 son inaceptablemente discordantes con los obtenidos mediante Stratus y Cirrus. Sería interesante investigar la existencia de alguna fórmula de conversión entre los datos obtenidos por los tres sistemas para que sus resultados fueran equivalentes.
Bibliografía
1. Kallenbach K, Frederiksen J. Optical coherence tomography in optic neuritis and multiple sclerosis: a review. Eur J Neurol. 2007;14:841-9. [ Links ]
2. Amat Peral P, Lugo Quintás FL, de la Vega Galiana C, Montero Moreno JA, Ruiz Moreno JM. Descripción de nuevos sistemas de tomografía de coherencia óptica. Actualizaciones tecnológicas en oftalmología. Disponible en: www.oftalmo.com. [ Links ]
3. Blumenthal EZ, Parikh RS, Pe´er J, Naik M, Kaliner E, Cohen MJ, et al. Retinal nerve fibre layer imaging compared with histological measurements in a human eye. Eye. 2009;23:171-5. [ Links ]
4. Toledo J, Sepulcre J, Salinas-Alaman A, García-Layana A, Murie-Fernández M, Bejarano B, et al. Retinal nerve fiber layer atrophy is associated with physical and cognitive disability in multiple sclerosis. Mult Scler. 2008;14:906-12. [ Links ]
5. Noval S, Contreras I, Rebolleda G, Muñoz-Negrete FJ. Optical coherence tomography versus automated perimetry for follow-up of optic neuritis. Acta Ophthalmol Scand. 2006;84: 790-4. [ Links ]
6. Vessani RM, Moritz R, Batis L, Zagui RB, Bernardoni S, Susanna R. Comparison of quantitative imaging devices and subjective optic nerve head assessment by general ophthalmologists to differentiate normal from glaucomatous eyes. J Glaucoma. 2009;18:253-61. [ Links ]
7. Sung KR, Wollstein G, Bilonick RA, Townsend KA, Ishikawa H, Kagemann L, et al. Effects of age on optical coherence tomography measurements of healthy retinal nerve fiber layer, macula, and optic nerve head. Ophthalmology. 2009;116: 1119-24. [ Links ]
8. Budenz DL, Fredette MJ, Feuer WJ, Anderson DR. Reproducibility of peripapillary retinal nerve fiber thickness measurements with stratus OCT in glaucomatous eyes. Ophthalmology. 2008; 115:661-6. [ Links ]
9. Cettomai D, Pulicken M, Gordon-Lipkin E, Salter A, Frohman TC, Conger A, et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch Neurol. 2008;65:1218-22. [ Links ]
10. Vizzeri G, Weinreb RN, González-García AO, Bowd C, Medeiros FA, Sample PA, et al. Agreement between Spectral-domain and Time-domain OCT for measuring RNFL thickness. Br J Ophthalmol. 2009;93:775-81. [ Links ]
11. Monteiro ML, Cunha LP, Vessani RM. Comparison of retinal nerve fiber layer measurements using Stratus OCT fast and regular scan protocols in eyes with band atrophy of the optic nerve and normal controls. Arq Bras Oftalmol. 2008;71:534-9. [ Links ]
12. Ghadiali Q, Hood DC, Lee C, Manns J, Llinas A, Grover LK, et al. An analysis of normal variations in retinal nerve fiber layer thickness profiles measured with optical coherence tomography. J Glaucoma. 2008;17:333-40. [ Links ]
13. Knight OJ, Chang RT, Feuer WJ, Budenz DL. Comparison of retinal nerve fiber layer measurements using time domain and spectral domain optical coherent tomography. Ophthalmology. 2009;116:1271-7. [ Links ]
14. Hood DC, Raza AS, Kay KY, Sandler SF, Xin D, Ritch R, et al. A comparison of retinal nerve fiber layer (RNFL) thickness obtained with frequency and time domain optical coherence tomography (OCT). Opt Express. 2009;17:3997-4003. [ Links ]
15. Krebs I, Falkner-Radler C, Hagen S, Haas P, Brannath W, Lie S, et al. Quality of the threshold algorithm in age-related macular degeneration: Stratus versus Cirrus OCT. Invest Ophthalmol Vis Sci. 2009;50:995-1000. [ Links ]
16. Kiernan DF, Hariprasad SM, Chin EK, Kiernan CL, Rago J, Mieler WF. Prospective comparison of cirrus and stratus optical coherence tomography for quantifying retinal thickness. Am J Ophthalmol. 2009;147:267-75. [ Links ]
17. Kakinoki M, Sawada O, Sawada T, Kawamura H, Ohji M. Comparison of macular thickness between Cirrus HD-OCT and Stratus OCT. Ophthalmic Surg Lasers Imaging. 2009;40: 135-40. [ Links ]
18. Costa-Cunha LV, Cunha LP, Malta RF, Monteiro ML. Comparison of Fourier-domain and time-domain optical coherence tomography in the detection of band atrophy of the optic nerve. Am J Ophthalmol. 2009;147:56-63. [ Links ]
19. Wu Z, Vazeen M, Varma R, Chopra V, Walsh AC, LaBree LD, et al. Factors associated with variability in retinal nerve fiber layer thickness measurements obtained by optical coherence tomography. Ophthalmology. 2007;114:1505-12. [ Links ]
20. Cheung CY, Leung CK, Lin D, Pang CP, Lam DS. Relationship between retinal nerve fiber layer measurement and signal strength in optical coherence tomography. Ophthalmology. 2008;115:1347-51. [ Links ]
21. Zheng Y, Cheung N, Aung T, Mitchell P, He M, Wong TY. Relationship of retinal vascular caliber with retinal nerve fiber layer thickness: The Singapore Malay eye Study. Invest Ophthalmol Vis Sci. 2009;50:4091-6. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: Llorens.victor@gmail.com
(V. Llorenç).
Recibido el 31 de mayo de 2009
Aceptado el 18 de junio de 2010