Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Archivos de la Sociedad Española de Oftalmología
versão impressa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.85 no.5 Mai. 2010
Atrofia de la capa de fibras nerviosas de la retina en pacientes con esclerosis múltiple. Estudio prospectivo con dos años de seguimiento
Atrophy of the retinal nerve fibre layer in multiple sclerosis patients. Prospective study with two years follow-up
E. García-Martína, V. Pueyoa, J. Fernándeza, C. Almárceguibb, I. Dolzb, J. Martíncc, J.R. Arac y F.M. Honrubiaa
aServicio de Oftalmología, Hospital Universitario Miguel Servet, Zaragoza, España
bServicio de Neurofisiología, Hospital Universitario Miguel Servet, Zaragoza, España
cServicio de Neurología, Hospital Universitario Miguel Servet, Zaragoza, España
Dirección para correspondencia
RESUMEN
Objetivos: Evaluar los cambios que se producen en la capa de fibras nerviosas de la retina (CFNR) de pacientes con esclerosis múltiple (EM) durante 2 años. Comparar la utilidad de la tomografía de coherencia óptica (TCO), polarimetría láser (GDx), potenciales evocados visuales (PEV) y campo visual en la detección del daño axonal.
Material y método: Se incluyeron 50 ojos de pacientes con EM que no hubiesen presentado brotes ni neuritis ópticas durante el seguimiento. Se realizó una exploración oftalmológica completa, que constó de agudeza visual (AV), defecto de refracción, visión de colores, campimetría, TCO, GDx y PEV. Todos los pacientes fueron reevaluados transcurridos 12 y 24 meses. Se estudió la correlación entre los parámetros mediante la prueba de Pearson.
Resultados: Al comparar las exploraciones basal y a los 2 años, se detectaron diferencias estadísticamente significativas (t de Student, p < 0,05) en el espesor medio, superior e inferior de la CFNR y en el volumen macular medidos con la TCO, mientras que no se encontraron diferencias significativas en las pruebas funcionales (AV, prueba de Ishihara, campimetría, PEV) ni en el GDx. La mayor diferencia fue observada en el cuadrante inferior (113,67 frente a 105,39 µm, p < 0,001). Se encontró correlación entre los parámetros estructurales obtenidos mediante GDx y TCO.
Conclusiones: En la evolución de la EM aparece daño axonal progresivo. Las mediciones de la TCO son eficaces para detectar variaciones del espesor de la CFNR y del volumen macular; sin embargo, estos cambios no fueron detectados mediante las pruebas funcionales ni con el GDx.
Palabras clave: Esclerosis múltiple. Capa de fibras nerviosas de la retina. Tomografía de coherencia óptica. Polarimetría láser. Potenciales evocados visuales.
ABSTRACT
Objective: To evaluate the changes over two years in the retinal nerve fibre layer (RNFL) of patients with multiple sclerosis (MS). To compare the ability of optical coherence tomography (OCT), scanning laser polarimetry (GDx), visual evoked potentials (VEP) and visual field examination to detect axonal loss in these patients.
Material and methods: Fifty eyes of MS patients without episodes or optic neuritis during follow-up were enrolled in this study. All patients underwent a complete ophthalmic examination that included visual acuity (VA), colour vision, refractive evaluation, visual field examination, OCT, GDx and VEP. All the patients were re-evaluated over a period of 12 and 24 months. Correlations between parameters were analysed by Pearson's test.
Results: There were changes in the RNFL thickness in MS patients with a 12 and 24-month follow-up. Differences between baseline and 2-year evaluation were statistically significant (p < 0.05, t test) in the mean, superior and inferior RNFL thickness and macular volume provided by OCT, while no significant differences were found using functional parameters (VA, colour vision, visual field and VEP) and GDx. The greater differences were obtained in the inferior RNFL thickness (113.67 frente a 105.39 µm, p < 0.001). Correlations were observed between structural parameters using GDx and TCO.
Conclusions: Progressive axonal loss can be detected in the optic nerve of MS patients. Measurements provided by TCO are useful tools to evaluate structural abnormalities in the RNFL and changes in macular volume, however these changes were not detected using functional tests or GDx.
Key words: Multiple sclerosis. Retinal nerve fibre layer. Optical coherence tomography. Scanning laser polarimetry. Visual evoked potentials.
Introducción
La esclerosis múltiple (EM) es una enfermedad crónica que afecta preferentemente a personas jóvenes y puede producir déficit neurológicos progresivos e importante discapacidad funcional. Una de las principales causas de discapacidad en la EM es el déficit visual, que aparece en el 80% de los pacientes y suele presentarse como pérdida de agudeza visual (AV) o como alteración en la motilidad ocular. Aproximadamente en la mitad de los pacientes, la EM se inicia con alteraciones visuales1,2.
La teoría más aceptada es que la EM tiene una patogenia múltiple, que asocia procesos de inflamación, desmielinización y daño axonal.
Existen evidencias de que el daño axonal está directamente relacionado con la discapacidad funcional permanente3,4. Clásicamente se consideraba que el daño axonal y la discapacidad se asociaban a inflamación y procesos autoinmunes contra la mielina; pero en los últimos años varios autores han demostrado la existencia de daño axonal en fases muy incipientes de la enfermedad, sin relación con episodios inflamatorios o autoinmunes contra la mielina5. Distintos trabajos, algunos de ellos realizados con animales de experimentación, han puesto de manifiesto la existencia de nuevos mediadores de pérdida axonal6,7. Existen evidencias clínicas2,8, radiológicas9,10 y patológicas11 que permiten definir el daño axonal como el elemento central en la patología y la clínica de la EM, ya que influye en la respuesta inflamatoria y se relaciona con la discapacidad.
La capa de fibras nerviosas de la retina (CFNR) está formada por los axones de las células ganglionares, que confluyen en el nervio óptico. Estos axones carecen de mielina, por lo que pueden ser un buen marcador de daño axonal. Numerosos autores han descrito la existencia de defectos en la CFNR de los pacientes con EM, tanto en aquellos que han presentado episodios de neuritis óptica como en aquellos que no han tenido manifestaciones oftalmológicas; si bien los primeros parecen tener una afectación mayor de esta estructura retiniana12-17.
La valoración clínica del nervio óptico debe afrontarse, por un lado, desde un punto de vista funcional y, por otro lado, estructural.
La reciente aplicación de las técnicas de análisis digital de imagen en oftalmología ha supuesto la aparición y desarrollo de parámetros que permiten una medición cuantitativa, objetiva y reproducible de la CFNR. Entre estas técnicas de análisis por imagen destacan la tomografía de coherencia óptica (TCO) y la polarimetría láser (GDx)18-20.
Estos nuevos instrumentos diagnósticos han permitido a algunos autores observar alteraciones en la CFNR de pacientes con EM, incluso sin el antecedente de episodios clínicos de neuritis óptica12-17, lo que señala la existencia de daño axonal no asociado a inflamación. En caso de confirmarse la utilidad del estudio de la CFNR como marcador biológico del daño axonal en la EM, esto podría resultar también de gran utilidad en dos ámbitos fundamentales. En primer lugar, podrían utilizarse para realizar un control evolutivo de la enfermedad, ya que el daño axonal está directamente relacionado con la discapacidad funcional secundaria a la EM. En segundo lugar, podrían ser buenos marcadores de la eficacia de las terapias modificantes de la enfermedad, que cada vez se utilizan más en estos pacientes con el objetivo de disminuir su progresión21-24.
Se han desarrollado trabajos que parecen indicar esta utilidad de la evaluación de la CFNR, pero aún son necesarios estudios de cohortes prospectivos que permitan determinar con exactitud tanto la relación entre los defectos de la CFNR y el daño neuronal global como su progresión paralela a lo largo de la evolución de la enfermedad.
Material y métodos
Se incluyeron 25 pacientes con EM (50 ojos) de forma prospectiva y fueron evaluados en el momento basal, a los 12 meses y a los 24 meses.
Para la inclusión de los sujetos en el estudio se utilizaron los siguientes criterios: a) diagnóstico de EM confirmado por un neurólogo a partir de los criterios de Posser; b) AV igual o superior a 0,1 en cada ojo para permitir el correcto desarrollo del protocolo exploratorio, y c) valores de presión intraocular de aplanamiento inferiores a 20 mmHg. Se excluyó del estudio a los pacientes que habían padecido un episodio de neuritis óptica u otra manifestación de la enfermedad considerada como brote de la misma en los 6 meses previos a su inclusión en el estudio o durante el seguimiento, y aquellos cuyo defecto de refracción era superior a 5 dioptrías de equivalente esférico o 3 dioptrías de astigmatismo.
El estudio fue aprobado por el Comité Ético del hospital y todos los participantes firmaron un consentimiento informado en el que se detallaba el objetivo del trabajo y las pruebas que se incluían en el protocolo exploratorio, así como la posibilidad de abandonarlo en el momento en que lo deseasen. Todos lo sujetos fueron sometidos a una exploración oftalmológica completa, que incluyó AV con optotipo de Snellen, prueba de colores (láminas isocromáticas de Ishihara), motilidad ocular, reflejos pupilares, medición del defecto de refracción, examen del polo anterior, tonometría de aplanación, valoración funduscópica del aspecto de la papila, perimetría computarizada (PA) empleando el analizador de campo Humphrey (Carl-Zeiss Meditec, Dublin, California) con una estrategia SITA Standard programa 30-2, TCO, GDx y potenciales evocados visuales (PEV).
La tomografía de coherencia óptica (TCO) (Stratus OCT 3000, Carl Zeiss Meditec, Dublin) empleó los siguientes protocolos para la obtención de imágenes retinianas: fast RNFL thickness (barridos circulares de 3,4 mm) y fast macula. Los parámetros evaluados fueron el espesor medio de la CFNR, el espesor en cada uno de los cuatro cuadrantes papilares y el volumen macular.
La polarimetría láser con compensación corneal variable (GDx VCC, Laser Diagnostic Technologies, San Diego) se llevó a cabo realizando barridos circulares centrados en la papila de 3,2 mm de diámetro con el objetivo de medir los espesores de la CFNR (nerve fiber index [NFI], promedio temporal-superior-nasal-inferior [TSNIT], promedio superior, promedio inferior y desviación estándar TSNIT).
Los PEV empleados en el estudio fueron de tipo pattern y se registraron con el equipo Medelec ER 94/ Sensor ST 10 y unos electrodos de disco bañados en cloruro de plata colocados en el cuero cabelludo de la zona occipital (Oz, electrodo activo) y en área frontal (Fz, electrodo de referencia). Como electrodo de tierra se colocó un electrodo de baja impedancia en la frente del paciente. Los estímulos se presentaron de forma monoocular y la frecuencia de alternancia de los estímulos pattern fue de 2 Hz. Se empleó un monitor de vídeo de 26 × 20 centímetros colocado a un metro de distancia del sujeto (ángulo visual de 16o) y el tamaño de los cuadrados fue de 1o de arco. El promedio de luminancia fue de 93,5 candelas/m2, con un contraste del 99%. Se analizaron la latencia y la amplitud del componente fundamental positivo, tomado convencionalmente como una deflexión hacia abajo (onda P100).
Las variables de valoración neurológica recogidas fueron edad, sexo, fenotipo de EM (recidivante-remitente, primaria progresiva, secundaria progresiva y enfermedad desmielinizante del sistema nervioso central sin filiar), tiempo de evolución desde el diagnóstico, y la escala de disfunción neurológica EDSS (Expanded Disability Status Scale).
Estas exploraciones fueron realizadas en el momento basal, al año y a los 2 años, con el objetivo de evaluar cambios en los parámetros registrados y valorar la correlación entre dichos cambios.
En el análisis estadístico, todas las variables mencionadas fueron registradas en una base de datos elaborada con el programa FileMaker Pro 5.0. Se realizó un primer estudio transversal, en el que las variables independientes fueron la presencia o no de EM, el tipo de EM y el tratamiento inmunomodulador, y las variables dependientes fueron los parámetros proporcionados por las diferentes técnicas diagnósticas incluidas en el protocolo del estudio. Las variables modificadoras del efecto incluidas en el estudio fueron la edad, el sexo y las cifras de presión intraocular. Transcurridos 12 y 24 meses desde este primer estudio, se reevaluó a los pacientes empleando los mismos parámetros y se realizó un análisis estadístico comparativo de los resultados obtenidos.
También se realizó un estudio de correlación entre el cambio observado a lo largo de los 2 años de seguimiento entre las diferentes variables mediante la prueba de Pearson.
Todos los análisis estadísticos fueron llevados a cabo con el programa estadístico SPSS versión 15.0 (SPSS, Inc., Chicago, Estados Unidos). De modo previo al análisis de los datos se observó que la mayoría se ajustaba a la normalidad mediante la prueba de Kolmogorov-Smirnov. Los resultados obtenidos de cada variable en ambas exploraciones fueron comparados mediante la prueba paramétrica de la t de Student.
Resultados
En el estudio se incluyeron 19 hombres y 31 mujeres, siendo la proporción hombre/mujer aproximadamente de 2:3. Su edad media fue de 42,21 años (rango: 20-69 años) y la media del tiempo de evolución de la enfermedad desde el momento del diagnóstico fue de 8,97 años (rango: 0,5-26 años). El tipo de EM predominante fue recidivante-remitente con 21 pacientes (88%), frente a los otros tipos: un paciente presentaba EM primaria progresiva (6%) y otro tenían EM secundaria progresiva (6%). La media de la escala de discapacidad neurológica (EDSS) empleada para evaluar a los pacientes fue de 2,66 (rango: 0-6,5) en la evaluación basal y de 2,86 (rango: 0-6,5) en la revisión a los 2 años.
Los resultados de todos los parámetros evaluados en este estudio en el momento basal y en las dos revisiones anuales, así como la diferencia entre ambas exploraciones y el nivel de significación de la comparación se encuentran detallados en la tabla 1. Como se observa en esta tabla, se han detectado diferencias significativas entre la evaluación basal y a los 2 años en el espesor medio, superior e inferior de la CFNR y en el volumen macular obtenidos con TCO. Sin embargo, en el resto de los parámetros evaluados se aprecia una clara tendencia a la disminución del espesor de la CFNR sin que los cambios sean estadísticamente significativos. El valor NFI del GDx presenta un aumento durante el período de seguimiento, lo que se traduce en una reducción de la CFNR, ya que este índice representa la alteración de la integridad de esta estructura, de tal forma que los valores superiores indican mayor alteración del espesor de la CFNR. Este parámetro fue inferior en el momento basal que al reevaluar a los pacientes a los 2 años, si bien no se encontró una significación estadística. Igualmente ocurre con la latencia de los PEV, en la que se observa un incremento a lo largo del seguimiento y es también reflejo de la pérdida de funcionalidad de la vía visual a medida que aumenta su valor.
El parámetro que más se modificó durante el seguimiento fue el espesor inferior de la CFNR medido en el TCO, que disminuyó una media de 8,28 µm en 2 años (113,67 µm en el momento basal frente a 105,39 µm en la revisión anual), como se representa en la figura 1. La probabilidad de que este descenso en el espesor medio de la CFNR producido a lo largo de 2 años en pacientes con EM se deba al azar es menor del 0,1% (p < 0,001). El cuadrante superior y el espesor medio medidos con la TCO también mostraron diferencias significativas y se redujeron una media de 6,47 y 4,92 µm respectivamente durante el período de seguimiento. De igual forma, el volumen macular disminuyó significativamente en estos pacientes, como queda reflejado en la figura 2.
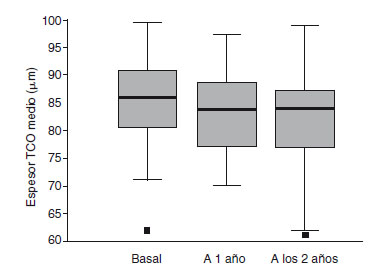
Figura 1 - Representación gráfica con diagramas de cajas
del espesor medio de la capa de fibras nerviosas de la retina
medida mediante tomografía de coherencia óptica (TCO) en
las exploraciones basal, al año y a los 2 años de seguimiento
en los pacientes con esclerosis múltiple.
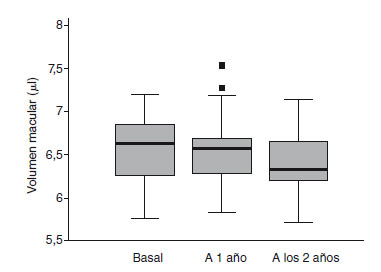
Figura 2 - Diagramas de cajas que representan el cambio
en el volumen macular medido con tomografía de coherencia
óptica en las exploraciones basal, al año y a los 2 años de
seguimiento en los pacientes con esclerosis múltiple.
El estudio de correlación entre los diferentes parámetros se realizó mediante una prueba de correlación de Pearson que no mostró correlación entre las diferencias observadas en las variables estructurales y las diferencias en la AV o en los PEV; pero sí hubo correlación significativa (p < 0,5) entre las diferencias observadas en la desviación media del campo visual y algunos parámetros de la TCO, y entre las diversas variables estructurales entre sí, como puede observarse en la tabla 2.
Discusión
El objetivo del estudio fue cuantificar los defectos en la CFNR en pacientes con EM y observar si, transcurridos 12 y 24 meses, se apreciaba una pérdida de fibras superior a la que fisiológicamente tiene lugar con la edad. La EM es un trastorno neurodegenerativo progresivo, que afecta al sistema nervioso central y, por tanto, se considera que provoca una reducción en la CFNR. Muchos autores consideran que esta pérdida neuronal tiene lugar aunque no aparezcan episodios inflamatorios ni brotes de la enfermedad. Nuestro estudio incluyó sólo a pacientes que no presentaran actividad durante el período de seguimiento, tanto a nivel oftalmológico como sistémico, con la intención de evaluar y cuantificar la pérdida de CFNR asociada a la progresión de la EM.
Clásicamente se empleaba la oftalmoscopia y las fotografías monocromáticas de la retina, que proporcionaban una valoración cualitativa y subjetiva de la CFNR y del nervio óptico, y sólo eran capaces de detectar defectos con pérdidas superiores al 50% de las células ganglionares de la retina25,26. Actualmente la aplicación de técnicas de análisis digital de imagen, como la TCO y el GDx, permiten valorar la CFNR de forma más precisa. Estas técnicas, no invasivas y poco dependientes del examinador, son capaces de realizar análisis muy precisos y de proporcionar mediciones cuantitativas en unos minutos y sin causar molestias al paciente27,28.
La función visual en la EM ha sido estudiada por varios autores y se ha detectado que existe una afectación de la misma en estos pacientes, especialmente en aquellos que han presentado episodios previos de neuritis ópticas. Esta disfunción visual se ha observado tanto en la AV29-32 como en la perimetría30,31, en la visión de colores12 y en los PEV, que muestran latencias más prolongadas y amplitudes menores en los pacientes con EM12,16,17,30,33,34. Sin embargo, de momento sólo han sido publicados estudios transversales que comparan la función visual entre los enfermos con EM y sujetos sanos, pero no ha sido estudiada la progresión en el tiempo de ambos grupos. En nuestro trabajo se observa una tendencia al aumento de la disfunción visual en los pacientes con EM a lo largo del tiempo de seguimiento, pero las diferencias no fueron estadísticamente significativas. Por este motivo, las pruebas estructurales de la CFNR parecen ser más sensibles para detectar las alteraciones causadas por la EM en la vía visual que la evaluación de su función visual.
En este estudio se ha observado que existe una disminución en el espesor de la CFNR de los pacientes con EM de un año para otro. Un estudio longitudinal realizado en 187 ojos de pacientes sanos evaluó la pérdida fisiológica de fibras de la retina que tiene lugar con la edad mediante TCO y determinó que una persona normal disminuye su promedio de CFNR en 0,16 µm al año. Esta pérdida es más acusada en personas de edades superiores a los 50 años35. Los resultados de nuestro estudio muestran que los pacientes con EM tienen una pérdida de 2,46 µm al año en este espesor medio de la CFNR, lo cual significa una reducción de esta estructura retiniana 15 veces superior a los sanos. Esto hace pensar que existen mecanismos fisiopatológicos, diferentes de la inflamación del nervio óptico, que causan daño axonal en esta enfermedad36-38.
El motivo por el que no se incluyó a pacientes que hubiesen padecido una neuritis óptica en los 6 meses previos al comienzo del estudio se basó en que es el tiempo que la mayoría de los autores consideran necesario para que las mediciones realizadas con las técnicas de análisis digital de la imagen, como TCO y GDx, sean capaces de registrar la degeneración retrógrada que se produce tras un episodio inflamatorio del nervio óptico, especialmente en el caso de las neuritis retrobulbares26,39-41.
La TCO ha destacado entre las diferentes técnicas de análisis de la CFNR como la más útil en el diagnóstico y seguimiento de neuropatías ópticas y de pacientes con EM19,26,27. Esto ha hecho que algunos autores sugieran que puede resultar útil para monitorizar la progresión de la enfermedad y la respuesta al tratamiento en los ensayos clínicos12,21,23,24,42, si bien es difícil saber si resulta correcto extrapolar los cambios neuronales observados en la CFNR al resto del sistema nervioso central, ya que esta estructura representa una pequeña parte del mismo y, además, la EM es una enfermedad multifocal que puede afectar diferentes áreas del sistema nervioso central de forma muy variable. Por otro lado, hay que tener en cuenta que tanto las pruebas funcionales como las estructurales tienen cierta variabilidad que puede justificar algunos de los cambios observados en las mediciones a lo largo del estudio, y que la calidad de las imágenes obtenidas mediante las técnicas de análisis digital de la imagen debe ser alta para que los datos proporcionados sean fiables, y esto no es siempre posible, especialmente en aquellos pacientes en los que no hay una buena fijación visual, existen anomalías en la motilidad ocular, nistagmus u otras alteraciones que dificulten la realización de las pruebas. Estas cuestiones deben ser consideradas para interpretar los resultados obtenidos en la evaluación de la CFNR y justifican la necesidad de realizar nuevos estudios que valoren el valor pronóstico del análisis de la CFNR en los pacientes con EM.
En conclusión, podemos afirmar que la evolución de la EM causa una pérdida axonal a nivel del nervio óptico mayor a la experimentada fisiológicamente por la población sana, aunque el paciente no haya presentado síntomas de actividad ni brotes propios de la enfermedad, y que esta degeneración axonal puede ser valorada mediante la TCO. La realización de estudios longitudinales con mayor tamaño muestral y tiempo de seguimiento puede resultar útil para la comprensión de la fisiopatología de la enfermedad y para valorar la utilidad del análisis cuantitativo de la CFNR como marcador de daño neuronal y de eficacia terapéutica en los ensayos clínicos.
Bibliografía
1. Lassmann H, Suchanek G, Ozawa K. Histopathology and the blood-cerebrospinal fluid barrier in multiple sclerosis. Ann Neurol. 1994;36:S42-6. [ Links ]
2. Trapp BD, Peterson J, Ransohoff RM, Rudick R, Mörk S, Bö L. Axonal transection in the lesions of multiple sclerosis. N Engl J Med 1998;338:278-85. [ Links ]
3. Palace J. Inflammation versus neurodegeneration: consequences for treatment. J Neurol Sci. 2007;259:46-9. [ Links ]
4. Hauser SL, Oksenberg JR. The neurobiology of multiple sclerosis: genes, inflammation, and neurodegeneration. Neuron. 2006;52:61-76. [ Links ]
5. Imitola J, Chitnis T, Khoury SJ. Insights into the molecular pathogenesis of progression in multiple sclerosis: potential implications for future therapies. Arch Neurol. 2006;63:25-33. [ Links ]
6. Frisen L, Hoyt WF. Insidious atrophy of retinal nerve fibers in multiple sclerosis. Funduscopic identification in patients with and without visual complaints. Arch Ophthalmol. 1974;92: 91-7. [ Links ]
7. Elbol P, Work K. Retinal nerve fiber layer in multiple sclerosis. Acta Ophthalmol (Copenh). 1990;68:481-6. [ Links ]
8. Ferguson B, Matyszak MK, Esiri MM, Perry VH. Axonal damage in acute multiple sclerosis lesions. Brain. 1997;120:393-9. [ Links ]
9. Davie CA, Barker GJ, Webb S, Tofts PS, Thompson AJ, Harding AE, et al. Persistent functional deficit in multiple sclerosis and autosomal dominant cerebellar ataxia is associated with axon loss. Brain. 1995;118:1583-92. [ Links ]
10. Davie CA, Barker GJ, Thompson AJ, Tofts PS, McDonald WI, Miller DH. 1H magnetic resonance spectroscopy of chronic cerebral white matter lesions and normal appearing white matter in multiple sclerosis. J Neurol Neurosurg Psychiatry. 1997;63:736-42. [ Links ]
11. Stadelmann C, Albert M, Wegner C, Bruck W. Cortical pathology in multiple sclerosis. Curr Opin Neurol. 2008;21:229-34. [ Links ]
12. Trip SA, Schlottmann PG, Jones SJ, Altmann DR, Garway-Heath DF, Thompson AJ, et al. Retinal nerve fiber layer axonal loss and visual dysfunction in optic neuritis. Ann Neurol. 2005;58: 383-91. [ Links ]
13. Toledo J, Sepulcre J, Salinas-Alaman A, García-Layana A, Murie-Fernandez M, Bejarano B, et al. Retinal nerve fiber layer atrophy is associated with physical and cognitive disability in multiple sclerosis. Mult Scler. 2008;14:906-12. [ Links ]
14. Della Mea G, Bacchetti S, Zeppieri M, Brusini P, Cutuli D, Gigli GL. Nerve fibre layer analysis with GDx with a variable corneal compensator in patients with multiple sclerosis. Ophthalmologica. 2007;221:186-9. [ Links ]
15. Kerrison JB, Flynn T, Green WR. Retinal pathologic changes in multiple sclerosis. Retina. 1994;14:445-51. [ Links ]
16. Parisi V, Manni G, Spadaro M, Colacino G, Restuccia R, Marchi S, et al. Correlation between morphological and functional retinal impairment in multiple sclerosis patients. Invest Ophthalmol Vis Sci. 1999;40:2520-7. [ Links ]
17. Steel DH, Waldock A. Measurement of the retinal nerve fibre layer with scanning laser polarimetry in patients with previous demyelinating optic neuritis. J Neurol Neurosurg Psychiatry. 1998;64:505-9. [ Links ]
18. Huang D, Swanson EA, Lin CP, Schuman JS, Stinson WG, Chang W, et al. Optical coherence tomography. Science. 1991;254:1178-81. [ Links ]
19. Pueyo V, Polo V, Larrosa JM, Mayoral F, Ferreras A, Honrubia FM. [Reproducibility of optic nerve head and retinal nerve fiber layer thickness measurements using optical coherence tomography]. Arch Soc Esp Oftalmol. 2006;81:205-11. [ Links ]
20. Weinreb RN, Shakiba S, Zangwill L. Scanning laser polarimetry to measure the nerve fiber layer of normal and glaucomatous eyes. Am J Ophthalmol. 1995;119:627-36. [ Links ]
21. Sepulcre J, Murie-Fernandez M, Salinas-Alaman A, García-Layana A, Bejarano B, Villoslada P. Diagnostic accuracy of retinal abnormalities in predicting disease activity in MS. Neurology. 2007;68:1488-94. [ Links ]
22. Sergott RC. Optical coherence tomography: measuring in-vivo axonal survival and neuroprotection in multiple sclerosis and optic neuritis. Curr Opin Ophthalmol. 2005;16:346-50. [ Links ]
23. Zaveri MS, Conger A, Salter A, Frohman TC, Galetta SL, Markowitz CE, et al. Retinal imaging by laser polarimetry and optical coherence tomography evidence of axonal degeneration in multiple sclerosis. Arch Neurol. 2008;65:924-8. [ Links ]
24. Sergott RC, Frohman E, Glanzman R, Al-Sabbagh A. The role of optical coherence tomography in multiple sclerosis: expert panel consensus. J Neurol Sci. 2007;263:3-14. [ Links ]
25. Honrubia F, Calonge B. Evaluation of the nerve fiber layer and peripapillary atrophy in ocular hypertension. Int Ophthalmol. 1989;13:57-62. [ Links ]
26. Quigley HA, Addicks EM. Quantitative studies of retinal nerve fiber layer defects. Arch Ophthalmol. 1982;100:807-14. [ Links ]
27. Jaffe GJ, Caprioli J. Optical coherence tomography to detect and manage retinal disease and glaucoma. Am J Ophthalmol. 2004; 137:156-69. [ Links ]
28. Paunescu LA, Schuman JS, Price LL, Stark PC, Beaton S, Ishikawa H, et al. Reproducibility of nerve fiber thickness, macular thickness, and optic nerve head measurements using Stratus TCO. Invest Ophthalmol Vis Sci. 2004;45:1716-24. [ Links ]
29. Fisher JB, Jacobs DA, Markowitz CE, Galetta SL, Volpe NJ, Nano-Schiavi ML, et al. Relation of visual function to retinal nerve fiber layer thickness in multiple sclerosis. Ophthalmology. 2006;113:324-32. [ Links ]
30. Pueyo V, Martin J, Fernandez J, Almarcegui C, Ara J, Egea C, et al. Axonal loss in the retinal nerve fiber layer in patients with multiple sclerosis. Mult Scler. 2008;14:609-14. [ Links ]
31. Cheng H, Laron M, Schiffman JS, Tang RA, Frishman LJ. The relationship between visual field and retinal nerve fiber layer measurements in patients with multiple sclerosis. Invest Ophthalmol Vis Sci. 2007;48:5798-805. [ Links ]
32. Pulicken M, Gordon-Lipkin E, Balcer LJ, Frohman E, Cutter G, Calabresi PA. Optical coherence tomography and disease subtype in multiple sclerosis. Neurology. 2007;69:2085-92. [ Links ]
33. Iester M, Cioli F, Uccelli A, Papadia M, Bandini F, Mancardi GL, et al. Retinal nerve fibre layer measurements and optic nerve head analysis in multiple sclerosis patients. Eye. 2009;23:407-12. [ Links ]
34. Gundogan FC, Demirkaya S, Sobaci G. Is optical coherence tomography really a new biomarker candidate in multiple sclerosis? A structural and functional evaluation. Invest Ophthalmol Vis Sci. 2007;48:5773-81. [ Links ]
35. Parikh RS, Parikh SR, Sekhar GC, Prabakaran S, Babu JG, Thomas R. Normal age-related decay of retinal nerve fiber layer thickness. Ophthalmology. 2007;114:921-6. [ Links ]
36. Smith KJ, Kapoor R, Hall SM, Davies M. Electrically active axons degenerate when exposed to nitric oxide. Ann Neurol. 2001;49: 470-6. [ Links ]
37. Brosnan CF, Battistini L, Raine CS, Dickson DW, Casadevall A, Lee SC. Reactive nitrogen intermediates in human neuropathology: an overview. Dev Neurosci. 1994;16:152-61. [ Links ]
38. Imitola J, Chitnis T, Khoury SJ. Insights into the molecular pathogenesis of progression in multiple sclerosis: potential implications for future therapies. Arch Neurol. 2006;63:25-33. [ Links ]
39. Costello F, Coupland S, Hodge W, Lorello GR, Koroluk J, Pan YI, et al. Quantifying axonal loss after optic neuritis with optical coherence tomography. Ann Neurol. 2006;59:963-9. [ Links ]
40. Noval S, Contreras I, Rebolleda G, Muñoz-Negrete FJ. Optical coherence tomography versus automated perimetry for follow-up of optic neuritis. Acta Ophthalmol Scand. 2006;84: 790-4. [ Links ]
41. Kupfer C. Retinal ganglion cell degeneration following chiasmal lesions in man. Arch Ophthalmol. 1963;70:256-60. [ Links ]
42. Gordon-Lipkin E, Chodkowski B, Reich DS, Smith SA, Pulicken M, Balcer LJ, et al. Retinal nerve fiber layer is associated with brain atrophy in multiple sclerosis. Neurology. 2007;69: 1603-09. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: egmvivax@yahoo.com
(E. García-Martín).
Recibido el 31 de mayo de 2009
Aceptado el 18 de junio de 2010














