My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos de la Sociedad Española de Oftalmología
Print version ISSN 0365-6691
Arch Soc Esp Oftalmol vol.85 n.9 Sep. 2010
Guías de práctica clínica de la SERV: manejo de las oclusiones venosas de la retina
SERV clinical paractice guidelines: management of retinal vein occlusion
F. Gómez-Ullaa, M.J. Abraldesa, E. Basaurib, M. Fernándeza, A. García-Layanac, P. Gilid, J. Monteroe,k, J. Nadalf, V. Moralesg, M. Saraviah, F. Cabrerai y E. Cerveraj
aComplejo Hospitalario Universitario de Santiago de Compostela, Instituto Tecnológico de Oftalmología (ITO), Santiago de Compostela, España
bHospital Son Llàtzer, Instituto Balear de Oftalmología (IBO), Palma de Mallorca, España
cClínica Universidad de Navarra, Pamplona, España
dHospital Universitario Fundación Alcorcón, Madrid, España
eHospital Universitario Pio del Rio Hortega, Valladolid, España
fCentro Oftalmológico Barraquer, Barcelona, España
gHospital Dr. Luis Sánchez Bulnes, México DF, México
hHospital Universitario Austral, Buenos Aires, Argentina
iComplejo Hospitalario Materno-Insular, Las Palmas de Gran Canaria, España
jConsorcio Hospital General Universitario de Valencia, Valencia, España
kVISSUM Instituto Oftalmológico de Alicante, Alicante, España
Dirección para correspondencia
RESUMEN
Propósito: Se presenta una guía de manejo de las oclusiones venosas retinianas. Esto se hace necesario en un momento en el que han aparecido varias alternativas terapéuticas cuyo papel aún no está completamente definido.
Métodos: Se revisa la literatura publicada hasta el momento identificando los artículos más relevantes, clasificándolos en base al nivel de evidencia.
Resultados: Teniendo en cuenta las distintas opciones de tratamiento que existen en la actualidad, se sugieren varias líneas de actuación. Se discute el papel de las exploraciones complementarias y se recomiendan pautas de tratamiento en base a los hallazgos clínicos, angiográficos y tomográficos.
Conclusiones: aunque no existe un consenso total, esta guía promueve un estándar de buena práctica clínica y proporciona una actualización del manejo de las oclusiones venosas retinianas.
Palabras clave: Oclusion venosa retiniana. Edema macular. Tomografía de coherencia óptica. Fotocoagulación. Angiografía. Fármacos antiangiogénicos.
ABSTRACT
Purpose: A guidelines for the management of retinal vein occlusion is presented. This is necessary because at this moment several therapeutic alternatives have been developed although their role is not yet sufficiently defined.
Methods: Review of the literature for evidence published up to date. Relevant literature was identified and the level of evidence graded. Evidence was then assessed for consistency, applicability and clinical impact. The information was contrasted with those guides published in other countries.
Results: Taking into account the different options of treatment that are currently used, several modes of action are suggested. The role of the various complementary examinations are discussed and it is recommended that criteria for the treatment are based on clinical, angiographic, and tomographic findings.
Conclusions: Although there is no overall consensus, these guidelines promote a good standard of clinical practise and provide an update of the management of retinal vein occlusion.
Key words: Retinal vein occlusion. Macular edema. Optic coherence tomography. Photocoagulation. Angiography. Antiangiogenic drugs.
Objetivos de la guía
El propósito de esta guía es presentar unas directrices generales que sirvan de orientación para la clasificación, diagnóstico y tratamiento de las oclusiones venosas retinianas (OVR) en un momento en el que están apareciendo nuevas alternativas terapéuticas cuyo papel aún no está bien definido.
Esta guía sugiere líneas de actuación para las diferentes variantes clínicas, pero no pretende establecer criterios de obligado cumplimiento, ni eximir al oftalmólogo de su responsabilidad de reflexionar ante un caso concreto y actuar según su buen criterio profesional. Además en modo alguno limita o vincula la libertad del oftalmólogo en su toma de decisiones para el tratamiento de un paciente determinado. Puede así optar por otra pauta distinta, dentro de las técnicas habituales requeridas, si entiende que, según su experiencia, el resultado buscado exige otro tipo de terapia. El que dicha opción no esté contemplada en este documento como pauta de actuación recomendada, no puede considerarse en modo alguno como una mala praxis profesional o una vulneración de la "lex artis ad hoc".
Para conseguir establecer las directrices se ha realizado una amplia revisión de la literatura y de los protocolos existentes por parte de una comisión nombrada a tal fin por la Sociedad Española de Retina y Vítreo y se han discutido las distintas opciones terapéuticas disponibles en la actualidad y su indicación más aceptada, de forma que las recomendaciones clínicas, diagnósticas y terapéuticas se basan en conocimientos científicos y niveles de evidencia.
Los niveles de evidencia y grados de recomendación están basados en la US Agency for Health Research and Quality:
Nivel de evidencia 1. 1a: la evidencia proviene de meta-análisis de ensayos controlados, aleatorizados, bien diseñados. 1b: la evidencia proviene de, al menos, un ensayo controlado aleatorizado.
Nivel de evidencia 2. 2a: la evidencia proviene de, al menos, un estudio controlado bien diseñado sin aleatorizar. 2b: la evidencia proviene de, al menos, un estudio no completamente experimental, bien diseñado, como los estudios de cohortes. Se refiere a la situación en la que la aplicación de una intervención está fuera del control de los investigadores, pero su efecto puede evaluarse.
Nivel de evidencia 3. La evidencia proviene de estudios descriptivos no experimentales bien diseñados, como los estudios comparativos, estudios de correlación o estudios de casos y controles.
Nivel de evidencia 4. La evidencia proviene de documentos u opiniones de comités de expertos o experiencias clínicas de autoridades de prestigio o de los estudios de series de casos.
Grado de recomendación. A: Basada en una categoría de evidencia 1. Extremadamente recomendable. B: Basada en una categoría de evidencia 2. Recomendación favorable. C: Basada en una categoría de evidencia 3. Recomendación favorable pero no concluyente. D: Basada en una categoría de evidencia 4. Consenso de expertos, sin evidencia adecuada de investigación.
Manejo de las oclusiones venosas de la retina
Clasificación anatómica
Permite diferenciar entidades con una historia natural, pronóstico y tratamiento diferentes1-3.
1. Oclusión de vena central de la retina (OVCR): oclusión de la vena central de la retina localizada en el nervio óptico.
2. Oclusión de rama venosa retiniana (ORVR):
ORVR mayor o principal: Oclusión de rama de primer orden fuera de la papila pero con afectación de ramas maculares.
ORVR macular o menor: afectación solo de una rama macular.
ORVR periférica o secundaria: oclusión de rama venosa que no afecta a la circulación macular, frecuentemente asintomática.
3. Oclusión hemicentral de vena retiniana (HemiC-OVR): oclusión de la rama principal superior o inferior de vena central de retina a nivel papilar. Clásicamente incluida entre las oclusiones de rama; sin embargo, el curso clínico, pronóstico y manejo está más próximo a la OVCR. Cuando la oclusión se produce fuera de la papila, el punto de la oclusión es visible y por la disposición anatómica de división afecta a toda la hemirretina superior o inferior, se denomina oclusión hemirretiniana pero a diferencia de la hemicentral en nada se diferencia de las ORVR.
Fisiopatología y factores de riesgo
La formación de trombos es el factor fisiopatológico primario y la proliferación endotelial y la reacción inflamatoria son efectos secundarios4.
1. OVCR: factores anatómicos como proximidad de arteria y vena central en lámina cribosa, localización, estrechamiento de los vasos a su paso, que puede conducir a la aparición de turbulencias y formación de trombos.
2. ORVR: cruce arteriovenoso por aplastamiento de la vena bajo la arteria (signo de Gunn) en la retinopatía esclerohipertensiva. La arteria y la vena comparten una misma adventicia y sus paredes vasculares se encuentran juntas.
Factores de riesgo (tabla 1)
En ocasiones las oclusiones vasculares retinianas ponen de manifiesto un proceso sistémico, con un incremento de la morbilidad y mortalidad.
Factores de riesgo clásicos: hipertensión arterial (HTA) y diabetes5,6.
1. Glaucoma de ángulo abierto: presente en el 40% de los pacientes con OVCR (o lo desarrollarán).
2. HTA: factor de riesgo más importante sobre todo en pacientes mayores de 60 años (asociación hasta en el 64% de los casos). La HTA no controlada se asocia a recurrencia del cuadro oclusivo o a la afectación del otro ojo.
3. Diabetes: probablemente no por la DM en sí sino por el incremento asociado de otros factores de riesgo cardiovascular.
4. Hiperlipidemia (principal factor de riesgo en menores de 50 años), también se encuentra presente en la mitad de los pacientes de más edad.
5. Hiperviscosidad sanguínea (policitemia, niveles elevados de fibrinógeno, macroglobulinemia de Waldenstrom)7,8.
6. Trombofilia (mayor predisposición a la formación de trombos), como los anticuerpos antifosfolípidos (anticardiolipina y el anticoagulante lúpico), hiperhomocisteinemia (riesgo de enfermedad vascular, concentración dependiente, independiente del resto de factores) y sistema de anticoagulantes naturales (factor V de Leiden, proteína C, proteína S y antitrombina III)9.
Se recomienda descartar la hiperhomocisteinemia en todos los pacientes con oclusión de la vena central de la retina; niveles superiores a 11µmol/l aumentan el riesgo de enfermedad aterosclerótica en individuos asintomáticos y se recomiendan niveles en el rango de 9-10µmol/l10,11 mediante complejos vitamínicos que contengan ácido fólico11.
El síndrome antifosfolípido (APS) se caracteriza por un aumento de la hipercoagulabilidad con trombosis de repetición (arterial y venosa), morbilidad en el embarazo (abortos fetales recurrentes) y alteraciones hematológicas (trombopenia y/o anemia hemolítica). El anticoagulante lúpico y los anticuerpos anticardiolipina son los mejor conocidos. El 29% de pacientes con APS primario presentan alteraciones oculares como tortuosidad vascular, exudados algodonosos y pequeñas oclusiones detectables mediante angiografía fluoresceínica (AGF)12.
Terapia hormonal sustitutiva y anticonceptivos orales: mayor riesgo de oclusión venosa. No debe ser instaurado en mujeres con antecedentes de eventos tromboembólicos retinianos. Se discute si se debe discontinuar tras una trombosis (se suele hacer, aunque se debe valorar de manera individual en cada caso)13.
Otros procesos infrecuentes: vasculitis retiniana, enfermedad de Behçet, poliarteriris nodosa, granulomatosis de Wegener.
Papel del oftalmólogo en el estudio de los factores de riesgo sistémicos
Las oclusiones vasculares retinianas se asocian a mayor riesgo de muerte por causa vascular cardiaca o cerebral. Es responsabilidad del oftalmólogo estudiar los principales factores de riesgo sistémicos, interpretar los resultados, y remitir al paciente al especialista adecuado (como norma general el inicio del manejo médico de los factores de riesgo se debe realizar dentro de los dos primeros meses tras el diagnóstico)14.
Los menores de 50 años normalmente presentan factores de riesgo como HTA o hiperlipidemias pero en ocasiones es imposible encontrar una causa subyacente.
En la Tabla 2 se expone un protocolo de solicitud de analíticas en las OVR.
Manifestaciones clínicas
Oclusión de vena central de la retina
Síntomas: pérdida visual brusca y grave, indolora (más acusada en formas isquémicas). Pérdida de campo visual extensa.
Signos: fase aguda: tortuosidad y dilatación venosa, hemorragias superficiales, edema macular (EM), edema de papila y exudados algodonosos peripapilares, en los cuatro cuadrantes de la retina. Defecto pupilar aferente (formas isquémicas). Fase crónica: vasos colaterales en la papila y retina, dilatación y tortuosidad venosa persistente, envainamiento venoso, estrechamiento arteriolar y anomalías maculares (EM crónico y alteraciones pigmentarias maculares). Neovascularización (15-34% formas no isquémicas; 50% formas isquémicas)2.
Oclusión de rama venosa retiniana
Síntomas: pérdida visual brusca, moderada (si se afecta la mácula). El EM es la causa más común de pérdida visual crónica. Escotomas o pérdida campimétrica sectorial/altitudinal (esto último solo en las formas isquémicas).
Signos: fase aguda: dilatación venosa y hemorragias retinianas superficiales en un sector bien delimitado (área de drenaje de la vena). Otros signos: EM, exudados algodonosos, estrechamiento arteriolar. Fase crónica: vasos colaterales, microaneurismas, alteraciones maculares crónicas: EM persistente, alteración del epitelio pigmentario de la retina (EPR), fibrosis subretiniana, membranas epirretinianas. Neovascularización papilar (NVP) o retiniana (NVR) (36% casos formas isquémicas), hemorragia vítrea3,15.
Oclusión hemicentral de vena retiniana
Síntomas: pérdida visual súbita con defecto campimétrico típicamente altitudinal (en las formas isquémicas).
Signos: dilatación venosa y hemorragias retinianas que afectan a la hemirretina superior o inferior, afectando por igual al cuadrante nasal y temporal. Otros signos de oclusión venosa. Desde un punto de vista clínico y fisiopatológico está más próxima a la oclusión de vena central, aunque con mayor riesgo de neovascularización que esta16.
Pruebas complementarias
Angiografía fluoresceínica (AGF)
Diferencia las oclusiones venosas isquémicas de las formas no isquémicas.
Determina la extensión de la isquemia y el EM, confirma el diagnóstico en casos dudosos y diferencia las telangiectasias de los neovasos. Puede tener un cierto valor pronóstico en la recuperación de la agudeza visual (AV) en la valoración de la mácula y la presencia de isquemia macular severa con agrandamiento de la zona avascular foveal, especialmente en las formas isquémicas de OVCR. Habitualmente la AGF no se realiza en la fase aguda de las OVR por el efecto pantalla de las hemorragias. Se suele esperar de 3 a 6 meses desde la fase aguda.
Oclusión de vena central de la retina
Diferencia formas isquémicas y no isquémicas (isquemia retiniana viene definida por la presencia de 10 o más áreas de disco (AD) de no perfusión retiniana)17.
Signos en la AGF: retraso en la circulación arteriovenosa (mayor en formas isquémicas), hipofluorescencia por efecto pantalla, áreas de no perfusión (formas isquémicas), tinción y rezume de paredes venosas, rezume macular en fases tardías. En fases crónicas: colaterales y/o neovasos.
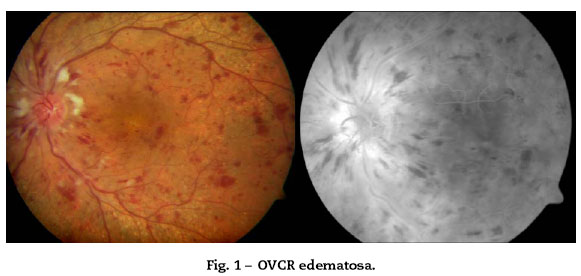
1. OVCR no isquémica, parcial, edematosa o hiperpermeable: 75% de los casos. Mejor pronóstico; la mayor complicación es el EM cistoide. Un tercio pueden evolucionar a formas isquémicas18 (Fig. 1).
2. OVCR isquémica o total: 25% de los casos. Peor pronóstico, desarrollan neovasos en el 35% de los casos19. La principal complicación es el glaucoma neovascular: el riesgo de neovasos en iris es mayor si el área de isquemia retiniana es superior a 10 AD20 (Fig. 2).
Oclusión de rama venosa retiniana
Permite diferenciar la ORVR no isquémica de la ORVR isquémica: mayor riesgo de neovascularización (36% si área isquémica >5 AD)21
Signos en la AGF: retraso en el relleno venoso, hipofluorescencia por efecto pantalla (hemorragias), hipofluoescencia por no perfusión capilar (isquemia), hiperfluorescencia difusa en fases tardías (rezume, edema), aumento de permeabilidad y tinción de las paredes venosas. (Fig. 3 y Fig. 4)
Oclusión hemicentral de vena retiniana
Permite diferenciar las formas no isquémicas (78% casos)22 de las isquémicas.
Signos en la AGF: iguales a los descritos en ORVR afectando a dos cuadrantes (hemirretina).
Tomografía de coherencia óptica (OCT)
Fundamental en el estudio de las oclusiones venosas para evaluar cuantitativa y cualitativamente si existe EM y la respuesta al tratamiento.
Se debe hacer:
1. En el momento del diagnóstico y antes del tratamiento (la indicación y el tipo de tratamiento dependen en gran medida de sus resultados).
En cada visita de seguimiento tras el tratamiento (mensual o trimestral el primer año). Si el paciente permanece estable en el segundo año se puede realizar semestralmente y luego anual.
Diagnóstico
1. Caracterización del EM: aporta información cuantitativa (medida del espesor retiniano) y cualitativa (cambios morfológicos asociados a la acumulación de líquido).
2. Estudio de la interfase vítreo-macular.
Cambios morfológicos:
1. Engrosamiento retiniano con o sin espacios quísticos (quiste único, múltiple o coalescencia) (Fig. 5).
2. Aumento de la reflectividad con efecto pantalla en caso de hemorragia.
3. Alteración de la depresión foveal.
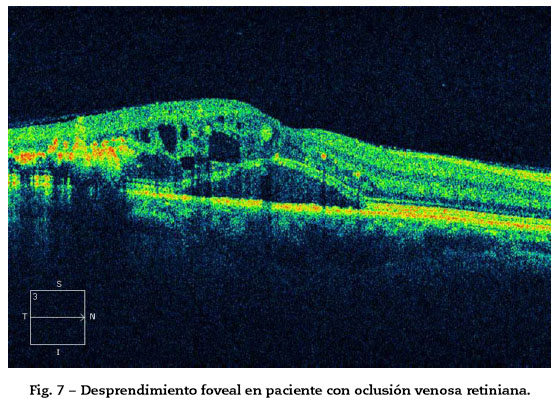
4. Desprendimiento de retina neurosensorial (DRNS) con líquido subretiniano (más frecuente en EM causado por oclusiones venosas que en otras dolencias por el daño del epitelio pigmentario (EPR) secundario a inflamación e isquemia y el incremento del fluido intrarretiniano)23. Justifica la mala visión del paciente (Fig. 7).
5. Presencia de membrana epirretiniana (MER) o agujero macular (AM)24 (Fig. 6).
6. Ayuda a localizar las áreas de mayor engrosamiento para guiar con la AGF el tratamiento con láser.
Tratamiento
1. Seguimiento de los pacientes a través de variaciones en el espesor retiniano (valoración cuantitativa de la respuesta terapéutica).
2. Evaluación secuencial de seguimiento: mejoría o empeoramiento del EM (indicación o no de retratamiento, con los cambios en AV).
3. Valoración de las complicaciones asociadas (agujeros lamelares tras la rotura de un quiste, formación de una MER, AM completo, síndrome de tracción vítreo-macular).
En la Fig. 8 se representa la aportación del estudio de fondo de ojo, AGF y OCT.
Tratamiento oftalmológico de las oclusiones venosas de la retina
Los objetivos del tratamiento son actuar sobre las complicaciones oftalmológicas que son causa de disminución visual y amenazan con la pérdida parcial o total de la visión y la identificación y actuación sobre factores sistémicos que pueden ser modificables.
Tratamiento de las oclusiones de vena central de la retina (fig. 9)
Se deben tratar siempre las enfermedades sistémicas asociadas cuando las haya como ya se ha comentado anteriormente. No hay evidencia de que el tratamiento precoz sobre el globo ocular modifique el pronóstico visual en los casos de OVCR establecida.
El principal problema es diferenciar entre las formas isquémicas y no isquémicas. Nivel de evidencia 3, grado de recomendación C.
Oclusión de vena central de la retina isquémica
Seguimiento: controles mensuales para descartar neovascularización iridiana (NVI) o neovascularización del ángulo (NVA)20. Puede ser suficiente con revisar cada 2-3 meses, a menos que existan factores de riesgo particulares. Nivel de evidencia 1, grado de recomendación A.
PFC cuando aparezca el primer signo de NVI o NVA20. Nivel de evidencia 1, grado de recomendación A.
PFC profiláctica cuando no se puedan realizar los controles preceptivos25. Nivel de evidencia 3, grado de recomendación C.
En el 90% de los casos, la regresión de los NVI/NVA se produce a los 1 o 2 meses tras la PFC. La persistencia de los neovasos debe controlarse y se puede realizar una PFC suplementaria.
La presencia de NVP o NVR sin NVI/NVA se debe tratar mediante PFC para impedir la neovascularización del segmento anterior.
No está comprobado el efecto protector del acetónido de triamcinolona intravítreo (TAIV) sobre la neovascularización anterior. Nivel de evidencia 4, grado de recomendación D.
Oclusión de vena central de la retina no isquémica
Controles periódicos durante 3 años para detectar una conversión a isquémica por el mayor riesgo de progresión durante ese período de tiempo20.
Pronóstico razonablemente bueno si no evoluciona a forma isquémica, con una restauración de la AV en cerca del 50% (la principal causa de mala AV es el EM cistoide crónico). El pronóstico depende de la AV inicial.
Seguimiento: AV de 20/40 o superior: control cada 1-2 meses durante 6 meses y posteriormente anual si el proceso está estable. AV inferior a 20/200: control mensual durante los 6 primeros meses y después bimestralmente los siguientes 6 meses (mayor grado de falta de perfusión y riesgo de desarrollar NVI/NVA). AV entre 20/50 y 20/200: control mensual durante los primeros 6 meses (riesgo intermedio de desarrollar NVI/NVA).
Si en algún momento la AV disminuye por debajo de 20/200, será necesaria una evaluación del estado de perfusión con seguimiento mensual durante otros 6 meses20.
Tratamiento del glaucoma neovascular
La panfotocoagulación (PFC) retiniana puede ser beneficiosa en el tratamiento del glaucoma neovascular. Nivel de evidencia 3, grado de recomendación C.
Si el ojo es amaurótico el objetivo es mantenerlo sin dolor, habitualmente con esteroides tópicos y atropina.
Si el ojo tiene visión, se controla la presión intraocular con fármacos antiglaucomatosos o mediante procedimientos cicloablativos. Nivel de evidencia 4, grado de recomendación D.
La utilización de bevacizumab intravítreo o intracamerular produce una regresión de los NVI y NVA26. Los neovasos del iris regresan más rápidamente cuando se utiliza bevacizumab en combinación con PFC que cuando se utiliza solo PFC. Bevazizumab puede reducir la necesidad de realizar un tratamiento quirúrgico, y servir como adyuvante en la cirugía filtrante27,28. Nivel de evidencia 3, grado de recomendación C.
Tratamiento del edema macular (fig. 10)
No existe ningún tratamiento efectivo para el EM asociado a la OVCR.

Fig. 10. Algoritmo del manejo del EM asociado a una obstrucción venosa retiniana.
1. El uso de TAIV y antiVEGF se realiza fuera de indicación.
2. La utilización de los implantes intravítreos de dexametasona (Ozurdex®) ha sido aprobada
por la FDA en junio de 2009 y actualmente está en proceso de aprobación por la EMEA.
3. Se puede valorar la realización de vitrectomía en cualquier momento en caso de evidencia
de tracción vítrea o en visiones bajas (menor o igual a 20/40) y falta de respuesta a los tratamientos establecidos.
La fotocoagulación en rejilla no produce ningún beneficio y no es recomendable. En el Central Vein Occlusion Study29 no se observaron diferencias significativas en la AV entre los ojos tratados mediante láser en rejilla y los no tratados. Nivel de evidencia 1, grado de recomendación A.
El tratamiento con TAIV puede conseguir una mejoría transitoria tanto anatómica como funcional del EM asociado a la OVCR (estudios de series de casos)30-33 necesitándose múltiples inyecciones para mantener el efecto. En muchos pacientes no se consigue una mejoría de la AV. La dosis óptima no está del todo aclarada, pero la más utilizada es la de 4mg34-36. Nivel de evidencia 4, grado de recomendación D.
La seguridad, a largo plazo, y la eficacia de la TAIV está siendo actualmente investigada en un ensayo clínico multicéntrico denominado SCORE (Standard Care versus Corticosteroid for Retinal Vein Occlusion Study)37-39, que compara la eficacia y seguridad de 1mg y 4mg de dosis de triamcinolona intravítrea sin conservantes frente a la observación en ojos con pérdida de visión asociada a EM secundario a OVCR no isquémica. Los resultados publicados hasta la fecha concluyen que el uso de triamcinolona intravítrea es superior a la observación y que la dosis de 1mg tiene un perfil de seguridad superior a la de la 4mg39. Nivel de evidencia 1, grado de recomendación A.
También han sido evaluados en un ensayo clínico multicéntrico y aleatorizado los resultados de los implantes de dexametasona intravítreos (Ozurdex®). Se trata de un estudio (estudio GENEVA -Global evaluation of implantable dexamethasone in retinal vein occlusion with macular edema-) a 6 meses ampliado a 12 meses en el que se analiza la eficacia y seguridad de 350µg y 750µg de Ozurdex® en OVR40. En los casos de OVCR el fármaco fue bien tolerado y se observó una mejoría significativa de la AV con ambas dosis a los 30, 60 y 90 días pero dicha mejoría no fue significativa a los 180 días. Los cambios en el grosor macular con OCT fueron significativos a los 90 días del estudio y dejaron de serlo a los 180 días. Nivel de evidencia 1, grado de recomendación A.
En varias series de casos se puso de manifiesto que el tratamiento con fármacos antiangiogénicos (anti-VEGF) intravítreos puede producir disminución del espesor macular, disminución de las hemorragias retinianas y mejoría de la AV. Sin embargo, los periodos de seguimiento de estas series de estudio son cortos41-45. En la actualidad este tratamiento no puede ser todavía recomendado. Nivel de evidencia 4, grado de recomendación D (Fig. 11).
Asimismo varias publicaciones sugieren que la administración intravítrea de bevacizumab en los momentos iniciales de una OVCR no isquémica puede revertir el EM, las hemorragias retinianas y mejorar la visión46. Sin embargo, como en estas etapas iniciales de la enfermedad la resolución espontánea puede ocurrir como parte de la historia natural de la enfermedad, no se puede recomendar este tratamiento basándose en la evidencia actual. Nivel de evidencia 4, grado de recomendación D.
Se esperan para el año 2010 los resultados del estudio CRUISE47, un ensayo clínico que valora la eficacia del ranibizumab en el tratamiento del edema macular secundario a la OVCR. Los resultados preliminares de este estudio relevan un incremento en la visión de los pacientes tras un seguimiento de 6 meses. Nivel de evidencia 1, grado de recomendación A.
Tratamientos experimentales
La anastomosis coriorretiniana inducida por láser48 es un tratamiento experimental cuyos resultados no han mostrado un claro beneficio. Además se han descrito varias complicaciones asociadas a este procedimiento como son la neovascularización coroidea49, la tracción y la fibrosis retiniana y subretiniana50 y el hemovítreo51.
Tratamiento de las oclusiones de rama venosas retinianas (fig. 12)
Al igual que en las OVCR, se deben tratar siempre las enfermedades sistémicas asociadas.
El EM y la NVR o NVP son las dos principales complicaciones de la ORVR susceptibles de tratamiento.
La neovascularización tiene lugar en el 36% de los ojos con áreas de no perfusión >5 DP y en el 62% de los ojos con >10 DP52,53.
Tratamiento de la neovascularización
La neovascularización se produce solo cuando existe un cierre de los capilares de al menos un cuadrante. Suele tener lugar en los seis meses siguientes a la oclusión.
La NVR y la NVP son indicación de realizar fotocoagulación en el área de retina isquémica (fotocoagulación sectorial)52,5. Nivel de evidencia 1, grado de recomendación A. La fotocoagulación se debe realizar una vez que se haya producido la neovascularización y no de forma profiláctica52,54.
Seguimiento: cada 3-4 meses en los pacientes que presentan isquemia en uno o más cuadrantes (Fig. 13).
Tratamiento del edema macular
Láser en rejilla en el área de difusión capilar, después de un periodo de 3 a 6 meses del inicio de la enfermedad y cuando ya se haya reabsorbido la mayor parte del componente hemorrágico, es beneficioso54-56. Nivel de evidencia 1, grado de recomendación A (Fig. 14).
Si la visión se reduce a 20/40 o peor, se espera de 3 a 6 meses para que el componente hemorrágico se haya aclarado. Se recomienda fotocoagulación macular en rejilla cuando la pérdida de visión es de 20/40 o peor sin mejoría y es debida a un EM con buena perfusión macular55. Si se debe a una falta de perfusión macular no se recomienda el tratamiento con láser55.
Revisiones: la primera a los tres meses de la oclusión, y las siguientes a intervalos de 3 a 6 meses, dependiendo de las posibles complicaciones y de si fueron o no tratados.
Pronóstico: Entre un tercio y la mitad de los pacientes con ORVR recuperan la visión a 20/40 o mejor sin tratamiento. Los pacientes con disminución de visión secundaria a EM superior a un año tienen muchas menos probabilidades de recuperar la visión (Fig. 10 y Fig. 14).
Inyecciones intravítreas de corticoides. La TAIV mejora la visión y reduce el EM secundario a ORVR57-59. Nivel de evidencia 4, grado de recomendación D.
Complicaciones: aumento de la presión intraocular y formación de cataratas. La seguridad, a largo plazo y la eficacia de la TAIV están siendo investigadas en el SCORE38,60, (eficacia y seguridad de 1mg y 4mg de dosis de triamcinolona intravítrea libre de conservantes frente al tratamiento estándar -fotocoagulación en rejilla- en ojos con pérdida de visión asociada a EM secundario a ORVR). No hubo diferencias en la AV a los 12 meses pero la tasa de acontecimientos adversos (presión intraocular elevada y catarata) fue superior en el grupo de 4mg. Según este estudio la fotocoagulación en rejilla sigue siendo el tratamiento estándar para pacientes con pérdida de visión asociada con EM secundario a ORVR. Nivel de evidencia 1, grado de recomendación A.
Los implantes de dexametasona intravítreos (Ozurdex®) han sido evaluados en el estudio GENEVA40. El fármaco fue bien tolerado y se observó una mejoría significativa de la AV a los 30, 60 y 90 días, que desapareció a los 180 días del tratamiento. Los cambios en el grosor macular con OCT, fueron significativos a los 90 días del estudio y dejaron de serlo a los 180 días. Nivel de evidencia 1, grado de recomendación A.
Las inyecciones perioculares de acetónido de triamcinolona61,62 presentan una eficacia mucho menor que cuando el fármaco se administra por vía intraocular62. Nivel de evidencia 3, grado de recomendación C.
Inyecciones de fármacos antiangiogénicos45,63-66: Bevacizumab: evidencia basada en series de casos con escaso seguimiento. Son necesarias múltiples inyecciones para mantener el efecto. La pauta más común de tratamiento es realizar dos o tres inyecciones durante los 5-6 primeros meses45,63. Los autores de esta guía recomiendan la realización de una fase de carga que consiste en la inyección mensual durante tres meses reevaluando posteriormente la necesidad de realizar más inyecciones. Nivel de evidencia 3, grado de recomendación C.
Son necesarios estudios controlados y aleatorizados para evaluar, a más largo plazo, la eficacia y la seguridad de las inyecciones intravítreas de bevacizumab. Actualmente no se pueden hacer recomendaciones para la utilización del bevacizumab. Nivel de evidencia 3, grado de recomendación C.
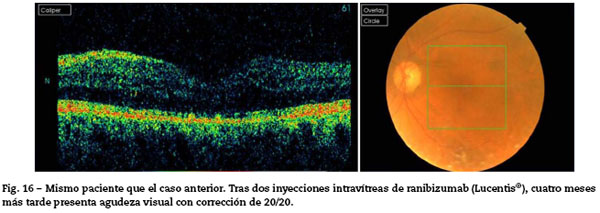
Ranibizumab: los resultados preliminares del ensayo BRAVO67 revelan una ganancia estadísticamente significativa en la visión de los pacientes tras un seguimiento de 6 meses. Nivel de evidencia 1, grado de recomendación A (Fig. 15 y Fig. 16).
Tratamiento de la oclusión hemicentral de vena retiniana
Similar al descrito para la ORVR con dos salvedades:
1. El riesgo de rubeosis es mayor en la oclusión venosa hemicentral de tipo isquémico que en la ORVR pero menor que en la OVCR68.
2. El riesgo de NVP es más alto en la HemiC-OVR que en la OVCR isquémica o en la ORVR16.
Tratamiento quirúrgico de las oclusiones venosas retinianas
Oclusión de vena central de la retina
Neurotomía óptica radial (NOR)
Principio: se basa en el concepto de "síndrome compartimental neuro-vascular".
Objetivo: descomprimir el compartimento escleral externo (espacio escleral, lámina cribosa, nervio óptico, arteria y vena central de la retina)69,70.
Procedimiento: vitrectomía pars plana, extracción de la hialoides posterior, realización de una incisión radial única en el lado nasal de la papila hasta el centro de la lámina cribosa, previo estudio AGF para valorar el lugar libre de grandes vasos. Nivel de evidencia 3, grado de recomendación C71.
La mejoría de la AV después de una NOR se cree que es debida a una más rápida resolución de un EM en OVCR estimulando la formación de vascularización colateral (óptico-ciliares) y la consecuente mejoría del flujo sanguíneo70. No hay evidencia que apoye el mecanismo de incremento del flujo vascular retiniano72.
Los resultados anatómicos y visuales de la NOR en las distintas series70-73 parecen ser mejores a largo plazo74,75 que la historia natural de la enfermedad19.
La terapia combinada de NOR con triamcinolona intravítrea71,72,76 no parece presentar diferencias estadísticamente significativas con la NOR aislada.
Complicaciones potenciales: hemorragias intraoperatorias, laceración de la arteria o vena central de la retina, perforación del globo ocular, desprendimiento de retina, defectos del campo visual.
Vitrectomía con o sin pelado de la membrana limitante interna (MLI)
Principio: el mecanismo de acción es desconocido. Se ha planteado una posible hipótesis, que explica esta mejoría por un aumento de suministro de oxígeno a la retina isquémica77. Otra teoría defiende que la vitrectomía libera la tracción de la superficie retiniana78,79. En cuanto al pelado de la membrana limitante interna, la tracción resultante de las fibras vítreas sobre las células de Müller incrementaría el riesgo de EM quístico80. Nivel de evidencia 3, grado de recomendación C.
Oclusión de rama venosa retiniana
Adventiciotomía del cruce arteriovenoso
Principio: se cree que la ORVR ocurre en el cruce arteriovenoso, donde arteria y vena comparten una adventicia común81; la HTA y la arteriosclerosis comprimen la vena, lo que da lugar a la aparición de turbulencias, lesión del endotelio vascular y secundariamente la formación de un trombo. Nivel de evidencia 3, grado de recomendación C.
El mecanismo de acción es descomprimir el cruce arteriovenoso82.
Procedimiento: vitrectomía pars plana, desprendimiento de la hialoides posterior alrededor del nervio óptico y de la retina posterior, incisión en la retina interna, a aproximadamente de 100 a 500µm del cruce arteriovenoso que se extiende paralela a la arteriola retiniana hasta alcanzar la adventicia común, en cuyo punto se separan los vasos83,84.
El éxito de la adventiciotomía se puede atribuir en parte a la vitrectomía que se realiza al mismo tiempo85,86.
Complicaciones potenciales: cataratas, defectos en la capa de fibras nerviosas, hemorragia, desgarros retinianos, desprendimiento de retina, gliosis posoperatoria. Se trata de un procedimiento difícil de realizar. La sección de la adventicia requiere cirugía bimanual.
No existe ningún estudio amplio, aleatorizado y controlado que defienda el uso de la adventiciotomía en el tratamiento del EM secundario a ORVR, aunque es un procedimiento a considerar especialmente en los casos de corta evolución.
Anticoagulación local
Objetivo: empleo de anticoagulantes y antiagregantes plaquetarios encaminado a la disolución del trombo a nivel de la lámina cribosa y a la prevención de nuevos trombos para restaurar el flujo hemático y mejorar la AV87,88. Se ha empleado RTPA por vía sistémica88, RTPA intravítrea87,89 o mediante cateterización de la arteria oftálmica con uroquinasa90. Nivel de evidencia 3, grado de recomendación C88.
El efecto del RTPA es mayor en trombos inmaduros pero menos efectivo en trombos maduros de larga evolución como es el caso de la OVCR91.
Los tratamientos anticoagulantes tales como la aspirina, heparina o trombolíticos intravenosos no han demostrado suficiente eficacia.
Tratamiento médico de las oclusiones venosas retinianas
Como ya se ha comentado anteriormente, es responsabilidad del oftalmólogo cuando hace el diagnóstico de OVR, estudiar los principales factores de riesgo sistémico (Tabla 1), solicitar la analítica correspondiente (Tabla 2), interpretar sus resultados y remitir al paciente al especialista para que inicie el tratamiento, si fuese necesario, con el objetivo de prevenir daños sistémicos asociados, la recurrencia de otra oclusión venosa y particularmente en el segundo ojo.
Los anticoagulantes, la heparina, no han demostrado ser eficaces. Lo mismo ocurre con los agentes fibrinolíticos como la estreptokinasa o el activador del plasminógeno tisular. Los fármacos antiagregantes como la aspirina o las prostaciclinas, aunque parecería lógico que tuviesen un efecto beneficioso, este no ha podido ser demostrado con niveles de evidencia 3, lo mismo ocurre con la hemodilución.
Se ha demostrado que las OVR están asociadas a un aumento de causas vasculares de muerte (cardiaca y cerebral)92. Por ello es importante el uso de fármacos antihipertensivos para controlar la tensión arterial en los pacientes con OVR que presenten una HTA como enfermedad de base, así como el uso de estatinas si fuese necesario, y seguir las indicaciones de las guías europeas para el control y tratamiento de la HTA.
La recurrencia de la OVR en el ojo afectado o su aparición en el adelfo puede darse hasta en el 15% de los pacientes, por lo que el control de los factores de riesgo cardiovascular subyacentes es importantísimo para reducir este porcentaje con un grado de recomendación C22.
En las personas por debajo de los 50 años, la OVCR suele ser mas benigna en mayor número de casos, aunque todavía hay un 15-20% que desarrollan pérdida importante de visión y complicaciones neovasculares, y aunque se ha indicado que la corticoterapia sistémica podría mejorar el pronóstico de este grupo, no hay evidencia científica para recomendarla. La píldora anticonceptiva es un antecedente frecuente y debe ser contraindicada en estos pacientes. Se deben también identificar enfermedades inflamatorias y enviar al especialista. Y en este grupo de edad con ORVR suele haber HTA y/o hiperlipidemia como enfermedad sistémica subyacente más frecuente, la cual debe ser tratada adecuadamente.
Bibliografía
1. Hayreh S.S. Prevalent misconceptions about acute retinal vascular occlusive disorders. Prog Retin Eye Res. 2005; 24:493-519. [ Links ]
2. Scott I.U., Blodi B.A., Ip M.S., Vanveldhuisen P.C., Oden N.L., Chan C.K., et al, Score Study Investigator Group. Score Study report 2: Interobserver agreement between investigador and Redding center classification of retinal vein occlusion type. Opthalmology. 2009; 116:756-61. [ Links ]
3. Haymore J.G., Mejico L.J. Retinal vascular occlusion syndromes. International Ophthalmology Clinics. 2009; 49:63-79. [ Links ]
4. Green W.R., Chan C.C., Hutchins G.M., Terry M. Central retinal vein occlusion: a prospective histopathologic study of 29 eyes in 28 cases. Trans Am Ophthalmol Soc. 1981; 79:371-422. [ Links ]
5. Sperduto R.D., Hiller R., Chew E., Seigel D., Blair N., Burton T.C., et al. Risk factors for hemiretinal vein occlusion: comparison with risk factors for central and branch retinal vein occlusion: the eye disease case-control study. Ophthalmology. 1998; 105:765-71. [ Links ]
6. The Eye Disease Case-Control Study Group. Risk factors for central retinal vein occlusion. Arch Ophthalmol. 1996; 114:545-54. [ Links ]
7. Williamson T.H., Rumley A., Lowe G.D. Blood viscosity, coagulation, and activated protein C resistance in central retinal vein occlusion: a population controlled study. Br J Ophthalmol. 1996; 80:203-8. [ Links ]
8. Avashia J.H., Fath D.F. Bilateral central retinal vein oclussion in Waldenstrom's macroglobulinemia. J Am Optom Assoc. 1989; 60:657-8. [ Links ]
9. Ehlers N. Thrombophilia: a feature of importance in retinal vein thrombosis?. Acta Ophthalmol Scand. 1999; 77:619-21. [ Links ]
10. Cahill M., Karabatzaki M., Meleady R., Refsum H., Ueland P., Shields D., et al. Raised plasma homocysteine as a risk factor for retinal vascular occlusive disease. Br J Ophthalmol. 2000; 84:154-7. [ Links ]
11. Vine A.K. Hyperhomocysteinemia: a risk factor for central retinal vein occlusion. Am J Ophthalmol. 2000; 129:640-4. [ Links ]
12. Castañón C., Amigo M.C., Banales J.L., Nava A., Reyes P.A. Ocular vaso-occlusive disease in primary antiphospholipid syndrome. Ophthalmology. 1995; 102:256-62. [ Links ]
13. Kirwan J.F., Tsaloumas M.D., Vinall H., Prior P., Kritzinger E.E., Dodson P.M. Sex hormone preparations and retinal vein occlusion. Eye. 1997; 11(Pt 1):53-6. [ Links ]
14. The Royal College of Ophthalmologists. Retinal Vein Occlusion (RVO) Interim Guidelines. Febrero 2009. [ Links ]
15. Hayreh S.S., Rojas P., Podhajsky , Montague P., Woolson R.F. Ocular neovascularization in retinal vascular occlusion -III. Incidence of ocular neovascularization huir retinal vein occlusion. Ophthalmology. 1983; 90:488-506. [ Links ]
16. Hayreh S.S., Hayreh M.S. Hemi-central retinal vein occlusion. Pathogenesis, clinical features, and natural history. Arch Ophthalmol. 1980; 98:1600-9. [ Links ]
17. Magargal L.E., Donoso L.A., Sanborn G.E. Retinal ischemia and risk of neovascularization following central retinal vein obstruction. Ophthalmology. 1982; 89:1241-5. [ Links ]
18. Minturn J., Brown G.C. Progression of nonischemic central retinal vein obstruction to the isqchemic variante. Ophthalmology. 1986; 93:1158-62. [ Links ]
19. The Central Vein Occlusion Study Group. Natural history and clinical management of central retinal vein occlusion. Arch Ophthalmol. 1997; 115:486-91. [ Links ]
20. The Central Vein Occlusion Study Group. A randomized clinical trial of early panretinal photocoagulation for ischemic central vein occlusion: The Central Retinal Vein Occlusion Study Group N Report. Ophthalmology. 1995; 102:1434-44. [ Links ]
21. Branch Vein Occlusion Study Group. Argon laser scatter photocoagulation for prevention of neovascularisation and vitreous hemorrhage in branch vein occlusion. A randomized clinical trial. Arch Ophthalmol. 1986; 104:34-41. [ Links ]
22. Hayreh S.S., Zimmerman M.B., Podhajsky P. Incidence of various types od retinal vein occlusion and their recurrence and demographic characteristics. Am J Ophthalmol. 1994; 117:429-41. [ Links ]
23. Catier A., Tadayoni R., Paques M., Erginay A., Haouchine B., Gaudric A., et al. Characterization of macular edema from various etiologies by optical coherence tomography. Am J Ophthalmol. 2005; 140(2):200-6. [ Links ]
24. Panozzo G., Parolini B., Gusson E., Mercanti A., Pinackatt S., Bertoldo G., et al. Diabetic macular edema: an OCT-based classification. Semin Ophthalmol. 2004; 19(1-2):13-20. [ Links ]
25. Laatikainen L. A prospective follow-up study of panretinal photocagulation in preventing neovascular glaucoma following ischaemic central retinal vein occlusion. Graefe's Arch Clin Exp Ophthalmol. 1983; 220:236-9. [ Links ]
26. Davidorf F.H., Mouser J.G., Derick R.J. Rapid improvement of rubeosis iridis from a single bevacizumab (Avastin) injection. Retina. 2006; 26:354-6. [ Links ]
27. Beutel J., Peters S., Lüke M., Aisenbrey S., Szurman P., Spitzer M.S., et al, the Bevacizumab Study Group. Bevacizumab as adjuvant for neovascular glaucoma. Acta Ophthalmol. 2008 Sep 20. [Epub ahead of print]. [ Links ]
28. Cornish K.S., Ramamurthi S., Saidkasimova S., Ramaesh K. Intravitreal bevacizumab and augmented trabeculectomy for neovascular glaucoma in young diabetic patients. Eye. 2009; 23:979-81. [ Links ]
29. The Central Vein Occlusion Study Group. Evaluation of grid patternphotocoagulation for macular edema in central vein occlusion. Ophthalmology. 1995; 102:1425-33. [ Links ]
30. Greenberg P.B., Martidis A., Rogers A.H., Duker J.S., Reichel E. Intravitreal triamcinolone acetonide for macular edema due to central retinal vein occlusion. Br J Ophthalmol. 2002; 86:247-8. [ Links ]
31. Karacorlu M., Ozdemir H., Karacorlu S. Intravitreal triamcinolone acetonide for the treatment of central retinal vein occlusion in young patientes. Retina. 2004; 24:324-7. [ Links ]
32. Williamson T.H., O´Donell A. Intravitreal triamcinolone for cystoid macular edma in nonischemic central retinal vein occlusion. Am J Ophthalmol. 2005; 139:860-6. [ Links ]
33. Gregory N.Z., Rosenfeld P.J., Puliafito C.A., Flynn H.W., Lee J.E., Mavrofrides E.C., et al. One year safety and efficacy of intravitreal triamcinolone acetónide for the management of macular edema secondary to central retinal vein occlusion. Retina. 2006; 26:889-95. [ Links ]
34. Gewaily D, Greenberg PB. Intravitreal steroids versus observation for macular edema secondary to central retinal vein occlusion. Cochrane Database Syst Rev. 2009 Jan 21,1:CD007324. [ Links ]
35. Roth D.B., Cukras C., Radhakrishnan R., Feuer W.J., Yarian D.L., Green S.N., et al. Intravitreal triamcinolone acetonide injections in the treatment of retinal vein occlusions. Ophthalmic Surg Lasers Imaging. 2008; 39:446-54. [ Links ]
36. Wang L., Song H. Effects of repeated injection of intravitreal triamcinolone on macular oedema in central retinal vein occlusion. Acta Ophthalmol. 2009; 87:285-9. [ Links ]
37. Scott I.U., Vanveldhuisen P.C., Oden N.L., Ip M.S., Blodi B.A., Jumper J.M., et al, SCORE Study Investigator Group. SCORE Study Report 1: Baseline Associations between Central Retinal Thickness and Visual Acuity in Patients with Retinal Vein Occlusion. Ophthalmology. 2009; 116:504-12. [ Links ]
38. The Standard Care vs. COrticosteroid for REtinal Vein Occlusion (SCORE) Study. Clinicaltrials.gov Identifier NCT00105027. [ Links ]
39. Ip M.S., Scott I.U., VanVeldhuisen P.C., Oden N.L., Blodi B.A., Fisher M., et al, SCORE Study Research Group. A randomized trial comparing the efficacy and safety of intravitreal triamcinolone with observation to treat vision loss associated with macular edema secondary to central retinal vein occlusion: the Standard Care vs Corticosteroid for Retinal Vein Occlusion (SCORE) study report 5. Arch Ophthalmol. 2009; 127:1101-14. [ Links ]
40. A Study of the Safety and Efficacy, of a New Treatment for Macular Edema Resulting From Retinal Vein Occlusion ClinicalTrials.gov Identifier: NCT00168324 and NCT00168298. [ Links ]
41. Spaide R.F., Chang L.K., Klancnik J.M., Yannuzzi L.A., Sorenson J., Slakter J.S., et al. Prospective study of intravitreal ranibizumab as a treatment for decreased visual acuity secondary to central retinal vein occlusion. Am J Ophthalmol. 2009; 147:298-306. [ Links ]
42. Campochiaro P.A., Hafiz G., Shah S.M., Nguyen Q.D., Ying H., Do D.V., et al. Ranibizumab for macular edema due to retinal vein occlusions: implication of VEGF as a critical stimulator. Mol Ther. 2008; 16:791-9. [ Links ]
43. Pieramici D.J., Rabena M., Castellarin A.A., Nasir M., See R., Norton T., et al. Ranibizumab for the treatment of macular edema associated with perfused central retinal vein occlusions. Ophthalmology. 2008; 115:e47-54. [ Links ]
44. Beutel J., Ziemssen F., Lüke M., Partsch M., Bartz-Schmidt K.U. The Bevacizumab Study Group. Intravitreal bevacizumab treatment of macular edema in central retinal vein occlusion: one-year results. Int Ophthalmol. 2010; 30:15-22. [ Links ]
45. Prager F., Michels S., Kriechbaum K., Georgopoulos M., Funk M., Geitzenauer W., et al. Intravitreal bevacizumab (Avastin) for macular oedema secondary to retinal vein occlusion: 12-month results of a prospective clinical trial. Br J Ophthalmol. 2009; 93:452-6. [ Links ]
46. Ferrara D.C., Koizumi H., Spaide R.F. Early bevacizumab treatment of central retinal vein occlusion. Am J Ophthalmol. 2007; 144:864-71. [ Links ]
47. A Study of the Efficacy and Safety of Ranibizumab Injection in Patients With Macular Edema Secondary to Central Retinal Vein Occlusion (CRUISE). Clinicaltrials gov Identifier NCT00485836. [ Links ]
48. McAllister I.L., Douglas J.P., Constable I.J., Yu D.Y. Laser-induced chorioretinal venous anastomosis for nonischemic central retinal vein occlusion: evaluation of the complications and their risk factors. Am J Ophthalmol. 1998; 126:219-29. [ Links ]
49. Eccarius S.G., Moran M.J., Slingby J.G. Choroidal neovascular membrane after laser-induced chorioretinal anastomosis. Am J Ophthalmol. 1996; 122:590-1. [ Links ]
50. Luttrull J.K. Epiretinal membrane and traction retinal detachment complicating laser-induced chorioretinal venous anastomosis. Am J Ophthalmol. 1997; 123:698-9. [ Links ]
51. Browning D.J., Rotberg M.H. Vitreous hemorrhage complicating laser-induced chorioretinal anastomosis for central retinal vein occlusion. Am J Ophthalmol. 1996; 122:588-9. [ Links ]
52. Branch Vein Occlusion Study Group. Argon laser scatter photocoagulation for prevention of neovascularization and vitreous hemorrhage in branch vein occlusion. A randomized clinical trial. Arch Ophthalmol. 1986; 104:34-41. [ Links ]
53. Shilling J.S., Kohner E.M. New vessel formation in retinal branch vein occlusion. Br J Ophthalmol. 1976; 60:810-5. [ Links ]
54. Hayreh S.S., Rubenstein L., Podhajsky P. Argon laser scatter photocoagulation in treatment of branch retinal vein occlusion. A prospective clinical trial. Ophthalmologica. 1993; 206:1-14. [ Links ]
55. The Branch Vein Occlusion Study Group. Argon laser photocoagulation for macular edema in branch vein occlusion. Am J Ophthalmol. 1984; 98:271-82. [ Links ]
56. Shilling J.S., Jones C.A. Retinal branch vein occlusion: A study of argon laser photocoagulation in the treatment of macular oedema. Br J Ophthalmol. 1984; 68:196-8. [ Links ]
57. Cakir M., Dogan M., Bayraktar Z., Bayraktar S., Acar N., Altan T., et al. Efficacy of intravitreal triamcinolone for the treatment of macular edema secondary to branch retinal vein occlusion in eyes with or without grid laser photocoagulation. Retina. 2008; 28:465-72. [ Links ]
58. Bearelly S., Cooney M.J., Stinnett S., Fekrat S. Intravitreal triamcinolone for cystoid macular edema related to branch retinal vein occlusion. Ann Ophthalmol (Skokie). 2006; 38:317-20. [ Links ]
59. Oh J.Y., Seo J.H., Ahn J.K., Heo J.W., Chung H. Early versus late intravitreal triamcinolone acetonide for macular edema associated with branch retinal vein occlusion. Korean J Ophthalmol. 2007; 21:18-20. [ Links ]
60. Scott I.U., Ip M.S., VanVeldhuisen P.C., Oden N.L., Blodi B.A., Fisher M., et al, SCORE Study Research Group. A randomized trial comparing the efficacy and safety of intravitreal triamcinolone with standard care to treat vision loss associated with macular Edema secondary to branch retinal vein occlusion: the Standard Care vs Corticosteroid for Retinal Vein Occlusion (SCORE) study report 6. Arch Ophthalmol. 2009; 127:1115-28. [ Links ]
61. Kawaji T., Takano A., Inomata Y., Sagara N., Iwao K., Inatani M., et al. Trans-Tenon's retrobulbar triamcinolone acetonide injection for macular oedema related to branch retinal vein occlusion. Br J Ophthalmol. 2008; 92:81-3. [ Links ]
62. Hayashi K., Hayashi H. Intravitreal versus retrobulbar injections of triamcinolone for macular edema associated with branch retinal vein occlusion. Am J Ophthalmol. 2005; 139:972-82. [ Links ]
63. Russo V., Barone A., Conte E., Prascina F., Stella A., Noci N.D. Bevacizumab compared with macular laser grid photocoagulation for cystoid macular edema in branch retinal vein occlusion. Retina. 2009; 29:511-5. [ Links ]
64. Iturralde D., Spaide R.F., Meyerle C.B., Klancnik J.M., Yannuzzi L.A., Fisher Y.L., et al. Intravitreal bevacizumab (Avastin) treatment of macular edema in central retinal vein occlusion: a short-term study. Retina. 2006; 26:279-84. [ Links ]
65. Rabena M.D., Pieramici D.J., Castellarin A.A., Nasir M.A., Avery R.L. Intravitreal bevacizumab (Avastin) in the treatment of macular edema secondary to branch retinal vein occlusion. Retina. 2007; 27:419-25. [ Links ]
66. Rensch F., Jonas J.B., Spandau U.H. Early Intravitreal Bevacizumab for Non-Ischaemic Branch Retinal Vein Occlusion. Ophthalmologica. 2008; 223:124-7. [ Links ]
67. A Study of the Efficacy and Safety of Ranibizumab Injection in Patients With Macular Edema Secondary to Branch Retinal Vein Occlusion (BRAVO). Clinicaltrials gov Identifier NCT00486018. [ Links ]
68. Hayreh S.S., Rojas P., Podhajsky P., Montague P., Woolson R.F. Ocular neovascularisation with retinal vascular occlusion- III. Incidence of ocular neovascularisation with retinal vein occlusion. Ophthalmology. 1983; 90:488-506. [ Links ]
69. Oprencak E.M., Bruce R.A., Lomeo M.D., Ridenour C.D., Letson A.D., Rehmar A.J. Radial optic neurotomy for central retinal vein occlusion. Retina. 2001; 21:408-15. [ Links ]
70. García-Arumi J., Boixadera A., Martínez-Castillo V., Castillo R., Dou A., Corcostegui B. Chorioretinal anastomosis. After radial optic reurotomy for central retinal vein occlusion. Arch Ophthalmol. 2003; 121:1385-91. [ Links ]
71. Opemcak E.M., Rehmar A.J., Ridenour C.D., Kurtz D.E. Radial optic neurotomy for central retinal vein occlusion 117 consecutive cases. Retina. 2006; 26(3):297-305. [ Links ]
72. Opremcak E.M., Rehmar A.J., Ridenour C.D., Kurtz D.E., Borkowski L.M. Radial optic neurotomy with adjunctive intraocular triamcinolone for central retinal vein occlusion. Retina. 2006; 26(3):306-13. [ Links ]
73. Shahid H., Hossain P., Amokau W.M. The management of retinal vein occlusion is interventional ophthalmology the way forward?. Br J Ophthalmol. 2006; 90:627-39. [ Links ]
74. Binder S., Aggemann T., Brunner S. Long-term affects of radial optic neurotomy for central retinal vein occlusion consecutive interventional cases series. Graefes Arch Clin Exp Ophthalmol. 2007; 245(10):1447-52. [ Links ]
75. CallizoJ , Kroll P., Mennel S., Schmidt J.C., Meyer C.H. Radial optic reurotomy for central retinal vein occlusion:long.term retinal perfusion outcome. Ophthalmologica. 2009; 223(5):313-9. [ Links ]
76. Beer P.M., Bakri S.J., Singh R.L., Liu W., Peters G.B., Miller M. Intraocular concentration and pharmacokinetics of triamcinolone acetonide after a single intravitreal injeccition. Ophthalmology. 2003; 110:681-6. [ Links ]
77. Stefansson E., Novack R.L., Hatchell D.L. Vitrectomy prevents retinal hypoxia in branch retinal vein occlusion. Invest Ophthalmol Vis Sci. 1990; 31:284-9. [ Links ]
78. Lewis H., Abrams G.W., Blumenkranz M.S., et al. Vitrectomy for diabetic retinopathy. Am J Ophthalmol. 1992; 99:753-9. [ Links ]
79. Tachi N., Ogino N. Vitrectomy for diffuse macular edema in cases o diabetic retinopathy. Am J Ophthalmol. 1996; 122:258-60. [ Links ]
80. Sebag J., Balazs E.A. Pathogenesis of cystoid macular edema: an anatomic consideration of vitreoretinal adhesions. Surv Ophthalmol. 1984; 28 suppl:493-8. [ Links ]
81. Branch Vein Occlusion Study Group. Argon laser photocoagulation for macular edema in branch vein occlusion. Am J Ophthalmol. 1984; 98:271-82. [ Links ]
82. Osterloh M.D., Charles S. Surgical decompression of branch retinal vein occlusion. Arch of Ophthalmol. 1988; 106:1469-71. [ Links ]
83. Opremcak E.M., Bruce R.A. Surgical decompression of branch retinal vein occlusion via arteriovenous crossing sheathotomy: a prospective review of 15 cases. Retina. 1999; 19:1-5. [ Links ]
84. Mester U., Dillinger P. Vitrectomy with arteriovenous descompression and internal limiting membrane dissection in branch retinal vein occlusion. Retina. 2002; 22:740-6. [ Links ]
85. Kumagai K., Furukawa M., Ogino N., Uemura A., Larson E. Long-term outcomes of vitrectomy with or without arteriovenous sheathotomy in branch retinal vein occlusion. Retina. 2007; 27:49-54. [ Links ]
86. Figueroa M.S., Torres R., Álvarez M.T. Comparative study of vitrectomy with and without vein decompression for branch retinal vein occlusion: a pilot study. Eur J Ophthalmol. 2004; 14(1):40-7. [ Links ]
87. Lahey J.M., Fong D.S., Kearney J. Intravitreal tissue plasminogen activator for acute central retinal vein occlusion. Ophthalmic Surg Lasers. 1999; 30:427-34. [ Links ]
88. Elman M. Thrombolytic therapy for central retinal vein occlusion: results of a pilot study. Tr Am Ophth Soc. 1996; XCIV:471-504. [ Links ]
89. Glacet-Bernard A., Kuhn D., Vine A.K., Oubraham H., Coscas G., Soubrane G. Treatment of recent onset central retinal vein occlusion with intravitreal issue plasminogen activator: a pilot study. Br J Ophthalmol. 2000; 84:609-13. [ Links ]
90. Ghazi N.G., Noureddine B., Haddad R.S., Jurdi F.A., Bashshur Z.F. Intravitreal tissue plasminogen activator in the management of central retinal vein occlusion. Retina. 2003; 23:780-4. [ Links ]
91. Loren L.J., Frade G., Torrado M.C., Navarro J.L. Thrombus age and tissue plasminogen mediated thrombolysis in rats. Throm Res. 1989; 56:67-76. [ Links ]
92. Tsaloumas M.D., Kirwan J., Vinall H., O'Leary M., Prior P., Kritzinger E.E., et al. Nine year follow up study of morbidity and mortality in retinal vein occlusion. Eye. 2000; 14:821-7. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
mabraldes@itogalicia.es
(M.J. Abraldes)
Recibido 27 Septiembre 2010
Aceptado 30 Septiembre 2010