Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.86 no.2 feb. 2011
Resultados funcionales tras queratoplastia endotelial: tres años de experiencia
Functional results after endothelial queratoplasty: three years of experience
A. Villarrubiaa, E. Palacína, C. Arángueza, J. Solanab y C.R. García-Alonsoc
aInstituto de Oftalmología La Arruzafa, Grupo INNOVA, Córdoba, España
bHospital Universitario Infanta Cristina de Badajoz, Badajoz, España
cETEA, Facultad de Ciencias Económicas y Empresariales, Universidad de Córdoba, Córdoba, España
Dirección para correspondencia
RESUMEN
Objetivo: Evaluar los resultados refractivos y visuales tras realizar una queratoplastia endotelial automatizada con disección de la membrana de Descemet (DSAEK).
Métodos: Estudio retrospectivo de 75 cirugías de DSAEK en 67 pacientes con distrofia endotelial de Fuchs o queratopatía bullosa realizadas en el Instituto de Oftalmología La Arruzafa desde marzo de 2007 hasta marzo de 2010. En 30 casos se asoció facoemulsificación e implante de LIO. Dividimos los casos en 3 grupos según el potencial visual: A (< 0,1), B (0,1-0,5) y C (> 0,5). Se estudió la agudeza visual sin corrección (AVSC), la refracción y la agudeza visual corregida (AVCC).
Resultados: La AVCC postoperatoria media (teniendo en cuenta los tres grupos de pacientes) ha mejorado 3 líneas respecto a la preoperatoria (p<0,01). El astigmatismo se ha incrementado en 0,5 dioptrías (p=0,21). El equivalente esférico entre los injertos < 8mm con respecto a los > 8,5mm revela una leve miopización en el grupo de injertos de mayor diámetro; igualmente ocurre en los casos asociados a facoemulsificación. No existe correlación entre la AVCC postoperatoria y el grosor del disco corneal. En el grupo C, la media de la AVCC fue de 0,8, ningún paciente quedó por debajo de 0,6 de AVCC y la media de AVSC fue de 0,5.
Conclusiones: Tras DSAEK, la AVCC incrementó con una ligera hipermetropización, sin cambios astigmáticos significativos y sin que influya el grosor del injerto corneal. DSAEK es una técnica efectiva para el tratamiento del edema corneal secundario a alteración endotelial.
Palabras clave: Queratoplastia. Distrofia de Fuchs. Queratopatía bullosa. Queratoplastia endotelial automatizada con disección de la membrana de Descemet.
ABSTRACT
Objective: To study the refractive and visual results after Descemet's stripping automated endothelial queratoplasty (DSAEK).
Methods: Retrospective study of 75 eyes in 67 patients with Fuchs' endothelial dystrophy or bullous queratopathy operated on in the Instituto de Oftalmología La Arruzafa from March, 2007 until March, 2010. Phacoemulsification and IOL implantation was involved in 30 cases. We divided all cases into three groups, depending on the potential visual acuity: A (< 0.1), B (0.1-0.5) and C (> 0.5). Uncorrected distance visual acuity (UCVA), corrected distance visual acuity (CDVA) and refraction were measured.
Results: Mean CDVA improved 3 lines compared to preoperative values (P<.01). Astigmatism increased by 0.5 dioptres (P=.21). A slight myopic change was found in cases where the donor disc was > 8.5mm, as well as in the cases in which phacoemulsification was associated. No correlation between CDVA and donor disc thickness was found. In the group of patients who only had corneal oedema, the mean CDVA was 0.8. No patients ended with less than 0.6 of CDVA and the mean UCVA was 0.5.
Conclusions: After DSAEK, CDVA improved with a slight hyperopic change, without significant changes in astigmatism. Donor disc thickness does not influence the CDVA. DSAEK is an effective surgical technique to restore a good visual acuity in cases with corneal oedema due to endothelial failure.
Key words: Keratoplasty. Fuchs' dystrophy. Bullous keratopathy. Descemet's stripping automated endothelial queratoplasty.
Introducción
La queratoplastia penetrante (QP) ha sido la técnica de elección para el tratamiento del fracaso endotelial durante el último medio siglo. Sin embargo, este procedimiento no está exento de inconvenientes: rehabilitación visual prolongada, astigmatismo elevado, complicaciones relacionadas con las suturas, queratitis infecciosa, dehiscencia de la incisión, rechazo endotelial e, incluso, la eventualidad de una hemorragia expulsiva. En los últimos años, la queratoplastia endotelial ha evolucionado desde que en 1998 Gerrit Melles publicara el primer caso exitoso de restauración de la transparencia corneal mediante el recambio de las capas posteriores de la córnea en un paciente con queratopatía bullosa1,2. Algunos años después, Mark Terry modificó el instrumental y comenzó a publicar series realmente importantes de pacientes3,4. La realización de una descemetorhexis5, así como la obtención del disco donante mediante una queratotomía realizada con microqueratomo sobre una cámara anterior artificial, hizo que la técnica fuese mucho más reproducible aún y que ambos lechos, donante y receptor, se unieran de una forma más homogénea6. Esta técnica ha sido bautizada como DSAEK (Descemet's stripping with automated endothelial queratoplasty: queratoplastia endotelial automatizada con disección de la membrana de Descemet) y es la que actualmente se realiza en muchos centros como alternativa a la QPP en el tratamiento del edema corneal por disfunción endotelial. En nuestro centro estamos realizando DSAEK desde hace 3 años y el objetivo de este trabajo es mostrar nuestros resultados refractivos y visuales así como compararlos con otras series previamente publicadas.
Sujetos, material y método
Se han analizado de forma retrospectiva las historias clínicas de los pacientes intervenidos desde marzo de 2007 hasta marzo de 2010 mediante técnica DSAEK. Todas las cirugías se realizaron de acuerdo a los Principios Éticos para las Investigaciones Médicas en Seres Humanos de la Declaración de Helsinki de la Asociación Médica Mundial (59a Asamblea General, Seúl, Corea, octubre 2008). La indicación quirúrgica en todos los casos fue por edema corneal debido a distrofia endotelial de Fuchs o a queratopatía bullosa. Se trata de 75 ojos de 67 pacientes (por tanto, 8 de ellos de forma bilateral), 32 varones y 35 mujeres. Todos ellos han cumplido, al menos un mes de evolución: la media ± desviación estándar (rango) ha sido: 15,4±10,59 (1-36) meses (M±DS [rango]). La edad media fue: 66±12,66 años (22-82). En 4 casos se trataba de pacientes con una QPP fracasada (DSAEK tras QPP) y en 30 casos (40%), se asoció facoemulsificación e implante de LIO en el mismo acto quirúrgico. Ocho de los pacientes eran afáquicos o bien presentaban lente de cámara anterior (CA). La agudeza visual corregida (AVCC) preoperatoria media fue de 0,22±0,23 (0,01-1,0) y el astigmatismo refractivo preoperatorio medio fue de 1,54±1,34 (0-8) dioptrías. Después de la cirugía, los pacientes fueron revisados al día siguiente, a los 3 días, a la semana, al mes, 3, 6, 12, 24 y 36 meses (en el caso de mayor seguimiento), excepto cuando alguna complicación aconsejaba alguna otra revisión. En cada revisión se midió la agudeza visual sin corrección (AVSC), refracción y AVCC. Los resultados reflejados en este trabajo son los de la última revisión realizada a cada paciente. Los datos se incluyeron en una tabla de Excel y, posteriormente, fueron procesados con el programa estadístico SPSS (SPSS v. 17, Inc. Chicago, USA.). Los análisis realizados han sido el contraste de medias (para determinar si existen diferencias significativas antes y después de la intervención realizada) y la correlación y regresión (ambas para evaluar si existen relaciones, lineales o no, entre las variables comparadas). Para el contraste de medias se han utilizado los siguientes métodos paramétricos: prueba T al 95% (α=0,95) para muestras independientes (este análisis se utiliza como pre-test), prueba T al 95% (α=0,95) para muestras relacionadas (ya que las variables se miden antes y después de la intervención) y análisis de la varianza ANOVA de un factor (α=0,95) (para confirmar o no los resultados obtenidos en el test anterior). Las pruebas no paramétricas de Wilcoxon, Friedman y Kendall (α=0,95) se han utilizado para comprobar la homogeneidad de las variables antes y después del tratamiento. Para el análisis de correlación y regresión lineal se han utilizado los métodos: Pearson -paramétrico- (α=0,95) y los no paramétricos (Tau b de Kendall y Rho de Spearman) (α=0,95).
Técnica quirúrgica
La técnica quirúrgica ha sido suficientemente descrita en multitud de trabajos6-9. Es preciso trabajar sobre un botón con rodete escleral que se adapte a la cámara anterior artificial, con un diámetro total de 16mm. La córnea debe tener una distancia blanco a blanco de, al menos, 11mm. Montamos el tejido donante sobre la cámara anterior artificial desarrollada por Ziemer Ophthalmic Systems AG (Switzerland) (Figura 1) para el microqueratomo Amadeus II. Se obtiene un disco completo de estroma anterior que nos deje un lecho de estroma posterior de entre 100 y 200μm. Situamos el botón sobre el sistema de trepanación de Hessburg-Barron con el endotelio hacia arriba. Obtenemos así un disco con estroma posterior, membrana de Descemet (MD) y endotelio. A continuación, marcamos el epitelio corneal del receptor (cuyo ojo ha sido bloqueado con anestesia retrobulbar y dilatado con cicloplégico y fenilefrina) con el mismo punch usado para trepanar la córnea donante (tintado con violeta de genciana): esta marca, centrada en la pupila, nos permitirá un correcto posicionamiento de la lamela donante. Solemos realizar dos paracentesis para poder manipular la córnea donante con menor traumatismo y, a continuación, practicamos la facoemulsificación de la forma habitual (en el caso de que esta sea necesaria) intentando entrar por el meridiano más curvo para reducir el astigmatismo. Una vez introducida la LIO, presurizamos la CA con viscoelástico y, con la pupila dilatada, tendremos un reflejo de fondo suficiente para realizar la descemetorhexis: marcamos y desprendemos la MD en los 360o bajo la línea realizada con el punch en el epitelio. Esta maniobra se puede realizar con instrumental diseñado para ello por múltiples autores (gancho de Sinskey de Katena (K3-5002, Katena Products, Inc., Denville NJ, EEUU) orientado de forma opuesta a la normal); nosotros preferimos usar una aguja de insulina a la que cortamos la punta y que doblamos 90o en el extremo distal y 45o en el extremo proximal. Una vez desprendida la MD en la periferia, podemos terminar de extraerla con un scraper de Melles (50.212-D, DORC, Zuidland, The Netherlands) o con una pinza de John (AE-4962, Asico LLC, Westmont, IL). A continuación, con el mismo instrumento utilizado para marcar la MD, realizaremos un raspado del estroma posterior en los 360o y con una anchura de 1,5mm por dentro del lecho creado por la descemetorhexis. Con esta maniobra, quedan expuestas las fibras de estroma posterior en la periferia con lo que la adhesión del disco donante en esa zona es mucho más fuerte. Una vez aspirado todo el viscoelástico de la CA, procedemos a cerrar la pupila con acetil colina y ampliamos la incisión principal a 5mm. Es el momento de introducir el disco donante y, para ello, existen varias modalidades; nosotros usamos en los primeros 6 casos la técnica basada en plegar la lamela a modo de taco mexicano e introducirla con pinzas; la usada en los últimos 69 casos es empleando una especie de inyector-deslizador (glide) diseñado por Maximo Busin (ref. 19098, Moria SA, Anthony, Francia) (Figura 2). En este caso debemos realizar una incisión opuesta a la principal de unos 2,5-3mm. Por una de las paracentesis de apoyo, introducimos un mantenedor de CA. A continuación, la lamela donante es depositada en el lecho del glide con el endotelio hacia arriba y sin usar viscoelástico sobre ella. Con la pinza de Busin (ref. 20004, Moria SA, Anthony, Francia), traccionamos de uno de sus bordes hasta que aparece por el extremo de este dispositivo el cual es rotado 180o y acercado a la incisión principal. La misma pinza es introducida por la incisión opuesta y, atravesando toda la CA, hacemos que su extremo asome por la incisión principal. En este momento, el borde del disco donante es atrapado con esta pinza y, mediante un movimiento opuesto, la lamela es introducida en la CA (Figura 3); sin ayuda de aire, es desplegada por la misma presión del mantenedor de CA que se retira una vez finalizada esta maniobra. Comoquiera que el tejido introducido en la CA suele quedar «flotando» en ella, debemos ayudarnos en este momento de una burbuja de aire introducida por la paracentesis para adherirlo al estroma posterior. Para desplegarlo definitivamente, inyectamos una burbuja de aire por la paracentesis opuesta y la lamela donante se abre y queda adherida al estroma posterior del receptor. Con el mismo instrumento usado para realizar la descemetorhexis, podremos centrar el disco en el lecho marcado con anterioridad para, finalmente, presurizar la CA con aire y dar un punto de sutura en la incisión principal; en este momento, colocamos viscoelástico sobre el epitelio corneal y ayudados por una espátula gruesa, drenamos el líquido que pueda quedar en la entrecara (realizando movimientos de presión centrífugos sobre la superficie corneal) para dejar al paciente en decúbito supino durante unos 15 minutos en la camilla de la sala de cirugía. Después de este período, extraemos en torno al 40% de la burbuja de aire de la CA para evitar una subida de tensión en el postoperatorio inmediato. Posteriormente, el paciente es pasado a su cama donde debe permanecer inmóvil al menos 2-3 horas para disminuir la posibilidad de una dislocación del disco.

Figura 1. Cámara anterior artificial para Amadeus II
(Ziemer Ophthalmic System AG, Switzerland).
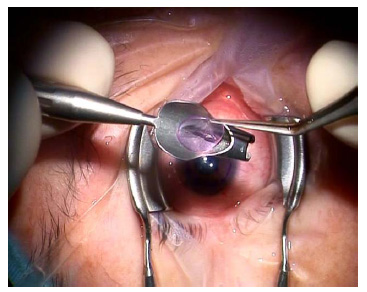
Figura 3. Introducción del lentículo donante desde una
incisión opuesta a la principal usando la pinza y el glide de Busin.
Las suturas fueron retiradas al mes de la cirugía. Durante el postoperatorio utilizamos en las primeras dos semanas acetato de prednisolona y ofloxacino cada 4 horas. Posteriormente, cambiamos a fluorometolona 1% 4 veces al día disminuyendo la frecuencia de las gotas durante 4 meses.
Resultados
En cuatro de los 75 casos no se ha podido completar el seguimiento del paciente por diferentes causas (Tabla 1). Los resultados pre- y postoperatorios refractivos y funcionales están reflejados en la Tabla 2. La AVCC postoperatoria media ha mejorado 3 líneas respecto a la preoperatoria, siendo estas diferencias significativas estadísticamente. El astigmatismo refractivo se ha incrementado media dioptría de media pero este cambio no ha resultado estadísticamente significativo.
La media del grosor del disco corneal en nuestra serie de pacientes (medido mediante OCT-Visante al mes de la cirugía) ha sido de 165±44 (88-263) μm; el diámetro de los injertos varió entre 7 y 9mm, siendo el 81% de ellos de 8-8,5mm. Buscando diferencias en el equivalente esférico entre los pacientes que recibieron un injerto de 8mm o menos versus los que lo recibieron de 8,5mm o más, se aprecia una leve miopización en el grupo de injertos de diámetro mayor. Igualmente ocurre con los casos en los que se asoció facoemulsificación: en estos, existe una leve tendencia al equivalente esférico miópico (Figura 4). Comparando la AVCC postoperatoria global con el grosor del disco corneal, hemos encontrado un bajísimo índice de correlación (Figura 5).
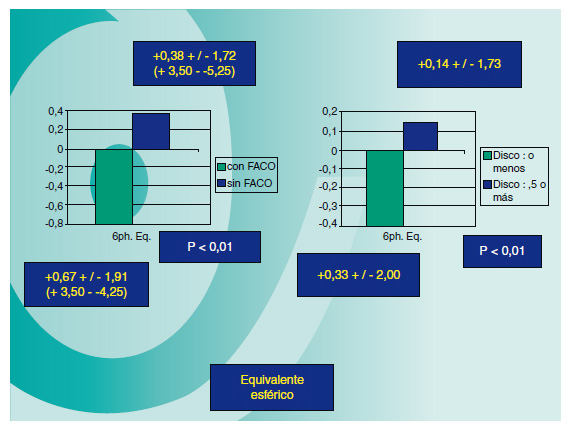
Figura 4. se ha observado una leve tendencia hacia la miopía postoperatoria cuando
asociamos facoemulsificación e implante de LIO; este mismo fenómeno lo hemos observado
en los casos en los que el diámetro del injerto ha sido de 8,5mm o mayor.
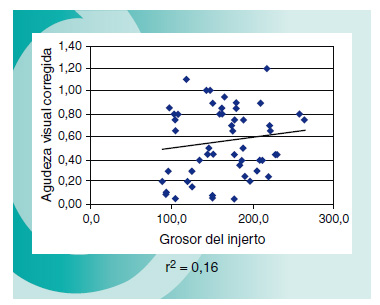
Figura 5. No hemos encontrado influencia del grosor del disco donante
(medido mediante OCT después de un mes de la cirugía) y la agudeza
visual corregida final.
Finalmente, dividiendo nuestros 75 casos según el potencial visual de cada uno de ellos, hemos establecido 3 grupos de pacientes (Figura 6):
- grupo A: pacientes con potencial visual de 0,1 o menor debido a que presentaban una degeneración macular asociada a la edad severa (o cualquier otra maculopatía), o bien eran pacientes con ambliopía profunda, severas alteraciones del estroma corneal que sabíamos que no iban a permitir una buena AVCC o pacientes con glaucoma terminal.
- grupo B: pacientes con potencial visual entre 0,1 y 0,5 debido a que presentaban una degeneración macular asociada a la edad leve, o bien eran pacientes con ambliopía leve-moderada o con alteraciones leve-moderadas del estroma corneal, y/o con alta miopía y/o astigmatismo.
- grupo C: pacientes que solo presentaban edema corneal sin ninguna otra dolencia ocular asociada.

Figura 6. En el grupo de pacientes que solo presentaban edema corneal (22 pacientes),
la media de la AVCC era casi de 0,8, ningún paciente quedó por debajo de 0,6 de AVCC
y la media de AVSC fue de casi 0,5.
Las diferencias en términos de AVCC entre estos 3 grupos de pacientes son evidentes. Además, en el grupo C (pacientes que solo presentaban edema corneal sin ninguna otra dolencia ocular asociada) en el que se incluyen 22 pacientes, la media de la AVCC era casi de 0,8, ningún paciente quedó por debajo de 0,6 de AVCC y la media de AVSC fue de casi 0,5.
Discusión
En nuestra serie de pacientes, tanto en términos de equivalente esférico como de esfera, la media es casi la emetropia, si bien, encontramos un rango amplio debido a las características preoperatorias de los pacientes, ya que había varios pacientes con alta miopía y con alta hipermetropía. Igualmente ocurre con el astigmatismo, debiendo tener en cuenta que los pacientes en los que existe un cilindro alto son pacientes que presentaban una QP preoperatoriamente. Lo importante es hacer notar que, en contraposición a QP, es un procedimiento que tiende ligeramente a la hipermetropización9-11 pero que, si realizamos facoemulsificación asociada, podemos ajustar la potencia de la LIO (seleccionando la LIO para un objetivo entre (-1,25) y (-1,50) dioptrías para quedarnos lo más cerca posible a la emetropia tal y como sugiere Terry9. En nuestra serie, en los casos en que se asoció facoemulsificación, se aprecia una leve miopización, probablemente como consecuencia de una leve hipercorrección en dicho ajuste ya que es frecuente no poseer la queratometría real del paciente y tener que seleccionar la queratometría del ojo adelfo. El hecho de que en el grupo de pacientes de injertos de mayor diámetro exista una leve miopización, podría ser debido a que la curvatura posterior en la periferia es diferente a la de los injertos de menor diámetro, tratándose esta frase de una mera conjetura. En cuanto al astigmatismo, la inducción media ha sido mínima y las diferencias respecto al preoperatorio no son significativas (similar a lo reportado en la literatura para DSAEK)9-11.
La AVCC postoperatoria media (teniendo en cuenta los tres grupos de pacientes globalmente) ha mejorado 3 líneas respecto a la preoperatoria, siendo estas diferencias significativas estadísticamente. La AVCC postoperatoria está dentro del rango que se observa en la literatura12-18, teniendo en cuenta que hablamos de un grupo heterogéneo de pacientes en el que existen casos con dolencia ocular asociada (ambliopía, astigmatismo alto, degeneración macular asociada a la edad, glaucoma avanzado, estroma corneal con cambios fibróticos, etc.).
Comparando la AVCC postoperatoria global con el grosor del disco corneal (medido mediante OCT al mes de la cirugía), hemos encontrado un bajísimo índice de correlación, indicando este hecho que el grosor del injerto corneal no influye en la agudeza visual final; este dato ya había sido establecido por Price11.
Las diferencias en términos de AVCC entre los 3 grupos de pacientes según su potencial visual son evidentes. Lo importante para nosotros es que en el grupo C (pacientes que solo presentaban edema corneal sin ninguna otra dolencia ocular asociada) en el que se incluyen 22 pacientes, la media de la AVCC era casi de 0,8, ningún paciente quedó por debajo de 0,6 de AVCC y la media de AVSC fue de casi 0,5. Estos datos son muy similares a los reportados en la literatura13-19 y bastante superiores a nuestros datos (y los de cualquier serie) de pacientes intervenidos mediante QP debido a distrofia endotelial de Fuchs o queratopatía bullosa19-21. La media de AVSC es de 0,3, también con un amplio rango; este dato, aunque parezca poco importante, no lo es: tener una media de AVSC de 0,3 en un grupo de pacientes en los que se incluyen casos con alteración retiniana, significa tener muchos pacientes cercanos a la emetropia y, la mayoría de ellos, sin componente de astigmatismo irregular.
Como conclusión, pensamos que DSAEK es una técnica efectiva para el tratamiento del edema corneal secundario a alteración endotelial, con resultados funcionales superiores a los publicados para21.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Melles GR, Eggink FA, Lander F, Pels E, Rietveld FJ, Beekhuis WH, et al. A surgical technique for posterior lamellar queratoplasty. Cornea. 1998; 17:618-26. [ Links ]
2. Melles GR, Lander F, Beekhuis WH, Remeijer L, Binder PS. Posterior lamellar queratoplasty for a case of pseudophakic bullous queratopathy. Am J Ophthalmol. 1999; 127:340-1. [ Links ]
3. Terry MA, Ousley PJ. Endothelial replacement without surface corneal incisions or sutures: topography of the deep lamellar endothelial keratoplasty procedure. Cornea. 2001; 20:14-8. [ Links ]
4. Terry MA, Ousley PJ. Deep lamellar endothelial keratoplasty in the first United States patients: Early Clinical Results. Cornea. 2001; 20:239-43. [ Links ]
5. Melles GR, Wijdh RH, Nieuwendaal CP. A technique to excise the Descemets' membrane from a recipient cornea (descemetorhexis). Cornea. 2004; 23:286-8. [ Links ]
6. Gorovoy MS. Descemet-stripping automated endothelial keratoplasty. Cornea. 2006; 25:886-9. [ Links ]
7. Price MO, Baig KM, Brubaker JW, Price FW. Randomized, prospective comparison of precut vs surgeon-dissected grafts for Descemet stripping automated endothelial keratoplasty. Am J Ophthalmol. 2008; 146:36-41. [ Links ]
8. Terry MA, Shamie N, Chen ES, Hoar KL, Phillips PM, Friend DJ. Endothelial keratoplasty: the influence of preoperative donor endothelial cell densities on dislocation, primary graft failure, and 1-year cell counts. Cornea. 2008; 27:1131-7. [ Links ]
9. Terry MA, Shamie N, Chen ES, Phillis PM, Shah AK, Hoar KL, et al. Endothelial keratoplasty for Fuchs' dystrophy with cataract: complications and clinical results with the new triple procedure. Ophthalmology. 2009; 116:631-9. [ Links ]
10. Covert DJ, Koenig SB. New triple procedure: Descemet's stripping and automated endothelial keratoplasty combined with phacoemulsification and intraocular lens implantation. Ophthalmology. 2007; 114:1272-7. [ Links ]
11. Price MO, Price FW. Descemet's stripping with endothelial keratoplasty: comparative outcomes with microkeratome-dissected and manually dissected donor tissue. Ophthalmology. 2006; 113:1936-42. [ Links ]
12. O'Brien PD, Lake DB, Saw VP, Rostron CK, Dart JK, Allan BD. Endothelial keratoplasty: case selection in the learning curve. Cornea. 2008; 27:1114-8. [ Links ]
13. Bahar I, Kaiserman I, Sansanayudh W, Levinger E, Rootman DS. Busin guide vs forceps for the insertion of the donor lenticule in Descemet stripping automated endothelial keratoplasty. Am J Ophthalmol. 2009; 147:220-6. [ Links ]
14. Busin M, Bhatt PR, Scorcia V. A modified technique for Descemet membrane stripping automated endothelial keratoplasty to minimize endothelial cell loss. Arch Ophthalmol. 2008; 126:1133-7. [ Links ]
15. Price MO, Price FW. Endothelial cell loss after Descemet stripping with endothelial plasty: influencing factors and 2-year trend. Ophthalmology. 2008; 115:857-65. [ Links ]
16. Koenig SB, Covert DJ, Dupps WJ, Meisler DM. Visual acuity, refractive error, and endothelial cell density six months after Descemet stripping and automated endothelial keratoplasty (DSAEK). Cornea. 2007; 26:670-4. [ Links ]
17. Koenig SB, Covert DJ. Early results of small-incision Descemet's stripping and automated endothelial keratoplasty. Ophthalmology. 2007; 114:221-6. [ Links ]
18. Dupps WJ, Qian Y, Meisler DM. Multivariate model of refractive shift in Descemet-stripping automated endothelial keratoplasty. J Cataract Refract Surg. 2008; 34:578-84. [ Links ]
19. Terry MA, Chen ES, Shamie N, Hoar KL, Friend DJ. Endothelial cell loss after Descemet's stripping endothelial keratoplasty in a large prospective series. Ophthalmology. 2008; 115:488-96. [ Links ]
20. Pineros O, Cohen EJ, Rapuano CJ, Laibson PR. Long-term results after penetrating keratoplasty for Fuchs'endothelial dystrophy. Arch Ophthalmol. 1996; 114:15-8. [ Links ]
21. Claesson M, Armitage WJ, Fagerholm P, Stenevi U. Visual outcome in corneal grafts: a preliminary analysis of the Swedish Corneal Transplant Register. Br J Ophthalmol. 2002; 86:174-80. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
alvillarrubia@yahoo.com
(A. Villarrubia)
Recibido 25 Mayo 2010
Aceptado 14 Diciembre 2010