Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.87 no.3 mar. 2012
Susceptibilidad antibiótica in vitro a fluoroquinolonas
In vitro antibiotic susceptibility to fluoroquinolones
C.A. Wong, V. Galvis, A. Tello, D. Villareal y J.J. Rey
Fundación Oftalmológica de Santander-Clínica Carlos Ardila Lülle (FOSCAL), Universidad Industrial de Santander, Laboratorio Higuera Escalante-Centro de Diagnóstico Ocular OCULAB
* Presentado parcialmente y ganador del primer puesto al trabajo libre en el XXXIV Congreso Nacional e Internacional de Oftalmología realizado en Bogotá, Colombia del 10 al 14 de agosto de 2010.
Dirección para correspondencia
RESUMEN
Objetivo: Determinar la susceptibilidad antibiótica de la bacterias obtenidas en cultivos de infecciones oculares en la Fundación Oftalmológica de Santander - Clínica Carlos Ardila Lulle (FOSCAL).
Materiales y métodos: Estudio descriptivo retrospectivo de una serie de registros de cultivos de muestras de superficie ocular y líquidos intraoculares del laboratorio OCULAB-FOSCAL en Floridablanca (Colombia) realizados entre enero y diciembre de 2007. Se realizó antibiograma por el método de Kirby-Bauer con sensidiscos impregnados de concentraciones determinadas de antibiótico.
Resultados Se recogieron un total de 352 muestras de los cuales 160 fueron de conjuntiva, 150 fueron de córnea y 42 de líquidos intraoculares. Se recuperó más de un microorganismo en el 45,65% del total de las muestras. El 78,7 y el 18,4% de las bacterias identificadas correspondieron a Gram positivos y a Gram negativos, respectivamente. El 6,3, 8,9, 33,2 y 35,6% de las bacterias Gram positivas fueron resistentes a gatifloxacino, moxifloxacino, ciprofloxacino y levofloxacino, respectivamente. El 7,4, 16,7, 16,7 y 25,9% de las bacterias Gram negativas fueron resistentes a gatifloxacino, moxifloxacino, ciprofloxacino y levofloxacino, respectivamente. La resistencia bacteriana global (tanto Gram positivos como Gram negativos) a moxifloxacino fue del 10,15% y a gatifloxacino del 6,46%, siendo esta diferencia estadísticamente significativa (p<0,05).
Conclusiones: En nuestro estudio, se evidenció el desarrollo de resistencia bacteriana en muestras oculares incluso con las fluoroquinolonas de cuarta generación. Sin embargo se encontraron menores niveles de resistencia para las fluoroquinolonas de cuarta generación que para las de tercera y segunda generación, especialmente entre Gram positivos. Gatifloxacino mostró menores niveles de resistencia que la moxifloxacino. La interpretación de esta superioridad debe, sin embargo, hacerse con cuidado en el campo clínico, ya que se deben tener en cuenta otros factores como la penetración tisular y la actividad in vivo.
Palabras clave: Resistencia bacteriana. Antibióticos. Fluoroquinolonas. Moxifloxacino. Gatifloxacino.
ABSTRACT
Objective: To determine the antibiotic susceptibility of bacteria recovered from cultures of ocular infections in the Fundación Oftalmológica de Santander - Clínica Carlos Ardila Lulle (FOSCAL).
Materials and methods: Retrospective descriptive study of a series of registries of cultures of samples from ocular surfaces and intraocular fluids from the OCULAB-FOSCAL laboratory in Floridablanca (Colombia) made between January and December of 2007. Antibiotic sensitivity screening by the method of Kirby-Bauer with impregnated Sensi-DiscsTM of determined antibiotic concentrations was performed.
Results: A total of 352 samples were studied: 160 from conjunctiva, 150 from cornea and 42 from intraocular fluids. Of the total of the samples more than one microorganism was recovered 45.65% of the samples. Gram positive and Gram negative bacteria were identified in 78.7 and 18.4%, respectively. Resistance to gatifloxacin, moxifloxacin, ciprofloxacin and levofloxacin was observed in 6.3, 8.9, 33.2 and 35.6%, respectively, of Gram positive bacteria. Resistance to gatifloxacin, moxifloxacin, ciprofloxacin and levofloxacin was also observed in 7.4, 16.7, 16.7%and 25.9%, respectively, of Gram negative bacteria. The overall bacterial resistance (Gram positive and Gram negative) to moxifloxacin was 10.15%, and to gatifloxacin it was 6.46%, being which showed a statistically significant difference (P<.05).
Conclusions: In our study the development of bacterial resistance to fourth generation fluoroquinolones was demonstrated in ocular samples. However, lower levels of resistance to fourth generation fluoroquinolones compared with that of third and second generation were found, particularly to Gram positive. Gatifloxacin showed lower resistance levels than moxifloxacin. Nevertheless, interpretation of this superiority must be made with caution in the clinical field, since other factors, like tissue penetration and in vivo activity, must be taken into account.
Key words: Bacterial resistance. Antibiotics. Fluoroquinolones. Moxifloxacin. Gatifloxacin.
Introducción
La introducción de agentes antimicrobianos en la Medicina fue uno de los avances más importantes en la medicina moderna pero rápidamente se encontró que los microorganismos podían desarrollar resistencia a ellos. Para combatir el desarrollo y diseminación de organismos resistentes, se ha propuesto el uso racional de los antibióticos así como el descubrimiento y desarrollo de nuevos agentes antimicrobianos1.
El oftalmólogo se enfrenta a diversos tipos de infecciones. Las más comunes son las infecciones superficiales, como las conjuntivitis, que afortunadamente no llevan a consecuencias serias; por otra parte, las infecciones de la córnea o las del segmento posterior como las endoftalmitis y las retinitis, pueden dejar serias secuelas visuales. La endoftalmitis ha sido asociada a pérdida visual severa en el 20% de pacientes2 y requiere a menudo vitrectomía posterior y aplicación de antibióticos intravítreos. Debido a la severidad de este tipo de infecciones, la prevención es la conducta más adecuada y los regímenes antibióticos profilácticos prequirúrgicos han llegado a ser la regla.
Las fluoroquinolonas son agentes bactericidas utilizados frecuentemente en Oftalmología3 y extremadamente efectivos, con amplio espectro y con especial actividad sobre los patógenos Gram negativos. Estas bloquean la síntesis del ácido desoxirribonucleico (ADN) bacteriano por inhibición de las topoisomerasas II y IV4,5. De acuerdo a su actividad se dividen en las de segunda generación: como ciprofloxacino; tercera generación: como levofloxacino; y cuarta generación: como moxifloxacino y la gatifloxacino6.
En general, las fluoroquinolonas se consideran muy buenas opciones para el tratamiento y prevención de diferentes infecciones oculares7-9 y ello explica su creciente uso en Oftalmología10. Sin embargo, el mal uso de los antibióticos (ya sean sistémicos o tópicos) nos puede llevar a la aparición de resistencia bacteriana; y de hecho, algunos estudios recientes sugieren que este fenómeno podría estar apareciendo, incluso con las modernas fluoroquinolonas de cuarta generación11. Por ello, con el presente estudio, pretendemos analizar la susceptibilidad antibiótica in vitro de la flora ocular patógena en cultivos de infecciones oculares en la Fundación Oftalmológica de Santander - Clínica Carlos Ardila Lulle (FOSCAL), Floridablanca (Colombia). La información recogida podría ser útil en la selección empírica de antibióticos y adicionalmente nos daría un panorama real de la resistencia microbiana en nuestro medio.
Materiales y métodos
Estudio descriptivo retrospectivo de una serie de registros de cultivos de muestras de superficie ocular (córnea o conjuntiva) y líquidos intraoculares del laboratorio OCULAB-FOSCAL (Floridablanca-Santander, Colombia), realizados entre enero y diciembre de 2007.
Para la toma de muestras de superficie conjuntival, se utilizó un raspado con hisopo de alginato de calcio o de algodón estéril. Para la toma de muestra de córnea, se realizó un raspado con espátula de Kimura estéril y adicionalmente con pinza de relojero se tomaron restos de tejido en la zona comprometida. En algunos casos, se estudió el tejido corneal obtenido en cirugía al realizar queratoplastia penetrante. Para los líquidos intraoculares, la toma se realizó por punción vítrea (humor vítreo) o por paracentesis (humor acuoso).
Para el estudio directo, se practicó un extendido en la lámina de vidrio y se realizó examen de Gram e hidróxido de potasio (KOH) al 10%. Luego de hacer el extendido para examen directo, se tomó muestra para colocarla en los caldos y en un segundo paso se sembró con asa bacteriológica en agar chocolate con CO2, agar sangre y agar Mc Conkey. En caso de sospecha de anaerobios, se cultivó en feniletilalcohol, agar carne-hígado, agar sangre y agar chocolate en anaerobiosis.
Se emplearon diversos caldos de cultivo para poder disponer de varias fuentes de muestra para los cultivos en platos de agar. Dentro de los caldos se incluyeron: caldo nutritivo de baja concentración estándar (extracto de levaduras 3g/L, ClNa 6g/L, base de peptona 15g/L, glucosa 1g/L) y caldo de triptosa (triptosa 20g/L, glucosa 1g/L, ClNa 5g/L, dicloruro de tiamina 0,005/L). Después de colocar la muestra en el caldo a 37oC, se esperaron 24 horas y se tomaron muestras para nueva evaluación bajo examen directo y para los cultivos en agar sólido.
Se revisaron los cultivos a las 24, 48 y 72 horas; informando el crecimiento microbiano en cada cultivo. Si no había crecimiento, se descartaron los medios de cultivo bacterianos a los 5 días.
Se realizó antibiograma solo para las bacterias con cultivo positivo. Para el antibiograma, se tomó una muestra del cultivo sobre el agar, y se colocó en un caldo de cerebro corazón durante aproximadamente 12 horas. Luego se extendió en un Agar Mueller Hinton para antibiograma, sembrando 3 veces toda la superficie de la placa girando la misma 60o después de cada siembra para obtener una inoculación uniforme. Se deja la tapa entreabierta por 5 minutos para permitir que se absorba toda la humedad de la superficie y luego se colocan los discos impregnados de antibiótico (Becton Dickinson -BBLTM Sensi-DiscTM Susceptibility Test Discs) específicos para Gram positivos o Gram negativos (método de Kirby Bauer).
Los sensidiscos antibióticos tenían concentraciones determinadas. Los antibiogramas fueron realizados por metodología convencional de difusión en Agar Mueller Hinton. Se incubaron las placas de agar durante 24 horas a 35oC y se estudió el crecimiento bacteriano en ellas. Se valoró el diámetro de la zona de inhibición que se formó alrededor de cada disco. Con esta referencia podemos informar si el microorganismo es sensible (S), tiene sensibilidad intermedia (I) o es resistente (R) a cada uno de los antibióticos ensayados en las placas.
Las variables fueron tomadas con una ficha de recolección individual para cada muestra siguiendo las normas de la Declaración de Helsinki y traspasadas a una base de datos en (Microsoft Excel). Se realizó el análisis de las variables con STATA y Epi Info 6.
Resultados
Se recogieron un total de 352 muestras de cultivos de superficie conjuntival (secreción conjuntival), superficie corneal (queratitis y úlceras corneales, muestra de botón corneal, muestra de entrecara de LASIK) y líquidos intraoculares (muestras de humor acuoso y humor vítreo). Del total de muestras, 160 fueron de conjuntiva (45,46%), 150 fueron de córnea (42,61%) y 42 de líquidos intraoculares (11,93%).
La distribución por sexos fue de 203 casos para el sexo masculino y de 149 para el sexo femenino. Se encontró mayor prevalencia estadísticamente significativa de muestras de córnea y líquidos intraoculares en varones (p=0,10), que corresponde con lo publicado por Serrano-Calderon et al.9 en nuestra institución, posiblemente en relación con el mayor riesgo de trauma ocular de los varones.
Del total de muestras, 322 (91,42%) tuvieron cultivos positivos. Se recuperó más de un microorganismo (infección polimicrobiana) en 147 cultivos (45,65% de las muestras), siendo significativamente mayor que lo reportado en otros estudios (21% encontrado por Yeh et al.)12. Con el fin de determinar si los microorganismos presentes en las infecciones polimicrobianas tenían diferente resistencia que las monomicrobianas, se analizó con tablas cruzadas de infección por microorganismo único contra infección polimicorbiana tanto para Gram positivos como para Gram negativos por separado, y no se encontraron diferencias estadísticamente significativas.
El total de bacterias identificadas fue de 385: 303 Gram positivos (78,7%), 71 Gram negativos (18,4%), 1 anaerobio (0,3%), 2 Mycobacterium (0,5%) y en 8 casos se sospechó Chlamydia trachomatis por la presencia de inclusiones citoplasmáticas sugestivas (2,1%); la notable preponderancia de infecciones por Gram positivos concuerda con estudios previos (Kunimoto et al. reportan un 71% de gérmenes Gram positivos en cultivos de queratitis)13. El total de hongos fue de 67 en el total de muestras, predominando Aspergillus sp.(46,3%), Fusarium sp. (26,9%) y Candida sp. (20,9%). El total de parásitos fue de 39 correspondiendo el 94,9% a amebas de vida libre del género Acanthamoeba sp.
En el grupo general de cultivos, dentro de los Gram positivos, los más comunes fueron Staphylococcus sp.(227 casos) incluyendo: 170 Staphylococcus coagulasa negativo (incluyendo S. epidermidis) y 57 Staphylococcus aureus coagulasa positivo. Le siguieron Corynebacterium sp.(59 casos), Streptococcus no hemolítico tipo B (7 casos), Bacillus sp.(6 casos), Streptococcus viridans (2 casos) y Enterococcus sp.(2 casos).
Dentro de los Gram negativos, los más comunes fueron Haemophilus sp. (24 casos), seguidos por Klebsiella enterobacter (18 casos), Pseudomonas sp. (11 casos), Escherichia coli (7 casos), Enterobacter sp. (3 casos), Acinetobacter sp. (2 casos), Achromobacter (2 casos); Serratia marcescens, Proteus mirabilis, Salmonella tyhpi y Aeromona hydrophylla (1 caso cada uno).
En conjuntiva se identificaron 207 gérmenes, siendo los más frecuentes Staphylococcus sp.(en su mayoría coagulasa negativo incluyendo S. epidermidis) y Corynebacterium sp.(Fig. 1), coincidiendo con estudios previos14,15,16. Se evidenciaron también Gram negativos, pero en un porcentaje mucho menor.

Fig. 1. Distribución de microorganismos en muestras
de conjuntiva en orden de frecuencia.
En córnea, se aislaron principalmente Staphylococcus sp.(en su mayoría coagulasa negativo incluyendo S. epidermidis), Acanthamoeba sp, Aspergillus sp, Corynebacterium sp.y Fusarium sp. (Fig. 2).
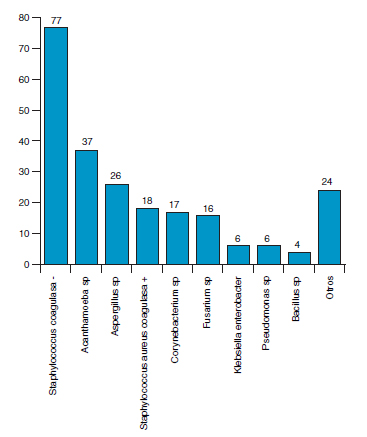
Fig. 2. Distribución de microorganismos en muestras
de córnea en orden de frecuencia.
En líquidos intraoculares, se recuperaron principalmente Staphylococcus coagulasa negativo (incluyendo S. epidermidis) y Staphylococcus aureus coagulasa positivo (Fig. 3).
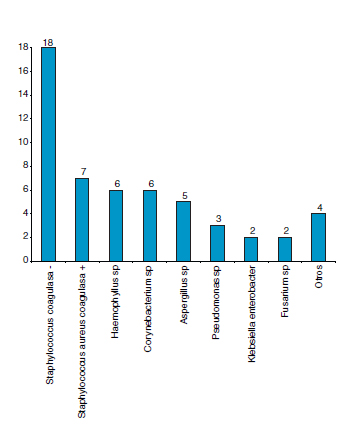
Fig. 3. Distribución de microorganismos en muestras
de líquidos intraoculares en orden de frecuencia.
El antibiograma se realizó en los cultivos con muestra positiva para bacterias y se colocaron sensidiscos de moxifloxacino (Tabla 1), gatifloxacino (Tabla 2), levofloxacino (Tabla 3) y ciprofloxacino (Tabla 4).
Comparación entre la resistencia a las fluoroquinolonas
Se obtuvo que los microorganismos presentaban una menor resistencia frente a las fluoroquinolonas de cuarta generación que frente a las de segunda y tercera, siendo esta diferencia estadísticamente significativa (p<0,05).
La resistencia bacteriana global (Gram positivas y Gram negativas de cualquier origen anatómico) a moxifloxacino fue del 10,15% (33 de 325) y a gatifloxacino fue del 6,46% (21 de 325), siendo esta diferencia estadísticamente significativa (p<0,05) por x2 en SPSS 10 (Fig. 4). Se obtuvo que la resistencia bacteriana global a levofloxacino fue de 30,77% (100 de 325) y a ciprofloxacino fue de 32,0% (104 de 325) (Fig. 4).
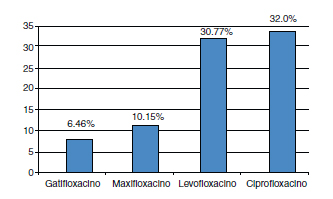
Fig. 4. Resistencia bacteriana total a las fluoroquinolonas:
gatifloxacino, moxifloxacino, levofloxacino y ciprofloxacino.
La resistencia bacteriana a las fluoroquinolonas, para los Gram positivos, ordenados de menor a mayor resistencia, fue así: gatifloxacino 6,3% (17 de 271), moxifloxacino 8,9% (24 de 271), ciprofloxacino 33,2% (90 de 271), levofloxacino 35,6% (91 de 271) (Fig. 5).
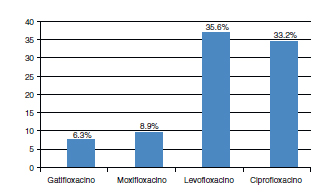
Fig. 5. Resistencia bacteriana a las fluoroquinolonas para
Gram positivos: Gatifloxacino, moxifloxacino, levofloxacino y ciprofloxacino.
Por su parte, la resistencia a las fluoroquinolonas para los Gram negativos ordenados de menor a mayor resistencia fue: gatifloxacino 7,4% (4 de 54), moxifloxacino 16,7% (9 de 54), levofloxacino 16,7% (9 de 54), ciprofloxacino 25,9% (14 de 54) (Fig. 6).
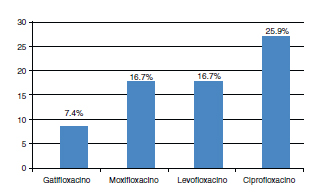
Fig. 6. Resistencia bacteriana a las fluoroquinolonas para Gram negativos:
gatifloxacino, moxifloxacino, levofloxacino y ciprofloxacino.
La mayor resistencia a moxifloxacino que a gatifloxacino mostró una diferencia estadísticamente significativa tanto para Staphylococcus aureus coagulasa positivos como para negativos (p=0,038 y p<0,005 respectivamente); pero no fue estadísticamente significativa para Pseudomonas sp.(p=0,737), probablemente por la pequeña cantidad de muestra de estos microorganismos.
Discusión
Las fluoroquinolonas, como se mencionó anteriormente, actúan sobre la ADN girasa (topoisomerasa II) y sobre la topoisomerasa IV; siendo las de cuarta generación de mayor acción, menor probabilidad de resistencia bacteriana y mayor espectro de acción porque actúan simultáneamente sobre las dos enzimas. Para desarrollar resistencia a las fluoroquinolonas de segunda generación (ciprofloxacino, ofloxacino), las bacterias solo necesitan de una mutación; mientras que las fluoroquinolonas más nuevas como moxifloxacino y gatifloxacino fueron específicamente diseñadas para verse menos afectadas por las mutaciones espontáneas, ya que necesitan generalmente de 2 mutaciones bacterianas para generar resistencias17. Sin embargo, la resistencia a las de generaciones anteriores ha crecido notablemente en la última década. Por ello puede servir de ayuda a los microorganismos para, con una nueva mutación, lograr la resistencia a las fluoroquinolonas de cuarta generación. In vitro se ha evidenciado el desarrollo de resistencia a las fluoroquinolonas de cuarta generación desde hace más de 5 años, aunque no existen estudios clínicos definitivos que confirmen la falta de efectividad de los tratamientos10.
Debido a los altos porcentajes de resistencia bacteriana a las fluoroquinolonas de segunda y tercera generación, se ha cuestionado su eficacia actual para tratamiento y profilaxis de infecciones oculares. En estudios publicados en la última década, se han informado niveles de resistencia bacteriana del 30% al ofloxacino18; niveles de resistencia de bacterias procedentes de queratitis, al ciprofloxacino del 21,5% (Gram positivos) y 2,7% (Gram negativos), y al ofloxacino del 18,5% y 2,7%, respectivamente19. Otra publicación13 mostró resistencia en 30,7% al ciprofloxacino en muestras in vitro de queratitis bacteriana, siendo mayor para los Gram positivos, lo cual fue similar a nuestros resultados (en muestras de córnea un nivel de 27% para todas las bacterias: 28,8% para Gram positivos y 13,3% para Gram negativos), y observándose un aumento creciente de esta resistencia a través de los años. Mather et al.20 en 2002 comunicaron superioridad de las fluoroquinolonas de cuarta generación sobre ciprofloxacino, ofloxacino y levofloxacino in vitro especialmente sobre los Gram positivos; siendo muy similar su eficacia con los Gram negativos. Esto ha sido confirmado en estudios más recientes de susceptibilidades bacterianas in vitro, donde se ha evidenciado una resistencia en aumento de los microorganismos a las de fluoroquinolonas de segunda y tercera generación (levofloxacino y tosufloxacino) en flora conjuntival normal y nos advierte de ciertas cepas de Staphylococcus sp. con posibles mecanismos de resistencia a las fluoroquinolonas, lo cual resulta importante para la práctica clínica3,15. Se ha publicado también que existe una mayor resistencia a las fluoroquinolonas en pacientes con ojo seco21.
En el presente estudio, observamos una resistencia en aumento con respecto a estudios previos y un dato llamativo, específicamente para las fluoroquinolonas de cuarta generación: los niveles de resistencia bacteriana fueron mayores entre los gérmenes Gram negativos que entre los Gram positivos. Estas tendencias justificarían el cambio hacia antimicrobianos con menores niveles de resistencia microbiana como las fluoroquinolonas de cuarta generación, especialmente en situaciones donde sea crítica la acción antibacteriana, como en tratamiento de infecciones corneales o intraoculares y profilaxis de endoftalmitis.
Con respecto a los patógenos específicos, Pseudomonas aeruginosa sigue siendo una bacteria que presenta alta resistencia; sin embargo, en nuestro estudio debido a la muestra muy pequeña es difícil determinar su sensibilidad antibiótica. Los Staphylococcus sp.mostraron una baja resistencia a estos 2 importantes antibióticos. Sin embargo, la resistencia va en aumento con respecto a estudios previos por lo cual se deben manejar estos antibióticos con mucha cautela18.
En nuestro estudio, se evidenció una cantidad importante de infecciones por Acanthamoebas sp.(37 de 231 muestras). Este es un microorganismo poco frecuente (menos del 1% de las úlceras corneales) y generalmente relacionado con el uso de lentes de contacto22-24. Nuestro estudio se correlaciona con la alta prevalencia descrita en un estudio previo realizado en la institución9 donde se evidenció que un 25% de los pacientes con queratitis infecciosa eran por Acanthamoeba sp, aun sin relación con el uso de lentes de contacto. Se está planeando un estudio prospectivo para determinar factores de riesgo de este tipo de queratitis amebiana en nuestro medio.
Es una realidad el desarrollo de resistencia por parte de las bacterias a todas las fluoroquinolonas, incluyendo las de cuarta generación. Sin embargo los porcentajes de resistencia de las de cuarta generación comparada con las de tercera y segunda es menor de manera estadísticamente significativa, especialmente para Gram positivos.
Al comparar gatifloxacino y moxifloxacino, el primero mostró menores niveles de resistencia microbiana in vitro en nuestro estudio, con diferencia estadísticamente significativa. La interpretación de esta superioridad debe, sin embargo, hacerse con cuidado en el campo clínico, ya que se deben tomar en cuenta otros factores como la penetración tisular de estos dos antibióticos, que es mayor para moxifloxacino, lo cual resulta en mayor concentración intraocular de este25,26,27.
En conclusión, encontramos que las fluoroquinolonas de segunda y tercera generación exhiben niveles elevados de resistencia microbiana en nuestro medio. Las de cuarta generación tienen unos niveles aún bajos de resistencia bacteriana y por ello su efectividad clínica, tanto en tratamiento como en profilaxis de infecciones, debe ser superior. Consideramos que el uso indiscriminado o la mala dosificación de estos antibióticos puede acelerar la aparición de resistencias microbianas, por lo cual se deben reservar para el tratamiento de infecciones conjuntivales refractarias, infecciones corneanas y endoftalmitis.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Bibliografía
1. Powers J. Antimicrobial drug development-the past, the present, and the future. Clin Microbiol Infect. 2004; 10:23-31. [ Links ]
2. Olson R. Challenges in Ocular Infectious Diseases and the Evolution of Anti-Infective Therapy. Surv Ophthalmol. 2004; 49:S53-4. [ Links ]
3. Blondeau J. Fluoroquinolones: Mechanism of action, Classification, and Development of resistance. Surv Ophthalmol. 2004; 49:S73-8. [ Links ]
4. Hooper D. Quinolones. En: Mandell G.L., Bennett J.E., Dolin R., editors. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 5th ed. Philadelphia, PA: Churchill Livingstone; 2000. 404-23. [ Links ]
5. Fynn-Thompson N, Pineda R. Antibiotic advances in Ophthalmology. Int Ophthalmol Clin. 2004; 44:91-102. [ Links ]
6. Kaufman S, Rusinek C, Salahuddin A, Ahee J, Prassad A. Comparison of the biocompatibility of gatifloxacin 0.3% and moxifloxacin 0.5%. Cornea. 2006; 25:S31-4. [ Links ]
7. O'Brien T. Evidence-based Review of Moxifloxacin. Int Ophtalmol Clin. 2006; 46:61-72. [ Links ]
8. Yamada M, Hatou S, Yoshida J. In vitro susceptibilities of bacterial isolates from conjunctival flora to gatifloxacin, levofloxacin, tosufloxacin, and moxifloxacin. Eye & Contact Lenses. 2008; 34:109-12. [ Links ]
9. Serrano-Calderon C, Hernández GA, Castillo CA, Gómez AJ. Perfil epidemiológico, clínico y microbiológico de los pacientes con queratitis infecciosa tratados en la Fundación Oftalmológica de Santander. MedUNAB. 2007; 10:93-8. [ Links ]
10. Mah F. Fourth-Generation Fluoroquinlones: New topical agents in the war on ocular bacterial infections. Curr Opin Ophthalmol. 2004; 15:316-20. [ Links ]
11. Bucci F, Amiaco L, Evans R. Antimicrobial efficacy of prophylactic gatifloxacin 0.3% and moxifloxacin 0.5% in patients undergoing phacoemulsification surgery. Eye & Contact Lens. 2008; 34:39-42. [ Links ]
12. Yeh D, Stinett S, Afshari S. Analysis of bacterial cultures in infectious keratitis 1997 to 2004. Am J Ophthalmol. 2006; 142:1066-8. [ Links ]
13. Kunimoto DI, Sharma S, Garg P, Rao G. In vitro susceptibility of bacterial keratitis pathogens to ciprofloxacin: Emerging resistance. Ophthalmology. 1999; 106:80-5. [ Links ]
14. Miño de Kaspar H, Koss M, He L, Blumenkranz M, Ta CN. Antibiotic susceptibility of preoperative normal conjunctival bacteria. Am J Ophthalmol. 2005; 139:730-3. [ Links ]
15. Chalita MR, Höfling-Lima AL, Paranhos A, Schor P, Belfort R. Shifting trends in in vitro antibiotic susceptibilities for common ocular isolates during a period of 15 years. Am J Ophthalmol. 2004; 137:43-51. [ Links ]
16. Goldstein MH, Kowalski RP, Gordon YJ. Emerging fluoroquinolone resistance in bacterial keratitis: A 5-year review. Ophthalmology. 1999; 106:1313-8. [ Links ]
17. Epstein S, Bottone E, Asbell P. Susceptibility testing of clinical isolates of Pseudomonas Aeruginosa to levofloxacin, moxifloxacin and gatifloxacin as a guideto treating Pseudomonas ocular infections. Eye & Contact Lens. 2006; 32:240-4. [ Links ]
18. Miller D, Flynn PM, Scott I, Alfonso E, Flynn H. In vitro fluoroquinolone resistance in Staphylococcal Endophthalmitis Isolates. Arch Ophthalmol. 2006; 124:479-83. [ Links ]
19. Kurokawa N, Hayashi K, Konishi M, Yamada M, Noda T, Mashima Y. Increasing ofloxacin resistance of bacterial flora from conjunctival sac of preoperative ophthalmic patients in Japan. Jpn J Ophthalmol. 2002; 46:586-9. [ Links ]
20. Mather R, Karenchak LM, Romanowski EG, Kowalski RP. Fourth generation fluoroquinolones: new weapons in the arsenal of ophthalmic antibiotics. Am J Ophthalmol. 2002; 133:463-6. [ Links ]
21. Hori Y, Maeda N, Sakamoto M, Shizuka K, Tomoyuki I, Tano Y. Bacteriologic profile of the conjunctiva in the patients with dry eye. Am J Ophthalmol. 2008; 146:729-34. [ Links ]
22. Srinivasan M, Gonzales A, George C. Epidemiology and aetiological diagnosis of corneal ulceration in Madurai, South India. Ann Acad Med Singapore. 2006; 35:185-9. [ Links ]
23. Bharati M, Ramakrishnan R. Microbiological diagnosis of infective karatitis: comparative evaluation of direct microscopy and culture results. Br J Ophthalmol. 2006; 90:1271-6. [ Links ]
24. Snrivasan M, Burman S, George C. Non-contact lens related Acanthamoeba keratitis at a tertiary eye care center in South India: Implications for eye care programs in the region. Med Sci Monit. 2003; 9:125-9. [ Links ]
25. Mc Culley JP, Caudle D, Aronowicz JD, Shine WE. Fourth-generation fluoroquinolone penetration into the aqueous humor in humans. Ophthalmology. 2006; 113:955-9. [ Links ]
26. Holland EJ, Lane SS, Kim T, Raizman M, Dunn S. Ocular penetration and pharmacokinetics of topical gatifloxacin 0.3% and moxifloxacin 0.5% ophthalmic solutions after keratoplasty. Cornea. 2008; 27:314-9. [ Links ]
27. Kim DH, Stark WJ, O'Brien T, Dick JD. Aqueous penetration and biological activity of moxifloxacin 0.5% ophthalmic solution and gatifloxacin 0.3% solution in cataract surgery patients. Ophthalmology. 2005; 112:1992-6. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
cwongm@institutowong.com
(C.A. Wong)
Recibido 4 Noviembre 2010
Aceptado 21 Junio 2011














