My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cirugía Plástica Ibero-Latinoamericana
On-line version ISSN 1989-2055Print version ISSN 0376-7892
Cir. plást. iberolatinoam. vol.38 n.2 Madrid Apr./Jun. 2012
https://dx.doi.org/10.4321/S0376-78922012000200010
Galactorrea grave tras aumento mamario con implantes
Severe galactorrhea after mammary augmentation with implants
Fidalgo Rodríguez, F.T. *
* Facultativo Especialista en Cirugía Plástica, Estética y Reparadora Hospital Universitario Reina Sofía, Córdoba. España.
Dirección para correspondencia
RESUMEN
La galactorrea es una complicación poco frecuente después de la cirugía plástica mamaria. Su causa aun es desconocida, aunque lo más probable es que su aparición tenga un origen multifactorial. En el caso que presentamos la paciente desarrolló incremento simétrico del volumen de ambas mamas después de un cirugía de aumento mamario. No se detectaron cambios en los valores de prolactina. El proceso no respondió al tratamiento con bromocriptina.
La galactorrea postquirúrgica con frecuencia sigue un curso benigno y autolimitado, culminando con resolución espontánea. Dependiendo de la severidad de los síntomas, su tratamiento puede ser médico y/o quirúrgico, con drenaje o incluso retirada de los implantes mamarios.
Palabras clave: Galactorrea, Aumento mamario, Mamoplastia de aumento, Implantes mamarios.
Código numérico: 5211-52114-52115.
ABSTRACT
Galactorrhea is a complication rarely observed after mammary plastic surgery. The cause remains unknown although it's likely to be multifactorial.
In the reported case, the patient described symmetric massive engorgement of both breasts after augmentation mammoplasty. No significant change was detected in the postoperative prolactin values. The condition was unresponsive to treatment with bromocriptine.
Postsurgical galactorrhea often follows a benign course culminating in spontaneous resolution Depending on symptom severity, treatment may be medical with the prescription of dopaminergic agonists, and/or surgical with drainage or even removal of the mammary implants.
Key words: Galactorrhea, Breast augmentation, Mammary augmentation, Mammary implants.
Numeral Code: 5211-52114-52115.
Introducción
La galactorrea es un trastorno caracterizado por la emisión de leche fuera del período de embarazo y puerperio. Es una complicación tardía y poco frecuente cuando se asocia a la cirugía mamaria. Se cree que el bloqueo de los conductos galactóforos puede ser la causa de la formación de galactoceles durante el embarazo en pacientes previamente operadas (1). Sin embargo, puede presentarse de forma aguda en el postoperatorio inmediato de una cirugía estética mamaria, asociándose con más frecuencia a reducción mamaria (3-12), donde el drenaje de leche a través de la herida puede interferir con el proceso de cicatrización. Con respecto al aumento mamario, su asociación con la galactorrea no está bien documentada en la literatura y son pocos los artículos dedicados a este tema. No obstante son muchos los cirujanos que refieren cómo algunas de sus pacientes han experimentado episodios de galactorrea autolimitada después de una cirugía de aumento mamario con implantes, que se resolvieron espontáneamente tras varias semanas sin necesidad de tratamiento (2).
Presentamos un caso grave de galactorrea postoperatoria después de una cirugía de aumento mamario bilateral que se desarrolló con una evolución tórpida y que terminó influyendo en el resultado final. Las actitudes diagnósticas y terapéuticas adoptadas durante el proceso y la evolución en función de las mismas, pueden ser de utilidad para otros casos de similar naturaleza.
Caso clínico
Mujer de 36 años de edad sin antecedentes patológicos de interés y madre de un hijo de 5 años de edad, que consulta para valorar aumento mamario bilateral. Presenta atrofia mamaria moderada con ptosis muy leve. La piel es de buena calidad, hidratada y sin estrías. No se palpan nódulos mamarios y la paciente no refiere ningún antecedente patológico mamario de relevancia. En las mamografías recientes no se detectó ninguna patología.
Tras la consulta y exploración clínica se decide llevar a cabo una cirugía de aumento mamario bilateral por vía periareolar inferior, con disección de bolsillo subpectoral y colocación de prótesis anatómicas de gel de silicona (McGhan® Style 140 MM de 320 cc.).
La intervención se realizó bajo anestesia general y transcurrió sin incidencias; la paciente fue dada de alta al día siguiente. A los 7 días de postoperatorio se encuentra bien, el aspecto de las mamas es normal, la simetría es adecuada y las molestias son de escasa relevancia. La paciente refiere que nota tensión en las mamas, pero sin dolor a la palpación. La cicatrización es correcta (Fig. 1).
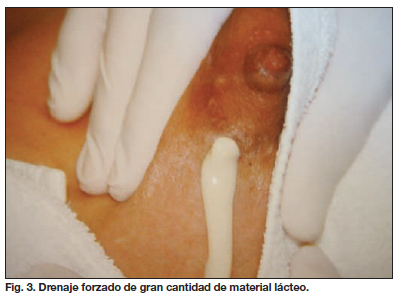
A los 15 días de postoperatorio acude a la consulta presentando aumento simétrico del volumen mamario y drenaje espontáneo de material líquido de coloración blanquecina a través de una pequeña dehiscencia de la herida periareolar derecha (Fig. 2). No ha presentado fiebre y las mamas no muestran signos inflamatorios. En el margen lateral de la cicatriz se aprecia un pequeño de fecto de 2 mm. por el que drena material, que al exprimir la mama aumenta su caudal (Fig. 3). Sospechando la existencia de un absceso retroareolar y decidimos dilatar dicho defecto usando una pinza de hemostasia, momento en el que se produce el drenaje espontáneo de una gran cantidad del citado material (Fig. 4). Al proceder a la expresión de la mama se aprecia igualmente que el material drena por el pezón y al hacer la misma maniobra en la mama izquierda, se aprecia también este drenaje por el pezón. Tomamos muestra para cultivo, siendo el resultado negativo. Ante estos hallazgos pensamos que la tumefacción de las mamas se debe a la producción de leche.
Recomendamos a la paciente realizar una analítica para estudiar los niveles de prolactina (PRL) y se realiza consulta con Ginecología que recomienda una ecografía mamaria bilateral, TAC craneal y análisis de hormonas tiroideas y suprarrenales. Los resultados de todas estas pruebas no mostraron signos patológicos. La ecografía mamaria reveló un aumento de la densidad del tejido mamario y no se apreció líquido en el bolsillo que alojaba la prótesis. Aún así se decide instaurar tratamiento con bromocriptina por vía oral de forma empírica, a una dosis inicial de 1,25 mg., 3 veces al día. Después de una semana de tratamiento y al no obtener respuesta, se aumentó la dosis hasta 2,5 mg. 3 veces al día. El tratamiento se mantendría hasta 2 semanas después del cese de la secreción.
A pesar del tratamiento la evolución fue tórpida y el cuadro de galactorrea no cesó, continuando el drenaje de leche a través de la herida de la mama derecha. Ambas mamas continuaban turgentes. Se mantiene a la paciente con vendajes moderadamente compresivos considerando que el drenaje continuo de leche por la fístula de la herida puede ser un estímulo mantenido para la lactancia, así como para sellar posibles espacios muertos en el bolsillo o en el tejido mamario.
Al cabo de 2 meses en los que la paciente fue sometida a revisiones y curas semanales, el cuadro de galactorrea cesó, deteniéndose el drenaje de leche a través de la herida y disminuyendo la turgencia en ambas mamas.
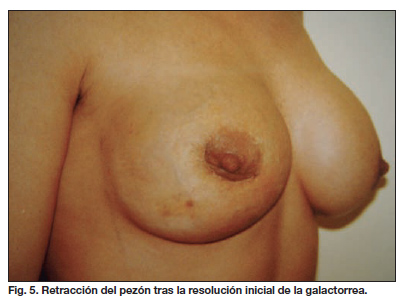
Sin embargo, 2 semanas después la paciente acude de nuevo presentando en esta ocasión aumento de volumen mamario unilateral derecho. Se realiza nueva ecografía mamaria que revela la existencia de un seroma intracapsular derecho. Se procede al drenaje del mismo bajo condiciones de asepsia y éste se resuelve en 7 días; pero la morfología de la mama comienza a verse afectada de tal forma que el trayecto a través del cual drenaba la leche se retrae deformando la areola. Se constata también que la mama desarrolla un grado incipiente de contractura capsular. Optamos por llevar a cabo revisión quirúrgica debido sobre todo a la deformidad provocada por la fístula areolar (Fig. 5).
La paciente es intervenida procediendo a la revisión del bolsillo en el que no se aprecia la existencia de ninguna colección líquida, tan solo escasos depósitos blanquecinos que se analizan Practicamos capsulotomías, recolocación de la prótesis que permanecía intacta y sin depósitos en su superficie y reparación de la retracción areolar. El informe anatomopatológico de los depósitos blanquecinos hallados describe la existencia de fibrosis hialinizada con infiltración crónica granulomatosa e infiltrado de histiocitos (Fig. 6).
Durante este segundo postoperatorio la paciente no desarrolla galactorrea y se recupera sin incidencias. Sin embargo, después de 1 año la mama derecha desarrolla contractura capsular grado III por lo que se decide reintervenir nuevamente (Fig. 7), realizando capsulectomía parcial debido a que los tegumentos se han adelgazado y se considera el riesgo de afectar la integridad de la piel durante la realización de una capsulectomia total, y capsulorrafia medial por ser esta la zona en la que el adelgazamiento de los tejidos es mayor. Cambiamos la prótesis por otra de idénticas carácterísticas. En el postoperatorio de esta nueva intervención detectamos como única complicación un síndrome de Mondor en la mama derecha.
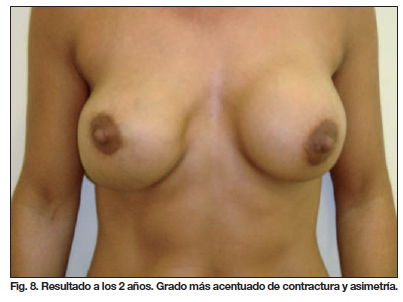
Al cabo de 2 años de postoperatorio la paciente presenta nuevamente signos compatibles con contractura capsular recidivada en la mama derecha, con notable afectación estética y de aparición más lenta en la mama izquierda (Fig. 8). El tratamiento quirúrgico que podría plantearse en esta ocasión sería: en la mama derecha nueva capsulectomía, si los tegumentos lo permiten, pudiendo precisar de refuerzo mediante malla de material sintético o biológico en la región ínferomedial, y en la mama izquierda capsulectomía y recambio de prótesis. No se descarta la necesidad de añadir procedimientos de mastopexia para corregir la posición del complejo teloareolar.
Discusión
Están descritas diferentes etiologías para explicar la galactorrea (13,14):
• Por defecto en la inhibición hipotalámica de la secreción de PRL o por aumento de la misma en suero al disminuir su eliminación de la circulación influida por la dopamina o por agonistas dopaminérgicos:
- Fármacos: neurolépticos (butirofenonas, fenotiacinas, risperidona, olanzapina, sulpiride), antidepresivos, antihipertensivos (metildopa, reserpina), opiáceos (codeína, morfina, metadona), antieméticos (metoclopramida, domperidona), cimetidina, lansoprazol, anovulatorios, verapamilo.
- Por afectación hipotalámica:
Tumores (craneofaringioma, pinealoma, meningioma, metástasis)
Histiocitosis X, sarcoidosis, lupus.
Irradiación, meningitis, encefalitis, hidrocefalia, lesiones vasculares.
- Por afectación del tallo hipofisario:
Sección del tallo (traumática, quirúrgica).
Compresión tumoral.
• Aumento de factores liberadores de PRL:
- Hipotiroidismo primario.
- Algunas hierbas como anís, hinojo, ortiga, cardo santo o semillas de fenogreco.
- Enfermedad de Addison.
- Enfermedad de Cushing.
• Tumores productores de PRL:
- Prolactinomas (tumores hipofisarios productores de PRL y en ocasiones también de GH). La causa más frecuente (25 % de los casos).
- Adenomas cromófobos.
- Producción ectópica de PRL o HPL
Carcinoma broncógeno.
Hipernefroma.
Mola hidatiforme, coriocarcinoma, teratoma ovárico.
• Causas locales:
- Estimulación mecánica repetida.
- Traumatismos torácicos.
- Cirugía mayor, toracotomía, cirugía mamaria.
- Infecciones locales (mastitis, herpes zoster).
• Otras:
- Insuficiencia renal crónica (50 % tienen PRL elevada, aunque la galactorrea es rara), silla turca vacía, cirrosis hepática, ovario poliquístico, carcinoma suprarrenal feminizante, hipertiroidismo, lesión medular.
• Idiopática: es un diagnóstico de exclusión y puede suponer hasta un 50 % de los casos.
El estímulo mecánico de la mama, las mastitis, los traumatismos y la cirugía torácica, así como el herpes zóster del tórax, desencadenan un mecanismo irritativo nervioso reflejo que asciende por los nervios torácicos afectando la liberación de los factores que regulan la PRL y pudiendo producir galactorrea. Ésta puede ser la etiología más fundada en el caso de galactorrea asociada a cirugía mamaria; sin embargo hemos de indicar que en la mayoría de las pacientes en los que se desarrolla esta complicación, los niveles de PRL son normales.
La presencia de secreción anómala a través del pezón o de la herida después de una cirugía mamaria debe hacer sospechar la existencia de infección; sin embargo, ésta cursa con dolor, síntomas inflamatorios y secreción purulenta, mientras que en la galactorrea la secreción es opalescente y no existen signos inflamatorios en la mama. En los cultivos de la secreción láctea pueden aparecer gérmenes de la flora normal de la piel que pueden confundir el diagnóstico. En caso de duda, un examen microscópico de la secreción que demuestre la presencia de glóbulos de grasa, confirmaría el diagnóstico de galactorrea.
Entre los factores comunes asociados a las pacientes que sufren este trastorno el más frecuente es el de haber tenido hijos, no encontrándose asociación para ningún otro factor.
Los estudios que se han llevado a cabo en el postoperatorio de la cirugía de aumento mamario controlando los niveles de PRL en sangre, revelan que después de la misma los niveles de PRL permanecen en valores normales, por lo que la colocación de las prótesis de silicona no se relaciona con un aumento de los niveles de PRL ni con un aumento de la lactación (15).
La lactación aparecida en el postoperatorio casi inmediato del caso de aumento mamario que presentamos no se relacionó con un aumento de los niveles de PRL, que en los análisis practicados resultaron normales. No se hallaron trastornos endocrinológicos asociados con un cuadro tipo hipotiroidismo o afectación suprarrenal, ni logramos diagnosticar otras causas de hiperprolactinemia.
El cuadro se desarrolló de forma bilateral, con emisión de leche por ambas mamas; sin embargo en la mama derecha sospechamos que se produjo un galactocele retroareolar que se complicó con drenaje espontáneo a través de la herida, afectando a la cicatrización y provocando a la larga retracción cicatricial en el trayecto fistuloso. La evacuación continua de leche se interpretó como causa de estimulo también continuo para la lactancia, con prolongación de la galactorrea, por lo que intentamos atenuar este estimulo aumentando la presión sobre la zona mediante un vendaje moderadamente compresivo para disminuir el drenaje (16).
Si bien no pudimos documentar la filtración de material lácteo al bolsillo, pues las ecografías practicadas descartaron en principio la presencia de líquido intracapsular, no descartamos que esta filtración se produjese aun en mínimas cantidades, influyendo así en la aparición del seroma intracapsular detectado al final del proceso. La presencia de escasos depósitos blanquecinos en la capsula periprotésica no pudo relacionarse directamente con la inclusión de material lácteo. Es de suponer que en este caso la filtración de leche que fue capaz de afectar a la integridad de la piel en la cicatriz, también fue capaz de progresar hacia el bolsillo, aunque debemos considerar que si esto se hubiese producido, al ser tan notable el caudal de leche, la acumulación en el bolsillo debería haber alcanzado un volumen importante, creando un autentico galactocele intracapsular y con ello más probabilidades de infección por dificultad para su reabsorción espontánea, generando depósitos más evidentes en los tejidos. Pero ninguna de estas circunstancias se produjo.
El tratamiento con bromocriptina se instauró de forma empírica, pues no llegamos a documentar hiperprolactinemia en ningún momento. Durante 2 meses los controles permanecieron dentro de niveles normales y no se produjo influencia en la evolución del caso. Mantuvimos tratamiento antibiótico con amoxicilina y clavulánico a dosis de 875/125 mg. cada 8 horas, por vía oral, durante los periodos de reagudización del proceso. En ningún momento la paciente documentó la presencia de fiebre ni de signos inflamatorios o infecciosos en las mamas.
La disminución de la turgencia mamaria se produjo de forma simultánea en ambas mamas al tiempo que se producía el cese de la galactorrea en un periodo de apenas una semana, después de 2 meses de tortuosa evolución. La mama izquierda adoptó una morfología aceptable, pero en la mama derecha las secuelas cicatriciales y la atrofia de los tegumentos afectaron notablemente a su naturalidad. La adopción de la medida consistente en vendaje compresivo de la mama pudo afectar de forma negativa a los tegumentos en la mama fistulizada, pero no tuvo sin embargo repercusiones en la mama contralateral.
El desarrollo de contractura capsular en la mama derecha era de esperar. En la mama izquierda sin embargo también se terminó desarrollando esta complicación, aunque a más largo plazo. Esto podría atribuirse inicialmente a la filtración de leche en el bolsillo o a la evolución tórpida del cuadro en general, lo que mantuvo la glándula mamaria activa durante todo el postoperatorio tanto a corto como a medio plazo. En ningún momento constatamos la existencia de líquido intracapsular durante la fase aguda del proceso; sólo fue evidente mediante ecografía cuando se desarrolló el seroma y éste al ser evacuado, no mostró ningún signo de contaminación por leche o material purulento.
La decisión de intervenir en la primera ocasión se adoptó debido a la deformidad generada por la fístula que afectaba notablemente a la forma de la mama y consiguientemente producía insatisfacción a la paciente. Sirvió para comprobar la integridad de la prótesis y la ausencia de material en el bolsillo. Los signos de contractura eran muy incipientes y consideramos que no justificaban la intervención por si solos; de ahí que no realizáramos capsulectomia total y que optáramos por reimplantar la misma prótesis. Esta decisión puede ser controvertida, pero se adoptó en virtud de la ausencia a lo largo de todo el proceso de signos de infección y a la falta de pruebas fehacientes de que la leche hubiese alcanzado el bolsillo. Puede plantearse la duda de si la colocación de una prótesis nueva hubiese podido evitar la aparición de la contractura que finalmente se instauró de nuevo. Podemos comparar entonces la evolución en ambas mamas: cuando se realizó la primera reintervención en la mama derecha, la mama izquierda no presentaba ningún signo patológico y nada indicaba que fuese a precisar de corrección alguna, no obstante al final también desarrolló contractura capsular.
La segunda intervención tampoco fue efectiva por completo ya que la contractura volvió a desarrollarse. En esta ocasión no creímos indicado practicar capsulectomía total para no dañar los tegumentos, ya notablemente adelgazados. El que quedasen restos de cápsula en los polos mediales de la mama podría relacionarse con un mayor riesgo de contractura, pero no olvidemos que en ocasiones la contractura capsular se soluciona solo con capsulotomías y después no se producen recidivas. Deducimos entonces que el desarrollo de galactorrea grave tras el aumento mamario aumentó las probabilidades de desarrollar contractura capsular en esta paciente.
La desigual evolución del cuadro en las dos mamas nos permitió comparar el comportamiento de las mismas ante esta complicación en dos circunstancias diferentes: con fistulización y sin ella. Las consecuencias de la fistulización fueron más dramáticas tanto desde el punto de vista clínico como desde el punto de vista estético, mientras que la mama fistulizada causo graves problemas a la paciente, la contralateral no le produjo más problemas que la sensación de turgencia, presentando ambas galactorrea. No obstante, al final ambas mamas se vieron afectadas por contractura capsular.
De esta evolución desigual concluimos que en el caso de galactorrea sin complicaciones asociadas la tendencia natural es al cese del cuadro de forma espontánea en un periodo variable de tiempo (17), debiendo ser nuestra actitud conservadora, pero advirtiendo a la paciente de que las probabilidades de desarrollar en el futuro una contractura capsular pueden aumentar. Por el contrario, la fistulización provoca notables dificultades de control y complica tanto el tratamiento como la evolución del cuadro, provocando a la larga importantes alteraciones estéticas en la mama (18).
A raíz de estos hallazgos nuestra recomendación en caso de galactorrea con fistulización es la retirada de los implantes sin proceder a su recolocación hasta que no ceda la actividad inflamatoria en las mamas. Recambiar los implantes a corto o medio plazo no evitó en nuestra paciente la aparición de contractura capsular. Si no se produce fistulización, podemos adoptar una actitud expectante, reservando el tratamiento quirúrgico para aquellos casos en los que se instaure un grado importante de contractura capsular.
Es importante reseñar que estas complicaciones estuvieron asociadas en nuestra opinión a la elección de la vía periareolar como acceso para la mamoplastia de aumento, vía en la que existe más riesgo de lesionar los conductos galactóforos. La incidencia es menor en el caso de utilizar la vía submamaria, puesto que dichos conductos quedan intactos en la mayoría de los casos. Por lo tanto, otra recomendación importante sería emplear la vía submamaria como vía de elección para el aumento mamario con implantes en aquellas pacientes que presenten antecedentes de galactorrea o que hayan realizado periodos largos o recientes de lactancia.
Conclusiones
La galactorrea después de un aumento mamario con implantes es una complicación poco frecuente. En la mayoría de los casos no se encuentra una causa que la explique. Del mismo modo, la resolución del cuadro se produce de forma espontánea en varias semanas, a veces, sin necesidad de tratamiento alguno. Sin embargo en el caso que presentamos, la aparición de una fístula y la intensidad y duración de la galactorrea complicaron el cuadro clínico dándole una dimensión diferente.
Lo cierto es que después de valorar la evolución del cuadro que presentó la paciente, con la afectación que ha conllevado tanto desde el punto de vista físico como psicológico, podríamos recomendar que ante cuadros de galactorrea copiosa tras una aumento mamario, que se compliquen con formación de galactocele y sobre todo con fistulización, una actitud acertada podría ser retirar los implantes y esperar a la resolución del cuadro para volver a valorar el aumento o incluso desaconsejarlo en un futuro.
Bibliografía
1. Acartürk S, Gencel E, Tuncer I.: An uncommon complication of secondary augmentation mammoplasty: bilaterally massive engorgement of breasts after pregnancy attributable to postinfection and blockage of mammary ducts. Aesth. Plast Surg. 2005;29(4):274. [ Links ]
2. Chun YS, Taghinia A.: Hyperprolactinemia and galactocele formation after augmentation mammoplasty. Ann Plast Surg. 2009;62(2):122. [ Links ]
3. Inguenault C, Capon-Degardin N, Martinot-Duquennoy V, Pellerin P.: Galactorrhea after mammary plastic surgery. Ann Chir Plast Esthet. 2005;50(2):171. [ Links ]
4. Arnon O, Mendes D, Winkler E, Tamir J, Orenstein A, Haik J.: Galactorrhea complicating wound healing following reduction mammaplasty. Aesthet Surg J. 2006;26(3):300. [ Links ]
5. Majdak-Paredes EJ, Shafighi M, During V, Sterne GD.: An unusual case of galactorrhea in a postmenopausal woman complicating breast reduction. J Plast Reconstr Aesthet Surg. 2009;62(4):542. [ Links ]
6. Gundeslioglu O, Altundag O, Altundag K, Bilen BT, Borman H.: Lactation, galactorrhea, and timing of reduction mammaplasty. Plast Reconstr Surg. 2006; 117(2):701. [ Links ]
7. Bentley M, Ghali S, Asplund OA.: Galactorrhoea causing severe skin breakdown and nipple necrosis following breast reduction. Br J Plast Surg. 2004;57(7):682. [ Links ]
8. Schuurman AH, Assies J, van der Horst CM, Bos KE.: Galactorrhea after reduction mammaplasty. Plast Reconstr Surg. 1993;92(5):951. [ Links ]
9. Menéndez-Graíño F, Pena Fernández C, Burrieza PI.: Galactorrhea after reduction mammaplasty. Plast Reconstr Surg. 1990;85(4):645. [ Links ]
10. Song IC, Hunter JG.: Galactorrhea after reduction mammaplasty. Plast Reconstr Surg. 1989;84(5):857. [ Links ]
11. Bronson DL.: Galactorrhea after reduction mammaplasty. Plast Reconstr Surg. 1989;83(3):580. [ Links ]
12. Bruck JC.: Galactorrhea: a rare complication following reduction mammaplasty. Ann Plast Surg. 1987; 19(4):384. [ Links ]
13. Vance ML, Thorner MO.: Prolactin: hyperprolactinemic syndromes and management. En: Degroot LY, ed. Endocrinology. Philadelphia: W.B. Saunders, 1989, Pp:408-18. [ Links ]
14. Basil HY: Etiology and treatment of hyperprolactinemia. Semin Reprod Endocrinol 1992;10:228. [ Links ]
15. El-Hassan ND, Zaworski RE, Castro A, LeMaire WJ.: Serum prolactin levels following augmentation mammaplasty. Plast Reconstr Surg. 1981;68(2):215. [ Links ]
16. Bedinghaus JM.: Care of the breast and support of breast-feeding. Prim Care. 1997;24(1):147. [ Links ]
17. Caputy GG, Flowers RS.: Copious lactation following augmentation mammaplasty: an uncommon but not rare condition. Aesth Plast Surg. 1994;18(4):393. [ Links ]
18. Mason T C.: Hyperprolactinemia and galactorrhea associated with mammary prostheses and unresponsive to bromocriptine. A case report. J Reprod Med. 1991;36(7):541. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Félix T. Fidalgo Rodríguez.
C/Bailarina Anna Pavlova 6.
14011, Córdoba. España.
e-mail: felixfidalgo@yahoo.es