Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Cirugía Plástica Ibero-Latinoamericana
versão On-line ISSN 1989-2055versão impressa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.39 no.1 Madrid Jan./Mar. 2013
https://dx.doi.org/10.4321/S0376-78922013000100007
Descripción y seguimiento a largo plazo de 123 pacientes con melanoma y biopsia selectiva del ganglio centinela
Description and long term follow up of 123 patients with melanoma and sentinel lymph node biopsy
Aguilar Barrón, P.*, Mendieta Eckert, M.**, Fernández Samaniego, F.***, Pijoan Zubizarreta, J.I.****, Gardeazabal García, J.***** y Gabilondo Zubizarreta, F.J.******
*Médico Interno Residente, Cirugía Plástica
**Médico Interno Residente, Dermatología
***Jefe Clínico, Cirugía Plástica
****Jefe de Sección, Unidad de Epidemiología Clínica
*****Jefe de Servicio, Dermatología
******Jefe de Servicio, Cirugía Plástica
Servicio de Cirugía Plástica y Grandes Quemados del Hospital Universitario Cruces e Instituto de Investigaciones Sanitarias BioCruces, Barakaldo, Bizkaia. España
Dirección para correspondencia
RESUMEN
El estudio del ganglio centinela (GC) en el tratamiento del melanoma requiere una estrecha colaboración entre el cirujano plástico, el dermatólogo, el especialista en Medicina Nuclear y el patólogo.
Presentamos un estudio retrospectivo sobre un grupo de 123 pacientes con melanoma primario cutáneo en los que se realizó técnica de biopsia selectiva del ganglio centinela (BSGC) entre diciembre de 1999 y diciembre del 2005 en el Hospital Universitario Cruces en Barakaldo (Bizkaia, España) y describimos la evolución a largo plazo y la relación entre los resultados de la BSGC y los eventos clínicos relevantes durante el seguimiento.
Fueron extirpados 294 ganglios centinela; en 15 pacientes el patólogo informó de la presencia de micrometástasis en el GC, desarrollando posteriormente metástasis a distancia el 46,6% de esos pacientes frente a un 19% en aquellos con GC negativo (p=0,021). De los 123 pacientes estudiados, 14 fallecieron por melanoma (11´4%): 3 en el primer año de seguimiento, 2 en el segundo, 3 en el tercero, 2 en el cuarto y 2 en el quinto año.
Nuestra experiencia confirma que la BSGC es una técnica sencilla y útil para el estadiaje del melanoma por mostrar una tendencia hacia la asociación estadística entre la positividad del GC y un peor pronóstico.
Palabras clave: Melanoma, Ganglio centinela.
Código numérico: 1720.
ABSTRACT
The study of sentinel node (SN) in the management of melanoma requires close collaboration among plastic surgeon, dermatologist, specialist in Nuclear Medicine and pathologist.
The authors present a retrospective study in a group of 123 patients with primary cutaneous melanoma who consented to sentinel node biopsy (SLNB) between December 1999 and December 2005 at the University Hospital Cruces (Barakaldo, Bizkaia, Spain). We describe the long-term evolution and the relation between SLNB results and relevant clinical events during follow-up.
We removed 294 sentinel nodes; 15 patients had tumour in the centinela node, subsequently developed distant metastasis in 46.6%, compared with 19% in patients with negative SN (p = 0.021). Of the 123 patients studied, 14 died of melanoma (11´4%): 3 in the first year of follow up, 2 in the second, 3 in the third, 2 in the fourth and 2 in fifth year.
We corroborate that the SLNB is an easy technique and useful for staging, showing the statistic relationship between positive SN and bad prognostic.
Key words: Melanoma, Sentinel node.
Numeral Code: 1720.
Introducción
El factor pronóstico individual más importante en la mayoría de las neoplasias sólidas primarias, incluyendo el melanoma, es la afectación o no de los ganglios linfáticos regionales hacia los que drena dicho tumor (1). Según la acepción más difundida, el ganglio centinela (GC) es precisamente éste primer ganglio linfático que recibe el drenaje aferente de un tumor primario; es decir, el que con más probabilidad se afectará por el tumor en caso de producirse metástasis por vía linfática (2). La localización y posterior biopsia selectiva de esta primera estación permite afinar el estadiaje TNM del melanoma, ya que es el método de estudio del estado ganglionar más sensible y específico del que disponemos (3). Es así una importante herramienta a la hora de identificar pacientes con peor pronóstico, en los que podremos tomar otras medidas terapéuticas adyuvantes y/o servir como criterio de estradificación en ensayos clínicos de terapias adyuvantes (3). Sin embargo, la capacidad de esta técnica para mejorar el pronóstico del paciente es muy controvertida, y algunos autores se cuestionan si existe una verdadera justificación para realizarla dada la morbilidad asociada y la carga psicosocial que puede tener para el paciente y su familia el saber que está en un estadio más avanzado de la enfermedad (4).
Presentamos un estudio retrospectivo de los pacientes a los que se ha realizado esta técnica entre diciembre de 1999 y diciembre del 2005 en el Hospital Universitario Cruces en Barakaldo (Bizkaia, España), para valorar, según nuestra experiencia, los resultados de la biopsia selectiva del ganglio centinela (BSGC) en el melanoma primario cutáneo. Realizamos un estudio descriptivo de la BSGC y una valoración de su utilidad en el seguimiento a largo plazo de estos pacientes.
Material y método
Revisamos retrospectivamente la información sobre las características clínicas y la evolución de 123 pacientes con melanoma cutáneo en estadios I y II (American Joint Committee on Cancer) que fueron enviados al Servicio de Cirugía Plástica del Hospital Universitario Cruces desde los Servicios de Dermatología de su área de influencia para la realización de técnica de biopsia selectiva del ganglio centinela (BSGC) desde diciembre del año 1999 a diciembre del 2005. Los criterios de inclusión utilizados para llevar a cabo esta técnica fueron: tener un índice de Breslow mayor de 1 mm y menor de 4 mm, sin ampliación de márgenes del tumor primario (que se lleva a cabo en el mismo tiempo quirúrgico que la BSGC) y sin evidencia de enfermedad metastásica ganglionar o visceral. Sin embargo, durante los primeros meses de aplicación de la técnica, ésta se realizó en algunos pacientes con índice de Breslow fuera de los límites indicados.
Los datos se obtuvieron a partir de la revisión de las historias clínicas y del archivo específico de melanomas de los Servicios de Cirugía Plástica y Dermatología del Hospital Universitario Cruces. En los casos en los que el paciente ya no acudía a nuestras consultas, se contactó telefónicamente con él o con sus familiares para obtener los datos actualizados de su estado.
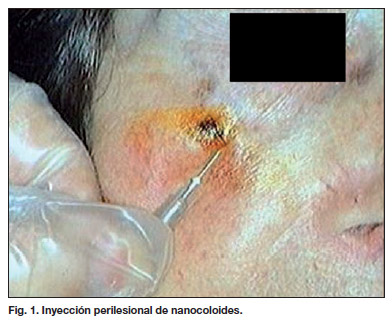
El procedimiento de identificación del GC y su extirpación quirúrgica fué el siguiente: 4 horas antes de la intervención, se realizaron 4 inyecciones intradérmicas perilesionales (Fig. 1), alrededor de la lesión o de la cicatriz postextirpación, de una solución de micelas coloidales (nanocoloides) de 50 a 100 nm, marcadas con 11.1 MBq de 99Tc, diluidas en 0.15-0.30 ml. de suero salino. En todos los casos, con la intención de identificar los ganglios centinelas y su localización, se practicó linfogammagrafía mediante la adquisición de imágenes planares desde los 10 minutos de la inyección hasta la detección del o los ganglios centinelas. Todas las exploraciones fueron realizadas con la gammacámara Starcam Mobile 300A (General Electric Medical Systems) de 37 fotomultiplicadores.
Los pacientes fueron colocados en la misma posición en la que iban a ser intervenidos y se tapó la zona perilesional, en el caso de ser necesario, con máscaras de plomo a fin de evitar interferencias. Posteriormente se procedió a la identificación del o los ganglios centinelas y al marcaje cutáneo con tinta indeleble. En quirófano, se localizaron intraoperatoriamente los ganglios centinelas utilizando una sonda gamma colimada (Europrobe) (Fig. 2) que se calibra antes del inicio de cada procedimiento (fotopico de 140 keV con una ventana de 10 keV). Después se procedió a su extirpación quirúrgica.
El tejido obtenido se fijó en formol hasta su procesamiento y luego se realizaron múltiples cortes que se fijaron en parafina. Se montaron 2 portaobjetos con 2 cortes cada uno. Se rebajó el bloque en un espesor de 150 micras y se volvieron a montar otros tantos cortes en idéntico orden, y así sucesivamente, hasta agotar la pieza. El primer portaobjetos de cada tanda de cortes se tiñó con hematoxilina-eosina y se examinó al microscopio. En los casos en los que en este examen no se veían células tumorales, en el corte siguiente se realizaban técnicas de inmunohistoquímica (S-100 y HMB 45) para mejorar la capacidad de detección de estas células.
El seguimiento posterior (mediana de seguimiento de 74 meses) se realizó de forma conjunta por los Servicios de Dermatología, Cirugía Plástica y en algunos casos por el de Oncología Médica, con una periodicidad cuatrimestral, semestral o anual en función del estadio. En los melanomas de riesgo intermedio y alto (estadios IIB y III) se realizó tratamiento adyuvante con interferón alfa 2b (IFN). Los melanomas metastásicos se trataron con dacarbacina o fueron incluidos en ensayos clínicos.
ANÁLISIS ESTADÍSTICO
Hemos realizado un estudio descriptivo de las siguientes características: variables demográficas del paciente (edad, sexo), del melanoma primario (localización, tipo histológico, Breslow, Clark, presencia de ulceración), del ganglio centinela (localización, número de ganglios marcados, presencia de micrometástasis, complicaciones y efectividad), de las intervenciones médico-quirúrgicas realizadas (linfadenectomía radical (número de ganglios extirpados y resultado anatomopatológico), IFN intravenoso y de la evolución clínica del paciente durante el periodo de seguimiento (presencia de metástasis y tiempo hasta su aparición, localización y tratamientos específicos).
Realizamos un estudio inferencial para evaluar la existencia de factores asociados con la positividad del GC y con el pronóstico de la enfermedad. Para ello utilizamos el test exacto de Fisher obtenido de tablas de contingencia, el test U de Mann-Withney para comparar variables continuas con distribución no gaussiana entre dos grupos independientes y analizamos la supervivencia utilizando tablas de vida mediante el método de Kaplan-Meier. La comparación intergrupos de los tiempos de supervivencia se realizó utilizando la prueba del long rank test. Consideramos estadísticamente significativos valores de p<0,05. En el análisis de supervivencia, el resultado evaluado fue la muerte debida a la progresión del melanoma. Los fallecimientos por causas no relacionadas con el melanoma se censuraron cuando acontecieron. El estudio descriptivo y analítico de estos datos se realizó mediante el programa estadístico Stata 11.2 para Windows (5).
RESULTADOS
Estudio descriptivo
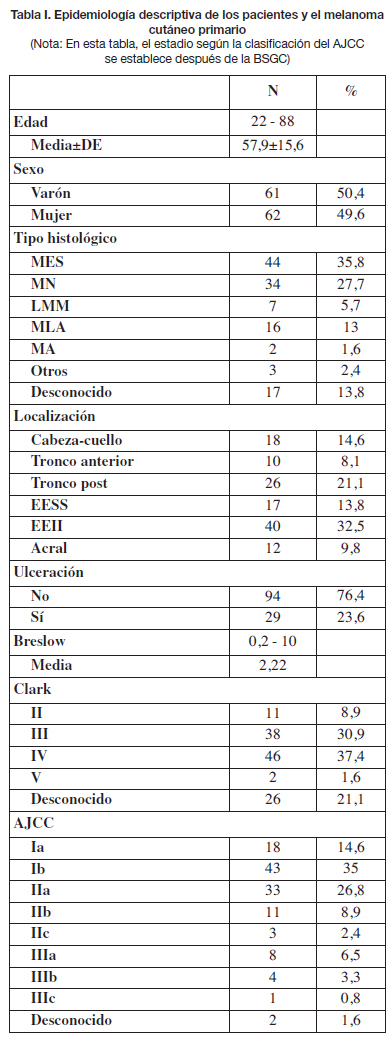
Las características de los pacientes y del melanoma primario se resumen en la Tabla I. De los 123 pacientes, 61 eran varones y 62 mujeres, con edades comprendidas entre los 22 y 88 años. La localización más frecuente fue en extremidades inferiores (32,5%), tronco posterior (21,1%) y cabeza y cuello (14,6%). La media del índice de Breslow fue de 2,22 mm y la mediana de 1,9 mm, siendo el rango de valores de 0,2 a 10 mm. Tras el estudio de los ganglios centinela se determinó el estadio según la clasificación del AJCC, siendo los más frecuentes el IB (35%) y el IIA (26,8%). En 2 casos no se pudieron recoger datos suficientes para el estadiaje. Cabe señalar que 2 pacientes habían tenido otro melanoma previamente, y que 1 paciente había tenido otros 2. Sin embargo, no se les había realizado la BSGC de esos tumores anteriores porque no cumplían criterios.
De los 123 pacientes, se pudo realizar BSGC en 120 pacientes (97,6%). En 2 no se pudo localizar el o los ganglios intraoperatoriamente por problemas técnicos con la sonda de captación. Por otra parte, no se pudo extirpar el ganglio señalado en 1 caso por no ser abordable quirúrgicamente dada su localización intraperitoneal. En otros 2 casos no se pudieron extirpar todos los ganglios detectados. La efectividad de la técnica de BSGC, definida como porcentaje de casos en los que se detectan GC y son extirpados en su totalidad aquellos que son detectados, es del 95,9%. Las localizaciones más frecuente del drenaje linfático primario del tumor fueron la región axilar y la inguinal (46,7% y 45% , respectivamente).
En la Tabla II se muestran las principales características de los GC detectados. La suma de localizaciones es mayor que el número de pacientes porque en el 11,3% de los casos hay dos zonas de drenaje. De las 6 metástasis en tránsito, 4 eran poplíteas y 2 lumbares. También se describió la presencia de ganglios centinela en otras regiones, como la ilíaca, intercostales e intraperitoneal. En total fueron extirpados 294 ganglios centinela. En la mayoría de los pacientes (69,9%) se obtuvo más de un ganglio centinela.
De los 120 pacientes a los que se les realizó la BSGC,en 15 (12,5%) el patólogo informó de la presencia de micrometástasis de melanoma tras el examen histológico convencional y/o el estudio con técnicas inmunohistoquímicas.Su localización más frecuente fue la inguinal yla axilar ipsilateral. Dos pacientes presentaron afectación en 2 localizaciones diferentes: 1 paciente con un melanoma en tercio superior de la espalda (región central) sufrió micrometástasis en ambas axilas, y 1 paciente con un melanoma en el pie tuvo 3 ganglios positivos en ingle y otro más en hueco poplíteo. De estos pacientes con micrometástasis, 9 (60%) tuvieron 1 solo GC positivo, 4 (26,7%) tuvieron 2 y 2 (13,3%) tuvieron 4 GC positivos.
Posteriormente, se realizó linfadenectomía radical (LR) en 13 de los 15 pacientes con micrometástasis (86,7%). En 1 paciente, el GC se localizó en la región poplítea y en otro en la región lumbar, lo que impidió emplear esta técnica. La Tabla III describe el número de ganglios linfáticos extirpados en la LR. En 3 pacientes (23%) se identificaron ganglios linfáticos con tumoración adicional.
Once pacientes (8,9%) presentaron complicaciones en la zona de la BSGC. La herida quirúrgica se infectó en 4 ocasiones (3,25%) y se desarrolló seroma en otros 3 casos (2,44%). Un paciente (0,81%) presentó ambas complicaciones. Otras complicaciones halladas fueron 1 dehiscencia de sutura, 1 hematoma local y 1 necrosis cutánea local, cada una de ellas en 1 solo paciente (0,81%).
Once pacientes (8,9%) presentaron complicaciones en la zona de la BSGC. La herida quirúrgica se infectó en 4 ocasiones (3,25%) y se desarrolló seroma en otros 3 casos (2,44%). Un paciente (0,81%) presentó ambas complicaciones. Otras complicaciones halladas fueron 1 dehiscencia de sutura, 1 hematoma local y 1 necrosis cutánea local, cada una de ellas en 1 solo paciente (0,81%).
El tiempo de seguimiento posterior a la técnica ha variado entre 1 y 120 meses, siendo la mediana de 74 meses. Durante el seguimiento clínico se produce la pérdida de 8 pacientes, 2 de ellos con enfermedad metastásica (1 visceral y 1 ganglionar) y ganglio centinela positivo. Eliminando estos pacientes el tiempo medio de seguimiento fue de 72 meses.
Durante el seguimiento, 27 pacientes (21.9%) presentaron metástasis, siendo las más frecuentes las viscerales con 17 pacientes (63%), seguidas de las cutáneas con 14 pacientes (51,8%) y las ganglionares con 12 (44,4%) (Tabla IV). Durante el seguimiento fallecieron por melanoma 14 de estos pacientes (51.8%), todos ellos con metástasis viscerales.
Factores relacionados con el pronóstico y el resultado de la técnica
No se encontró asociación (p>0,05) entre las siguientes características del melanoma y la positividad del GC: índice de Breslow, ulceración y localización. De los 15 pacientes con GC positivo, 7 (46,6%) desarrollaron metástasis frente a 20 de los 105 pacientes con GC negativo (19%) (p=0,021; RR = 2,5; IC 95% 1,3-4,9). Estos últimos pueden considerarse como falsos negativos de la BSGC ya que la prueba no fue capaz de predecir el potencial metastásico del melanoma. Aunque proporcionalmente fallecieron por melanoma más pacientes con GC positivo (3 de 15, 20%) que con GC negativo (11 de 105, 10,5%), esta diferencia no es estadísticamente significativa (p = 0,376 RR = 2, IC 95% 0,6-6,2) (Tabla V).
Existe una tendencia a la asociación estadística entre el índice de Breslow y el fallecimiento por melanoma cuando eliminamos del análisis aquellos pacientes que tienen un Breslow < de 1 mm (dado que en estos últimos no se indica hoy la BSGC) (p = 0,07). Dos de los 14 fallecidos por melanoma (14,2%) tenían más de 4 mm de espesor tumoral; el resto tenía entre 1 y 4 mm de espesor: 3 (21,4%) tenía 4 mm de espesor tumoral; 5 (35,7%) presentaban un Breslow entre 1 y 1,99 mm, 3 (21,4%) entre 2 y 2,99 mm y por último, 1 paciente (7,1%) entre 3 y 3,99. Ninguno de los pacientes con un espesor < 1mm falleció (Gráfica 1)
Análisis de supervivencia.
De los 123 pacientes incluidos en el estudio, 14 (11,4%) fallecieron a causa del melanoma; entre ellos no se contabilizan los 5 pacientes que fallecieron por otras causas durante el tiempo de seguimiento.
La probabilidad de sobrevivir es del 98% en el primer año y del 90% a los 5 años (Gráfica 2). La mediana de seguimiento fué de 74 meses con un seguimiento máximo de 120 meses.
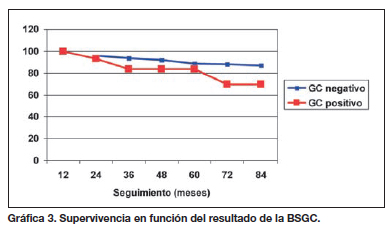
Cuando analizamos la supervivencia en relación con el resultado de la BSGC no encontramos diferencias estadísticamente significativas en la supervivencia de ambos grupos (p = 0,143), aunque de nuevo vemos una tendencia hacia la asociación estadística entre la detección de ganglio centinela positivo y la mortalidad por melanoma. Llama la atención el hecho de que los 3 pacientes fallecidos por melanoma durante el primer año tras la técnica pertenezcan al grupo con resultado negativo del GC (Gráfica 3). Estos 3 pacientes corresponden a melanomas nodulares (Breslow 1´9 mm, 9 mm y 10 mm) y al periodo de aprendizaje de la realización de la BSGC en nuestro Servicio.
En nuestro grupo de pacientes con metástasis la supervivencia al año fué del 89% , con un 73% y 54% a los 3 y 5 años respectivamente (Gráfica 4). El hecho de tener enfermedad metastásica se asocia significativamente con una menor supervivencia (log rank test p<0,001).
Discusión
Los estudios epidemiológicos presentan el índice de Breslow como principal factor pronóstico del melanoma no metastásico y en los casos con metástasis ganglionares, el número de ganglios afectos (6,7). En base a esto se propone a la BSGC como herramienta para la estadificación e identificación de aquellos pacientes con peor pronóstico.
Existe controversia en la indicación de la BSGC en pacientes con Breslow <1mm y> de 4mm; es por esto que en los primeros meses de aplicación de la técnica del ganglio centinela en nuestra muestra, se realizó en algunos pacientes con índice de Breslow <1mm o> 4 mm. Aquellos pacientes con melanoma < 1mm tienen buen pronóstico, con pocas metástasis a distancia; por ello, esta técnica sólo está indicada dentro de este grupo en pacientes que asocian factores pronósticos adversos, entre ellos el índice mitótico (9). Sin embargo, en nuestra serie no se tuvo en cuenta este factor debido a su reciente incorporación al estudio anatomopatológico. Los casos con Breslow >4 mm siguen siendo materia de debate. Algunos aseguran que tienen un alto riesgo de metástasis ocultas en el momento del diagnóstico, por lo que no estaría justificado el estudio de los ganglios linfáticos regionales (9).
Desde la primera descripción por Morton y col. de la técnica para BSGC en 1991, se ha ido perfeccionando para conseguir detectar los GC con la mayor eficacia posible y con la mínima morbilidad. En la última década se ha ido extendiendo su utilización en muchos centros hospitalarios de Europa, Norteamérica y Australia para el tratamiento del melanoma; a pesar de que, con los datos actuales, no influye en la supervivencia (8). Sin embargo, en todas las series publicadas se confirma que la BSGC en pacientes con melanomas de espesor intermedio, proporciona una mayor precisión en la formulación de un pronóstico que el resto de datos demográficos e histopatológicos conocidos.
Hemos estudiado retrospectivamente 123 pacientes con melanoma a los que se les practicó técnica del BSCG entre 1999 y 2005. De forma similar a lo establecido mayoritariamente en los protocolos en uso, la gran mayoría de los pacientes a los que se les realizó BSGC tenían melanomas de espesores entre 1 y 4 mm. Los melanomas con menor índice de Breslow tienen una baja probabilidad de presentar GC positivo, y por tanto se considera que no se beneficiarían de esta técnica que en este caso añadiría molestias, morbilidad y costes innecesarios (9). Por otra parte, tampoco se beneficiarían de la BSGC los pacientes con melanomas superiores a 4 mm, por tener mayores posibilidades de presentar metástasis a distancia en el momento del diagnóstico.
En nuestro estudio, los análisis anatomopatológicos realizados revelaron células metastásicas en los ganglios centinelas en 15 pacientes (12%). Estos resultados son similares a los que presentan otras series publicadas (4,10).
Como era de esperar, en nuestra serie hubo una mayor frecuencia de metástasis en pacientes con GC positivo, de los que casi la mitad desarrolló metástasis a distancia posteriores que en el grupo de pacientes con GC negativo, en los que se produjeron en casi 1 de cada 5 pacientes. Cabe destacar que de estos últimos, 5 (4.6%) tuvieron metástasis ganglionares en la misma región donde se realizó la BSGC y pueden ser considerados como falsos negativos, ya que la prueba no fue capaz de predecir el potencial metastático vía linfática del melanoma. Este porcentaje se puede considerar bajo teniendo en cuenta otros estudios publicados, en los que oscila entre el 4 y el 32% (11,12). Se han planteado varias teorías para explicar estos resultados. Por un lado, algunos casos pueden atribuirse a la curva de aprendizaje necesaria para realizar esta técnica (13, 14). Otra posibilidad sería que la diseminación del tumor se produjera como consecuencia de un bypass linfático o hematológico que circunvale el primer ganglio (14). También se explicarían por la existencia de células tumorales en tránsito en el momento de la exploración y que todavía no hubieran llegado al ganglio centinela (8, 14), o por obstrucción de linfáticos por células metastásicas que redirijan la circulación linfática (14). Finalmente, los falsos negativos podrían deberse a fallos en el estudio anatomopatológico. Para estos últimos casos, está en investigación la información pronóstica que podría aportar la PCR a tiempo real para detectar aquellos pacientes con enfermedad micrometastásica que no ha sido detectada por métodos convencionales (14).
Consideramos interesante destacar la existencia en nuestro estudio de pacientes con localizaciones atípicas del GC positivo: en 1 paciente en el hueco poplíteo y en otro bajo el músculo dorsal ancho. Estos GC positivos alejados de los drenajes habituales están reflejados escasamente en la literatura. Su valor pronóstico es incierto y requeriría de series más amplias para poder ser evaluado con precisión.
En nuestra experiencia, similar a la descrita por otros grupos, la técnica de BSGC es un procedimiento que requiere un aprendizaje relativamente sencillo (14) con complicaciones leves (9,14) que, cuando aparecen, se solucionan sin secuelas.
Nuestros resultados son superponibles a los de otras series (15, 16, 17). La capacidad de detectar el ganglio centinela es ligeramente inferior en nuestra serie: 95,9% frente a 99% (17), probablemente debido a la curva de aprendizaje. Sin embargo, la tasa de complicaciones posteriores a la BSGC es muy similar a otras reportadas en la lirteratura: 9% frente a 10% (17,18).
La frecuencia de afectación de ganglios linfáticos adicionales, signo de peor pronóstico, publicada en otros estudios es del 20-23% (19), cifras similares a las de nuestra serie clínica. Mientras en nuestro estudio no se detecta una asociación estadísticamente significativa entre la supervivencia y el resultado de la BSGC, otros estudios sí muestran asociación estadística significativa entre ganglio centinela negativo y mayor supervivencia (20). Las diferencias se podrían deber, entre otros motivos, al tamaño muestral moderado, a la inclusión inicial de pacientes fuera del protocolo, al tiempo de seguimiento y a la curva de aprendizaje, entre otros
Con los datos actuales no podemos afirmar que los pacientes con melanoma a los que se realiza la BSGC tengan una mayor supervivencia que aquellos a los que se les deja en observación y se les practica la linfadenectomía radical en caso de aparición de adenopatías palpables.
Conclusiones
Nuestros estudios han demostrado que la técnica realizada ha tenido una efectividad técnica alta, una tasa baja de falsos negativos, una escasa morbilidad e incidencia de tumoración adicional en las LR y ausencia de recidivas regionales en las zonas de los GC positivo.
Podemos decir que el GC constituye actualmente un método de rutina para por un lado, conocer el grado de extensión del melanoma y por otro, permitir una estrategia terapéutica basada en una mejor estadificación. Sin embargo, en nuestro estudio no se observa una asociación significativa entre la positividad del GC y el pronóstico de la enfermedad.
Agradecimientos
A los Servicios de Medicina Nuclear y Anatomía Patológica del Hospital Universitario Cruces por su estimada colaboración.
Bibliografía
1. Morton DL, Cochran AJ.: The case for lymphatic mapping and sentinel lymphadenectomy in the management of primary melanoma. Br J Dermatol 2004; 151(2): 308-319. [ Links ]
2. Nieweg OE, Tanis PJ, Kronn BR.: The definition of a sentinel node. Ann Surg Oncol 2001; 8 (6): 538-541. [ Links ]
3. Johnson TM, Sondak VK, Bichakjia CK y col.: The role of sentinel lymph node biopsy for melanoma: evidence assessment. J Am Acad Dermatol 2006; 54(1): 19-27. [ Links ]
4. Doting MHE, Hoekstra HJ y col.: Is sentinel node biopsy beneficial in melanoma patients?.A report on 200 patients with cutaneous melanoma. Eur J Surg Oncol 2002;28:673-678. [ Links ]
5. Johnson TM, Bradford CR, Gruber SB y col.: Staging workup, sentinel node biopsy, and follow-up tests for melanoma. Arch Dermatol 2004; 140:107-113. Stata Statistical [ Links ]
6. Martí Carrera E, Díaz Gutiérrez AJ, Martín Díaz M, y col: El ganglio centinela en el melanoma: nuestra experiencia. Cir plást iberolatinoam 2006; 32: 117-126. [ Links ]
7. Gardeazabal García J, Regalado J, Fernández Samaniego F, Pijoán J.: Estudio comparativo de los pacientes con melanoma en el Hospital de Cruces entre las décadas 1977-1986 y 1987-96. Medicina Cutanea Ibero-Latino-Americana 2000; 28:236-240. [ Links ]
8. Kettlewell S; Moyes C y col.: Research: value of sentinel node status as a prognostic factor in melanoma: prospective observational study, BMJ, 2006, doi: 10.1136/bmj. 38849. 680509.AE [ Links ]
9. Stebbins W, Garibyan L, Sober AJ.: Sentinel lymph node biopsy and melanoma: 2010 update (Part 2). J Am Dermatol. 2010; 62 (5) 737-748. [ Links ]
10. Gershenwald JE, Thompson W, Mansfield PF y col.: Multi-institutional melanoma lymphatic mapping experience: prognostic value of sentinel lymph node status in 612 stage I or II melanoma patients. J Clin Oncol 1999;17:976. [ Links ]
11. Harlow SP, Krag DN, Ashikaga T y col.: Gamma probe guided biopsy of the sentinel node in malignant melanoma: A multicentre stdudy. Melanoma Res 2001;11:45-55. [ Links ]
12. Jacobs IA, Chevinsky AH, Swayne LC y col: Gamma probe directed lymphatic mapping and sentinel lymphadenectomy in primary melanoma: reliability of the procedure and analysis of failures after long-term follow-up. J Surg Oncol 2001; 77:157-164. [ Links ]
13. Tanis PJ, Nieweg OE, Hart AA y col. The illusion of the learning phase for lymphatic mapping. Ann Surg Oncol 2002;9:142-147. [ Links ]
14. Stebbins W, Garibyan L, Sober AJ.: Sentinel lymph node biopsy and melanoma: 2010 update (Part 1). J Am Dermatol. 2010; 62 (5): 723-734. [ Links ]
15. Moroi Y.: Significance of sentinel lymph node biopsy in malignant melanoma: overview of international data. Int J Clin Oncol 2009; 14: 485-489. [ Links ]
16. Gipponi M, Di Somma C, Peressini A, Solari y col.: Sentinel lymph node biopsy in patients with stage I/II melanoma: clinical experience and literature review. J Surg Oncol 2004; 85 (3): 133-140. [ Links ]
17. Boland GM.: Gershenwald. Sentinel lymph node biopsy in melanoma. Cancer J 2012; 18 (2): 185-191. [ Links ]
18. Morton DL, Cochran AJ, Thompson JF, y col.: Sentinel node biopsy for early-stage melanoma: accuracy and morbidity in MSLT-I, an international multicenter trial. Ann Surgry 2005; 242 (3):302-311. [ Links ]
19. Debarbieux S, Duru G, Dalle Sy col.: Sentinel lymph node biopsy in melanoma: a micromorphometric study relating to prognosis and completion lymph node dissection. Br J Dermatol 2007; 157: 58-67. [ Links ]
20. Morton DL, Thompson JF, Cochran AJ y col: Sentinel-node biopsy or nodal observation in melanoma. N Engl J Med 2006; 355: 1307-1317. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dra. Patricia Aguilar Barrón
Servicio de Cirugía Plástica y Grandes Quemados
Hospital Universitario Cruces
Plaza de Cruces SN. Barakaldo. Bizkaia. España
e-mail: p.aguilarbarron@hotmail.com