My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cirugía Plástica Ibero-Latinoamericana
On-line version ISSN 1989-2055Print version ISSN 0376-7892
Cir. plást. iberolatinoam. vol.39 n.1 Madrid Jan./Mar. 2013
https://dx.doi.org/10.4321/S0376-78922013000100010
Reconstrucción quirúrgica tras destrucción nasal por Leishmania Panamensis
Surgical reconstruction after nasal destruction by Leishmania Panamensis
Vélez Bernal, F.*, Vélez Trujillo J.A.** y Vélez Bernal, I.D.***
*Especialista en Cirugía Plástica, Estética, Maxilofacial y de la Mano. Clínica IQ Interquirófanos, Medellín, Colombia
**Cirujano, Universidad Pontificia Bolivariana. Investigador asociado Programa de Estudio y Control de Enfermedades Tropicales (PECET) de la Universidad de Antioquia, Medellín, Colombia
***Cirujano, especialista en Parasitología y Medicina Tropical. Profesor de la Facultad de Medicina y Director del Programa de Estudio y Control de Enfermedades Tropicales (PECET) de la Universidad de Antioquia. Medellín, Colombia
Dirección para correspondencia
RESUMEN
Algunas especies de Leishmania del subgénero Viannia, especialmente Leishmania braziliensis y Leishmania panamensis, pueden invadir la mucosa naso-orofaríngea al diseminarse por vía linfática y sanguínea a partir de una lesión cutánea y ocasionar lesiones en el tabique nasal, paladar blando, úvula, pilares amigdalinos, laringe, faringe, dorso nasal, labios y pómulos, que pueden conducir a la desfiguración. La mucosa más frecuentemente afectada es la del tabique nasal, principalmente en su parte anterior. La invasión de la mucosa puede ocurrir simultáneamente con lesiones cutáneas activas, aunque más frecuentemente aparecen 1 o 2 años después de la lesión en la piel; sin embargo, en el 16 % de los casos no hay antecedentes de lesiones cutáneas, lo que sugiere que con la picadura del insecto vector se produjo una infección primaria asintomática u oligosintomática y luego se produjo la diseminación del parasito a la mucosas.
En este artículo presentamos 2 casos clínicos de leishmaniosis mucosa producidos por L. panamensis y los procedimientos quirúrgicos reconstructivos que se realizaron. Se hace además un recuento de los diagnósticos diferenciales en tejidos oronasales.
Palabras clave: Leishmaniasis mucosa, Leishmania panamensis, Reconstrucción nasal.
Código numérico: 168-2444.
ABSTRACT
Species of Leishmania of Viannia subgenus, mainly L. braziliensis and L. panamensis, may invade the nasooro-pharyngeal mucosal after spread from the skin lesion via lymph and blood, causing lesions in the nasal septum, soft palate, uvula, tonsillar pillars, larynx, pharynx, nasal dorsum, lips and cheeks. The mucosal membrane most frequently affected is the nasal septum, mainly in the anterior region. The invasion of mucosa may occur simultaneously with active skin lesions, but most often appear 1 or 2 years after the skin lesion; nevertheless, in 16 % of cases there is no history of skin lesions suggesting that the primary infection coursed with few symptoms and then was spread to mucosal membranes.
In this article 2 cases of L panamensis mucosal leishmaniasis and the reconstructive surgery used are presented. A discussion of the differential diagnosis of oro-nasal tissues is also presented.
Key words: Mucosal leishmaniasis, Leishmania panamensis, Nasal reconstruction.
Numeral Code: 168-2444.
Introducción
La leishmaniasis es un conjunto de enfermedades infecciosas, endémicas en 97 países del mundo localizados en zonas tropicales y subtropicales, causadas por al menos 20 especies de parásitos del género Leishmania (L.) que son transmitidos a los mamíferos a través de la picadura de insectos hembras hematófagas pertenecientes a los géneros Lutzomyia en las Américas y Phlebotomus en el resto del mundo. El parásito tiene como reservorio a animales domésticos y silvestres y en ocasiones, al hombre; en éste, la infección por Leishmania puede afectar a la piel, a las mucosas y a tejidos y órganos hematopoyéticos como la medula ósea, el hígado y el bazo, produciendo un espectro de enfermedad con diferentes formas clínicas conocidas como leishmaniosis cutánea (LC), leishmaniosis mucosa (LM) y leishmaniosis visceral (LV). A su vez, la LC se puede presentar de forma localizada (LCL) o difusa (LCD) (1,2).
Después de que los parásitos en su forma promastigote son inoculados en la piel por la picadura del insecto vector, invaden las células dendríticas y las células de Langerhans (macrófagos de la piel), donde se transforman en amastigotes y se dividen por fisión binaria; para ello deben escapar de los mecanismos microbicidas del huésped. Al reproducirse destruyen macrófagos y se produce en la dermis una reacción inflamatoria de tipo granulomatoso crónica caracterizada por un cúmulo de linfocitos, plasmocitos y células gigantes multinucleadas. La acción del complemento y destrucción del granuloma lleva a la necrosis tisular (2). El periodo de incubación dura entre 2 semanas y 2 meses y después aparecen en el sitio de la picadura las primeras manifestaciones clínicas de la LC con la formación de un nódulo pequeño, redondeado, indurado en la base, que aumenta de tamaño y crece concéntricamente.
La necrosis en el granuloma se manifiesta con aparición de costra; la caída de la costra deja al descubierto una lesión tipo úlcera franca, de bordes levantados, bien definidos, igualmente con induración en la base. Precozmente se observa linfadenitis regional que señala la diseminación temprana de los parásitos a diferentes órganos del sistema mononuclear fagocítico. Cuando se trata de especies de Leishmania americanas del subgénero Viannia, especialmente L. braziliensis y L. panamensis, los parásitos pueden migrar hasta las mucosas naso-oro-faringeas donde ocasionan la LM (1,2).
El compromiso mucoso se puede producir de dos formas: por difusión hematógena o linfática del parásito a partir de la piel a la mucosa, o por contigüidad de una lesión cutánea localizada en el dorso de la nariz o en los labios. Tras la diseminación hematógena y linfática, el parásito se localiza más frecuentemente en el tabique nasal donde ocasiona inicialmente hiperemia que es seguida por la aparición de pequeñas lesiones nodulares, confluentes, que semejan granos de arroz; posteriormente se forma una ulcera circular, de bordes elevados (Fig. 1), que aumenta de tamaño y perfora el tabique nasal. La actividad parasitaria continúa en los bordes de la perforación, con destrucción de los tejidos que lleva, tras meses o años, a la destrucción del septum nasal, lo que produce la figura clásicamente descrita de "nariz de danta" o "nariz de tapir". Posteriormente, el daño de los tejidos compromete el dorso nasal, el paladar, los labios y los pilares amigdalianos, causando una gran morbilidad y deterioro de la calidad de vida de los pacientes. Cuando el origen primario es el paladar, se observan lesiones verrugosas o vegetantes que destruyen la úvula y el paladar blando y afectan a los tejidos vecinos e incluso a la laringe, ocasionando disfonía y una tos seca.
En la mayoría de los casos, la LM se produce por L. braziliensis, pero también puede estar provocada por otras especies como L. panamensis y L. guyanensis (1,2).
Se han propuesto numerosos tratamientos locales y sistémicos con el fin, no solo de eliminar los parásitos, sino también de reducir el tamaño de las cicatrices y las secuelas de la destrucción de las membranas mucosas. Sin embargo, aunque el tratamiento farmacológico permite la curación de la lesión, persiste la destrucción de la membrana de la piel y de las mucosas que causa la desfiguración, la estigmatización y el deterioro de la calidad de vida de los pacientes (1,2).
Teniendo en cuenta que la cara es un elemento esencial en la identidad del ser humano, que participa en la imagen que cada persona refleja en los demás y que la nariz, además de cumplir funciones fisiológicas importantes tales como la calefacción y purificación del aire que se respira o la captura de los olores, es una parte importante de los rasgos distintivos de la cara, la Cirugía Plástica Reconstructiva surge como la mejor posibilidad para mejorar la calidad de vida de los pacientes afectados por LM. Su prioridad es restablecer, en la medida de lo posible, la función y la forma de las estructuras dañadas y esto solo debe buscarse cuando el tratamiento farmacológico específico contra Leishmania ha sido exitoso y no hay evidencia clínica y de laboratorio de actividad de la enfermedad. Desafortunadamente, sólo muy pocos pacientes pueden tener acceso a la reconstrucción quirúrgica. En este trabajo presentamos 2 casos de reconstrucción quirúrgica tras amputación nasal severa como resultado de una LM crónica.
Casos clínicos
Caso 1. Paciente varón de 17 años de edad, estudiante, procedente del área rural del municipio de Barbacoas, departamento de Nariño, Colombia, que fue remitido por la Secretaría de Salud local al Programa de Estudio y Control de Enfermedades Tropicales (PECET) de la Universidad de Antioquia con diagnóstico de LM. En el interrogatorio clínico, el paciente relata que a la edad de 5 años presento múltiples lesiones en la piel que fueron diagnosticadas como LC y tratadas con antimoniato de meglumina (Glucantime®), 2 ampollas al día durante 20 días; sin embargo 2 años más tarde se inició compromiso mucoso que evolucinó de forma progresiva hasta la destrucción del tabique nasal.
En el examen físico se encontró un paciente en aceptables condiciones generales, con 42 kg.de peso, avergonzado por la desfiguración nasal que padecía, alerta, afebril y consciente; auscultación cardiopulmonar normal, abdomen blando y depresible, sin masas ni megalias. Se observaron cicatrices características de LCL en el codo izquierdo, miembro inferior derecho, espalda y abdomen, sin evidencia de actividad en el momento de la consulta.
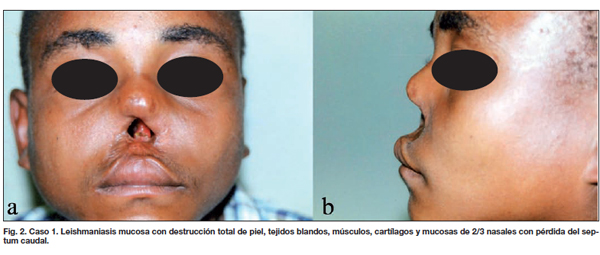
En la evaluación prequirúrgica se observaron los siguientes hallazgos clínicos: destrucción total de piel, tejidos blandos músculos, cartílagos y mucosas de 2/3 nasales con pérdida del septum caudal (Fig. 2). Se le practicó examen directo y cultivo por aspirado y serología que fueron positivos. La cepa de Leishmania fue identificada como L. panamensis mediante técnica de anticuerpos monoconales (3). Se le administró tratamiento bajo observación con antimoniato de meglumina a dosis de 20 mg/kg/día durante 28 días y luego, se siguió un esquema adicional con istianato de pentamidina (Pentacarinat®), a dosis de 4 mg/kg/día, ínterdiario, durante 4 días, hasta lograr la curación de la lesión, la cual fue puesta en evidencia por la desaparición de los signos de actividad de la lesión y el aplanamiento y cicatrización de los bordes de la zona destruida.
El paciente volvió a su lugar de residencia y regresó a Medellín 16 meses después. Se le repitieron las pruebas de laboratorio para diagnostico de LM encontrándo negativo el examen directo (frotis), aunque persistía la presencia de anticuerpos determinados por Dot-ELISA y Western blot. Para tener una mayor seguridad de la eficacia del tratamiento y evitar recaídas que pudieran arruinar el procedimiento reconstructivo, se decidió dar un refuerzo terapéutico con isotianato de pentamidina 4 mg/kg, ínterdiario, durante una semana (en total 4 dosis) y se realizaron todas las evaluaciones prequirúrgicas propias de la cirugía reconstructiva a practicar.
Se le explicaron al paciente los riesgos y las posibles complicaciones de la cirugía y previo consentimiento informado, se estableció un plan de procedimientos quirúrgicos para reconstruir la bóveda nasal, la columela y las alas y cubrir el dorso nasal cruento con restauración anatómica de piel y de tejidos blandos. La cirugía se realizó bajo anestesia general, llevándose a cabo los siguientes procedimientos:
1) Desprendimiento y eversión de parte del borde nasal superior externo que estaba cicatrizado.
2) Levantamiento de un par de colgajos nasogenianos que se evirtieron para dar cobertura, unidos al colgajo anterior, del techo de la fosa nasal; reconstrucción de columnela y parte de los rebordes de las narinas.
3) Levantamiento de un colgajo frontal basado en la técnica descrita por Millard en 1957, que se rotó para dar cobertura y reconstruir el dorso, la punta y las alas nasales (4).
4) Cierre primario de las heridas resultantes, tanto en frente como en surcos nasogenianos.
Pasadas 6 semanas se liberaron los colgajos de sus pedículos vasculares y se remodelaron los bordes (Fig. 3).
El paciente se sometió a evaluaciones anuales durante 4 años, en los cuales no se evidenció recaída para LM y solo persistieron títulos de anticuerpos específicos para Leishmania que en ningún momento fueron superiores a 1/32.
Caso 2. Paciente varón de 42 años de edad,procedente de la vereda Las Mercedes, municipio Bahía Solano, departamento del Chocó, Colombia, zona endémica de LC producida por L. panamensis y que fue remitido por la Empresa Prestadora de Servicios de Salud al PECET con impresión diagnostica de LM. En el interrogatorio clínico el paciente refiere que desde hace 6 meses presenta úlcera en dorso nasal con destrucción del tabique nasal. Relata también que a la edad de 20 años fue diagnosticado de LC en extremidades inferiores, la cual fue tratada empíricamente por los curanderos locales.
En el examen físico se encontró un paciente en aceptables condiciones generales, alerta, afebril y consciente, de 62 kg. de peso; auscultación cardiopulmonar normal, abdomen blando y depresible, no doloroso, sin masas ni megalias. Se observaron dos cicatrices compatibles con LC en rodilla izquierda y en tercio superior lateral de la pierna derecha, sin evidencia de actividad en el momento de la consulta.
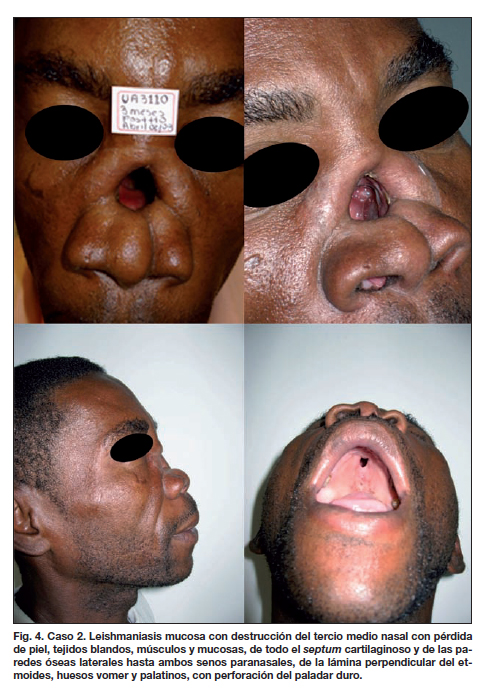
En la evaluación médica se observaron los siguientes hallazgos clínicos: destrucción de tercio medio nasal con pérdida de piel, tejidos blandos, músculos, y mucosas, de todo el septum cartilaginoso y de las paredes óseas laterales hasta ambos senos paranasales; de la lámina perpendicular del etmoides, de los huesos vomer y palatinos hasta perforar el paladar duro (perforación de 9 mm de diámetro) (Fig.4). Fue diagnosticado mediante examen directo y serología de LM y se le administró tratamiento específico con miltefosina (Impavido®) a dosis de 2.5 mg/kg/día durante 28 días, hasta lograr la desa-parición de los signos de actividad de la lesión.
El paciente regresó a revisión 3 meses después de terminar el tratamiento, momento en el que se encontró una lesión completamente cicatrizada. Se programó evaluación con el cirujano plástico y se dio un refuerzo en el tratamiento con miltefosina a dosis de 2.5 mg/kg/día durante 14 días, buscando con ello evitar recaídas que pudieran arruinar el procedimiento reconstructivo.
Se le explicaron al paciente los riesgos y las posibles complicaciones de la cirugía, y previo consentimiento informado, se estableció el plan de procedimientos quirúrgicos a practicar con el propósito de lograr la reconstrucción anatómica del paladar, del piso nasal y del techo nasal con cobertura anatómica del dorso.
La cirugía se practicó bajo anestesia general, llevándose a cabo los siguientes procedimientos:
1) Reconstrucción de paladar:
a) Levantamiento de dos colgajos de vecindad y cierre primario en dos planos (palatorrafia), logrando el cierre total de la abertura oronasal (Fig. 5).
2) Reconstruccion de dorso nasal:
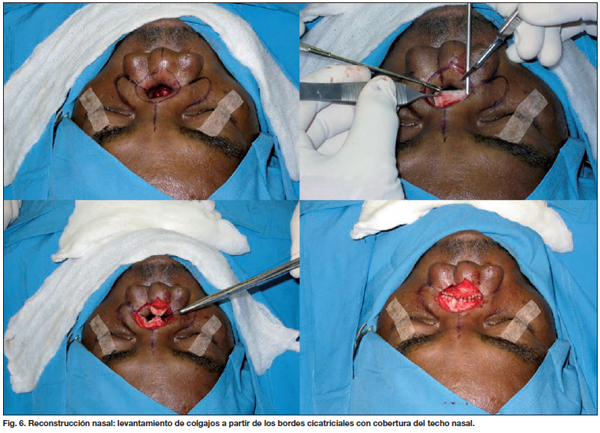
a) Levantamiento de colgajos a partir de los bordes cicatriciales del defecto que se evierten para dar cobertura al techo nasal (Fig. 6).
b) Levantamiento de dos colgajos nasogenianos que se rotan para dar cobertura a todo el dorso nasal (Fig. 7).
c) Retirada de los puntos externos 10 días después de la cirugía (Fig. 8).
El paciente fue evaluado periódicamente durante 12 meses hasta evidenciar plena cobertura y restitución de sus funciones bucales y nasales.
Discusión
Colombia es un país endémico para leishmaniasis y ocupa el segundo lugar en América, después de Brasil, en número de casos diagnosticados anualmente (cerca de 20.000 casos). El 99.3 % de los casos son de LC y solo el 0.3 % son de LM, siendo L. panamensis y L. braziliensis las especies responsables de la mayoría de los casos (5). La menor incidencia de LM en Colombia con relación a otros países como Perú y Bolivia, donde la incidencia de LM es del orden del 5 % del total de casos de leishmaniosis, puede deberse a la circulación de cepas menos virulentas pero también, al estado inmunitario de las personas. Llama la atención la baja incidencia de LC en Colombia cuando se sabe que en zonas endémicas alejadas de centros de atención solo 1 de cada 10 pacientes con LC reciben tratamiento completo especifico para leishmaniosis, por lo que no se puede atribuir a una mayor cobertura de tratamiento especifico (6). La baja incidencia también podría deberse al estigma que produce la LM, que hace que estos pacientes acuden menos a la consulta. Sin embargo y pese a la relativamente baja incidencia informada en Colombia, la LM ocasiona un drama personal y social de gran magnitud.
El compromiso mucoso de la leishmaniosis en sus inicios puede pasar desapercibido, ser indoloro o producir un leve dolor en el dorso nasal. El paciente puede, al limpiarse la nariz, observar costras con pintas de sangre. Hasta un 16 % de los pacientes no refieren antecedentes de LC. Por ello, la LM se debe sospechar siempre en pacientes que proceden o han vivido en áreas endémicas de leishmaniosis. El hallazgo del compromiso mucoso inicial e incluso de la perforación inicial del tabique, se puede hacer de forma temprana durante un examen médico rutinario o cuando el paciente consulta por otra enfermedad, sin ser necesariamente ese el motivo de consulta. El rápido diagnóstico y el tratamiento eficaz contra la LM, evitan el avance de la enfermedad y que se llegue a estados tan avanzados como los presentados en este trabajo, con grandes destrucciones de la nariz.
Aunque con el tratamiento específico de la LM, ya sea con antimoniales pentavalentes, anfotericina B (deoxicolato o liposomal), isotianato de pentamidina o miltefosina, se logra impedir o frenar el avance de la enfermedad y la cicatrización de la lesión, se hace necesario complementar el tratamiento farmacológico con cirugía reconstructiva que permite la resocialización de la persona al evolverle la calidad de vida perdida como consecuencia de la enfermedad. Desafortunadamente, son muy pocos los pacientes con LM que tienen acceso a una cirugía de este tipo, pues generalmente son humildes, y viven en áreas apartadas de los centros de atención médica. Más aun, los pacientes que llegan a estados avanzados de destrucción facial, habitualmente viven solitarios y apartados en áreas rurales donde sufren el drama personal de haber perdido toda esperanza de curación tras múltiples intentos, tanto con la medicina oficial como con la medicina tradicional, de buscar un tratamiento efectivo para un mal cuyas causas no conoce y que por lo visible, es objeto de múltiples interpretaciones, cargando un estigma doloroso, con el agravante de que sobreviven muchos años padeciendo esta enfermedad. Este drama no es solo del paciente sino también de la familia y de la comunidad donde viven (7-9).
La experiencia de la reconstrucción nasal se convierte en algo maravilloso para el paciente, la comunidad y el personal de la salud, pues le brinda literalmente al primero la posibilidad de volver a vivir. Es en estas situaciones es en las que se pude evidenciar en grado sumo la importancia de la Cirugía Plástica en su misión y compromiso de aliviar el dolor, fin último de la Medicina, y procurar el bienestar de todos los pacientes, independientemente de su situación social.
Es muy importante tener en cuenta también que en la LM es fundamental tener un diagnóstico preciso, tanto parasitológico como epidemiológico y serológico y descartar los diagnósticos diferenciales para poder instaurar un tratamiento específico. Entre aquellos que se deben tener en cuenta en este proceso diagnóstico destacamos los siguientes:
a) Granuloma letal de la línea media: enfermedad no neoplásica de etiología desconocida que comienza con inflamación, ulceración y perforación de la nariz y del paladar y que progresa hacia la destrucción gradual de las estructuras faciales de la línea media (10).
b) Lepra: infección causada por el Mycobacterium leprae que puede afectar la membrana de la mucosa nasal produciendo lesiones que pueden presentarse como máculas anestésicas, pálidas, nódulos infiltrados discretos eritematosos o una infiltración cutánea difusa (11).
c) Paracoccidioidomicosis: enfermedad micótica producida por Paracoccidioides brasiliensis, que puede afectar a la cavidad bucal, principalmente a las encías y a la mucosa de los rebordes alveolares. Produce granulomas apicales y periodontitis de avance rápido con movilidad progresiva de los dientes, lesiones granulomatosas con puntillado eritematoso que da un aspecto aframbuesado, dolorosas, en labios, encía, suelo de la boca, mucosa bucal y paladar, pudiendo presentarse movilidad dentaria y ocasionalmente macroquelia (12).
d) Rinoescleroma: enfermedad granulomatosa que afecta a la nariz y a la nasofaringe, habitualmente debida a Klebsiella rhinoscleromatis. La enfermedad progresa en 3 estadios: exudativo o rinítico, proliferativo (infiltrativo y nodular) y fibrótico. Cursa muy lentamente y las lesiones son asintomáticas en su inicio, hasta que aparecen la destrucción de tejidos o complicaciones. Al examen físico, el paciente presenta rinorrea fétida y congestión nasal. En la mayoría de los casos se encuentra afectado el septum; además puede haber velamiento maxilar y etmoidal (13).
e) Granulomatosis de Wegener: vasculitis granulomatosa del tracto respiratorio superior e inferior asociada a glomerulonefritis. El cuadro clínico empieza como una afección de vías respiratorias superiores acompañado de afección del estado general, congestión nasal, sinusitis, epistaxis, otitis media y otras lesiones mucofaríngeas. El daño nasal se manifiesta con costras, ulceras y destrucción del cartílago septal, produciendo una deformidad nasal denominada en silla de montar (14).
f) Perforación de tabique causada por el abuso de cocaína; ésta afecta a la microcirculación de la superficie de la mucosa nasal, llevando a la destrucción de la mucosa y del cartílago nasales con inflamación crónica que causa obstrucción creciente de la nariz que dificulta la respiración y el olfato (15).
Conclusiones
La LM en una entidad clínica relativamente frecuente, subdiagnosticada, endémica en Colombia, que requiere para su control médico la instauración de tratamiento específico contra el parásito y también la reconstrucción quirúrgica de las secuelas. Antes de cualquier acto de Cirugía Plástica Reconstructiva se debe confirmar la curación de la leishmaniosis, para así evitar recaídas que lleven a la pérdida del trabajo quirúrgico. Es fundamental tener un diagnóstico preciso, tanto parasitológico como epidemiológico y serológico y descartar los diagnósticos diferenciales para instaurar el tratamiento específico.
El tratamiento integral de la LM requiere del trabajo conjunto, multidisciplinario, de médicos parasitólogos, cirujanos plásticos y otros profesionales de la salud.
Agradecimientos
Los autores agradecen a la Dra. Sara María Robledo por la revisión y corrección del manuscrito y al señor Juan Fernando Cuartas por la elaboración de las figuras.
Bibliografía
1. World Health Organisation: WHO Technical Report series No. 949. Control of the leishmaniasis: report of a meeting of the WHO Expert Committee on the Control of Leishmaniases, Geneva, 22-26 March 2010.Pp: 186. [ Links ]
2. David C.V, Craft N.: Cutaneous and mucocutaneous leishmaniasis. Dermatol. Ther. 2009; 22 (6): 491-502. [ Links ]
3. McMahon-Pratt D., Bennett E. y David J.R.: Monoclonal antibodies that distinguish subspecies of Leishmania braziliensis. J Immunol 1982;129 (3): 926-927. [ Links ]
4. De Abullarade, J.: Reconstrucción de canto interno y pared lateral nasal con colgajo zigomático de mejilla. Cir. plást. iberolatinoam., 2009, 35 (2):123-128. [ Links ]
5. Saravia NG, Weigle K, Navas C, y col.: Heterogeneity, geographic distribution, and pathogenicity of serodemes of Leishmania viannia in Colombia. Am. J. Trop. Med. Hyg. 2002; 66 (6): 738-744. [ Links ]
6. Vélez ID, Hendrickx E, Robledo SM, del Pilar Agudelo S.: Gender and cutaneous leishmaniasis in Colombia. Cad Saude Publica. 2001; 17 (1): 171-180. [ Links ]
7. Cido Carvalho, F.A.M. y col.: Reconstrucción de nariz y labios en secuela de quemadura eléctrica. Cir. plást. iberolatinoam. 2009, 35 (3):.237-242. [ Links ]
8. De Abullarade, J.: Versatilidad del colgajo zigomático de mejilla en la reconstrucción nasal. Cir. plást. iberolatinoam., 2012; 38 (3):.273-276. [ Links ]
9. Pitanguy I, Ribiero A.: Leishmaniasis. Surgical treatment of its sequelae. Plast. Reconstr. Surg. 1965; 36 (5): 565-572. [ Links ]
10. Mendenhall WM, Olivier KR, Lynch JW Jr, Mendenhall NP.: Lethal midline granuloma-nasal natural killer/T-cell lymphoma. Am J Clin Oncol 2006; 29 (2): 202-206. [ Links ]
11. Shah AR, Zeitler D, Wise JB.: Nasal reconstruction of the leprosy nose using costal cartilage. Otolaryngol Clin North Am 2009; 42 (3): 547-555. [ Links ]
12. Sposto MR, Scully C, de Almeida OP, Jorge J, Graner E, Bozzo L.: Oral paracoccidioidomycosis. A study of 36 South Aerican patients. Oral Surg Oral Med Oral Pathol 1993; 75 (4): 461-465. [ Links ]
13. Moraes MA, Magalhães AV, Marinho LC, Azevedo AE, Carneiro FP, Raymundo IT.: Rhinoscleroma causing severe bilateral nasal obstruction. Braz J Infect Dis 2010; 14 (2): 190-192. [ Links ]
14. Plaza G, Espinosa A, Ferrando J, Pinedo F.: Wegener granulomatosis and cocaine-induced midline destructive lesion: differential diagnosis. Med Clin (Barc) 2009; 133 (6): 237-238. [ Links ]
15. Angit C, Dabrowski MT, Owen CM.: Cocaine-induced midline destructive lesion. Clin Exp Dermatol 2009; 34: 469-470. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Federico Vélez B.
Calle 7 No. 39-197 of 16-10 Medellín, Colombia
e-mail: fedevelez@hotmail.com