My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cirugía Plástica Ibero-Latinoamericana
On-line version ISSN 1989-2055Print version ISSN 0376-7892
Cir. plást. iberolatinoam. vol.41 n.3 Madrid Jul./Sep. 2015
https://dx.doi.org/10.4321/S0376-78922015000300008
Tratamiento de fracturas abiertas de tibia grado IIIB-IIIC de Gustilo con colgajos libres microvascularizados
Gustilo IIIB-IIIC open tibial fractures requiring microvascular free flaps
Camporro-Fernández, D.*; Ontaneda-Rubio, A.** y Castellanos-Morán M. **
* Especialista en Cirugía Plástica, Reparadora y Estética, Jefe del Servicio.
** Médico Residente.
Servicio de Cirugía Plástica y Unidad de Quemados, Hospital Universitario Central de Asturias (HUCA), Oviedo, España.
Dirección para correspondencia
RESUMEN
Los objetivos de este artículo son aportar nuestra experiencia en el tratamiento de las fracturas tibiales tipo IIIBIIIC mediante colgajos libres y presentar nuestro protocolo de actuación ante este tipo de lesiones.
El estudio incluye una serie de 49 pacientes en los que se realizaron un total de 51 colgajos libres. El desbridamiento y la estabilización ósea se practicaron el día 1 de la lesión. El número de desbridamientos hasta cobertura fue de 1 a 3 (media 2,1). El tiempo medio desde la lesión a la cobertura definitiva fue de 9,3 días. Hubo supervivencia en 46 colgajos (90,2%), y los 5 fallidos se resolvieron mediante 2 colgajos de piernas cruzadas, un segundo colgajo libre y 2 amputaciones infracondíleas.
Obtuvimos consolidación primaria en 23 casos (47% de los pacientes). En el resto realizamos procedimientos ortopédicos secundarios con un 4% de osteomielitis crónicas y un 4% de pseudoatrosis infectadas, una de las cuales requirió amputación secundaria. En total hubo 3 amputaciones, con un 94% de piernas salvadas.
El tratamiento de estos pacientes se debe llevar a cabo en un centro hospitalario donde haya estrecha colaboración entre traumatólogos y cirujanos plásticos. A pesar del avance en todas las especialidades implicadas, creemos que la adecuada cobertura con colgajos microvascularizados es clave para obtener la consolidación, sin infección, de estas fracturas.
Palabras clave: Fractura abierta tibia, Reconstrucción miembro inferior, Colgajos libres.
Nivel de evidencia científica: 4.
ABSTRACT
The purpose of this article is to report our clinical experience of lower extremity microsurgical reconstruction in severe Gustilo IIIB or IIIC open tibial fractures, and to describe our treatment protocol for these patients.
Fifty-one free flaps were used in 49 consecutive patients. Debridement and stabilization of the fracture were invariably performed in the first day of the injury. The number of debridements prior to definitive treatment was between 1-3 (mean 2,1). Severe soft-tissue defects requiring flap coverage were treated 6-19 days (mean 9,3 days). Survival was achieved in 46 flaps (90,2%); the 5 free flaps failed were solved 2 with limb amputation, one with a secondary free flap, and 2 with cross-leg flaps.
Twenty-three (47%) fractures progressed to primary bony union while 26 (53%) required a bone-stimulating procedure to achieve this outcome. Overall, there was a rate of deep infection at the site of fracture of 4%, and of serious infected bony nonunion of 4%. One extremity underwent secondary amputation. The salvage rate of functional limb was 94%.
Severe open tibial fractures should be referred directly to specialist centres for simultaneous combined management by orthopaedic and plastic surgeons. Although the various specialties involved in the management of severe limb injuries have significantly improved over the past few decades, successful free-flap reconstruction is key to ensuring an infection-free fracture union.
Key words: Open tibial fractures, Lower limb reconstruction, Free flaps.
Level of evidence: 4.
Introducción
La clasificación de Gustilo (1) para evaluar la gravedad de las fracturas abiertas describe 3 grupos de progresiva gravedad. Se fundamenta en la longitud de la herida abierta, grado de contaminación y extensión de la lesión de partes blandas en torno al hueso. A su vez, para definir mejor el pronóstico, el grupo III se reclasifica en 3 subgrupos según la extensión de la exposición ósea, con/sin avulsión de periostio, necesidad de cirugía de cobertura de partes blandas y necesidad de reparación vascular (1).
Las fracturas abiertas de tibia (peroné) tipo IIIB-IIIC de Gustilo están causadas por traumatismos de alta energía (precipitaciones, accidentes de tráfico, armas de fuego...), y producen pérdida crítica de partes blandas y periostio (cobertura de tibia especialmente vulnerable), pérdida de hueso y extensa devascularización de la zona afectada (2). Ello dificulta, en muchos casos, la posibilidad de usar los tejidos locorregionales, por lo que es necesario recurrir al uso de colgajos microvascularizados y a sistemas de fijación para conseguir una cobertura estable del hueso expuesto y de las estructuras neurovasculares.
Cabe destacar, en la patogenia de estos traumatismos, que se produce una lesión de la vascularización endostal y perióstica en el hueso fracturado. La curación, y sobre todo la reosificación, dependerán del aporte sanguíneo desde los tejidos blandos adyacentes, que a consecuencia de la lesión, está ausente (3). Estos hallazgos indican la importancia de conseguir una reposición adecuada y los más precoz posible de la cobertura externa para: obtener una herida estable, promover la consolidación ósea y prevenir la infección.
El desbridamiento precoz y preciso de todos los tejidos lesionados y devascularizados junto con la correcta estabilización y fijación ósea, constituyen los otros dos pilares en la gestión de este tipo de traumatismos (4).
Por todo ello, estas lesiones conllevan siempre un tratamiento complejo, con gran consumo de recursos, y son susceptibles de generar morbilidad asociada con diferentes grados de discapacidad en un alto porcentaje de los pacientes tratados. En nuestra opinión, es fundamental protocolizar al máximo el tratamiento de estos pacientes y que éste se realice en centros hospitalarios en los que sea posible la colaboración entre cirujanos ortopédicos y cirujanos plásticos desde el primer gesto quirúrgico (5).
Presentamos este trabajo con 2 objetivos prioritarios en mente. El primero es aportar nuestra experiencia en el tratamiento de las fracturas de tibia Gustilo IIIB-IIIC mediante el uso de colgajos libres microvascularizados. El segundo, es sentar las bases de nuestro protocolo de actuación en estos pacientes desde el tratamiento inicial, pasando por su seguimiento y por las cirugías secundarias, si son precisas.
Material y método
Durante el período comprendido entre enero de 1997 y septiembre de 2013, se realizaron en el Servicio de Cirugía Plástica del Hospital Universitario Central de Asturias (Oviedo, España) un total de 180 colgajos microvascularizados para cobertura de defectos en miembros inferiores. De ellos, 51 se destinaron al tratamiento de 49 pacientes diagnosticados de fractura abierta de tibia (peroné) por traumatismo de alta energía: en 1 paciente se sustituyó un colgajo necrosado por otro de forma inmediata y en otro se utilizaron 2 colgajos.
Establecimos los siguientes criterios de inclusión de pacientes en el presente estudio: fracturas de tibia (con o sin peroné) tipo Gustilo IIIB-IIIC diagnosticadas por evaluación en sala de urgencias o tras primer desbridamiento en quirófano, donde se decidió la reconstrucción primaria o la amputación, y que precisaron cobertura primaria con colgajos libres. Consideramos como criterios de exclusión: fracturas IIIB-IIIC en las que se usaron colgajos, locorregionales, fracturas cerradas quirúrgicas, osteomielitis crónicas o seudoartrosis infectadas con pérdida de cobertura cutánea secundaria a complicaciones de la herida.
Realizamos el estudio de forma retrospectiva. Obtuvimos los datos de las historias clínicas y a través de entrevistas directas con los pacientes durante el seguimiento ambulatorio. Analizamos la localización anatómica de las fracturas, el número de desbridamientos practicados, el tipo de fijación ósea empleada, el momento de la cobertura y el tipo de colgajo, así como las complicaciones precoces y tardías, el tiempo de seguimiento hasta la consolidación y los procedimientos quirúrgicos secundarios.
La evaluación inicial de los pacientes, tras su ingreso en el Servicio de Urgencias se realizó siguiendo los principios ATLS (Advanced Trauma Life Support) (6). Una vez estabilizados, se les trasladó a quirófano donde se realizó un primer desbridamiento, generalmente a cargo del Servicio de Traumatología, y una realineación del miembro con reducción y estabilización de la fractura. Los pacientes subsidiarios de revascularización urgente de la pierna pasaron a tratamiento por el Servicio de Cirugía Vascular en el caso de persistir la situación de isquemia tras la reducción de la fractura. Al final del procedimiento se tomaron cultivos y se instauró tratamiento antibiótico de amplio espectro. Posteriormente, fueron trasladados a consulta con Cirugía Plástica para seguimiento en las siguientes 24-48 horas. Aquellos pacientes que recibieron tratamiento inicial en otros centros hospitalarios, fueron trasladados al Servicio de Cirugía Plástica con mayor demora.
Ya en nuestro Servicio, y en los casos en los que lo consideramos preciso, llevamos a cabo un segundo desbridamiento quirúrgico para obtener la clasificación definitiva del tipo de lesión y eliminar todo tejido residual necrosado. Al final del mismo, colocamos un sistema de terapia de presión negativa como cobertura temporal (Renasys EZ Plus® de Smith & Nephew). Instauramos esta terapia de vacío en modo continuo en todos los pacientes, con presiones de entre -75 y -100 mmHg y con cambios cada 48-72 horas hasta el momento de la cobertura definitiva.
Solicitamos en todos los pacientes estudios de imagen preoperatorios para valorar el estado de los vasos receptores antes de realizar el colgajo microvascularizado. Utilizamos la angiotomografía computarizada (Toshiba Medical Systems, Aquilion 64 Slice CFX) en la mayoría de los casos. En pacientes con bypass previo, o si los vasos receptores están ubicados distales al tobillo, preferimos la arteriografía por catéter convencional (Philips Integris 9890-63272). Según las características del paciente, del defecto (ubicación, dimensiones, complejidad tridimensional), estado de los vasos receptores y la posible necesidad de procedimientos secundarios, utilizamos para la reconstrucción colgajos musculares (Fig. 1), fasciocutáneos o compuestos, incluyendo hueso vascularizado (Fig. 2).
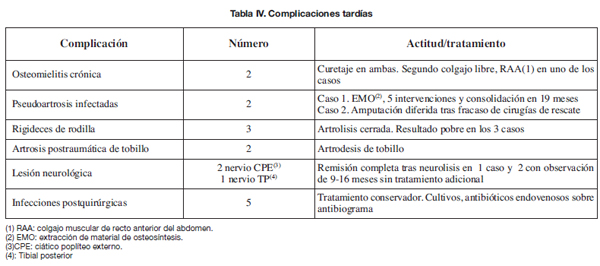
Definimos como complicaciones precoces las relacionadas con la evolución de la herida y la supervivencia del colgajo, y como complicaciones tardías las que surgen durante el seguimiento ulterior o las relacionadas con los procedimientos ortopédicos secundarios.
Los pacientes fueron controlados hasta la consolidación de la fractura, considerada bajo los criterios de carga completa sin dolor o signos de callo óseo en la radiografía en dos proyecciones a 90o.
RESULTADOS
Todos los pacientes sobrevivieron sin complicaciones sistémicas significativas. La distribución según sexo fue de 43 varones (86%) y 6 mujeres (14%). La edad media osciló entre los 5 y los 66 años, con una media de 33,8 años. La etiología, localización anatómica de las fracturas, clasificación diagnóstica, método de fijación ósea y tipo de colgajo libre utilizado se describen en la Tabla I. Los accidentes de tráfico (coche y moto) fueron la causa más frecuente y la fijación externa el método de estabilización ósea más usado. Las lesiones en tercio distal de pierna y tobillo suman más del 81% de los casos.
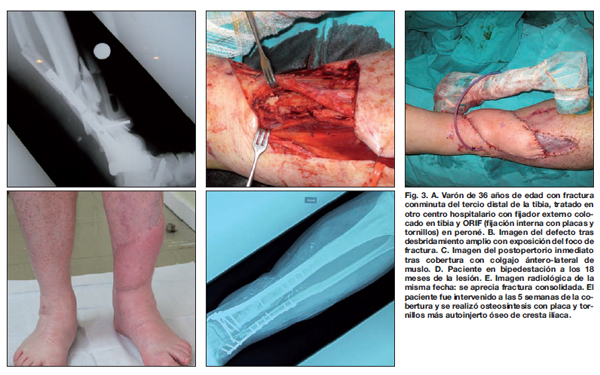
Por ejes vasculares donantes, el femoral circunflejo externo se utilizó en 25 (49%) de los 51 colgajos disecados. El colgajo más usado fue el fasciocutáneo ánterolateral de muslo en su forma simple o quimera (20 casos) (Fig. 3), seguido del colgajo muscular de dorsal ancho (14 casos) (Tabla I). En 4 pacientes con pérdida ósea segmentaria mayor de 6 cm se realizó reconstrucción ósea primaria mediante colgajo ósteo-muscular de dorsal ancho y escápula vascularizada. El equipo de Cirugía Plástica encastró el hueso entre los segmentos tibiales, sin precisar material de osteosíntesis añadido.
La arteria tibial anterior junto con sus venas comitantes fueron los vasos receptores más usados, seguidos de los tibiales posteriores. En 31 casos se suturaron 2 venas por colgajo. Se emplearon 2 injertos venosos para reconstrucción arterial: tibial anterior y poplítea (Tabla I).
El número de desbridamientos, incluyendo el realizado el mismo día de la cobertura del defecto, fue de 1 a 3 (media 2.1). La cobertura definitiva se realizó entre los 6 y los 19 días tras la lesión, con una media de 9,3 días. El tamaño definitivo de los defectos osciló entre los 65 y los 310 cm2, con una media 110 cm2. Todos los detalles de estos parámetros están reflejados en la Tabla I.
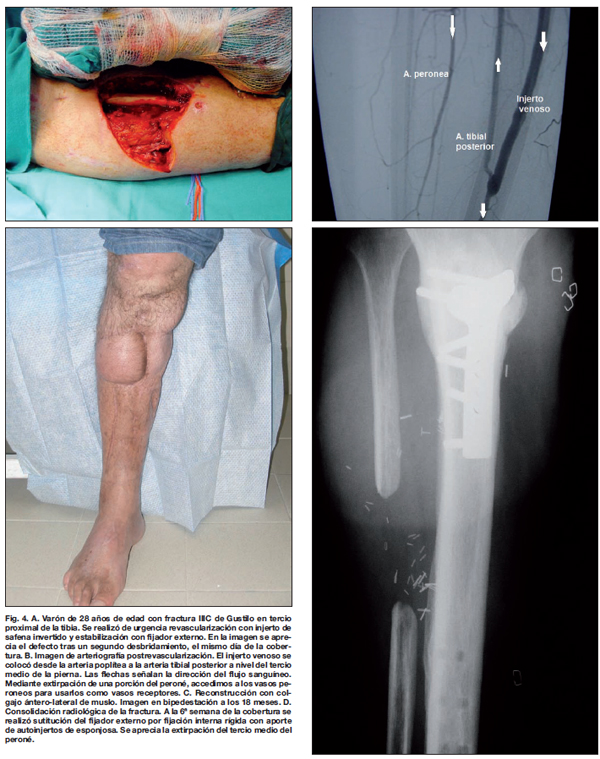
Hubo 5 casos de fracturas Gustilo IIIC (Fig. 4), y todas fueron revascularizadas antes de las 6 horas. Todas las fracturas tipo IIIC fueron estabilizadas con fijador externo tipo Hoffman antes de la reconstrucción arterial con injerto de vena safena invertido, y en todas se llevaron a cabo fasciotomías compartimentales profilácticas postrevascularización. En 3 de ellas se realizó arteriografía intraoperatoria. No hubo complicaciones postoperatorias por la isquemia previa o por la revascularización subsiguiente.
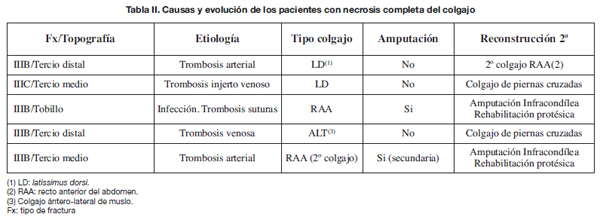
Hubo 8 colgajos que precisaron revisión en quirófano por problemas vasculares, 7 de forma urgente. De ellos, 5 se necrosaron de forma completa: hubo 2 trombosis arteriales, 1 trombosis de un injerto venoso, 1 trombosis venosa y 1 trombosis del pedículo por infección (Tabla II).
La supervivencia global fue del 90,2% (46 colgajos). En 3 de los 5 pacientes fue necesario el rescate de la extremidad mediante un colgajo libre de recto anterior del abdomen y en 2 mediante colgajos pediculados de piernas cruzadas (Tabla II). Otro paciente, con una reconstrucción satisfactoria mediante colgajo de músculo vasto lateral, sufrió una nueva exposición del foco de fractura tras un procedimiento ortopédico; en este caso se utilizó un colgajo de recto anterior del abdomen para cubrir el defecto, que a su vez presentó necrosis por trombosis arterial. En total hubo 2 amputaciones por fracaso del colgajo libre. En estos pacientes la infección profunda subyacente contraindicaba continuar con la reconstrucción.
Otras complicaciones precoces fueron: 2 necrosis parciales, que se resolvieron con cicatrización dirigida; 4 infecciones superficiales (8.5%), de las que 2 requirieron limpieza quirúrgica. Ambas correspondían a 2 de los 6 casos tratados con clavo endomedular primario.
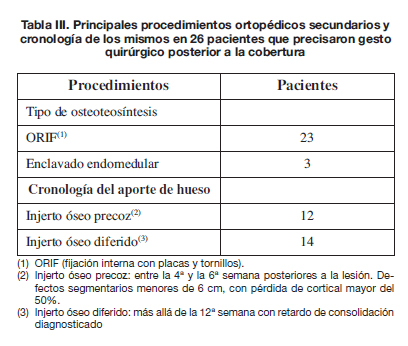
El tiempo hasta la consolidación ósea osciló entre los 4 y los 19 meses, con una media de 9,7 meses. Obtuvimos la consolidación primaria de la fractura, sin ningún procedimiento adicional tras la cobertura, en 23 pacientes (47%). Los 26 restantes (53%) precisaron de algún gesto quirúrgico postcobertura. En total llevamos a cabo 38 procedimientos en estos 26 pacientes (Tabla III). Todos precisaron aporte de autoinjertos óseos. En 12 pacientes los realizamos, entre la 4a y la 6a semana postcobertura definitiva y en 14 más allá de la 12a semana. Habitualmente fue necesaria la colaboración del Servicio de Cirugía Plástica para el levantamiento y ulterior reposición de los colgajos.
Reflejamos las complicaciones tardías en la Tabla IV. La más frecuente fue la infección postoperatoria que apareció en 5 (19,2%) de los 26 pacientes que requirieron procedimientos ortopédicos secundarios.
Discusión
La clasificación de Gustilo estandariza por categorías las fracturas abiertas de miembro inferior y ayuda en la planificación del tratamiento. Las fractura abiertas tipo IIIB-IIIC de tibia, con o sin peroné, suponen el grado más severo de la clasificación de Gustilo (1). Las fracturas grado IIIB se caracterizan por una interrupción de la vascularización tibial y un daño severo de las partes blandas circundantes, con una alta tasa de complicaciones. El éxito del tratamiento de estas lesiones debe combinar una adecuada estabilización ósea junto a una reconstrucción adecuada de las lesiones de partes blandas. Ya que las fracturas grado IIIB de Gustilo implican un significativo traumatismo locorregional, estos tejidos pueden no estar disponibles para su movilización. Por ello, muchas veces, debemos recurrir al uso de colgajos libres y al uso de material de osteosíntesis para dar cobertura al foco de fractura y a otras estructuras como nervios, tendones y vasos.
Las fracturas grado IIIC se producen, al igual que las anteriores en el ámbito de traumatismos de alta energía. Este tipo de lesiones implica siempre la necesidad de reparación arterial urgente para revascularizar el miembro isquémico. En los 5 casos de nuestro estudio en los que se consultó al Servicio de Cirugía Plástica para cobertura, las extremidades sobrevivieron a la revascularización. El diagnóstico se hizo preoperatoriamente y ningún paciente sobrepasó el tiempo crítico de isquemia (músculo y nervio son los tejidos más susceptibles) de 6 horas (7). En 3 casos, 1 por lesión a doble nivel y otros 2 por localización del trombo en lesión vascular cerrada, fue necesario realizar arteriografía intraoperatoria. La reparación vascular se hizo en el 100% de los casos con injerto de safena interna invertido, que en nuestra experiencia proporciona una excelente permeabilidad postoperatoria (7).
En nuestro hospital, estamos en coordinación con el Servicio de Traumatología para tratar este tipo de lesiones. Esto proporciona al paciente una menor tasa de complicaciones y reintervenciones (5). Consideramos que una fijación esquelética estable, seguida de desbridamientos agresivos de todos los tejidos desvitalizados y de una cobertura vascularizada de partes blandas, hecho todo de manera coordinada, es el mejor tratamiento para estos traumatismos. Pero los resultados indican que la cobertura tisular de partes blandas es la clave del éxito (8).
La planificación de la reconstrucción precisa, como paso previo, un correcto diagnóstico de la extensión de la lesión. En nuestro medio se hace en quirófano y el cirujano ortopédico puede pedir la colaboración del cirujano plástico para el primer contacto con el paciente. El dilema hoy en día, no está tanto en cómo salvar una extremidad, sino el saber si éste es el mejor tratamiento para el paciente. No utilizamos ningún tipo de tabla de puntuación para valorar una amputación primaria. Además, un estudio de Bosse y col. (9) demostró que estas tablas tienen una utilidad limitada en la decisión de salvar o no la extremidad afectada. La decisión final debe ser individualizada para cada caso según el estado de la extremidad, el estado general del paciente y sus deseos, su edad, profesión, etc.
Es fundamental una estabilización ósea precoz encaminada a restaurar la alineación de la extremidad, limitar la extensión de las lesiones en partes blandas y a mejorar el flujo sanguíneo (4). El 88% de los pacientes de nuestra serie fue estabilizado con un fijador externo, indicado sobre todo en fracturas a múltiples niveles, fracturas articulares, pérdidas de hueso segmentarias, e inestabilidad del tobillo (4). Por su versatilidad, en las fracturas tipo IIIC se usó un fijador tipo Hoffman antes de la revascularización. En nuestra serie, cuando la pérdida ósea era mínima, se realizaron de forma precoz fijaciones con clavo endomedular en 6 casos. En estos pacientes observamos 2 infecciones postoperatorias (33,3%) que requirieron limpieza quirúrgica. Estos porcentajes son los que aparecen también en series similares a la nuestra (10).
Realizamos el desbridamiento inicial bajo isquemia si el estado del miembro lo permite, y preferentemente lo lleva a cabo un cirujano experimentado. Evaluamos las estructuras de superficie a profundidad, eliminando todo el tejido aparentemente no viable incluido el músculo y el tejido de deguantamiento cutáneo. Respetamos los ejes neurovasculares y los fragmentos óseos unidos a periostio. A continuación retiramos la isquemia y reevaluamos la herida en busca de tejido no viable residual. Es importante repasar las masas musculares: color, sangrado y contractilidad. Al final del procedimiento colocamos un dispositivo de terapia de presión negativa que nos ayuda a conseguir la contracción de la herida al tiempo que proporciona un ambiente cerrado y húmedo para la herida, elimina el exceso de fluidos y exudados, ayuda a disminuir el edema y favorece la angiogénesis y la granulación (11). Estos dispositivos los usamos como preparación del lecho de la herida y no sustituyen, en nuestra experiencia, a la cobertura definitiva del defecto con tejido autólogo vascularizado. La media de desbridamientos en nuestra serie es de 2,1 incluyendo el que realizamos inmediatamente antes de la reconstrucción de partes blandas. Pensamos que los desbridamientos seriados deben evitarse, en la medida de lo posible, en esta tipo de lesiones, ya que contribuyen a la desecación e infección de los tejidos expuestos.
El tipo de cobertura más apropiada para cada paciente dependerá de la localización del defecto sobre la tibia y de sus dimensiones, incluyendo profundidad y estructuras implicadas. El estado de los ejes vasculares es determinante tanto para su uso como vasos receptores de colgajos libres como para la viabilidad de los colgajos regionales. Hallazgos recientes han demostrado que las fracturas tipo IIIC y IIIB con amplia zona de lesión implican un alto riesgo vascular para estos pacientes, y que en ellos es recomendable hacer pruebas de imagen antes de llevar a cabo la cobertura con un colgajo libre (12). Estas pruebas nos ayudan más que el simple hecho de la presencia de pulsos periféricos a prevenir complicaciones isquémicas, a valorar la viabilidad de un colgajo microvascularizado, y a detectar anomalías anatómicas congénitas o adquiridas. La angioTC es la prueba de elección, salvo en los casos con vasos receptores distales a tobillo, en los que la resolución es menor con la angioTC o si ha habido un bypass previo. La angioTC es una prueba menos invasiva que la angiografía convencional, nos proporciona un mapa vascular tridimensional (3D) con fase venosa si queremos, evalúa aspectos externos de la pared del vaso como pueden ser la presencia de un trombo mural o de un ateroma, y define bien las referencias anatómicas y el estado del hueso y de los tejidos perivasculares (inflamación) (13).
El uso de colgajos locorregionales estuvo limitado en nuestra serie por la intensidad de los traumatismos, el tamaño de los defectos y las lesiones de partes blandas adyacentes. Aunque tenemos experiencia en la reconstrucción de estos defectos con colgajos musculares (gemelos y sóleo) y fasciocutáneos (perforantes de tibial posterior), no estaban indicados en los casos recogidos. Los defectos fueron superiores a los 60 cm2 de media en el tercio distal, el tobillo y el pie (Tabla I), lo que superaba la superficie útil de los músculos descritos, incluso del colgajo de sóleo a pedículo distal (14). Con respecto a los colgajos regionales fasciocutáneos, Schaverien y col. (15) han demostrado la utilidad, en la cobertura de las fracturas IIIB-IIIC de los colgajos de perforantes de tibial posterior. No describen sin embargo el tamaño medio de los defectos reconstruidos en su serie y por otra parte, los contraindican en caso de lesiones adyacentes o de lesión del eje vascular.
Los resultados indican que las fracturas de tibia se pueden cubrir con colgajos libres musculares o fasciocutáneos, con resultados similares. Los músculos son de elección en defectos extensos (anchura superior a 10 cm), profundos, de configuración irregular, gran cantidad de espacio muerto, o en casos de exposición de hueso desvitalizado (16).
En los defectos óseos segmentarios superiores a 6-8 cm preferimos hacer una reconstrucción ósea primaria. El uso de colgajos óseos vascularizados es recomendable para defectos óseos superiores a 6 cm. La reconstrucción primaria con injertos óseos vascularizados soslaya los problemas de fibrosis y escasez de vasos receptores de la cirugía secundaria (17). Nuestra elección aquí es el colgajo quimera de músculo dorsal ancho y borde lateral de la escápula vascularizado a través de la arteria angular. Sus ventajas, a nuestro juicio, son el disponer de un pedículo largo que evita el uso de injertos vasculares, el proporcionar un gran aporte de partes blandas con independencia espacial de las porciones ósea y muscular, y un adecuado componente óseo que permite puentear defectos tibiales de hasta 11 cm, según los datos recogidos en nuestra serie de pacientes (18).
En los defectos pretibiales distales, de tobillo y con extensión a dorso de pie, sin gran profundidad o excesivo espacio muerto, preferimos los colgajos fasciocutáneos, en general del eje femoral circunflejo. Nos permiten trabajar a dos campos y obtenemos pedículos de 8-16 cm de longitud, lo que nos facilita hacer suturas vasculares lejos de la zona de lesión. En 4 casos hemos disecado colgajos quimera con una pastilla independiente de vasto lateral para relleno de espacio muerto o aposición ósea directa, y hemos obtenido paletas cutáneas de hasta 30 x 11 cm, lo que nos ha permitido cubrir defectos extensos (19). Otras ventajas adicionales de los colgajos fasciocutáneos son que, en caso de procedimientos ortopédicos secundarios, toleran mejor el levantamiento que los musculares y se remodelan más fácilmente.
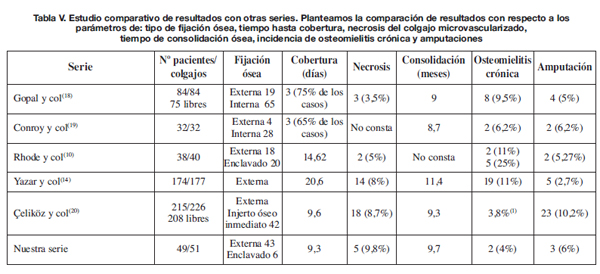
Si establecemos una comparación entre nuestra serie de pacientes con otras series publicadas (10, 16, 20-22) (Tabla V), observamos que el tiempo transcurrido desde la lesión hasta la cobertura definitiva no influye significativamente en la supervivencia de los colgajos. De hecho en las series de Yazar y col. (16) Y Rhode y col. (10), con un tiempo medio de cobertura de 14,62 en la primera y de 20,6 días en la segunda, se aprecian tasas de fracaso inferiores a la nuestra, 5% y 8% respectivamente. Nuestro tiempo medio hasta cobertura del defecto son 9,3 días, similar al que presenta la serie de Celiköz y col. (20). La demora temporal hasta consolidación ósea es equivalente en las 5 series que comparamos con la nuestra, independientemente del tiempo hasta cobertura y del método de fijación empleado (Tabla V). Sin embargo la incidencia de osteomielitis crónica es mayor en las series de Rhode y col. (10) y en la de Yazar y col. (16). En éstas, la demora temporal hasta cobertura es más elevada. Observamos también un pico de osteomielitis crónica en los pacientes tratados con clavo endomedular en la serie de Rhode. Esto no se ve en las series de Gopal y col. (20) y en la de Conroy y col. (21) que usan de forma predominante la fijación ósea con clavo endomedular; pero también vemos que estas 2 series reflejan los menores tiempos de cobertura (Tabla V). Los casos de fracaso de reconstrucción que conllevan amputación se asemejan en las 6 series, excepto en la de Çeliköz y col. (22), en la que el número es más elevado (un 10% de las amputaciones primarias); probablemente la causa es que en su serie los casos proceden de traumatismos balísticos de muy alta energía.
Hemos encontrado útil nuestro protocolo general de actuación con estos pacientes (Fig. 5). La estabilización ósea y el desbridamiento óseo precoces permiten realizar en el primer día una clasificación adecuada de la lesión. En los días 2 y 3 se reevalúa el desbridamiento y se valora el estado vascular del miembro afecto. Entre los días 5 y 10 se haría la cobertura definitiva según los parámetros establecidos. Los cultivos de hueso obtenidos el día de la cobertura determinarán el tipo y duración del tratamiento antibiótico complementario. En 21 días se puede obtener, en pacientes sin complicaciones, el alta hospitalaria. Los pacientes con defectos segmentarios de tibia menores de 6 cm y con pérdida cortical de más del 50%, son reingresados en un plazo de 4 a 6 semanas para aportarles injerto óseo precoz. Los pacientes sin defecto óseo segmentario pero con retardo de consolidación a las 12 semanas, se reevalúan para aporte de injerto óseo de forma diferida.
Este protocolo no pretende ser un axioma en el tratamiento de estos pacientes. Simplemente resume nuestra visión para abordar este tipo de lesiones.
Conclusiones
Tras 4 décadas de experiencia microquirúrgica, no existe un consenso absoluto acerca de cuál es el mejor protocolo y/o estrategia en el tratamiento y cobertura de las fracturas abiertas de tibia producidas por traumatismos de alta energía. En nuestra serie de pacientes, las decisiones se individualizaron para cada caso y se tomaron por consenso. La consideración funcional debe ser mandatoria antes de continuar adelante con la reconstrucción de estas extremidades. La efectiva y precoz estabilización ósea, el desbridamiento agresivo y la colaboración interdisciplinar, son imprescindibles para alcanzar el éxito terapéutico.
En estos pacientes sin embargo, la clave continúa siendo una adecuada cobertura vascularizada. El tipo de colgajo libre a emplear siempre irá en función de las características y ubicación de la herida, del estado de los vasos receptores y de los tejidos circundantes. Con un trabajo exhaustivo y coordinado hemos conseguido en nuestra serie un 94% de salvamento de extremidades.
Bibliografía
1. Gustilo R.B., Mendoza R.M., Williams D.N.: Problems in the management of type III (severe) open fractures: a new classification of type III open fractures. J. Trauma. 1984; 24(8):742-746. [ Links ]
2. Giannoudis P.V., Papakostidis C., Coberts C.: A review of the management of open fractures of the tibia and femur. J. Bone Joint Surg. 2006; 88-B(3):281-289. [ Links ]
3. Pollak A., McCarthy M.L., Burgess A.R.: A short-term wound complications after application of flaps for coverage of traumatic soft-tissue defects about the tibia. J. Bone Joint Surg. 2.000; 82-A (12):1681-1691. [ Links ]
4. Griffin M., Malahias M., Khan W., Hindocha S.: Update on the management of open lower limb fractures. Open Orthop. J. 2012; 6 (Suppl 3):571-577. [ Links ]
5. Naique S. B., Pearse M., Nanchahal J.: Management of severe open tibial fractures. The need for combined orthopaedic and plastic surgical treatment in specialist centres. J. Bone Joint Surg. 2006; 88-B (3):351-357. [ Links ]
6. American College of Surgeons: Advanced Trauma Life Support Program for Doctors: 9th ed. Chicago: American College of Surgeons; 2012. [ Links ]
7. Glass G.E., Pearse M.F., Nanchahal J.: Improving lower limb salvage following fractures with vascular injury: a systematic review and new management algorithm. J. Plast. Reconstr. Aesteth. Surg. 2009; 62(5): 571-579. [ Links ]
8. Chummun S., Wigglesworth T.A., Young K, et al.: Does vascular Injury affect the outcome of open tibial fractures? Plast. Reconstr. Surg. 2013;131(2):303-309. [ Links ]
9. Bosse M.J., MacKencie E. J., Kellam J.F., et al.: A prospective evaluation of the clinical utility of the lower-extremity injury severity scores. J. Bone Joint Surg. 2001; 83-A(1):3-14. [ Links ]
10. Rhode Ch., Greives M.R., Cetrulo C., Lerman O.Z., Levine J.P., Hazen A.: Gustilo Grade IIIB Tibial fractures requiring microvascular free flaps: External fixation versus intramedullary rod fixation. Ann. Plast. Surg. 2007; 59(1):14-17. [ Links ]
11. De Juan Pérez F.J.: Terapia VAC® en traumatismo grave de pierna izquierda. Cir. plást. iberolatinoam. 2010; 36(3): 247-254. [ Links ]
12. Haddock N.T., Garfein E.S., Saadeh B., Levine J.P.: The lower-extremity Allen test. J. Reconstr. Microsurg. 2010; 25(7):399-403. [ Links ]
13. Chow L.C., Napoli A., Klein M.B., Chang J., Rubin G.D.: Vascular mapping of the leg with multi-detector row CT angiography prior to free-flap transplantation. Radiology 2005;237(1):353-360. [ Links ]
14. Pu L.L.Q.: Soft-tissue reconstruction of an open tibial wound in the distal third of the leg: a new treatment algorithm. Ann. Plast. Surg. 2007;58(1):78-83. [ Links ]
15. Schaverien M.V., Hamilton S.A., Fairburn N.F., Rao P., Quaba A.A.: Lower limb reconstruction using the islanded posterior tibial artery perforator flap. Plast. Reconstr. Surg. 2010;125(6):1735-1743. [ Links ]
16. Yazar S., Lin Ch.-H., Ulusal A.E., Wei F.-Ch.: Outcome comparison between free muscle and free fasciocutaneous flaps for reconstruction of distal third and ankle traumatic open tibial fractures. Plast. Reconstr. Surg. 2006;117(7):2468-2475. [ Links ]
17. Yazar S., Lin Ch.-H., Wei F.-Ch.: One-stage reconstruction of composite bone and soft-tissue defects in traumatic lower extremities. Plast. Reconstr. Surg. 2004; 114(6):1457-1466. [ Links ]
18. Erdinger K., Windhofer Ch., Papp Ch.: Osteomuscular latissimus dorsi scapula flap to repair chronic, posttraumatic osteomyelitis of the lower leg. Plast. Reconstr. Surg. 2001;107(6):1430-1435. [ Links ]
19. Camporro D., García E., Barrio L.: Versatility of the lateral circumflex femoral arterial (LCFA) system flaps for lower extremity soft tissue reconstruction. Eur. J. Plast. Surg. 2013;36(9):559-566. [ Links ]
20. Gopal S., Majumder S., Batchelor A.G., Knight S.L., De Boer P., Smith R.M.: Fix and flap: the radical orthopaedic and plastic treatment of severe open fractures of the tibia. J. Bone Joint Surg. 2000; 82-B(7):959-966. [ Links ]
21. Conroy J., Agarwal M., Giannoudis P.V., Matthews S.J.E.: Early internal fixation and soft tissue cover of severe open tibial pilon fractures. Int. Orthop. 2003; 27(6): 343-347. [ Links ]
22. Çeliköz B., Sengezer M., Selçuk I., et al.: Subacute reconstruction of the lower leg and foot defects due to high velocity-high energy injuries caused by gunshots, missiles, and land mines. Microsurgery, 2005; 25(1):3-15. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Daniel Camporro Fernández
C/Benedicto Santos López, 2, 5oG
33013 Oviedo (Asturias), España
Correo electrónico: dcamporro@arquired.es