Introducción
La obesidad y el sobrepeso han aumentado de manera importante en los últimos años, lo que ha llevado a un incremento en los procedimientos quirúrgicos para disminuir la grasa corporal como son las abdominoplastías y lipoaspiraciones. Si bien el tejido adiposo rutinariamente se ha manejado como material de desecho, cirujanos plásticos y otros investigadores han documentado su uso como fuente abundante y accesible de células estromales multipotenciales utilizables en medicina regenerativa.(1) Dichas células se caracterizan por presentar marcadores estromales positivos (>90%) como CD13, CD73 y CD90; y marcadores hematopoyéticos negativos (<2%) como CD11b y CD45.(2) Diversos estudios han demostrado que estas mantienen su capacidad de diferenciación en múltiples tipos celulares incluyendo osteoblastos, condrocitos, adipocitos, miocitos y neuronas, tras una expansión in vitro.(1,3-5)
Dado que el tejido adiposo permite extracciones de grandes volúmenes con baja morbilidad este tejido se presenta actualmente como una interesante fuente de obtención de células estromales, de fácil acceso y con volúmenes de tejido considerables.
Las células estromales derivadas del tejido adiposo (CEDA) han probado ser candidatas adecuadas para muchas aplicaciones en medicina regenerativa e ingeniería de tejidos,(5) tales como defectos y trastornos óseos, enfermedades cardiovasculares, trastornos neurológicos, enfermedades autoinmunes, así como para mejorar el resultado del trasplante de médula ósea y de órganos sólidos.(6,7)
Un tema que surge respecto al almacenamiento y la preservación de estas células para la posterior aplicación en clínica, es el método de criopreservación a utilizar que logre mantener adecuadas tasas de viabilidad y preservar el potencial de diferenciación de las CEDA tras un ciclo de congelación.(8) La comprensión de las características biológicas durante el almacenamiento y postdescongelación de estas células es esencial en la investigación preclínica y clínica para asegurar la preservación de sus propiedades.(9) Por lo tanto, el desarrollo de protocolos efectivos de almacenamiento de CEDA aumentará su uso y utilidad en la aplicación en ingeniería de tejidos.
La criopreservación requiere la utilización de productos químicos que cumplan con la función de ser agentes crioprotectores (CP), equipamiento de congelación y obviamente, su almacenaje en nitrógeno líquido.
El daño producido por la criopreservación típicamente se debe a:(10-13)
– Injuria osmótica o tóxica debido a la adición de CP que son necesarios para disminuir el daño por congelación.
– Injuria por enfriamiento asociado a la disminución de la temperatura desde la ambiental a la de cambio de fase (formación de hielo).
– Injuria por congelación asociada con la formación de hielo extra e intracelular.
– Daño por descongelación asociado al aumento de la temperatura desde su almacenamiento en nitrógeno líquido a la temperatura ambiental.
No obstante todo lo anterior, la criopreservación ha mostrado ser el protocolo más eficiente en cuanto a recuperación de células viables postalmacenamiento y es ampliamente utilizada. El medio ideal para criopreservar CEDA es aquel que reúna condiciones de atoxicidad y que logre una mayor viabilidad celular sin disminuir el potencial de diferenciación. Es así como la elección y la composición de un medio óptimo de criopreservación es un área de intensa investigación en el campo de la criobiología.
Nuestro línea de trabajo está dirigida hacia la aplicación clínica de las CEDA para medicina regenerativa. Para esto se deben generar protocolos que optimicen la tasa de viabilidad postcriopreservación sin necesidad de utilizar criopreservantes que contengan proteína animal. El dimetilsulfóxido (DMSO) es uno de los CP más utilizados y de mejor rendimiento en cuanto a tasa de viabilidad postcriopreservación.(14)
El objetivo de nuestro trabajo es obtener células estromales humanas derivadas del tejido adiposo, implementar un protocolo de criopreservación que utilice un medio definido libre de proteína animal y medir las tasas de viabilidad de CEDA tras un ciclo de criopreservación para su eventual aplicación clínica.
Material y método
Pacientes y muestra
Utilizamos grasa fresca de tejido celular subcutáneo de la pared abdominal de 5 pacientes sometidas a lipoaspiración electiva en el Hospital Clínico de la Universidad de Chile. Empleamos como criterios de inclusión: pacientes de sexo femenino, de entre 20 a 45 años de edad, con índice de masa corporal (IMC) inferior a 28 kg/m2 y sin comorbilidades asociadas. Obtuvimos la autorización de cada paciente mediante un consentimiento informado escrito específico para la investigación y aprobado por el Comité de Ética Científico de la misma institución.
Obtención de las células estromales derivadas del tejido adiposo
Procesamos las muestras dentro de las primeras 6 horas tras su extracción de las pacientes. Utilizamos 100 ml de grasa fresca que lavamos 3 veces con 100 ml de una solución tampón fosfato (PBS - Phosphate-Buffered Saline) a temperatura ambiente para remover eritrocitos y leucocitos. Rescatamos el tejido adiposo sobrenadante y lo resuspendimos en un volumen equivalente de medio DMEM/F12 (Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12.Gibco®, EE.UU.) con colagenasa tipo I al 0.1% (Gibco®, EE.UU.). Incubamos la solución en un baño a 37 °C, con agitación continua durante 90 minutos. Luego la centrifugamos a 600 G durante 20 minutos a temperatura ambiente para separar los adipocitos maduros de la fracción vascular estromal (FVE). Aspiramos el sobrenadante quedando el pellet, que corresponde a la FVE que contiene las CEDA. La FVE fue resuspendida en el medio de cultivo y sembrada en placas de cultivo de 100 mm de diámetro para expansión celular.
Las células fueron expandidas realizando subcultivos (1:2) cuando se alcanzaba el 80% de confluencia.
Caracterización de las células estromales derivadas del tejido adiposo
Realizamos un panel de inmunofenotipificación mediante citometría de flujo en 3 muestras de CEDA de nuestro laboratorio en el subcultivo número 3. Consideramos 20.000 eventos por marcador como control de calidad correspondiente a la utilización de estas células.(2,15)
Proceso de criopreservación
La criopreservación la llevamos a cabo entre los subcultivos 3-4 (dentro de la fase exponencial de crecimiento). Una vez alcanzada la cantidad celular necesaria (4.5 a 5 millones de células, aproximadamente), se liberaron las células de la misma forma que para un subcultivo. Luego realizamos recuentos con Trypan Blue en cámara de Neubauer, rescatando una muestra de 0.5 x 106 cél/ml para criopreservarla en un medio vehículo (DMEM/F12 con rojo fenol, Gibco®, EE.UU.) con DMSO 10% (1.5 M). Realizamos el control con medio vehículo sin CP.
Empleamos una técnica de baja complejidad y costo-efectiva para llevar los criotubos a -80 °C de manera semicontrolada. Para este fin, utilizamos un receptáculo con isopropil alcohol que produce disminución de la temperatura a una velocidad aproximada de 1 °C/min (Thermo Scientific Nalgene Mr. Frosty®. Misuri, EE.UU.)(16,17) Al día siguiente, los criotubos se cambiaron a nitrógeno líquido para ser almacenados hasta su utilización. A las 4 semanas los descongelamos en un baño a 37 °C (1 minuto) y evaluamos la viabilidad.
Evaluación de la viabilidad
Determinamos la viabilidad de las CEDA con citometría de flujo cuantitativa antes y después de un ciclo de criopreservación. Para esto cargamos 3 tubos para citometría con 200 µL de suspensión celular (0.5 x 106 cél/ml) por paciente. Como controles utilizamos células necróticas inducidas por metanol(14) (1 tubo) y células vivas no criopreservadas (1 tubo). Empleamos el marcador ioduro de propidio (IP) mezclando la suspensión celular con 2 µL de IP antes de la adquisición de datos por el citómetro. La tinción celular con IP indica que se ha alterado la integridad de la membrana plasmática, por lo que su marcación con el colorante indica que las células se encuentran necróticas, distinguiéndose así de las células vivas. La citometría, por lo tanto, mostrará 2 poblaciones celulares: vivas (IP-negativas) y necróticas (IP-positivas). Analizamos las células mediante un sistema de citometría de flujo Becton-Dickinson® (Nueva Jersey, EE.UU.), considerando 40.000 eventos como significativos.
Calculamos la tasa de viabilidad obtenida mediante citometría de flujo con IP a través de la siguiente fórmula:
RESULTADOS
Para la obtención del aspirado graso incluimos en el estudio 5 pacientes de sexo femenino, con una edad de 38 años (rango de 28 a 34 años), IMC de 26.6 kg/m2 (rango de 25.2 a 27.8 kg/m2) y la grasa extraída fue 1950 ml (rango de 1700 a 2200 ml) (Tabla I).
Tabla I Características de las pacientes estudiadas
| Promedio | Rango | |
|---|---|---|
| Edad (años) | 38 | 28 - 44 |
| IMC (kg/m2) | 26.6 | 25.2 - 27.8 |
| Grasa extraída (ml) | 1950 | 1700 – 2200 |
| Grasa procesada (ml) | 100 |
IMC: índice de masa corporal
Obtuvimos células estromales derivadas del tejido adiposo lipoaspirado de estas 5 pacientes. El panel de inmunofenotipificación fue compatible con CEDA (Tabla II: en la columna de la derecha mostramos los criterios IFATS-ISCT(2) para ser consideradas células estromales derivadas del tejido adiposo, y en las columnas de la izquierda los hallazgos obtenidos que son compatibles con dichos criterios).
Tabla II Panel de inmunofenotipificación de 3 muestras de células estromales derivadas del tejido adiposo
| Marcador | 1 | 2 | 3 | Criterio IFATS-ISCT |
|---|---|---|---|---|
| IgG1k- FITC | 3.76 | 1.1 | 2.58 | ND |
| IgG1k- PE | 3.83 | 1.63 | 2.46 | ND |
| IgG1k-AF488 | 3.42 | 0.14 | 0.86 | ND |
| IgG2bk-PE | 3.24 | 0.43 | 0.83 | ND |
| CD29-PE | 99.8 | 100 | 100 | >80% Positivo |
| CD44-FITC | 98.7 | 93.4 | 99.6 | >80% Positivo |
| CD73-PE | 99 | 99.8 | 99.9 | >80% Positivo |
| CD90-FITC | 99.5 | 97 | 99.7 | >80% Positivo |
| CD105-PE | 99.2 | 99.7 | 99.6 | >80% Positivo |
| CD34-PE | 22.7 | 14.5 | 4.88 | 2-30% Variable |
| CD45-FITC | 3.73 | 0.12 | 2.61 | <2% |
| CD19-FITC | 3.6 | 1.21 | 2.86 | Bajo o negativo |
| CD11b-AF488 | 3.32 | 0.38 | 2.31 | Bajo o negativo |
| HLADR-PE | 2.92 | 3.77 | 2.35 | Bajo o negativo |
IFATS: International Federation for Adipose Therapeutics and Science; ISCT: International Society for Cellular Therapy; ND: no detectable
Medimos la viabilidad de las CEDA de cada paciente mediante citometría de flujo con ioduro de propidio (IP). En la Fig. 1 vemos los histogramas obtenidos del control negativo (células necróticas), control positivo (células vivas), precriopreservación y postcriopreservación. Realizamos los controles negativo y positivo para evaluar la capacidad de la citometría de flujo de detectar células muertas y vivas, respectivamente. En las figuras inferiores observamos la viabilidad antes y después de un ciclo de criopreservación y cómo se distribuye la cantidad de células vivas y muertas en el histograma.
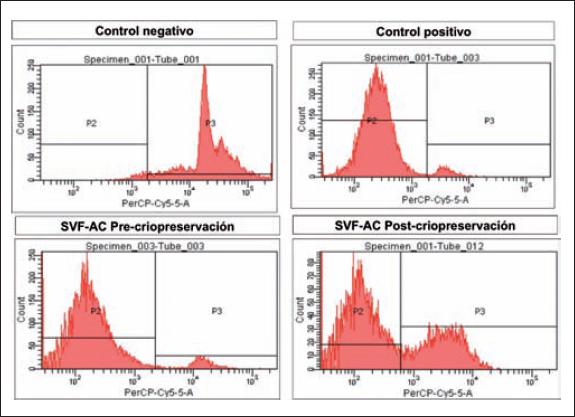
Fig. 1 Ejemplo de histogramas obtenidos: células de control negativo (metanol), control positivo (células vivas), antes del ciclo de criopreservación y posterior a este (SVF-AC: células estromales derivadas del tejido adiposo).
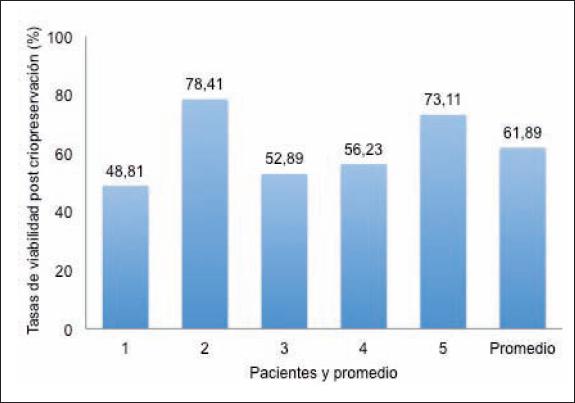
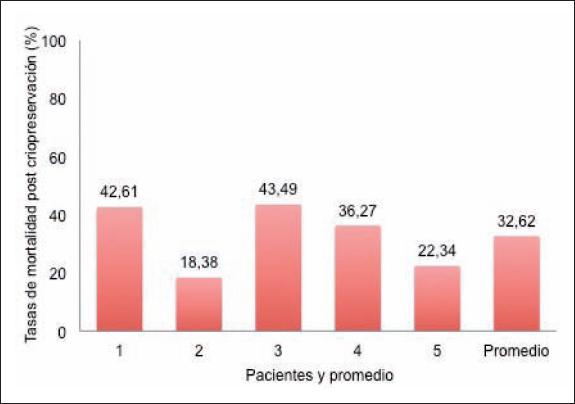
La tasa de viabilidad promedio obtenida de los diferentes pacientes fue 61.89% (rango de 48.81 a 78.41%), mientras que la tasa de mortalidad promedio fue de 32.68% (rango de 18.38 a 43.49%). Presentamos el detalle de las tasas de viabilidad y mortalidad de las 5 pacientes en las Fig. 2 y 3, respectivamente.
Discusión
En nuestra experiencia, es posible obtener tasas de viabilidad aceptables de células estromales derivadas del tejido adiposo tras un ciclo de criopreservación utilizando DMSO 10% en ausencia de proteína animal.
El uso de productos químicos en el medio de congelación, que partió como una observación fortuita de Polge(13) en los años 40, ha mostrado hoy en día ser un requisito para el resultado exitoso de un proceso de criopreservación.
El medio ideal para criopreservar CEDA es aquel que no sea tóxico y que logre una mayor viabilidad celular sin disminuir el potencial de diferenciación. Thirumala y col.(14) demostraron que se puede lograr una viabilidad de hasta un 87% con un medio de congelación libre de suero (humano o bovino) utilizando DMSO 10%. Esta viabilidad es mayor que la obtenida con menores concentraciones de DMSO (2, 4, 6 y 8%) cuando se combinaba con metilcelulosa o con suero fetal bovino o humano. En otro trabajo, este mismo autor mostró similares resultados de viabilidad en medios que utilizaban DMSO comparados con PVP 10% (63 frente a 54).(18) Esto conincide con estudios que demuestran que existe una factibilidad técnica y que la morfología e integridad de membrana son comparables en medios de criopreservación libres de suero homo y heterólogos utilizando sólo DMSO como criopreservante, tanto en CEDA como en otras células progenitoras humana.(19) En nuestro trabajo obtuvimos tasas de viabilidad menores, pero sin embargo aceptables y comparable a las de algunos estudios previos utilizando un medio definido, libre de proteína animal, que lo hace reproducible y permite su eventual aplicación en clínica.
La menor tasa de viabilidad obtenida en nuestro estudio tras 4 semanas de criopreservación no puede ser explicada por el tiempo en que se almacenaron las CEDA en nitrógeno líquido (aproximadamente -196°C). Se ha observado que estas células mantienen tasas de viabilidad >80% tras 1 y 6 meses, cayendo sólo al 70% al año de criopreservación;(20) sin embargo, mantienen su capacidad de diferenciación y el fenotipo de los marcadores de superficie. Otro factor que podría haber influido en nuestras tasas de viabilidad postcriopreservación obtenidas es la velocidad a la cual son congeladas las células. La velocidad controlada (1°C/min) tiene mejores resultado en la criopreservación de células mamíferas.(21) El descenso controlado de la temperatura permite que se forme hielo extracelular mientras el agua supercooled, proceso mediante el cual se disminuye la temperatura de un líquido o gas bajo su punto de congelación sin llevarlo a estado sólido, se transporta fuera de la célula, logrando así la vitrificación del medio intracelular. A velocidades más lentas se genera daño producto de un aumento de la concentración de solutos intracelulares a medida que el agua sale de la célula llegando a la deshidratación. Por el contrario, a velocidades más rápidas el agua no alcanza a salir de la célula y se genera hielo intracelular que produce la ruptura de la membrana.(21) La utilización de un sistema semicontrolado o no automático podría exponer a las células a velocidades mayores o menores a la ideal durante el proceso de congelación, provocando una disminución en las tasas de viabilidad en comparación con sistemas automatizados de disminución de la temperatura.
Si bien nuestro rendimiento en cuanto a viabilidad postcriopreservación en inferior al reportado por otros autores,(14, 22) la evaluación de esas tasas habitualmente se realiza mediante una técnica poco precisa como es la exclusión con Trypan Blue.(23,24) Está descrito que esta técnica tiende a sobreestimar la viabilidad, por ejemplo: un 90% de células descongeladas se excluyen con esta prueba (viables), sin embargo sólo un 60% de muestra ser capaz de adherirse a la placa a las 24 horas, condición fundamental de las CEDA.(23) La medición de la viabilidad utilizando una técnica más precisa como IP por citometría de flujo, es una estrategia más adecuada para enfrentar esta interrogante ya que evalúa la viabilidad mediante la valoración de la integridad de la membrana plasmática y nuclear. Es así como el IP evalúa la etapa final de la muerte celular,(25) por lo que las células inviables no impactan en la mortalidad.
El desafío ahora para nuestro laboratorio es intentar esclarecer las variables que podrían haber influido en las tasas de viabilidad obtenidas mediante estudios de criopreservación con un sistema de descenso automatizado de la temperatura o a través de la utilización de diferentes combinaciones de CP. Además sería interesante conocer las características de las células descongeladas en cuanto a su capacidad de adherirse y expandirse en la placa, formar colonias y diferenciarse en diferentes tipos celulares.
Conclusiones
Las células estromales derivadas del tejido adiposo han probado ser candidatas adecuadas para muchas aplicaciones en medicina regenerativa. El almacenamiento mediante criopreservación de estas células para su posterior utilización clínica aumentará su uso y aplicación en ingeniería de tejidos.
Mediante un protocolo de criopreservación que utilice DMSO 10% en ausencia de proteína animal, es posible obtener tasas de viabilidad aceptables de células estromales derivadas del tejido adiposo tras un ciclo de criopreservación. Al utilizar un medio definido, el procedimiento es reproducible y permite su eventual aplicación en clínica.