Introducción
En los últimos 15 años se han realizado a nivel mundial más de 150 trasplantes de tejido compuesto (TTC) a lo largo de toda la anatomía.(1) Todos estos procedimientos se han podido llevar a cabo extrapolando los regímenes de inmunosupresión de los protocolos actualmente empleados para trasplantes de órgano sólido (TOS).(2) Sin embargo, los efectos secundarios de carácter metabólico, infeccioso y oncológico justificados en caso del TOS, no son aceptables para el TTC al no encontrarse el receptor en una situación de riesgo vital. Estos regímenes tampoco han logrado controlar de forma absoluta la aparición de episodios de rechazo agudo (RA), ni el posterior desa-rrollo de un rechazo crónico..(3-5)
Existen distintas estrategias para intentar lograr un estado de tolerancia inmunitaria con vistas a disminuir la dosis de inmunosupresión y sus efectos secundarios, definida dicha tolerancia inmunitaria como la supervivencia de un tejido extraño sin la necesidad de inmunosupresión a largo plazo. La primera estrategia busca reemplazar completamente las células del sistema inmunitario del receptor por células del donante, creando un estado de quimerismo completo. Sin embargo, el requerimiento de irradiación mieloablativa previa y el potencial riesgo de Enfermedad Injerto Contra Huésped (EICH), hacen que esta estrategia no sea asumible en este contexto.(6) La segunda estrategia, busca la modulación del sistema inmunitario del receptor para permitir la coexistencia de ambas extirpes celulares, alcanzando un estado de quimerismo mixto. Al no requerir mieloablación previa, la principal ventaja de esta estrategia es la menor toxicidad precondicionamiento.(4)
El sistema inmunitario posee distintos mecanismos de protección para evitar una hiperactivación del mismo. Uno de ellos es la denominada tolerancia a endotoxina (TE), que consiste en una autorregulación de las células del sistema inmune innato, particularmente de los monocitos y de las células dendríticas (presentadoras de antígenos), que cambian de un fenotipo proinflamatorio a otro antiinflamatorio ante una estimulación antigénica masiva. La TE se observa en los pacientes con sepsis bacteriana, que pasan de una fase inicial de respuesta inflamatoria sistémica a otra antiinflamatoria de compen-
sación, produciéndose un estado de inmunosupresión relativa.(7) A partir de estos hallazgos, estudios tanto in vitro como in vivo han demostrado que cuando las células del sistema inmune innato se exponen a dosis bajas de lipopolisacárido bacteriano (LPS, un componente de las bacterias Gram-negativas), entran en un estado transitorio de anergia y son incapaces de responder a posteriores estímulos con LPS..(8-10) Este fenómeno no sólo se limita a estados sépticos, sino que también se ha observado en isquemia hepática y renal, síndromes coronarios agudos, fibrosis quística y leucemia linfática crónica, mediante tolerancia cruzada entre LPS y otro tipo de estímulos..(11,12)
Basándonos en esta anergia, la utilización de LPS podría permitir desarrollar tolerancia tras un insulto como puede ser un TTC. Hasta donde conocemos, el efecto que puede tener la infusión de LPS sobre el desarrollo de tolerancia en un TTC aún no ha sido evaluado.
Nuestro objetivo principal es valorar el efecto inmunomodulador del precondicionamiento con LPS en el contexto de un TTC experimental de extremidad posterior en ratas, comparando las diferencias en el tiempo hasta la aparición de un episodio de RA. Además, establecemos como objetivos secundarios el valorar la morbilidad asociada al precondicionamiento, la intensidad del rechazo en las biopsias tisulares y el patrón de citoquinas presente en el contexto de un TTC tras el precondicionamiento con LPS.
Material y método
Protocolo quirúrgico experimental
Realizamos transferencias de patas traseras entre ratas (Rattus Norvergicus) cruzando el Complejo Mayor de Histocompatibilidad. Utilizamos ratas Brown-Norway (LBN RT1n) de 5-11 semanas de vida como donantes y ratas Lewis (LEW RT1n) como receptoras.(13) Dividimos el total de animales previamente en 2 grupos según el precondicionamiento que recibieron. El grupo I recibió 1 ml de suero salino fisiológico (SSF) intravenoso (iv.) 72 horas antes de realizar el trasplante. Precondicionamos el grupo II 72 horas pretrasplante con una dosis iv. no letal de 0.8 mg/Kg (0.16 ml/Kg) de LPS (Serotype 055:B5, Sigma®). Posteriormente, todos los grupos recibieron inmunosupresión diaria con ciclosporina A (CsA) a dosis decrecientes. Mantuvimos los animales trasplantados con vida hasta que presentaron un episodio de RA.(14)
Todas las ratas utilizadas en el estudio recibieron un trato digno de acuerdo con la Directiva del Consejo de Europa publicada el 22 de Septiembre de 2010 (2010/63/UE). El estudio contó con la aprobación del Comité Ético y de Bienestar Animal (CEBA) del Hospital Universitario La Paz (Madrid, España), con número 01/2016.
Realizamos la cirugía con anestesia inhalatoria; primero la inducción con isoflurano al 5% (Forane®, Abbott) y manteniendo posteriormente al animal con una mascarilla al 2%. La analgesia postoperatoria la llevamos a cabo administrando tramadol 20 mg/kg/12h vía subcutánea (sc.) durante los primeros 2 días de posoperatorio. Junto a la analgesia administramos profilaxis antibiótica con enrofloxacino 5-10 mg/kg/24h vía sc.(14)
Técnica quirúrgica
Realizamos un trasplante heterópico de la pata trasera de la rata Brown Norway a la región inguinal derecha de la rata Lewis receptora, con anastomosis término-terminal de los vasos femorales mediante puntos sueltos de monofilamento irreabsorbible 10/0 (Ethilon®, Johnson & Johnson).(13) Para evitar el arrastre de la pata y las consiguientes complicaciones, practicamos la amputación del pie del aloinjerto realizando una osteotomía de tibia y peroné distales y posterior cobertura con musculatura del muñón para evitar la ulceración del mismo. Dejamos una isla cutánea de 20 x15 mm para la monitorización del trasplante, así como de los episodios de RA.
Protocolo de inmunosupresión
En todos los grupos de experimentación los animales receptores recibieron terapia inmunosupresora diaria con CsA a dosis decrecientes. Durante la primera semana de postoperatorio los animales recibieron 16 mg/Kg de CsA sc., para después ir disminuyendo la dosis semanalmente a 8 mg/Kg, 4 mg/Kg y 2 mg/Kg respectivamente. A partir de la cuarta semana (30 días postrasplante), dejamos de administrar CsA.(15)
Toma de muestra y protocolo de extracción
Bajo anestesia inhalatoria, tomamos 0.5-1 ml de sangre periférica en un tubo heparinizado a través de la vena caudal de la cola de la rata. Realizamos estas extracciones antes del precondicionamiento (-72 horas), el día del trasplante (0 horas), y posteriormente a los 7, 21, 30, 45 y 60 días de postoperatorio, y siempre que el animal se sacrificara por presentar un episodio de RA.(15)
Cuando el aloinjerto presentó un episodio de RA con alopecia o epidermólisis, los animales fueron anestesiados para la extracción y posterior análisis del mismo. Preservamos el aloinjerto en formol al 10% para estudio histológico. Tras la extracción, sacrificamos al animal receptor con una inyección intracardiaca de 1 ml de cloruro potásico y ratificamos la ausencia de pulso y respiración.
Parámetros evaluados
-Rechazo agudo. Inspeccionamos diariamente el miembro trasplantado buscando signos de RA: edema, eritema, descamación, alopecia, epidermólisis, exudación o necrosis cutánea.
-Bienestar animal. Llevamos a cabo diariamente medida del peso, crecimiento de pelo y color de cada animal con el objetivo de valorar cualquier perdida del bienestar animal.
-Citometría de flujo en sangre periférica. Incubamos las muestras de sangre periférica con anticuerpos antirrata contra los linfocitos T maduros (anti CD3), los linfocitos T Helper (anti CD4) y los linfocitos T citotóxicos (anti CD8). También valoramos la presencia de quimerismo linfoide en todas las muestras de sangre periférica. Resuspendimos las células mononucleares presentes, y tras tinción con anticuerpos monoclonales para caracterizar el distinto origen celular, realizamos el análisis por citometría de flujo con 3 colores.(14)
-Expresión génica de citoquinas. Medimos los marcadores de las reacciones inflamatorias producidas mediante arrays de proteínas (BDTM Cytometric Bed Array o CBA) en sangre periférica. Centramos el estudio en las siguientes citoquinas: TNF-α (del inglés, tumor necrosis factor; factor de necrosis tumoral) e INF-β (interferón β).
-Estudio histológico. Incluimos todas las muestras en parafina según protocolo estándar, realizamos cortes seriados (5 μm) con microtomo (Leica® RM2555) y teñimos con hematoxilina-eosina. Estudiamos las muestras mediante un sistema de análisis de imagen compuesto por un microscopio Olympus® BX14 (Olympus®, Tokio, Japón) acoplado a una cámara, con magnificación de 10X. Establecimos la intensidad del episodio de rechazo en las biopsias cutáneas por 2 observadores distintos, según la clasificación de Banff de 2007 para aloinjertos de tejidos compuestos con piel (Tabla I).(14) Así mismo valoramos el grado de infiltrado leucocitario muscular de manera semicuantitativa de 0 a 4 (0: nada; 1: leve; 2: moderado; 3: intenso; 4: muy intenso) por 2 observadores distintos.
Tabla I. Clasificación de Banff de 2007 para el rechazo agudo en aloinjertos de tejidos compuestos con piel
Grado Hallazgos anatomopatológicos 0 Ausencia o escasos infiltrados inflamatorios I LEVE. Leves infiltrados inflamatorios perivasculares, sin afectación de la epidermis II MODERADO. Infiltrados moderado-graves a nivel perivascular, con/sin leve afectación epidérmica y/o de los anejos cutáneos (limitándose a espongiosis y exocitosis). Ausencia de disqueratosis o apoptosis a nivel epidérmico III SEVERO. Denso infiltrado inflamatorio tisular con afectación de la epidermis, presentando apoptosis, disqueratosis y/o queratinolisis IV RECHAZO AGUDO NECROTIZANTE. Necrosis franca de la epidermis y otras estructuras cutáneas -Análisis estadístico. Analizamos todos los datos utilizando el programa estadístico SPSS 20.0 (IBM SPSS Statistics®) y el programa Prism 5.0 (GraphPad®). Analizamos la supervivencia mediante el método de Kaplan-Meier y comparamos los resultados mediante el test de Log-Rank. Para analizar la pérdida de peso utilizamos el método de ANOVA de medidas repetidas y para comparar los episodios diarreicos el test chi-cuadrado. Para el análisis del grado de rechazo, tanto de piel como de músculo, empleamos el test de Kruskall-Wallis y a continuación un test 2 a 2 con el método De Dwass, Steel, Critchlow-Fligner. Por último, recogimos el quimerismo en los distintos tiempos de la evolución y comparamos mediante el análisis de la varianza con medidas repetidas. Establecimos la significación estadística para un valor de p de 0.05.
RESULTADOS
Resultados del modelo experimental
Practicamos 46 trasplantes de extremidad posterior en ratas, de los cuales desestimamos 9 (19.5%) por los siguientes motivos: 2 alotrasplantes presentaron úlceras de decúbito en el muñón; 2 animales fallecieron intraoperatoriamente debido a pérdidas hemáticas; y 5 trasplantes presentaron fallo de la anastomosis microquirúrgica.
Confirmamos la patencia del pedículo vascular en todos los trasplantes en el momento de la autopsia. Ninguno de los animales presentó manifestaciones clínicas de EICH.
Supervivencia del aloinjerto
Los animales del grupo de experimentación I (control) presentaron signos de RA antes de los 15 días tras el cese de tratamiento inmunosupresor (mediana: 40 (37.6 -42.4) días postcirugía). Por el contrario, los animales del grupo II que habían recibido un precondicionamiento con LPS, presentaron el episodio de RA a partir del día 60 desde la cirugía (mediana: 68 (52.9 - 83) días postcirugía), diferencia que resultó estadísticamente significativa (p=0.001) (Fig. 1).
Efectos secundarios asociados al precondicionamiento
De los 17 animales que recibieron precondicionamiento con LPS, 14 (82.35%) tuvieron episodios diarréicos. Ninguno de los animales del grupo control presentó esta complicación. La diferencia en la tasa de complicaciones del grupo precondicionado con LPS respecto al grupo control resultó estadísticamente significativa (p=0.015).
Todos los animales perdieron peso durante las 2 primeras semanas postrasplante, independientemente del grupo, evidenciando su recuperación a partir de la tercera semana. Los animales del grupo control presentaron una pérdida ponderal media de 17.4 ± 0.814 gr, y en los que recibieron LPS 72 horas fue de 40.23 ± 01.883 gr (p= 0.034).
Citometría de flujo
El porcentaje de linfocitos totales en el grupo I presentó un ascenso tras el trasplante hasta el día 7 postrasplante (31.2 ± 9.2% de linfocitos totales) para descender posteriormente hasta el día del episodio de RA.
En el grupo II (LPS 72 horas) observamos un descenso del porcentaje de linfocitos desde el día de la cirugía, alcanzando un nivel mínimo al 7º día de postoperatorio (15.6 ± 3.4% de linfocitos totales), diferencia que resultó estadísticamente significativa respecto al grupo control (p= 0.0024).
El quimerismo en sangre periférica está determinado por el porcentaje de células T del donante (tanto CD8/RT1 como CD4/RT1). El máximo nivel de quimerismo en el grupo II (precondicionado con LPS) lo observamos entre los días 21 y 30 postrasplante (2.33 ± 0.35% de células MHC I negras; 0.755 ± 0.571% de CD4+ y 0.89 ± 0.082% de CD8+), momento a partir del cual fue disminuyendo paulatinamente hasta niveles de mínimos el día 60 postrasplante (0.24 ± 0.229% de células MHC I negras, 0.284 ± 0.3595% CD4+ y 0.059 ± 0.0205% de CD8+). El máximo nivel de quimerismo en el grupo control se mantuvo por debajo respecto al grupo II, presentando un pico posterior, en el día 30 postrasplante (2.15 ± 1.11% células MHC I negras, 0.086 ± 0.065% de CD4+ y 0.0477 ± 0.058% de CD8+) con descenso de las cifras hasta niveles mínimos en el día 45 (0.514 ± 0.783% de células MHC I negras, 0.185 ± 0.262% de CD4+ y 0.031 ± 0.02% de CD8+) (Fig. 2). Observamos diferencias estadísticamente significativas entre el grupo control y el grupo precondicionado con LPS en el día 21 para los linfocitos T maduros (p=0.015) y para los CD4+ (p= 0.021).

Fig. 2. Citometría de flujo en sangre periférica de los grupos control (I) y LPS (II). Superior izquierda: porcentaje de linfocitos totales en la sangre periférica del animal receptor. Superior derecha: porcentaje de células del animal donante en la sangre periférica del animal receptor. Inferior izquierda: porcentaje de linfocitos T CD8+. Inferior derecha: porcentaje de linfocitos T CD4+.
Expresión génica de citoquinas
En el grupo precondicionado con LPS (grupo II), la expresión de la citoquina TNF-α (Fig. 3) sigue un curso ascendente con la administración de LPS, para después presentar una evolución descendente. Los niveles vuelven a aumentar a partir del día 30, coincidiendo con el cese de la inmunosupresión. En el grupo control (Fig. 3), vemos que su expresión génica sigue un curso ascendente desde el momento del trasplante, alcanzando su máximo en el momento del episodio de RA y manteniéndose siempre más baja que en el grupo precondicionado.
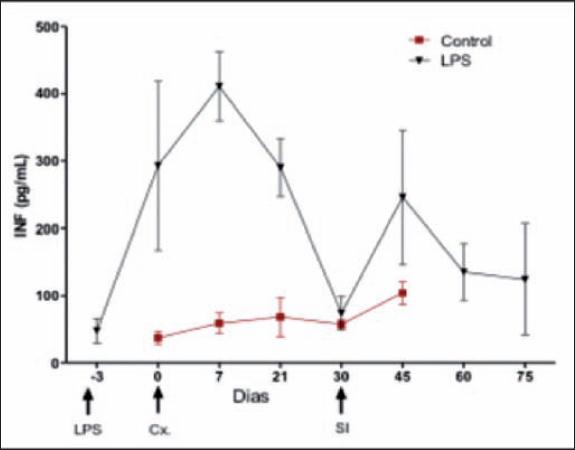
La Figura 4 muestra la expresión génica de la citoquina IFN-β. En el grupo II observamos un ascenso de los niveles desde el momento del precondicionamiento hasta 1 semana postcirugía. A continuación, los niveles descienden de forma progresiva hasta el día del episodio de RA. En el grupo control la expresión génica de IFN-β presenta una pendiente más suave, manteniéndose en todo momento por debajo de los valores de grupo precondicionado.
Resultados histológicos
El grupo control presentó una mediana de 3 (rango intercuartílico: 2.75 - 3.25) en la clasificación de RA de Banff 2007. El grupo precondicionado con LPS presentó una mediana de 1 (rango intercuartílico: 1-2). El análisis estadístico encontró diferencias estadísticamente significativas entre ambos grupos (p = 0.038) (Fig. 5)

Fig. 5. Histología del rechazo cutáneo. Tinción con hematoxilina-eosina. Izquierda (x10): grupo I (control), denso infiltrado linfocitario, gran desestructuración de la epidermis, con queratinolisis y necrosis. Derecha (x10): grupo II (LPS), leve infiltrado linfocitario dermo-epidérmico y perivascular, manteniendo la arquitectura cutánea y vasos y anejos conservados.
Respecto a la valoración semicuantitativa del infiltrado leucocitario muscular, el grupo control presentó una mediana de 3 (rango intercuartílico: 2.75 - 3.25), y el grupo II presentó una mediana de rango intercuartílico: 1-2. Encontramos diferencias estadísticamente significativas entre ambos grupos (Fig. 6).

Fig. 6. Histología del músculo. Tinción con hematoxilina-eosina. Derecha (x10): grupo I (control), denso infiltrado linfocitario perimisial y perivascular con alteración de la arquitectura fascicular. Izquierda (x10): grupo II (LPS), escaso infiltrado perimisial manteniendo la arquitectura fascicular.
Discusión
Desde su primera descripción en 1946 por Paul Beeson, diferentes estudios han intentado dilucidar el mecanismo molecular que induce la TE(16) pero este continúa sin estar claro..(17-19) La TE fue descrita inicialmente en modelos animales mediante la demostración de la reducción de la mortalidad asociada a dosis letales de LPS en animales que habían sido pretratados con dosis bajas de LPS. Otros estudios demostraron que la inducción de TE también protegía del daño por isquemia-reperfusión en órganos como el hígado, el riñón, el intestino o el cerebro, siendo este además uno de los principales mecanismos de inducción del rechazo crónico en un trasplante..(17,18) A partir de estos hallazgos, Ishiyama y col. observaron que la inducción de TE con dosis bajas de LPS aumentaba el tiempo hasta el rechazo del aloinjerto, siendo este tiempo el doble que en los casos control.(19)
En nuestro trabajo, en consonancia con los resultados de Ishiyama y col., observamos un mayor tiempo hasta la aparición de RA en el grupo precondicionado en comparacion con el grupo control. Sin embargo, coincidiendo con lo observado en otros estudios, este grupo presentó un mayor número de complicaciones de carácter biológico, representadas fundamentalmente por una mayor pérdida ponderal y el desarrollo de episodios diarreicos, con una diferencia estadísticamente significativa cuando comparamos con el resto de grupos del estudio.(19) Atribuimos ambas complicaciones al estado de inflamación sistémica que supone la administracion inicial de LPS en el animal.(20)
En nuestro estudio observamos una reducción estadísticamente significativa de la población de linfocitos en sangre periférica durante la primera semana postcirugía en los animales del grupo II en comparacion con el grupo control. Este hallazgo coincide con los resultados obtenidos por otros grupos,(19) y se atribuye a una deplección funcional de las células presentadoras de antígenos con la consiguiente incapacidad para desencadenar una respuesta inmunitaria adaptativa, que se traduce en una disminución de la proliferación de la población linfocitaria ante un estímulo antigénico. El estudio de Delano y col. mostró que la deplección linfocitaria en pacientes con sepsis puede ser secundaria a la expansión de células mieloides inmaduras GR1+ CD11B+. Este tipo de células produce óxido nítrico, especies reactivas de oxígeno y peroxinitrito, induciendo así la apoptosis y la inhibición de la proliferación de las células T.(21) Otro posible mecanismo implicado sería el citado por Zanin-Zhorov, que consiste en el aumento de la actividad de las células T reguladoras cuya función es la inhibición de la proliferación y diferenciación de los linfocitos T.(22) A pesar de todos los estudios mencionados, el mecanismo exacto de la TE sigue sin estar claro y probablemente sea la suma de todos.
En el análisis del quimerismo mixto observamos un mayor porcentaje del mismo en el grupo precondicionado con LPS entre los días 21 y 30 postcirugía, fundamentalmente a expensas de los linfocitos T CD4+. Este aumento de células T reguladoras podría indicar una mayor inmunorregulación a nivel del sistema inmune adaptativo y explicar el mayor tiempo hasta desarrollar un episodio de RA en el grupo pretratado con LPS. No obstante, observamos que el estado de quimerismo no es estable, sino que disminuye según nos acercamos al día del episodio de rechazo. Hewit y col. lograron un elevado nivel de quimerismo (60%) en ratas receptoras de un trasplante de pata, consiguiendo un estado de tolerancia indefinido que se atribuyó directamente al nivel de quimerismo estable.(23) Sin embargo, estudios con quimerismos transitorios como el de Bourget y el de Semionow, sugieren que aunque inicialmente se requiere la presencia de quimerismo para inducir tolerancia, posiblemente este no sea necesario para mantenerla a largo plazo..(14,24)
En relación a la expresión de citoquinas, en el grupo II observamos un aumento de la respuesta inflamatoria que se refleja en el aumento de TNFα desde la administración de LPS hasta el momento del trasplante. Paradójicamente tras la intervención quirúrgica, que se comporta como un potente estímulo proinflamatorio, el TNFα continúa en un curso descendente. El IFNβ (citoquina antiinflamatoria) también se eleva con la administración de la endotoxina, permaneciendo oscilante pero siempre con niveles por encima de los del grupo control. Coincidiendo con este resultado, el estudio de Biswas y col. observó como el estímulo con LPS a dosis bajas producía una disminución de las citoquinas proinflamatorias (IL-6 (Interleukina-6) y TNFα) y un aumento de las antiinflamatorias (INFβ, IL-10 (Interleukina-10), TGFβ (del inglés, tisular growth factor-βfactor de crecimiento tisular-β)). Esto se atribuyó a la activación del TLR-4 (del inglés, Toll-like receptor; Receptor tipo Toll) por la vía MyD88-independiente (TRIF/TRAM), que consiste en una sobreexpresión de citoquinas antinflamatorias como el IFNβ, que a su vez sería indispensable para la expresión de IL-10 y TGFβ en los tejidos. Los resultados del estudio coinciden con la evidencia previa en cuanto al patrón de inmodulación de la respuesta inmunitaria innata.(7)
Aunque la respuesta inmune a los antígenos del alotrasplante depende de múltiples factores, como la disparidad de Complejo Mayor de Histocompatibilidad entre donante y receptor, la antigenicicidad de los distintos componentes trasplantados, el tratamiento inmunomodulador empleado y la diversidad de la respuesta inmune específica genéticamente dependiente, parece que la TE abre una vía hacia la tolerancia inmunitaria en el campo del TTC. De acuerdo con Hettiaratchy y col., uno de los criterios que se debe cumplir para que una estrategia de tolerancia sea clínicamente relevante es que el régimen de precondicionamiento no presente una morbilidad injustificable.(5) La administración de LPS no es un precondicionamiento plausible dada la morbilidad asociada al mismo, haciendo necesario el desarrollo de análogos de LPS no tóxicos que permitan desarrollar este enfoque en la práctica clínica.
Conclusiones
El mecanismo de tolerancia a endotoxina retrasa la aparición de episodios de rechazo agudo en el trasplante de tejido compuesto. El análisis de la histología cutánea y muscular ha demostrado la mayor intensidad del RA en los grupos no precondicionados. La expresión génica de citoquinas ha permitido comprobar el comportamiento de las respuesta inflamatoria a nivel molecular.