Introduccion
El mejor entendimiento actual del cáncer de mama, los avances en las técnicas quirúrgicas y la optimización de los métodos adyuvantes han permitido que la cirugía conservadora sea considerada como la primera línea de tratamiento. Aunque una mastectomía clásica es inevitable en pacientes con tumores de gran tamaño, multicéntricos o con contraindicación para radioterapia postoperatoria, la tendencia actual apunta hacia utilizar técnicas que conserven la mayor cantidad de tejido autólogo sin empeorar el pronóstico general de la paciente.
Los avances en el diagnóstico genético y los modernos métodos radiológicos han permitido que las indicaciones de las técnicas profilácticas hayan aumentado considerablemente. Estos procedimientos suelen plantearse a personas sanas, sin antecedentes oncológicos, pero con alto riesgo de desarrollar un tumor; también a pacientes mastectomizadas por causa de un cáncer mamario para reducir el riesgo en la mama contralateral.(1)
La mastectomía reductora de riesgo, también conocida como mastectomía profiláctica, consiste en extirpar la mayor cantidad de tejido posible de una mama sana para reducir el riesgo potencial de desarrollar cáncer. Está indicada en pacientes que tienen mayor riesgo de desarrollar cáncer de mama que el resto de la población. Sin embargo no se puede decir que elimine el riesgo de padecerlo, únicamente que lo reduce.
El Complejo Hospitalario Universitario de La Coruña es una institución pública de cuarto nivel y el centro principal de referencia de la provincia de La Coruña en la Comunidad Autónoma de Galicia (España). Dentro de esta institución funciona la Unidad de Senología y Patología Mamaria, en la que se realizan un promedio aproximado de 500 cirugías al año relacionadas con dicho órgano. Se tratan pacientes con enfermedad oncológica de la mama, patología benigna y cirugía reconstructiva. La Unidad está formada por especialistas de los Servicios de Cirugía Plástica, Cirugía General, Ginecología, Radiología, Oncología y Radioterapia.
Los especialistas en Cirugía General y Ginecología proporcionan el tratamiento inicial de la patología benigna y oncológica en estrecho contacto con los especialistas en Cirugía Plástica, quienes se encargan del proceso reconstructivo cuando este es necesario. Dicho proceso puede incluir la simetrización de la mama contralateral (reducción y pexia), la colocación de prótesis o expansores mamarios, la realización de colgajos pediculados o libres, la remodelación de cirugías previas o la reconstrucción primaria en la mastectomía reductora de riesgo (MRR). También se encarga del tratamiento de las pacientes con gigantomastia, realizando reducciones mamarias bilaterales no relacionadas con procesos oncológicos. No contempla la realización de Cirugía Estética de la mama y únicamente se realizan tratamientos incluidos en el plan de la Seguridad Social española (sistema público nacional de salud).
Este trabajo pretende revisar la técnica quirúrgica de mastectomía tipo IV con injerto libre de complejo areola pezón (MIVAP), presentando la experiencia de la Unidad de Cirugía de la Mama (UMA) de nuestro hospital mediante una serie de casos seleccionados de pacientes con alto riesgo de desarrollar un cáncer mamario en las que empleamos esta técnica como alternativa reconstructiva inmediata con prótesis en un solo tiempo quirúrgico.
Material y método
Exponemos la técnica quirúrgica y analizamos 9 casos de mujeres con indicación de mastectomía ahorradora de piel y/o MRR a quienes se les realizó una MIVAP. El rango de edad de las pacientes fue de entre 24 y 45 años.
Incluimos mujeres que optaron por una mastectomía profiláctica primaria y también pacientes que solicitaron una mastectomía profiláctica secundaria: antecedentes de cáncer mamario, que habían sido curadas mediante cualquier tipo de intervención previa diferente a una mastectomía, como por ejemplo una cuadrantectomía o una oncoplástia. El 50% de las pacientes de la muestra no había padecido ningún cáncer y por lo tanto se trataba de mujeres sanas.
Excluimos pacientes con otro tipo de mastectomía diferente a la MIVAP o con cualquier otra indicación para la mastectomía diferente a la opción de reducción de riesgo.
Revisamos las diferentes complicaciones posibles tras la intevención: seroma, hematoma, infección, exposición de la prótesis, dehiscencia de la herida quirúrgica, linfedema, si el objetivo estético fue o no alcanzado y el tiempo medio de reincorporación a su vida habitual, y comparamos con las existentes en la literatura revisada.
Para evaluar el grado de satisfacción global de las pacientes y de los cirujanos con el resultado obtenido tras la intervención, plateamos un cuestionario anónimo a cada una de las pacientes con las siguientes preguntas a los 6 meses y al año de la intervención:
¿Ha tenido algún problema para reincorporarse a su trabajo una vez transcurrido 1 mes después de la intervención?
¿Resultó incomodo o doloroso el periodo postoperatorio inmediato (primera semana tras la intervención). Marque del 0 al 10 el grado de incomodidad o dolor que pudo presentar. Marque con una X en una escala analógica visual, donde crea que corresponde: 0 se considera nada de dolor o molestia tras la intervención y 10 si tuvo dolor o molestia insoportable.
¿Se siente más tranquila después de la cirugía respecto a la posibilidad latente de desarrollar un cáncer de mama?
¿La cirugía ha afectado de alguna manera la percepción propia de su imagen corporal? ¿Ha necesitado algún tipo de ayuda externa (psicólogo o psiquiatra)?
Valore de 0 a 10 el grado de satisfacción respecto al cumplimiento de sus expectativas estéticas después de la cirugía.
A los cirujanos se les aplicó el siguiente cuestionario también 6 meses y 1 año después de la intervención:
¿Cree que su paciente está satisfecha con el resultado?
¿Ha tenido alguna complicación tras la intervención quirúrgica?
¿Estéticamente, cuál es su grado de satisfacción con la intervención realizada en una escala de 0 a 10 donde 0 es nada satisfecho y 10 totalmente satisfecho?
Presentamos la técnica quirúrgica empleada y recogemos nuestra casuística.
Técnica quirúrgica
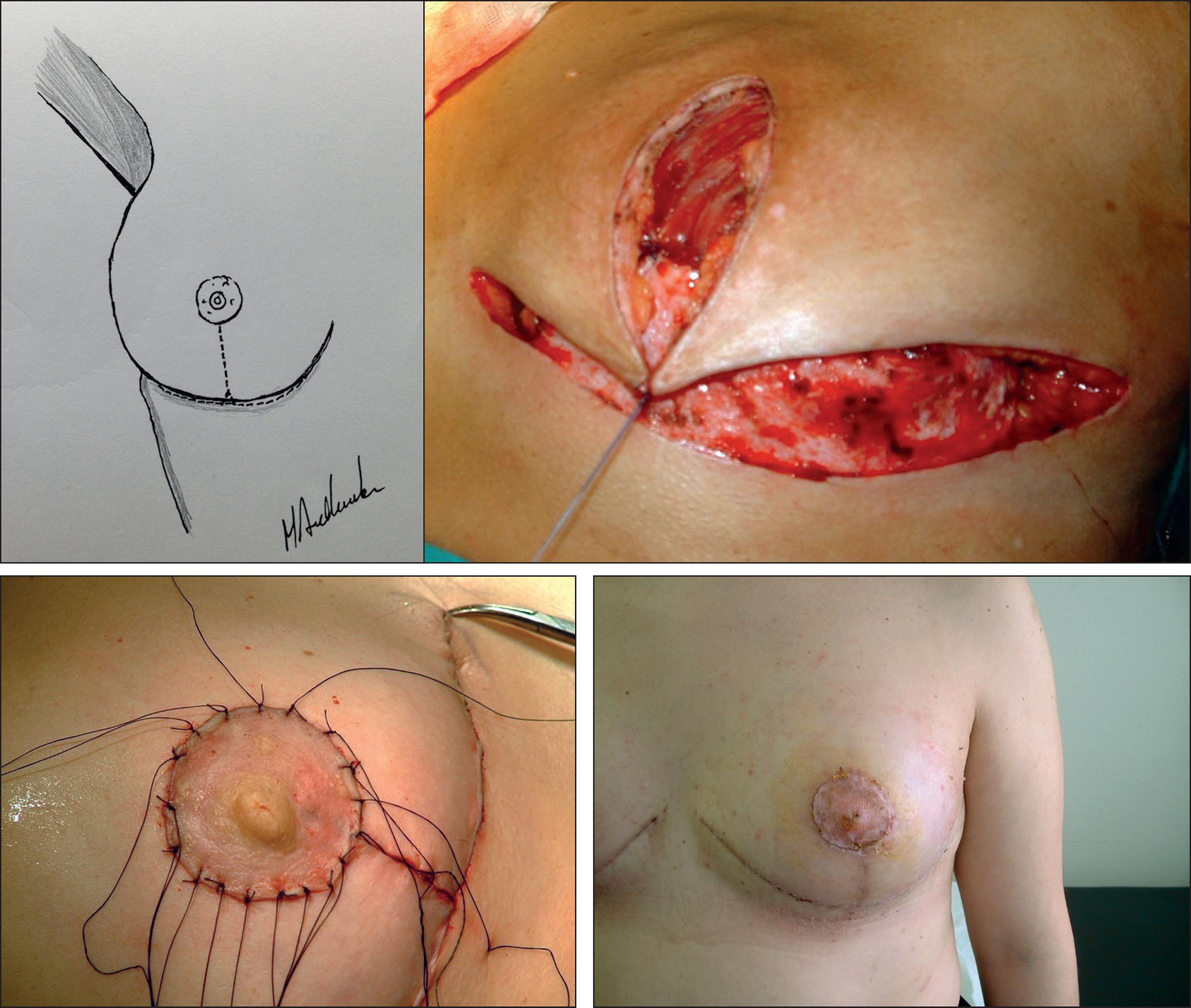
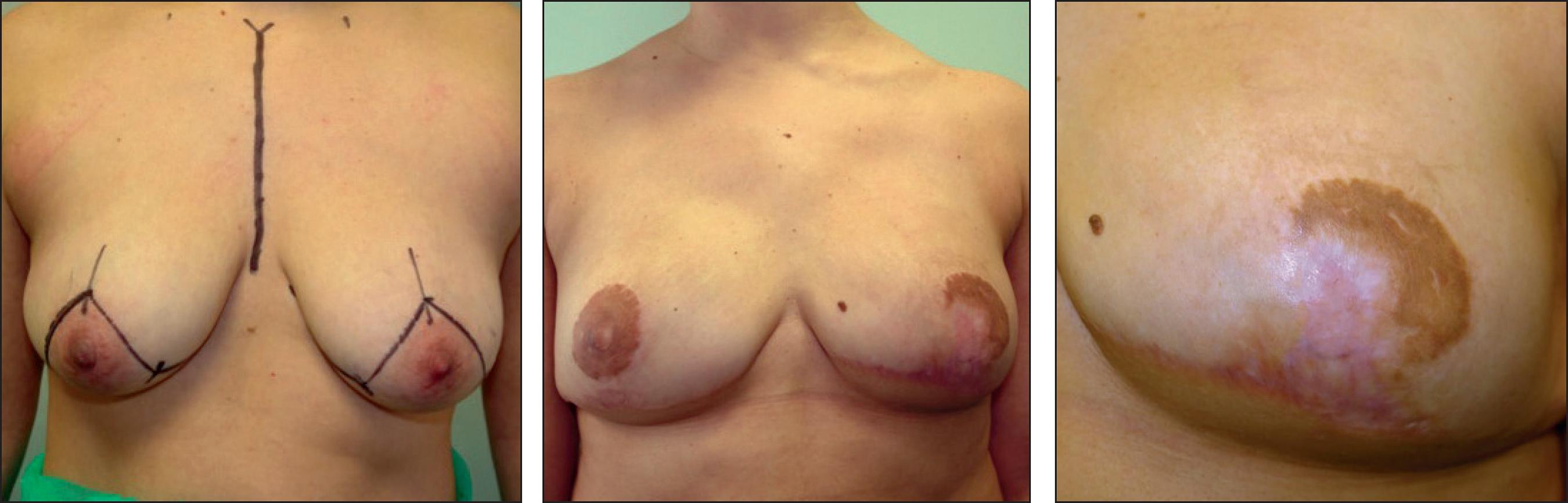
La MIVAP consiste en una mastectomía con fines profilácticos para reducir el riesgo oncológico empleando el patrón de reducción mamaria de Wise. En la Fig. 1 ilustramos el diseño de las incisiones, conservando un colgajo dermo-graso desepidermizado en los cuadrantes inferiores para dar cobertura al implante (Fig. 2). El colgajo dermo-graso obtenido a partir del polo inferior de la mama tras su desepidermización se afronta mediante sutura al músculo pectoral mayor desinsertado en su borde inferior, proporcionando entre ambos un bolsillo adecuado para la cobertura del implante (Fig. 3).
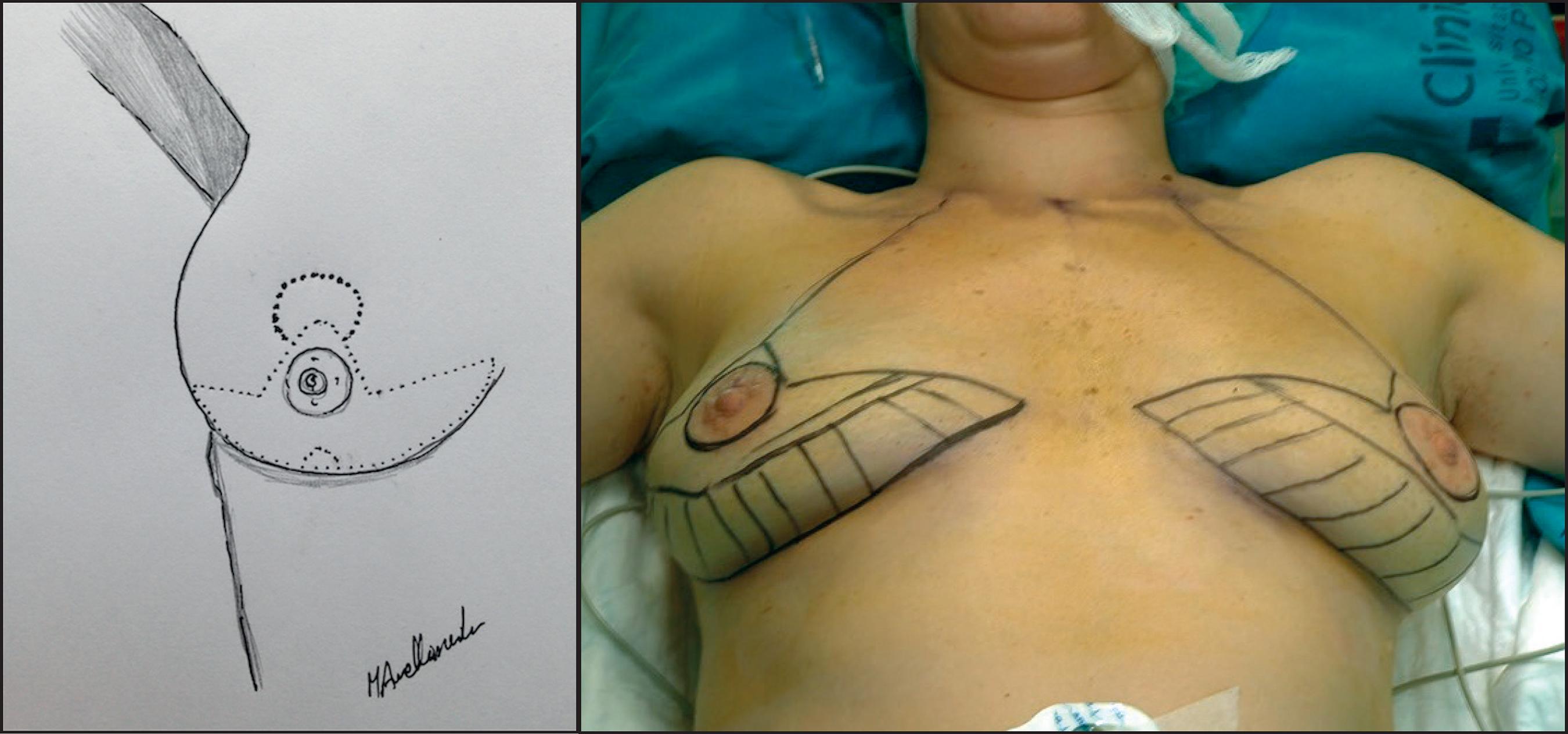
Figura 1. A Patrón de reducción mamaria de Wise. B. Patrón de Wise dibujado en la piel de la paciente en la que se conservará un colgajo dermograso desepidermizado en el polo inferior (zona rayada) para dar cobertura al implante.
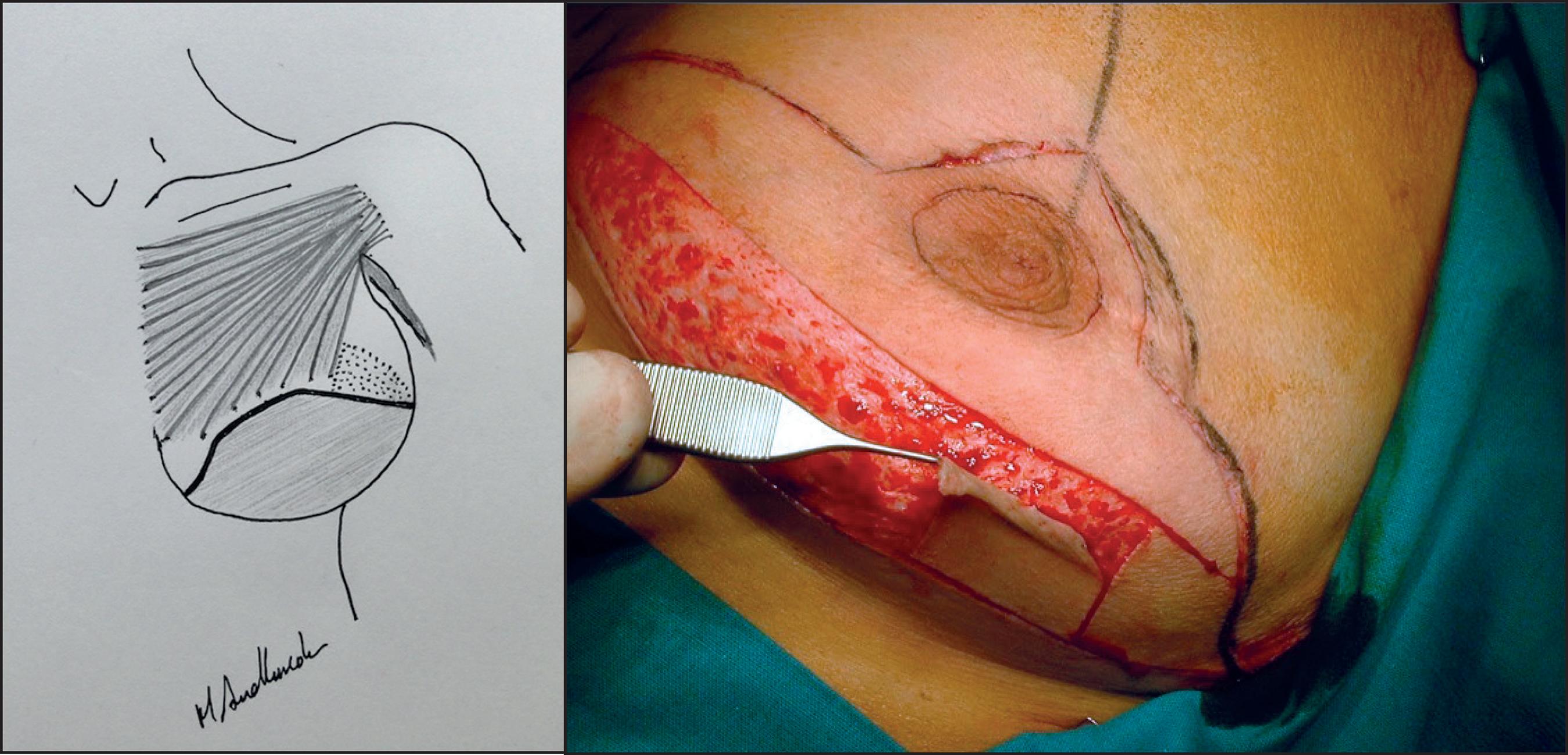
Figura 2. Diseño de colgajo dermograso para cubrir el implante en los polos inferiores. A. Rayado: músculo pectoral mayor; sombreado: colgajo dermograso; Punteado: prótesis mamaria. B. Desepidermización del colgajo dermograso.
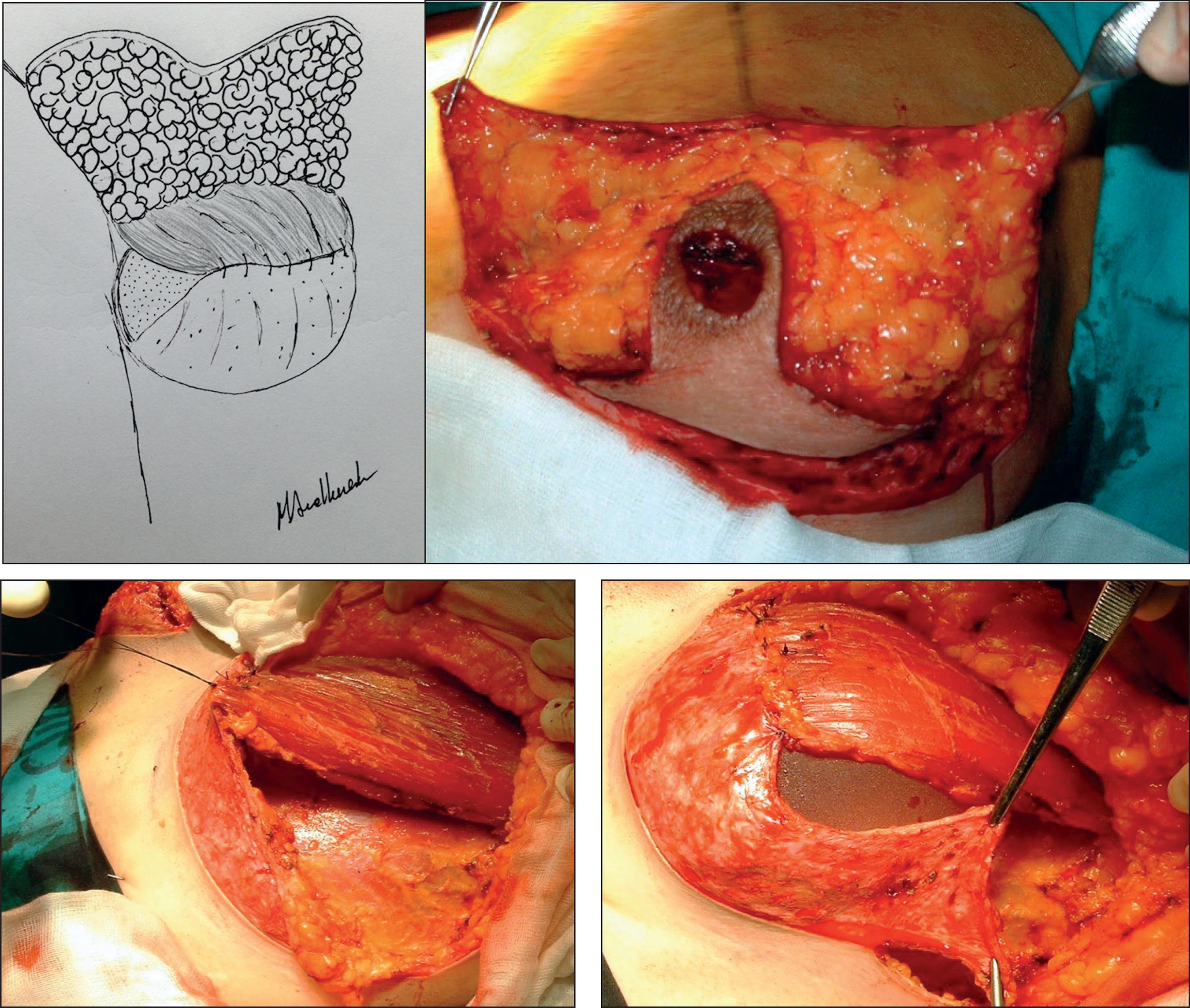
Figura 3. Prótesis dentro del bolsillo formado por el músculo pectoral mayor y el colgajo dermograso.
Pesamos el tejido mamario en una báscula digital y lo enviamos para su estudio anatomopatológico. Realizamos la biopsia selectiva del ganglio centinela (BSGC) en los casos en los que haya datos clínicos o radiológicos de cualquier posible afectación tumoral de la mama a extirpar (incluimos para la valoración la región de la axila), como por ejemplo la presencia de tumoraciones palpables o microcalcificaciones en la mamografía que de forma preoperatoria, se realiza protocolariamente a todas las pacientes. Para el abordaje de la BSGC utilizamos la misma incisión de la mastectomía.
Una vez realizada la extirpación de la piel, grasa y glándula mamaria por encima del músculo pectoral, levantamos dicho músculo por su borde inferior y disecamos un bolsillo entre este y la pared costal, con el tamaño adecuado para alojar el implante escogido. Posteriormente colocamos la prótesis en dicho espacio y cerramos la cavidad con suturas reabsorbibles que afrontan el borde inferior del músculo pectoral con el colgajo dermo-graso desepidermizado, cubriendo por completo el implante. Finalmente procedemos al cierre de la piel siguiendo el patrón de Wise, cubriendo todo el montaje subcutáneo, y llevamos a cabo el injerto libre de areola y pezón (Fig. 4).
Resultados
La muestra estuvo compuesta por 9 pacientes que acudieron a nuestra Unidad de Patología Mamaria durante un periodo de 2 años solicitando la realización de una mastectomía reductora de riesgo con al menos una indicación adecuada para la misma, y en consecuencia fueron sometidas a tratamiento quirúrgico en dicha Unidad. La media de edad fue de 35.8 años (mínima de 24 y máxima de 45 años). Todas fueron mujeres.
La indicación más frecuente para realizar una MIVAP fue el antecedente de cáncer ginecológico (ovario o mama) asociado a una mutación en el gen BRCA 1 o BRCA 2 (3 pacientes). También se indicó en 2 pacientes con positividad para mutación del BRCA 1 o BRCA 2, sin antecedentes tumorales. Solo tuvimos 1 caso con mutaciones en el gen supresor p53 (síndrome de Li-Fraumeni), 1 caso de alta carga familiar de cáncer de mama u ovario (más de 3 familiares en primera línea) pero sin positividad para ninguna mutación genética, y 2 pacientes con cancerofobia completaron el resto de la muestra.
En la tabla I resumimos las indicaciones de las pacientes del grupo de estudio.
Los implantes utilizados en todos los casos fueron de gel cohesivo de silicona, anatómicos, texturizados de alta proyección y con una media de volumen de entre 250 a 350 cc.
Tabla I. Indicaciones de la técnica en las pacientes de nuestro grupo de estudio
| Indicaciones | Casos |
|---|---|
| Antecedente de cáncer ginecológico (ovario o seno) asociado a una mutación en el gen BRCA 1 o 2 | 3 |
| Positividad para mutación del BRCA 1 o 2 sin antecedentes tumorales | 2 |
| Mutaciones en el gen supresor p53 (síndrome de Li-Fraumeni) | 1 |
| Cancerofobia | 2 |
| Alta carga familiar de cáncer de mama u ovario, sin positividad para ninguna mutación genética. | 1 |
| TOTAL | 9 |
Durante la evaluación de las complicaciones encontramos que no se presentaron seromas ni hematomas, pero si 1 caso de infección postoperatoria que hizo necesaria la retirada de la prótesis. No identificamos casos de dehiscencias de sutura, ulceración de la piel por efecto de la prótesis o exposición espontanea del implante. Realizamos BSGC en 3 pacientes por la presencia de microcalcificaciones subclínicas en la mamografía previa a la cirugía: 2 pacientes con antecedente de cáncer ginecológico (ovario o mama) asociado a una mutación en el gen BRCA 1 o 2 y 1 con positividad para mutación del BRCA 1 o 2 pero sin antecedentes tumorales. Una de estas 3 pacientes, con antecedente de cáncer ginecológico (mama) asociado a una mutación en el gen BRCA 2, desarrolló linfedema estadio IIa a los 6 meses de la cirugía (valoración según el estadiaje de los linfedemas de laInternational Society of Lymphology) (Tabla II).(2)
Tabla II. Complicaciones registradas en las pacientes de nuestro grupo de estudio
| Complicaciones | Casos | Implante (cc) |
Proyección | % |
|---|---|---|---|---|
| Infección postoperatoria | 1 | 330 | alta | 11 |
| Linfedema | 1 | 295 | alta | 11 |
| Necrosis parcial del complejo areola-pezón | 1 | 265 | alta | 11 |
| Fibrosis con falta de volumen medial | 9 | 100 | ||
| Pobre resultado estético percibido par la paciente | 2 | 22 | ||
| 295 | alta | |||
| Pobre resultado estético percibido por los cirujanos | 1 | 265 | alta | 11 |
Con respecto al cuestionario que llevamos a cabo entre las pacientes, ninguna de ellas presentó problemas para incorporarse a su trabajo pese a las complicaciones encontradas (Tabla I). Tres pacientes (33%) indicaron que el periodo postoperatorio fue doloroso y 6 (66%) que fue molesto y poco doloroso. Objetivamente, la media muestral del dolor/molestia en la escala análoga visual fue de 4.3. Cuando se les preguntó si estaban más tranquilas después de la cirugía respecto a la posibilidad latente de desarrollar un cáncer de mama, 9 pacientes (100%) respondieron afirmativamente. Ninguna necesitó ayuda psicológica y solo 2 (22%) indicaron que les gustaba más la apariencia de su pecho antes de la intervención. La media de satisfacción con el cumplimiento de las expectativas estéticas tras la intervención se situó en 7.4 en la escala análoga visual aplicada para esta pregunta.
Cuatro cirujanos del equipo valoraron a todas las pacientes en consultas de revisión mensuales realizadas independientemente a cada una de ellas. Según los datos recogidos, todas las pacientes se encontraban satisfechas con el objetivo de la intervención (reducción de riesgo de cáncer de mama), pero 2 indicaron que el resultado estético había sido inferior al esperado. Teniendo en cuenta las limitaciones estéticas y habiendo cumplido con el objetivo de la intervención (reducción de riesgo) la media de satisfacción de los cirujanos se situó en un 8.5 en la escala análoga visual. Los 4 cirujanos coincidieron en que 8 de las 9 pacientes el resultado estético en cuanto a cicatrices y forma de la mama era satisfactorio, pero en 1 de ellas el resultado estético era poco satisfactorio debido a un aspecto vacío de los polos mediales de la mama y una cicatriz en el complejo areola pezón, resultante de una necrosis parcial del complejo areola pezón que se había corregido mediante tatuaje.
La reincorporación a la vida diaria ocurrió alrededor de los 34 días (mínima de 27 y máxima de 45 días). Las pacientes jóvenes tardaron más tiempo en reanudar su vida habitual que las de mayor edad.
A continuación presentamos en imágenes y con leyenda explicativa 6 casos de nuestra muestra que consideramos podrían ilustrar claramente las diferentes indicaciones por las que llevamos a cabo una MIVAT, a saber:
-
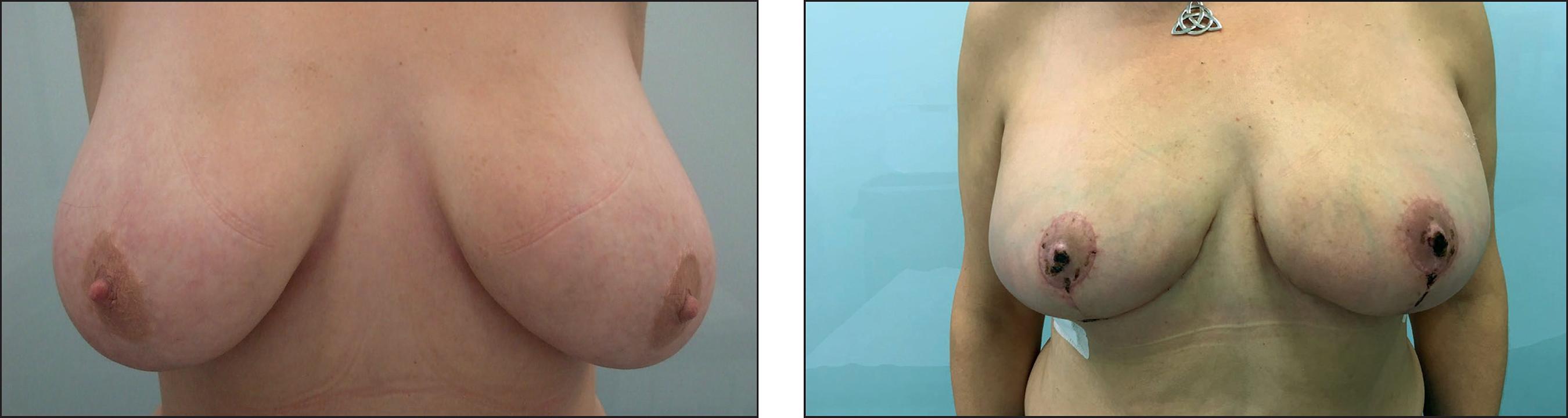
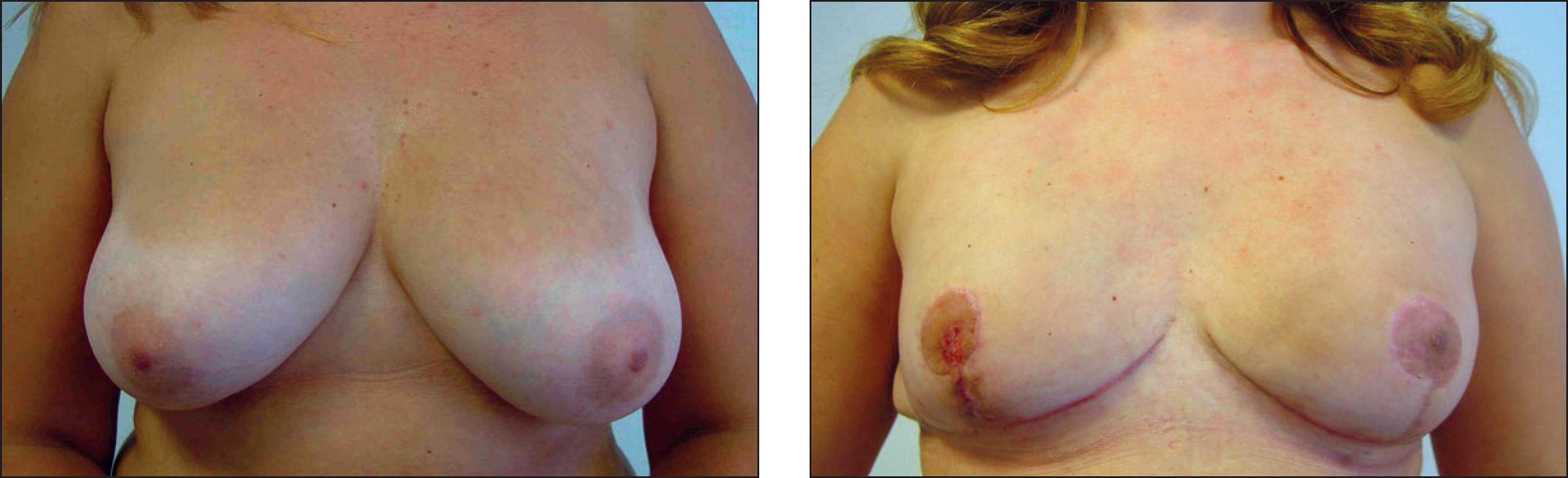
Caso 1. Carcinoma ductal infiltrantein situen mama derecha + BRCA 2 (Fig. 5).
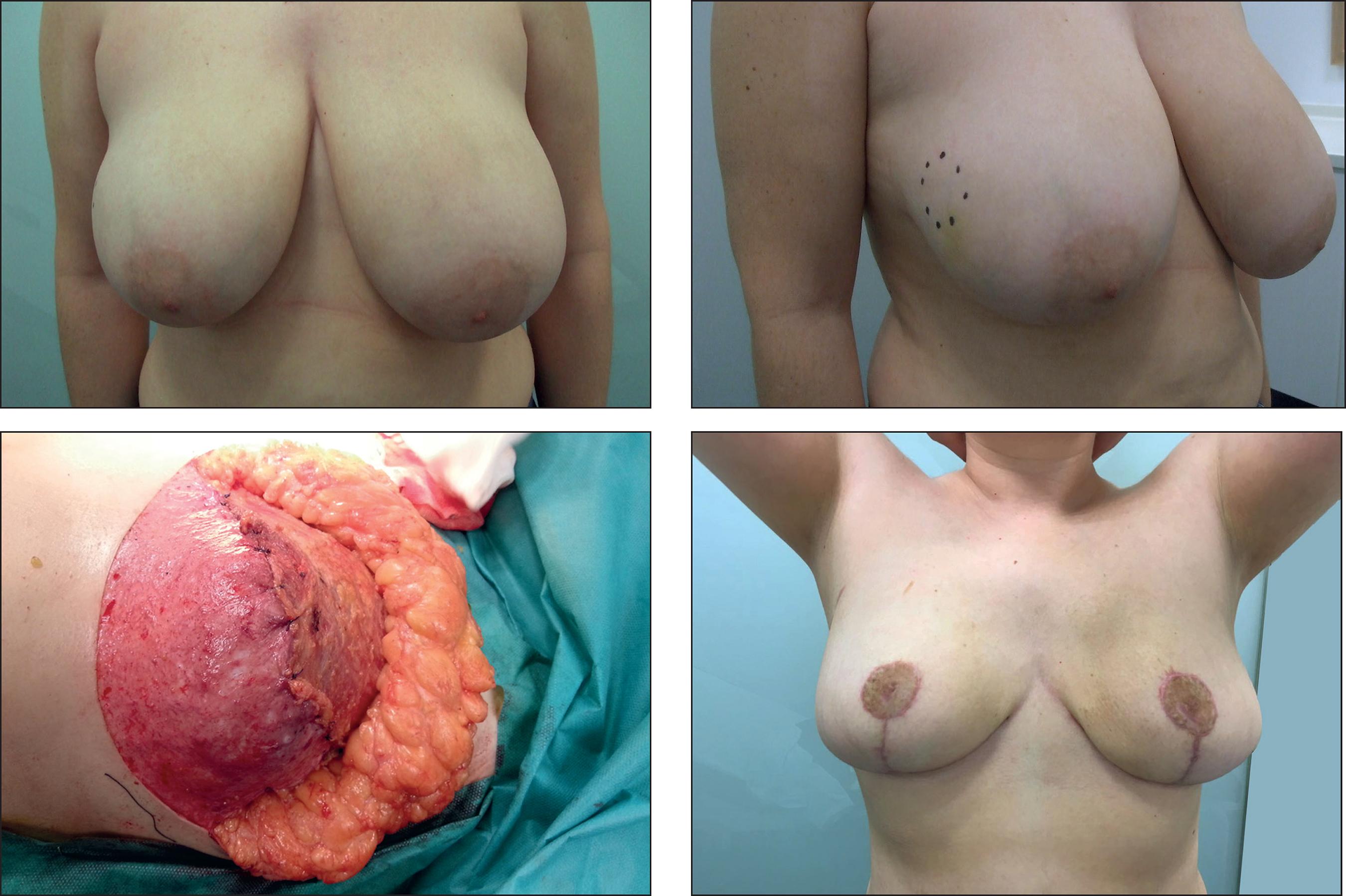
Figura 5. Caso 1. Indicación: carcinoma ductal infiltrante in situ en mama derecha + BRCA 2. Paciente de 45 años. A y B. Preoperatorio. El círculo punteado es la ubicación del tumor. C. Bolsillo introperatorio. D. Postoperatorio a las 3 semanas. Implante anatómico de gel cohesivo de silicona de 330 cc.
-
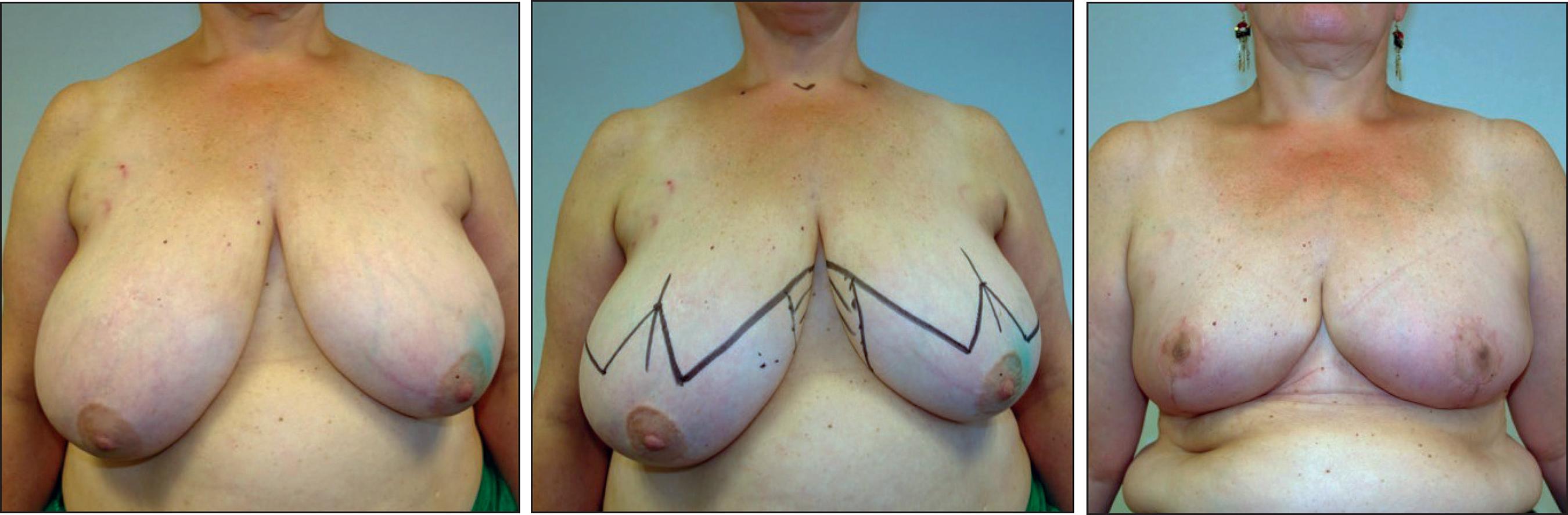
Caso 2.Antecedente de carcinoma seroso de ovario bilateral + BRACA 1 (Fig. 6).
-
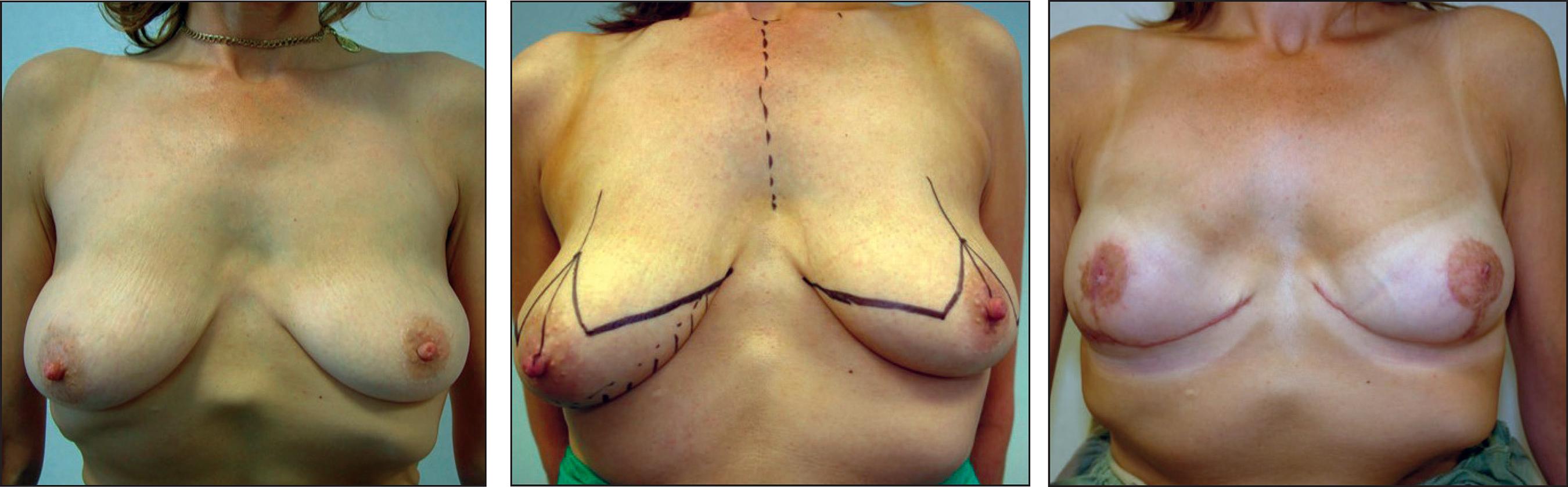
Caso 3.Carcinoma ductal infiltrantein situen mama izquierda + BRCA 2 (Fig. 7).
-
Caso 4.Cancerofobia (Fig. 8).
-
Caso 5.Antecedentes familiares (Fig. 9).
-
Caso 6.Síndrome de Li Fraumeni (Fig. 10).
Discusión
Las cirugías agresivas y mutilantes y/o que impliquen una gran distorsión en la imagen corporal como la mastectomía radical, asocian una importante carga psicológica para las pacientes que las padecen pudiendo desembocar en una depresión.(3)El cáncer de mama representa una patología con elevada incidencia a mundial, registrándose más de 1.676.000 nuevos casos al año, siendo el cáncer más frecuente entre las mujeres.(4)
Históricamente la finalidad del tratamiento ha sido oncológica radical, extendiendo las amputaciones desde el centro del tórax hasta la axila. Sin embargo, durante los últimos años el avance en el tratamiento quirúrgico conservador para el cáncer de mama con técnicas como la mastectomía subtotal, la cuadrantectomía, la oncoplastia o la linfadenectomía selectiva, etc., de la mano de nuevos tratamientos médicos adyuvantes como la quimioterapia, los medicamentos biológicos, la quimioterapia neoadyuvante, la radioterapia, etc., han permitido a la cirugía realizar tratamientos cada vez más conservadores, proporcionando a estas pacientes ciertas ventajas tanto físicas como psicológicas.
Un paso más adelante en la prevención del cáncer de mama es la realización de una mastectomía reductora de riesgo (MRR), mal llamada hasta hace unos años mastectomía profiláctica puesto que no evita la aparición del cáncer de mama sino que solo disminuye su riesgo, en pacientes sanas con alto riesgo de sufrir un cáncer o que habiendo sido curadas de uno deciden reducir el riesgo de presentarlo en la mama contralateral. Toth y col.(5)describen en sus trabajos la mastectomía ahorradora de piel y dan un paso más proponiendo la reconstrucción inmediata en el mismo tiempo quirúrgico, disminuyendo así el tiempo en que las pacientes pueden verse mutiladas con la repercusión psicológica que esto conlleva.
En nuestro trabajo presentamos la mastectomía ahorradora de piel tipo IV con injerto libre del complejo areola-pezón (MIVAP) como una técnica de fácil aprendizaje, capaz de proporcionar cobertura adecuada de la prótesis mamaria y que evita la necesidad de colocar materiales extraños añadidos como matrices dérmicas(6)o de realizar diversos colgajos músculares para optimizar el espesor del tejido sobre la prótesis.(7)Por otra parte, anclar el músculo pectoral al colgajo dermo-graso desepidermizado ubicado en el polo inferior, minimiza su retracción hacia arriba evitando la aparición de arrugas subcutáneas que pueden empeoran el resultado estético final.
Algunos estudios han encontrado que la mastectomía profiláctica de la mama sana podría mejorar la supervivencia.(8,9)La indicación más frecuente en nuestro trabajo fue el antecedente de cáncer ginecológico (ovario o mama) asociado a una mutación en el gen BRCA 1 o 2, seguida por la positividad para mutación del BRCA 1 o 2 sin antecedentes tumorales y la cancerofobia.
Indicaciones como el síndrome de Li-Fraumeni, donde una mutación en el gen supresor p53 aumenta la susceptibilidad de presentar tumores como cáncer de mama, sarcomas de partes blandas, tumores cerebrales y osteosarcomas,(10)son menos frecuentes. En este trabajo presentamos 1 caso en el que realizamos una MRR a una paciente con este síndrome.
En una serie de 18 casos en pacientes sometidas a mastectomía ahorradora de piel con reconstrucción inmediata utilizando implantes de silicona subpectorales con una técnica similar a la utilizada por nosotros, Della Rovere y col. mencionan aproximadamente un 5% de complicaciones como infección o hematoma y un porcentaje similar de pobre resultado cosmético a largo plazo producto de fibrosis en el polo inferior de la mama.(11)En nuestra muestra, el pobre resultado estético se detectó en 2 pacientes (22%). Según estos autores el principal problema que tienen las mastectomías clásicas, en las que no se da importancia al espesor del tejido entre el implante y la piel, viene dado por la falta de cobertura en el polo ínfero-medial. Por esta razón ellos prefieren, al igual que nosotros, la colocación de los implantes mamarios en el plano subpectoral, lo que sin duda mejora la cobertura.
Ninguna de nuestras pacientes presentó hematoma ni dehiscencia, pero en 1 caso fue necesario retirar una de las prótesis por una infección tardía de la zona quirúrgica. La fibrosis y la consiguiente retracción tisular cicatricial y pérdida de volumen en el polo ínfero-medial de la mama se presentó en diferentes grados. En todas ellas encontramos pérdida del espesor tisular secundario a fibrosis cicatricial, dando una imagen ancha al escote que a la vista impresiona como de una separación aumentada de las mamas.
El músculo se mantuvo en su sitio disminuyendo la tendencia a su retracción cefálica gracias a la sutura con el colgajo dermograso y en ningún caso se retrajo, proporcionando una cobertura correcta al polo superior de la mama. Creemos que la fibrosis inferior y el ensanchamiento del escote se debe a que el bolsillo protésico cede a la mecánica del tórax y al movimiento de los brazos, tendiendo a lateralizar los implantes.
Bajo la piel radiada existe mayor riesgo de infección e intolerancia a la prótesis,(12)teniendo a veces que retirarlas para sustituirlas por otras o por tejido autólogo. Todas las pacientes de nuestra muestra toleraron adecuadamente las prótesis implantadas y ninguna había recibido radioterapia previa. Una paciente presentó linfedema grado IIa en relación con la BSGC.
Un 30% de necrosis del CAP o del colgajo cutáneo es para Santanelli y col. el talón de Aquiles de este procedimiento.(13)Esto produce una pérdida de volumen en el polo inferior de la mama y del CAP con un claro empobrecimiento del resultado estético. Solo 1 de nuestras pacientes presentó necrosis parcial del CAP que corregimos mediante la realización de un tatuaje definitivo con un color similar al resto de la areola; la paciente quedó satisfecha con el resultado logrado. Para disminuir el riesgo de presentar esta complicación, Wapnir y col. han descrito una técnica intraoperatoria en la que utilizan verde de indocianina para valorar mediante una cámara infrarroja computarizada el patrón vascular de la mama, lo que les permite controlar la disección durante toda la intervención, disminuyendo el riesgo de necrosis del CAP(14)y/o del colgajo cutáneo. En nuestras pacientes no hemos utilizado técnicas como esta aunque creemos que podría resultar válido su empleo a la hora de evitar las complicaciones, claro está que a expensas de aumentar el coste de la intervención y el tiempo de quirófano. Hay que resaltar que este procedimiento solo se podría realizar en pacientes totalmente sanas y/o que no tengan ninguna indicación de extirpación del CAP por su proximidad con un tumor.
La MIVAP resulta especialmente útil en mujeres con glándulas mamarias grandes y la idea de realizar una MRR. Seis de las 9 pacientes de nuestra muestra deseaban además de la reducción del riesgo una reducción del tamaño de sus mamas, por lo que se beneficiaron de la mastectomía profiláctica y de la reducción y pexia mamarias.
Consideramos que, si se siguen adecuadamente los pasos de esta técnica, los resultados son reproducibles y la herida quirúrgica fácilmente cierra sin tensión y con una adecuada cobertura del implante por tejidos autólogos. De Vita y col. consideran este procedimiento como la técnica más adecuada para la reducción de riesgo de padecer cáncer mamario en pacientes con macromastia.(15)La MIVAP permite realizar la mastectomía reductora de riesgo, la reducción y la reconstrucción mamaria en un solo tiempo quirúrgico, cumpliendo adecuadamente con los 3 objetivos cuyo beneficio redunda en una menor cantidad de actos quirúrgicos y/o anestésicos, menos periodos de inactividad laboral y mejor recuperación de los tejidos tras una única intervención.(16)
Conclusiones
La MIVAP es una alternativa viable para proponer a las pacientes con mamas de tamaño moderado a grande que desean la realización de una MRR, y debe ser tenida en cuenta dentro del arsenal terapéutico en pacientes con alto riesgo de desarrollar un cáncer de mama.
Realizar una mastectomía reductora de riesgo mediante la técnica descrita en este trabajo permite obtener un resultado satisfactorio en la mayoría de las pacientes siempre y cuando la indicación sea correcta. En general la valoración subjetiva y objetiva de los resultados globales de la técnica es percibida como favorable tanto por parte del equipo médico como de las pacientes.
La curva de aprendizaje de la MIVAP es corta. Tiene la ventaja de ser fiable y reproducible con resultados similares si se ejecuta meticulosamente. Solo es necesario un tiempo quirúrgico para la mastectomía y la reconstrucción, evitando así las complicaciones de un expansor cutáneo y la necesidad de una segunda intervención para su cambio por una prótesis definitiva.