Introducción
El proceso de integración de los injertos se produce en 3 fases. A) Inbibición plasmática, proceso que dura 48 a 72 horas en el cual la nutrición del injerto de piel va a depender de la absorción del exudado del lecho receptor. B) Inoculación de vasos sanguíneos, donde hay formación de puentes de fibrina entre el injerto y el lecho receptor que posteriormente formarán las microanastomosis de los vasos capilares. C) Revascularización, en la que se produce un crecimiento de nuevos vasos sanguíneos del lecho receptor que se orientan hacia el injerto; estos, junto con las microanastomosis vasculares existentes entre el injerto y el lecho receptor, van a formar la circulación definitiva del injerto.(1)
Las causas más frecuentes de pérdida de un injerto de piel son: un lecho receptor inadecuado, hematomas, seromas, infección y cizallamiento entre el injerto y el lecho receptor que llevan a la pérdida de contacto entre las superficies con la consecuente rotura de la malla de fibrina y las microanastomosis vasculares en formación. Es importante que el cizallamiento entre el injerto y el lecho receptor no se presente, por este motivo se debe garantizar la adherencia del injerto al lecho receptor durante los primeros 5 días, ya que este es el periodo más importante para la nutrición e integración del injerto de piel.(2)
El tipo de curación oclusiva más frecuentemente utilizado se realiza colocando un apósito humectado con algún tipo de petrolato sobre el injerto cubierto con un apósito y vendaje con algo de presión sobre el área receptora, con el objetivo de que el injerto se adhiera al lecho receptor y permanezca fijo y aislado del medio externo. Este tipo de curación es conocida como apósito de Blair-Brown.(3) Sin embargo, este procedimiento no garantiza una adherencia absoluta que favorezca la integración.
La presión negativa, concepto muy utilizado hoy en día por la Biomedicina en múltiples dispositivos médicos, hace referencia a todos aquellos valores que están por debajo de los de la presión atmosférica, entendida esta última como la unidad de superficie que ejerce el aire que forma la atmósfera sobre la superficie terrestre, y que medida a nivel del mar equivale a 760 mmHg.(4,5) Su uso en la práctica médica se remonta a 1928 cuando Drinker-Sahw la utilizaron en el primer respirador eléctrico a presión negativa, familiarmente conocido como pulmón de acero.(6)
En 1952 Arthur Raffl(7) observa las complicaciones que se presentaban en los colgajos de piel en pacientes a las que les había realizado mastectomía radical, como la movilidad de los tejidos, la colección de fluidos y la infección. Raffl comienza a utilizar la presión negativa en pacientes a las que al final de la mastectomía radical realizaba una incisión en piel en el colgajo inferior y colocaba un catéter numero 16 French, con tres orificios cerca de su punta, que fijaba con sutura para evitar las fugas. Obtenía la presión negativa a través del catéter con succión en el quirófano, y cuando los colgajos de piel estaban ajustados contra la axila y la caja torácica, en la habitación de la paciente, conectaba el catéter nuevamente a un sistema de succión. Normalmente drenaba 300 a 400 cc. sero-sanguinolentos en 48 horas. A las 72 horas retiraba el catéter, disminuyendo de esta forma las complicaciones sobre este tipo de colgajos.(8)
En 1993, los cirujanos plásticos Morykwas y Argenta patentaron un dispositivo para aplicar presión subatmosférica en el manejo de heridas. Publicaron su experiencia clínica con un sistema de presión negativa que emplearon inicialmente en el tratamiento de úlceras por presión y pie diabético. Esta técnica implicaba colocar un apósito de espuma de celda abierta en la cavidad de la herida y una presión subatmosférica controlada de 125 mmHg de forma continua. Trataron de esta forma 300 heridas: 175 crónicas, 94 subagudas y 31 agudas. Doscientas noventa y seis heridas respondieron favorablemente al tratamiento con presión subatmosférica, con una mayor tasa de formación de tejido de granulación.(9)
El objetivo principal de la curación oclusiva con el sistema de presión negativa (SPN) es proporcionar una presión negativa constante sobre la superficie del injerto, facilitando la adherencia del injerto al lecho receptor y minimizando así las fuerzas de cizallamiento en el lecho del injerto.(10) Además, al aplicar presión subatmosférica se facilita el proceso de cicatrización y se disminuye la microflora bacteriana, y al aumentar la tensión de oxígeno se optimiza el tiempo de integración de los injertos,(11-13) lo que además ayuda a disminuir los tiempos de hospitalización.(14)
Se conocen varias explicaciones de por qué la presión negativa favorece el proceso de integración de un injerto, entre las que se mencionan:
Disminución del líquido intersticial: se favorece el flujo sanguíneo así como el aporte de oxígeno a la herida.(15)
Perfusión tisular: el aumento de la perfusión favorece el flujo sanguíneo en los colgajos y principalmente en los injertos de piel, optimizando el proceso de integración.(16)
Contracción de la herida: por medio de la formación de la malla de colágeno se favorece mecánicamente la aproximación.(17)
Estrés mecánico: se aumenta la vascularización de los tejidos, la migración y proliferación de los fibroblastos, acelerando el proceso de reepitelización.(18)
Teniendo en cuenta lo anterior queremos presentar nuestra experiencia clínica con la utilización de un método que ofrezca mayor seguridad en la fijación e integración del injerto, el SPN como curación oclusiva, y evaluar en términos de porcentaje la integración del injerto de piel de espesor parcial al lecho receptor a través de una metodología digital informática.
Material y método
Desarrollamos nuestra investigación en base a un estudio descriptivo retrospectivo. Tomamos como muestra a todos los pacientes con defectos de cobertura que presentaban un lecho receptor con tejido de granulación óptimo para realizar injerto de piel de espesor parcial en el Servicio de Cirugía Plástica de la Clínica Reina Catalina sede Barranquilla y Baranoa en Colombia, desde el 1 de enero de 2019 hasta el 31 de diciembre del mismo año.
Llevamos a cabo una búsqueda en la base de datos sistematizada del Servicio, empleando como criterios de inclusión y exclusión los siguientes:
Criterios de inclusión: hombres y mujeres de cualquier edad a quienes se les realizó injerto de piel parcial y cura oclusiva con SPN en la Clínica Reina Catalina sede Barranquilla y sede Baranoa (Colombia).
Criterios de exclusión: pacientes con defectos de cobertura en cara.
El SPN utilizado fue The WoundPro® (Pensar Medical, LLC, Norco, CA).
Los datos fueron ingresados en Microsoft Excel y analizados en el programa SPSS para Windows (Versión 23). La recolección de datos incluyó las variables edad, sexo, etiología del defecto de cobertura, área anatómica, tamaño en cm2 del defecto, porcentaje de integración del injerto, porcentaje de pérdida del injerto y días de curación que requirió el paciente después de retirado el SPN hasta la curación total.
Realizamos un estudio analítico descriptivo retrospectivo de la población para determinar la distribución de frecuencias (medidas de tendencia central y de dispersión para variables cuantitativas) y frecuencias relativas (para variables cualitativas). Presentamos los datos en texto, tablas, cuadros y gráficas para resaltar la información relevante de la investigación. Las fotografías de los pacientes que mostramos fueron previamente autorizadas por el paciente y/o acudiente con firma de un consentimiento informado y avalado por el Comité de Ética Médica de la Clínica Reina Catalina, sede Barranquilla, Colombia.
Una vez colocado el SPN lo mantuvimos durante 6 días en todos los casos, para luego retirarlo y proceder a la toma de imagen fotográfica. Posteriormente, cuantificamos la integración de los injertos de forma digital a través de un programa de procesamiento de imágenes (ImageJ?) que calcula el área total injertada en la fotografía, dando como resultado un valor en pixeles; en esta misma fotografía se marca el área de no integración arrojando otro valor en pixeles; luego estos 2 valores se utilizan en el complemento informático desarrollado por el Área de Sistemas de la Clínica, que consiste en una calculadora de porcentajes programada en la plataforma Java a través de herencia de clases, lo que permite realizar operaciones básicas (suma, resta, multiplicación y división) y combinarlas, en este caso mediante una regla de tres, para obtener un resultado matemático que permita, de manera más objetiva, evaluar la integración del injerto.
El protocolo empleado en cada paciente fue el siguiente:
1. Preoperatorio. Preparamos el lecho receptor realizando desbridamientos quirúrgicos, colocando el SPN para promover la formación de tejido de granulación, y una vez obtenido, realizamos una toma de cultivo del tejido. Se considera positivo cuando el resultado es mayor de 10*5 unidades formadoras de colonias por gramo de tejido. Procedemos a interconsulta por Infectología para manejo guiado según antibiograma.
Una vez cumplidas las 72 horas de tratamiento antibiótico, llevamos al paciente a un nuevo desbridamiento quirúrgico con toma de un nuevo cultivo de tejido; si el resultado es negativo, procedemos a realizar el injerto de piel.
2. Intraoperatorio. Preparamos el lecho receptor, tomamos fotografía preoperatoria, tomamos el injerto de piel parcial con dermatomo eléctrico (Padgett? Modelo B, Integra LifeSciences, Princeton, NJ). Tras la toma, realizamos fenestraciones en el injerto con hoja de bisturí número 15 o pasamos el injerto de piel parcial por el mallador de injertos para expandirlo y evitar la formación de hematomas y seromas entre el injerto y el lecho receptor. Colocamos el injerto sobre el área receptora y lo fijamos con sutura no absorbible; tomamos fotografía posoperatoria y colocamos el SPN: primero ponemos sobre el injerto una gasa parafinada que contiene además gluconato de clorhexidina, a continuación una espuma hidrófoba y fijamos con un adhesivo para evitar las fugas. Configuramos el sistema a una presión continua de 70 mmHg (Fig. 1).

Figura 1. Mujer de 6 años de edad con quemadura por líquido hirviente del 6% de la superficie corporal total. A. Defecto de cobertura en región genital y cara medial de ambos muslos. B. Intraoperatorio: injerto de piel parcial fijado al lecho receptor con sutura no absorbible. C. Intraoperatorio: aplicación de apósitos que contienen parafina y un antiséptico. D. Intraoperatorio: aplicación de la esponja de poliuretano hidrófobo sobre el injerto protegido con en el apósito, que se fija finalmente con una película adhesiva y se deja en función continua a presión de 70 mmHG.
En el área donante hacemos cura cerrada con apósito de plata.
3. Posoperatorio. Practicamos la primera cura del injerto al sexto día en todos los casos. Tomamos fotografía del injerto y lo dejamos cubierto con un apósito delgado humectado con algún tipo de petrolato.
La fotografía se ingresa al programa ImageJ?, que toma las medidas correspondientes al área integrada y al área no integrada. Posteriormente, estos valores son introducidos en el aplicativo Java que realiza un cálculo matemático para obtener el resultado porcentual del área integrada.
Tras este proceso indicamos el alta hospitalaria del paciente, para continuar el manejo de forma ambulatoria con el programa de clínica de heridas cada 72 horas y control con el especialista a los 8 días y posterior según evolución.
Resultados
Revisamos 70 pacientes y un total de 90 injertos de piel de espesor parcial. El sexo masculino fue el predominante, con un total de 42 casos (60%) con una edad promedio de 41.8 años (mínima de 6 años y máxima de 85 años). El grupo etario de 51 a 60 años presentó el mayor número de pacientes injertados con 14 casos (Grafico 1).
La etiología más frecuente fue la quemadura, con el 34% de los casos (n=24), debido a que en nuestros centros médicos contamos con una unidad especial para el manejo de pacientes quemados, seguida por las ulceras varicosas con el 24% (n=17) (Gráfico 2).
El promedio del tamaño de los defectos injertados fue de 132 cm2 (mínima de 12 cm2 y máxima de 450 cm2).
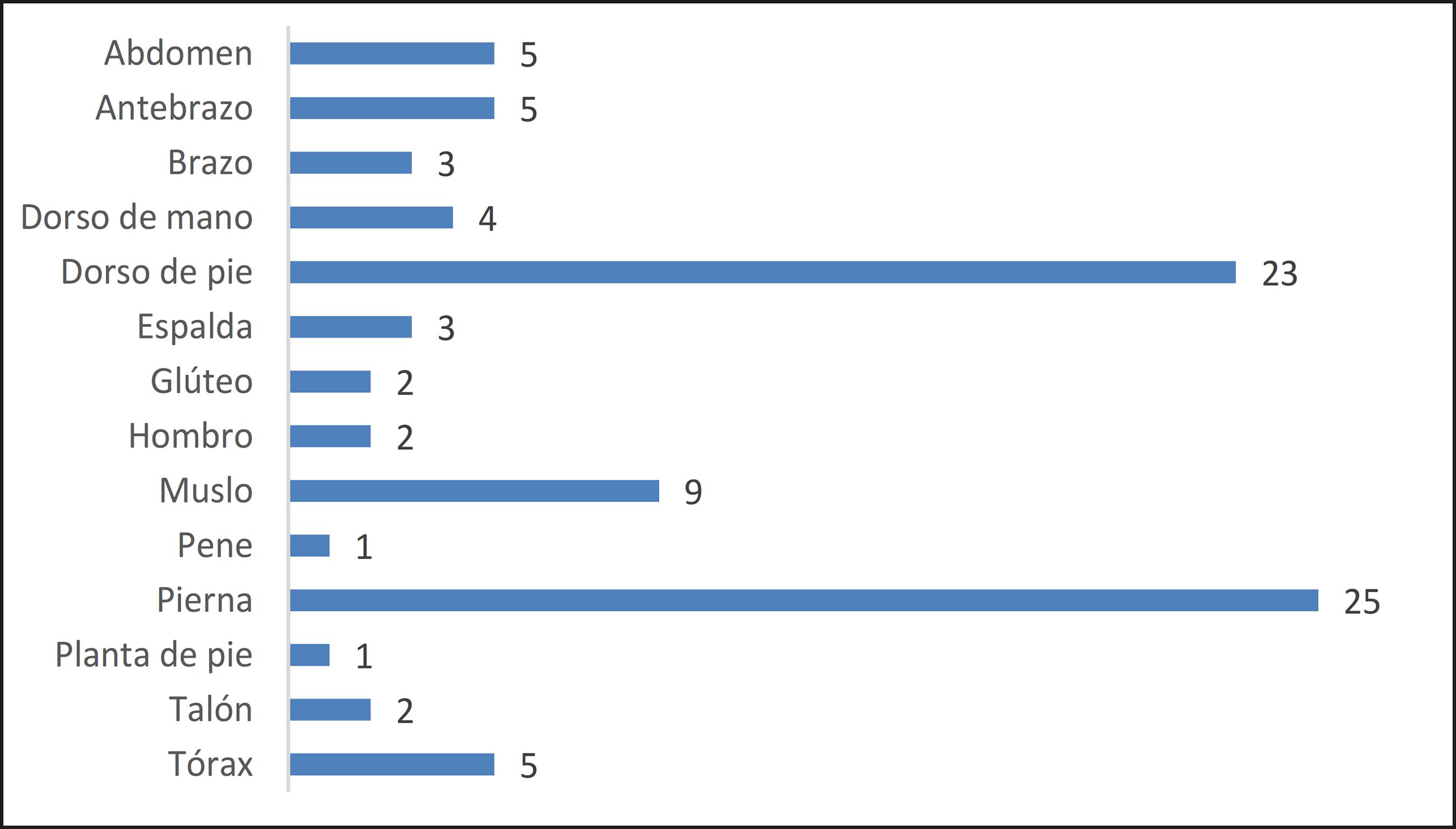
Sobre el total de 90 injertos realizados, el área más tratada fue la pierna con 25 injertos (27.7% de los injertos realizados), seguida del dorso del pie con 23 (25.5%) (Gráfico 3).
Evaluamos la integracion de los injertos al 6º dia, cuando realizamos la primera cura del injerto, momento en que tomamos la fotografia. Empleamos sobre la imagen el software informatico ImageJ®con el cual el cirujano selecciona con el cursor del ratón el área injertada y el área no integrada, obteniendo el área en pixeles de lo seleccionado; luego en la calculadora programada al efecto obtenemos el resultado matemático para evaluar la integración del injerto, tal y como mostramos en las Figuras 2 y 3.

Figura 2. Varón de 55 años de edad con defecto de cobertura en miembro inferior izquierdo del 4.5% de superficie corporal total secundario a quemadura por fuego. A. Área cruenta con tejido de granulación en buenas condiciones. B. Posoperatorio inmediato antes de la colocación del SPN. C. Primera cura al 6º día; área total injertada (selección amarilla con el programa de procesamiento de imágenes Image J). D. Área no integrada (selección amarilla con el programa de procesamiento de imágenes Image J®). E. Calculadora con porcentajes calculados.

Figura 3. Varón de 55 años de edad con defecto de cobertura en dorso de pie izquierdo secundario a quemadura con liquido hirviente del 1% de superficie corporal total. A. Defecto intraoperatorio. B. Injerto de piel parcial con fenestraciones. C. Primera cura al 6º día; área total injertada seleccionada con el programa de procesamiento de imágenes Image J®. D. Calculadora con porcentajes calculados. E. Última cura a las 2 semanas de retirar el sistema de presión negativa.
Nuestros resultados muestran que el promedio de integración al 6º día fue del 98.4% de la superficie del injerto. En más de 80 (88.8%) injertos de piel parcial, observamos una integración que osciló entre el 81 y el 100 %, tal y como presentamos en el Gráfico 4.

Gráfico 4. Número de casos según el porcentaje de integración logrado con el sistema de presión negativa
Además de tener un beneficio en la integración del injerto de piel, el SPN también permite mantener el injerto de piel aislado, disminuyendo así la infección. En el seguimiento de nuestros pacientes en la consulta externa, a 30 días no evidenciamos ningún proceso infeccioso en el área injertada.
La curación completa después de retirado el SPN tuvo una media de 20.32 días (mínimo de 14 días y máximo de 35 días).
Discusión
El SPN se ha presentado como una alternativa para el manejo de heridas agudas o crónicas de distinta etiología.
En nuestra aplicación del SPN a la oclusión de injertos, aprovechamos una de las ventajas que aporta que es la succión que actúa a través de la esponja de poliuretano hidrófoba que se moldea y adapta perfectamente a la herida, eliminando el espacio muerto debajo de ella y creando una adherencia uniforme entre el tejido circundante y la herida.(20) Esto permite eliminar la formación de hematomas entre el área receptora y el injerto, tal y como pudimos observar en nuestro estudio donde en los casos informados no se presentó esta complicación en ningún paciente.
Hasta donde hemos podido revisar empleando una búsqueda informatizada en las bases de datos Medline, PubMed y Scielo, utilizando las palabras clave injerto de piel (skin graft), terapia de presión negativa (negative pressure therapy), apósito de presión negativa (negative pressure dressing), herida (wound), quemaduras (burns), exiten muchos artículos en los que se describe el éxito del SPN en el manejo de heridas, pero no se encuentra mucha bibliografía disponible sobre su uso como curación oclusiva en los de injertos de piel parcial.
Blackburn y col., en 1998, son de los primeros en utilizar el SPN como método para curación de injertos de piel parcial, reportando 3 casos en los que mencionan que los injertos se integraron en más del 95 % del área injertada y el SPN fue retirado al tercer día.(21) Nuestra casuística durante 1 año de estudio fue de 90 injertos de piel de espesor parcial manejados con SPN como curación oclusiva.
En el 2002, Scherer y col. publican una serie de 61 pacientes en los que utilizaron el SPN para la curación de injerto de piel parcial comparando 2 grupos, uno en el que utilizaron el SPN para la oclusión del injerto y otro en el que realizaron cura con apósito tipo Blair-Brown, y retirando el sistema al 4º día. En nuestra investigación, siempre retiramos el sistema al 6º día. Al igual que en nuestro estudio, en el de Scherer y col. la etiología predominante del defecto de cobertura fue la quemadura. Ellos observaron que los pacientes en los que no utilizaron el SPN como método de curación oclusivo requirieron reinvención de injerto en el 19% (n=3) frente al 3% en el grupo con presión negativa (n=1), concluyendo que el uso del SPN tenía menor requerimiento de reintervención de injerto de piel.(22)
El uso del SPN para la cura oclusiva de los injertos de piel de espesor parcial puede utilizarse en heridas de diferentes etiologías. En 2014, el grupo de investigación de Kamolz y col.(23) reporta el uso de este método en pacientes quemados con extensión de más del 25% de superficie corporal total a quienes realizaron injertos de piel. Su muestra fue de 37 pacientes en los que utilizaron el SPN para la cura oclusiva del injerto de piel parcial, aplicando presión continua entre 75 a 125 mmHg. En nuestro estudio, en todos los casos utilizamos la misma presión de 70 mmHg. Kamolz y col. retiran el SPN al 4º día y observan tasas de integración de más del 95% en los injertos realizados, sin mencionar el método de cuantificación de la integración. Además, refieren las ventajas del SPN sobre todo en áreas de superficie irregular, ya que permite mayor adherencia del injerto al lecho receptor y disminuye notoriamente la fuerza de cizallamiento que se puede producir con curas convencionales. En nuestro estudio no solo utilizamos el SPN en pacientes con heridas por quemaduras (n=24), sino también en pacientes con úlceras varicosas (n=17), trauma (n=12), pie diabético (n=11) y algunos casos de fascitis necrotizante (n=6).
En nuestro estudio, el tamaño de los defectos fue variable, con una media de defecto de 133.48 cm2 (12 cm2 - 450 cm2). En Sídney (Australia) Moisidis y col. en 2004(24) reportan el uso del SPN en 22 pacientes evaluando 2 grupos, uno control en el que se realizó cura con apósito y otro con SPN en el que se realizaron injertos de piel parcial en áreas mayores de 25 cm2. La presión que utilizaron fue continua a 100 mmHg y el SPN se mantuvo durante 5 días. La integración del injerto se registró tanto cuantitativamente (expresada como porcentaje de epitelialización registrada por inspección general) como cualitativamente (calificada como mala, satisfactoria, buena o excelente), a diferencia de nuestro estudio en el que la evaluación de la integración del injerto la realizamos al 6º día por medio digital, obteniendo así un resultado más objetivo de la integración del injerto que fue de un promedio de 98.4% gracias a la medición digital del área integrada del injerto. A diferencia de estudios anteriormente mencionados donde el promedio de integración del injerto fue del 95% utilizando el SPN, en nuestro estudio tenemos un porcentaje más alto de integración, sin complicaciones asociadas, y con una media de curación completa de 20.32 días.
La utilización de tecnología aplicada a la Medicina es cada vez más frecuente. Desde que en el año 2018 se inició la utilización del SPN para la curación oclusiva de los injertos de piel parcial en la Clínica Reina Catalina de Barranquilla, Colombia, encontramos resultados subjetivos de mejor integración del injerto de piel en estos pacientes, por lo que iniciamos la investigación en la literatura que nos llevó a encontrar que los artículos publicados siempre mencionan la valoración de la integración del injerto de forma subjetiva, por medio de la inspección de un médico. Así nació la idea de reemplazar la medición que hace el ojo humano por una computadora, empleando un sistema de imágenes y desarrollando una calculadora de porcentajes para obtener un resultado matemático que nos permitiera, de manera más objetiva, evaluar la integración del injerto.
Creemos que la metodología desarrollada y aplicada en el presente estudio permitirá realizar investigaciones futuras, sabiendo ya con datos demostrados que el SPN es un método que permite una mayor integración de los injertos y la epitelización de los defectos tratados, logrando una más rápida recuperación de los pacientes.
Conclusiones
Presentamos una metodología de cuantificación digital mediante sistemas informáticos del porcentaje de integración del injerto de piel parcial empleando un SPN como método de curación oclusiva de los injertos
En nuestra experiencia, logramos un promedio del 98.4% en la integración de los injertos a los 6 días de posoperatorio, lo cual se traduce en un menor tiempo de hospitalización y en la no necesidad de procedimientos quirúrgicos complementarios, lo que lo convierte en un método costo-efectivo. Es importante hacer notar además, que esa tasa de éxito es independiente del área corporal injertada, grupo etario, extensión del defecto a cubrir y de la etiología de la lesión.
Todo esto creemos que convierte al SPN en una herramienta efectiva para el cirujano en todos los escenarios de manejo de heridas con injerto de piel de espesor parcial, además de ser un método útil, seguro y reproducible.