Introducción
La piel es el órgano más grande del cuerpo, posee una superficie aproximada de 2 m2 y, aproximadamente, un 30% de su composición es agua.(1) Posee numerosas e importantes funciones como la protección frente a factores externos, la regulación térmica, la hidratación y la percepción de estímulos.(2) A nivel histológico, la piel está compuesta por la epidermis, la dermis y la hipodermis.(3) A su vez, la epidermis se divide en estrato basal, estrato espinoso de Malpighi, estrato granuloso y estrato córneo. En cada estrato están presentes queratinocitos en distintos estadios evolutivos que acabarán convirtiéndose en cornecitos y desprendiéndose, completando así, el proceso de autorrenovación cutánea.(4) Además de queratinocitos, en la epidermis hay meloncitos, encargados de la síntesis de melanina; células de Merkel, con funciones sensitivas y células de Langerhans cuya función es la presentación de antígenos formando parte del sistema mononuclear fagocítico.(5) La epidermis descansa sobre la membrana basal y subyacente a la misma, se dispone la dermis que, a su vez, se divide en dermis papilar y dermis reticular.(6) La dermis está compuesta por matriz extracelular, es decir, por una red tridimensional formada por proteínas y otras moléculas que rodean y sostienen las células aportando estructura a la piel. Entre las fibras de esta matriz se encuentra una población celular intrínseca fibroblástica en un 90%, correspondiendo el 10% restante,a la población celular extrínseca. Los fibroblastos tienen como función principal la síntesis de componentes de la matriz extracelular como las fibras de colágeno y las fibras elásticas y contribuyen, de manera importante, al cierre de heridas y a la generación de cicatrices.(7) Por otro lado, la hipodermis está formada principalmente por tejido adiposo y su funciones son el aislamiento térmico y la reserva energética.(8)
La Ingeniería Tisular es la rama de la Bioingeniería encargada de la aplicación de los principios y métodos de la ingeniería a las ciencias de la vida.(7) Los pilares sobre los cuales se configura esta disciplina son las células, los factores de crecimiento y los materiales biocompatibles que forman el constructo (Fig. 1). Su objetivo es la combinación de los tres pilares para obtener un tejido artificial que permita la reparación o el reemplazo de un órgano dañado o inexistente.
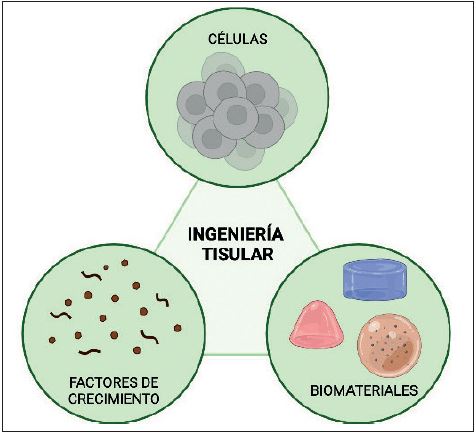
Figura 1. Elementos fundamentales de la Ingeniería Tisular (elaborado en la aplicación en línea Biorender.com).
Durante las últimas décadas, el auge de la Ingeniería Tisular ha conducido a un aumento del interés por la generación de tejidos artificiales. Se ha propuesto la piel artificial como tratamiento de algunas afecciones cutáneas como las quemaduras de gran extensión o los tumores cutáneos. Actualmente, la generación de piel artificial requiere la obtención de una muestra de piel del paciente y de un largo procedimiento de expansión celular(9) que genera una inevitable demora terapéutica conduciendo a un incremento de la morbimortalidad de los pacientes con quemaduras de gran extensión. Por este motivo, la búsqueda de métodos que aceleren este procedimiento es de gran interés.
Una de las estrategias con gran potencial clínico es el uso de secretoma derivado de células madre mesenquimales (MSC). Se trata del conjunto de moléculas liberadas por las MSC al espacio extracelular incluyendo esencialmente factores de crecimiento, citoquinas, proteasas y factores de transcripción involucrados en procesos de adhesión, migración, proliferación y diferenciación celular.(10) Recientes hallazgos han demostrado que el potencial regenerativo de las MSC probablemente esté asociado a los factores de crecimiento que liberan, siendo este efecto similar al uso de Terapias Celulares.(11)
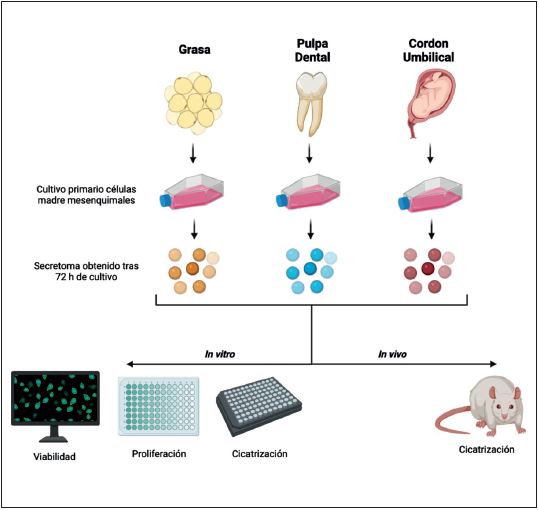
El presente estudio tiene como objetivo evaluar el potencial de regeneración del secretoma obtenido de tres tipos celulares: MSC del tejido adiposo, MSC de la pulpa dental y MSC de la gelatina de Wharton del cordón umbilical.
Material y método
Aislamiento y cultivo de células madre mesenquimales humanas (MSC)
Para la generación de cultivos celulares primarios de células madre mesenquimales humanas, se obtuvieron muestras correspondientes a tres donantes diferentes (n=3). El tejido adiposo se utilizó para obtener células madre mesenquimales derivadas del tejido adiposo (ADSC), las células madre mesenquimales de la pulpa dental (DPSC) se obtuvieron de dientes humanos y los cordones umbilicales se usaron para obtener células madre mesenquimales de la gelatina de Wharton (WJSC).
Todas las muestras se procesaron utilizando técnicas de digestión enzimática en una solución de 2 mg/mL de colagenasa tipo I de Clostridium histolyticum (Gibco-Thermo Fisher Scientific, Waltham, MA, EE.UU.) durante 6 horas a 37ºC. Las células madre mesenquimales humanas aisladas se recogieron mediante un proceso de centrifugación, quedando estas en el pellet. Tanto las ADSC como las DPSC se cultivaron en Dulbecco Modified Eagle´s Medium (DMEM) (Sigma-Aldrich/Merck, Burlington, MA, EE.UU.) completado con un 10% de suero bovino fetal (SBF) y un 1% de antibióticos y antimicóticos (100 U/mL de penicilina G, 100 mg/mL de estreptomicina y 0.25 mg/mL de anfotericina B) (Sigma-Aldrich/Merck). Por otro lado, las WJSC se cultivaron en medio Amniomax-C100 (Gibco-Thermo Fisher Scientific). En todos los casos, las células se mantuvieron a condiciones estándar de cultivo celular a 37ºC en un incubador húmedo (Esco Lifesciences Group Ltd., Singapur, Singapur) con un 5% de CO2. Una vez las células alcanzaron un 70% de confluencia fueron tripsinizadas usando tripsina-ácido etilendiaminotetracético (EDTA) al 0,25% (Sigma-Aldrich/Merck).
Aislamiento y cultivo de fibroblastos de dermis de piel humana
Los cultivos celulares primarios de fibroblastos de piel humana se obtuvieron a partir de pequeñas biopsias de piel de donantes sanos sometidos a una cirugía menor con anestesia local. Brevemente, los fibroblastos humanos fueron obtenidos mediante digestión enzimática del estroma de las muestras de piel utilizando una solución de 2 mg/mL de colagenasa tipo I de Clostridium histolyticum (Gibco-Thermo Fisher Scientific) a 37ºC durante 6 horas con agitación. Los fibroblastos aislados se cultivaron en DMEM (Sigma-Aldrich/Merck) suplementado con un 10% de SBF y 1% de antibióticos y antimicóticos (ambos de Sigma-Aldrich/Merck) como se ha explicado en el apartado anterior. Las células se cultivaron en frascos de cultivo de 75 cm2 (Sarstedt) y se mantuvieron a 37ºC en un incubador húmedo con un 5% de CO2.
Obtención de secretoma derivado de MSC y evaluación de su efecto sobre fibroblastos de dermis de piel humana
Una vez alcanzada una confluencia superior al 70%, se esperó 72 horas para recolectar el medio de cultivo de cada tipo de célula madre mesenquimal (ADSC, DPSC, WJSC), el cual contenía las sustancias liberadas por las células. Brevemente, el medio de cultivo obtenido de MSC se centrifugó durante 10 minutos para eliminar todos los restos celulares y cuerpos apoptóticos, a continuación se utilizó un filtro estéril de 0,22 µm (Sarstedt, Nümbrecht, Alemania). Los secretomas obtenidos de los tres cultivos de cada tipo de célula madre mesenquimal (ADSC, DPSC, WJSC) se agruparon en una única suspensión. Se denominaron ADSC-s, DPSC-s y WJSC-s.
Para evaluar los efectos de cada tipo de secretoma sobre cultivos primarios, los fibroblastos se cultivaron en placas de cultivo celular de 96 pocillos (Sarstedt) a una densidad celular de 1.7x104 células/cm2 con DMEM. Pasadas 48 horas, el DMEM fue reemplazado por medio suplementado con concentraciones crecientes de cada tipo de secretoma: C1 (500 µg/mL), C2 (2000 µg/mL). Para los controles se utilizó medio (DMEM) sin suplementar. Los fibroblastos se cultivaron con cada tipo y cada concentración de secretoma durante 24, 48 y 72 horas (Fig. 2).
Efecto del secretoma derivado de MSC sobre la viabilidad celular de fibroblastos de dermis de piel humana
Para estudiar el efecto biológico de los secretomas de ADSC, DPSC y WJSC sobre la viabilidad celular, se empleó un kit de análisis de viabilidad/citotoxicidad celular (LIVE/DEAD® Life Technologies, Carlsbad, CA, EE.UU.). En resumen, los fibroblastos incubados con cada tipo y concentración de secretoma se lavaron con tampón fosfato (PBS) y se les añadió una solución de trabajo de acetoximetilcalceína y bromuro de etidio durante 15 minutos a 37°C. Posteriormente, las células se lavaron de nuevo con PBS y se obtuvieron imágenes histológicas empleando un microscopio de fluorescencia invertido Nikon Eclipse Ti-U (Nikon, Tokio, Japón). En cada muestra se cuantificó el porcentaje de células vivas (teñidas de verde) y de células muertas (teñidas de rojo). Todos los análisis se realizaron por triplicado (n=3).
Efecto del secretoma derivado de MSC sobre la proliferación celular de fibroblastos de dermis de piel humana
Para estudiar el potencial de los distintos tipos de secretomas de MSC sobre la proliferación de los fibroblastos, se realizó un estudio in vitro durante 24, 48 y 72 horas, y se cuantificó el número de células empleando un citómetro de flujo Novo Cyte® (ACEA Biosciences, Inc., San Diego, CA, EE.UU.). Cada grupo de células (fibroblastos cultivados con diferentes tipos y concentraciones de secretoma) se lavó dos veces con PBS y se tripsinizó con tripsina-EDTA al 0.25% (Sigma/Aldrich Merck). A continuación, se resuspendieron las células desprendidas en una solución tamponada que consistía en una mezcla de PBS con un 10% de FBS y un 2% de EDTA (Sigma/Aldrich Merck). Todos los análisis se realizaron por triplicado (n=3).
Efecto del secretoma derivado de MSC sobre la migración celular de fibroblastos de dermis de piel humana in vitro
Con el fin de determinar la capacidad de los secretomas estudiados (ADSC-s, DPSC-s, WJSC-s) para estimular la migración de los fibroblastos se llevó a cabo un análisis de cicatrización de heridas in vitro empleando el Oris® Universal Cell Migration Assembly Kit (Platypus Technologies LLC, Fitchburg, WI, EE.UU.). Para este ensayo, se cultivaron fibroblastos de dermis a una densidad celular de 1.7x104 células/cm2 en placas de 96 pocillos en presencia de medio de cultivo DMEM (Sigma-Aldrich/Merck). A continuación, se retiraron físicamente los tapones de confluencia celular para permitir que las células migraran a las zonas previamente ocupadas por esos tapones, y se sustituyó el medio de cultivo DMEM por cada tipo de secretoma (ADSC-s, DPSC-s, WJSC-s) a las concentraciones previamente determinadas (C1, C2). Se obtuvieron imágenes tras 24, 48, 72 horas de seguimiento con un microscopio invertido Nikon Eclipse Ti-U. Estos análisis se realizaron por triplicado (n=3).
Efecto del secretoma derivado de MSC sobre la cicatrización de lesiones cutáneas in vivo
Tres ratas Wistar fueron anestesiadas mediante una inyección intraperitoneal de acepromazina (Calmo-Neosan® 0.001 mg/g), ketamina (ImaIgene 1000® 0.15 mg/g) y atropina (0.05 µg/g). A continuación, se generaron cuatro defectos cutáneos en el dorso de cada animal utilizando un punzón dermatológico de 8 mm. Una vez alcanzada la hemostasia, se aplicaron 50 µL de cada tipo de secretoma a cada defecto cutáneo, empleando DMEM como control. Los defectos cutáneos se protegieron con una gasa estéril y se realizó un seguimiento de los animales durante 20 días.
Análisis estadístico
Se realizaron comparaciones específicas por pares con la prueba U de Mann-Whitney. Este análisis se utilizó para comparar los grupos de estudio (a una concentración y tiempo) entre sí y con el grupo de control. Todas las pruebas estadísticas se realizaron con el software SPSS v. 25 (SPSS, Inc., Chicago, IL, EE.UU.) y con el complemento de Excel Real Statistics, disponible en www.real-statistics.com (Dr. Charles Zaiontz, Purdue University, West Lafayette, IN, EE.UU.). El nivel de significación estadística se fijó en el 5%.
Resultados
Efecto del secretoma derivado de MSC sobre la viabilidad celular de fibroblastos de dermis de piel humana
Para valorar el efecto biológico en términos de bioseguridad y biocompatibilidad de los secretomas procedentes de células madre mesenquimales humanas se realizó un ensayo LIVE/DEAD®. Todos los resultados obtenidos en esta prueba mostraron valores de viabilidad altos. Los fibroblastos humanos expuestos a las concentraciones de secretoma C1 y C2, a las 24, 48, y 72 horas de estudio in vitro mostraron porcentajes de células vivas superiores a 95%, evidenciandose un aumento de la viabilidad a las 48 y 72 horas de cultivo (Fig. 3 y 4, Tabla I).

Figura 3. Análisis cuantitativo de viabilidad determinado mediante el ensayo LIVE/DEAD®. Los fibroblastos fueron expuestos a los tres tipos de secretomas estudiados y a distintas concentraciones (C1 y C2) durante tres tiempos diferentes (24, 48, 72 horas). ADSC-s: secretoma derivado de células madre mesenquimales de tejido adiposo; DPSC-s: secretoma derivado de células madre mesenquimales de pulpa dental; WJSC-s: secretoma derivado de células madre mesenquimales de la gelatina de Wharton del cordón umbilical. Se expresan medias y desviaciones típicas mediante barras de error.

Figura 4. Análisis cualitativo de viabilidad determinado mediante el ensayo LIVE/DEAD®. Los fibroblastos fueron expuestos a los tres tipos de secretomas estudiados (ADSC-s, DPSC-s, y WJSC-s) y a distintas concentraciones (C1 y C2) durante tres tiempos diferentes (24, 48, 72 horas). ADSC-s: secretoma derivado de células madre mesenquimales de tejido adiposo; DPSC-s: secretoma derivado de células madre mesenquimales de pulpa dental; WJSC-s: secretoma derivado de células madre mesenquimales de la gelatina de Wharton del cordón umbilical. Barra de error: 50µm.
Tabla I. Análisis cuantitativo de viabilidad celular determinado mediante el ensayo LIVE/DEAD®. Los fibroblastos humanos fueron expuestos a distintos tipos de secretoma (ADSC-s, DPSC-s, WJSC-s) y a distintas concentraciones (CTR, C1 y C2). Las mediciones se realizaron a tres tiempos diferentes (24, 48 y 72 horas). Los valores corresponden al porcentaje de células vivas en cada grupo y se muestran como medias ± desviaciones típicas. ADSC-s: secretoma derivado de células madre mesenquimales de tejido adiposo; DPSC-s: secretoma derivado de células madre mesenquimales de pulpa dental; WJSC-s: secretoma derivado de células madre mesenquimales de la gelatina de Wharton del cordón umbilical.
| VIABILIDAD | LIVE/DEAD® | |||
|---|---|---|---|---|
| 24 h | 48 h | 72 h | ||
| ADSC-s | C1 | 96.9 ± 0.4 | 100 ± 0 | 99 ± 0 |
| C2 | 97.1 ± 1.9 | 99 ± 1.0 | 100 ± 0 | |
| DPSC-s | C1 | 95.0 ± 0.1 | 100 ± 0 | 100 ± 0 |
| C2 | 97.2 ± 1.0 | 99 ± 1.0 | 100 ± 0 | |
| WJSC-s | C1 | 98.3 ± 1.0 | 99 ± 1.0 | 99 ± 0 |
| C2 | 95.7 ± 1,1 | 99 ± 0 | 99 ± 1 | |
| CONTROL (DMEM) | 98%±0 | 100%±0 | 99±0 | |
Así pues, los resultados permiten concluir que la aplicación de secretoma obtenido de células madre mesenquimales humanas de tejido adiposo, pulpa dental y gelatina de Wharton es seguro in vitro para fibroblastos humanos.
Efecto del secretoma derivado de MSC sobre la proliferación celular de fibroblastos de dermis de piel humana
Para evaluar la proliferación celular de los fibroblastos expuestos a secretoma de MSC (ADSC-s, DPSC-s, WJSC-s) se empleó la citometría de flujo, con la que se pudo cuantificar el número de células presentes en cada pocillo donde se encontraban fibroblastos expuestos a las distintas concentraciones (C1, C2) durante 24, 48, 72 horas. En general, todos los resultados obtenidos a partir de las 48 horas de cultivo revelan un incremento del número de fibroblastos humanos cultivados en presencia de secretoma con respecto al control (Fig. 5).

Figura 5. Análisis cualitativo de la proliferación celular de los fibroblastos humanos expuestos a distintos tipos de secretoma de células madre mesenquimales humanas determinado por contaje celular secuencial mediante citometría de flujo. Los fibroblastos humanos fueron expuestos a distintas concentraciones (CTR, C1 y C2) durante tres tiempos diferentes (24, 48 y 72 horas). Los valores se muestran como ADSC-s: secretoma derivado de células madre mesenquimales de tejido adiposo; DPSC-s: secretoma derivado de células madre mesenquimales de pulpa dental; WJSC-s: secretoma derivado de células madre mesenquimales de la gelatina de Wharton del cordón umbilical.
Concretamente, durante las primeras 24 horas, los cultivos enriquecidos con ADSC-s a concentración C2 presentaron mejores resultados respecto al control (DMEM) y respecto a los cultivos enriquecidos con WJSC-s, siendo estas diferencias estadísticamente significativas (p≤0.05). En el caso de los cultivos enriquecidos con DPSC-s a concentración C2 se hallaron valores superiores al control (DMEM) y a los cultivos enriquecidos con WJSC-s, siendo estas diferencias también estadísticamente significativas (p≤0.05). Sin embargo, no se hallaron diferencias significativas respecto al control a 24 horas en los cultivos enriquecidos con WJSC-s (p≥0.05). Tras 48 horas de exposición al secretoma, se hallaron diferencias estadísticamente significativas respecto al control en el caso de los fibroblastos cultivados con medio enriquecido con DPSC-s a concentración C1 y con WJSC-s a concentración C2 (p≤0.05). Es importante destacar que no se hallaron diferencias estadísticamente significativas entre los distintos tipos de secretoma (p≥0.05). Finalmente, después de 72 horas de exposición al medio enriquecido con secretoma, las diferencias halladas aumentaron de manera considerable en los grupos estudiados, siendo estadísticamente significativas respecto al control en el caso de las concentraciones C1 de ADSC-s y, C1 y C2 de DPSC-s (p≤0.05). Los fibroblastos expuestos a ADSC-s mostraron valores de proliferación más elevados respecto a los secretomas de DPSC-s y WJSC-s a concentración C2, siendo estos resultados estadísticamente significativos (p≤0.05). Por su parte, los cultivos enriquecidos con DPSC-s presentaron valores significativamente superiores a ADSC-s a C1 y a WJSC-s a C2 (p≤0.05) (Tabla II, Fig. 5).
Tabla II. Análisis cualitativo de la proliferación celular determinado por contaje celular secuencial mediante citometría de flujo. Los fibroblastos humanos fueron expuestos a distintos tipos de secretoma (ADSC-s, DPSC-s, WJSC-s) y concentraciones (CTR, C1 y C2). Las mediciones se realizaron a tres tiempos diferentes (24, 48 y 72 horas). Los valores se muestran como medias ± desviaciones típicas. ADSC-s: secretoma derivado de células madre mesenquimales de tejido adiposo; DPSC-s: secretoma derivado de células madre mesenquimales de pulpa dental; WJSC-s: secretoma derivado de células madre mesenquimales de la gelatina de Wharton del cordón umbilical. Las diferencias estadísticamente significativas se muestran como; A: diferencias respecto a ADSC-s; D: diferencias respecto a DPSC-s; W: diferencias e respecto a WJSC-s; *Diferencias estadísticamente significativas respecto al control.
| Proliferación | Contaje celular (Citometría de flujo) | |||
|---|---|---|---|---|
| 24 h | 48 h | 72 h | ||
| ADSC-s | C1 | 772.67 ± 45.0D | 1290.0 ± 19.80 | 2465.33 ± 304.67D |
| C2 | 944.67 ± 46.32*,W | 1249.33 ± 513.05 | 3528.67 ± 231.25*,D,W | |
| DPSC-s | C1 | 484.67 ± 248.79*,A,W | 1618.0 ± 239.76* | 3682.0 ± 779.22*,A |
| C2 | 954.0 ± 28.0*.W | 1348.0 ± 173.42 | 2956.0 ± 204.42*,A,W | |
| WJSC-s | C1 | 889.33 ± 71.14D | 1529.33 ± 704.16 | 2622.0 ± 302.41 |
| C2 | 837.33 ±19.01A,D | 1614.0 ± 145.59* | 2146.0 ±443.95A,D | |
| CONTROL (DMEM) | 850.67 ± 51.32 | 1047.33 ± 277.07 | 2010.67 ± 363.63 | |
Efecto del secretoma derivado del MSC sobre la migración celular de fibroblastos de dermis de piel humana in vitro
Con el fin de valorar la capacidad del secretoma obtenido de células madre mesenquimales para inducir la migración de fibroblastos se realizó el test Oris™ Universal Cell Migration Assembly Kit empleando fibroblastos de dermis de piel humana. Durante el estudio se realizaron fotografías cada 24 horas de cada pocillo de la placa hasta que la superficie fue completamente cubierta por fibroblastos. En el análisis de las 24 primeras horas no se hallaron diferencias entre los medios enriquecidos con secretoma y el control (DMEM). Sin embargo, a partir de las 48 horas, los fibroblastos cultivados en medio enriquecido con secretoma tendían a cubrir una mayor cantidad de superficie en comparación con el control (DMEM). Concretamente, en el caso de los cultivos enriquecidos con ADSC-s y WJSC-s a concentración C2 y DPSC-s a concentración C1. Tras 72 horas de cultivo, la confluencia de los fibroblastos humanos era cercana al 100% en todos los cultivos enriquecidos con ADSC-s, DPSC-s y WJSC-s a concentración C2 así como en los cultivos de ADSC-s y DPSC-s a concentración C1, no siendo de este modo en el caso de los controles (Fig. 6).

Figura 6. Análisis del test de migración. DPSC-s: secretoma derivado de células mesenquimales de tejido adiposo; DPSC-s: secretoma derivado de células mesenquimales de pulpa dental; WJSC-s: secretoma derivado de células mesenquimales de la gelatina de Wharton del cordón umbilical. Barra de error: 100µm.
Efecto del secretoma derivado de MSC sobre la cicatrización de lesiones cutáneas in vivo
Con el fin de estudiar in vivo los resultados previamente descritos in vitro, se realizó un análisis de la cicatrización de heridas in vivo en ratas Wistard. Los resultados de este estudio mostraron un aumento claro en el ritmo de cierre de las heridas realizadas en la piel de los animales de experimentación. En concreto, esta mejoría se observó especialmente a partir del día 10 en las heridas tratadas con ADSC-s y DPSC-s. Posteriormente, a los 20 días de la incisión, todas las heridas tratadas con secretoma estaban completamente epitelizadas aunque sin folículos pilosos, no siendo así en el caso del control, dónde aún persistía una costra de pequeño tamaño que indicabala persistencia del defecto tisular (Fig. 7). No se evidenció ninguna complicación durante el transcurso del experimento en lo que se refiere a infecciones, sangrado o necrosis tisular.

Figura 7. Imágen del estudio in vivo. Se presentan cuatro defectos cutáneos de espesor total realizados mediante “punch” de 8 mm en el dorso de ratas Wistar. ADSC-s: secretoma derivado de células madre mesenquimales de tejido adiposo; DPSC-s: secretoma derivado de células madre mesenquimales de pulpa dental; WJSC-s: secretoma derivado de células madre mesenquimales de la gelatina de Wharton del cordón umbilical.
Discusión
La generación de piel artificial es un reto que ha sido asumido por la Ingeniería Tisular durante las últimas décadas. Sin embargo, los modelos de los que actualmente disponemos presentan inconvenientes importantes.(12) Uno de ellos es el tiempo de fabricación, ya que se necesitan aproximadamente 4 semanas(13,14) para que crezcan las células. La demora en el desbridamiento y la cobertura de las quemaduras contribuye a la colonización bacteriana y a desajustes de hidroelectrolitos(15) y, por consiguiente, al aumento de la morbimortalidad de los pacientes.(16) En el presente trabajo se analiza el efecto del uso de distintos tipos de secretomas obtenidos de células madre mesenquimales humanas sobre cultivos de fibroblastos con el propósito de hallar procedimientos que aceleren los tiempos de generación de piel artificial mediante protocolos de Ingeniería Tisular. Se pretende pues, disminuir el tiempo que transcurre desde la toma de muestra del paciente hasta que se dispone de la piel artificial para su aplicación.
El potencial regenerador del secretoma obtenido de células madre mesenquimales humanas está siendo estudiado en numerosos tejidos, como el cardíaco(17) o el renal.(18) Hasta la fecha no existe evidencia científica sobre cuál es la fuente de células madre mesenquimales que aporta un secretoma con mejores propiedades regenerativas y tampoco sobre si estas propiedades son dependientes del tejido que se pretenda generar o reparar. Con el fin de profundizar en esta línea de estudio, se compara en este trabajo el efecto regenerador de tres tipos de secretoma a dos concentraciones distintas. Es importante destacar que en la actualidad existe un déficit de estudios científicos que exploren los resultados del secretoma a largo plazo y, como consecuencia, debemos ser cautos con la extrapolación clínica de este tipo de nuevas terapias.(19)
En primer lugar, se estudió la viabilidad de los fibroblastos cuando se exponían a medios enriquecidos con secretoma obtenidos de células madre mesenquimales a distintas concentraciones. Todos los valores de viabilidad recogidos en este análisis se situaron por encima de 95%, por lo que a partir de los mismos se puede concluir que la aplicación de este tipo de secretomas sobre cultivos de fibroblastos es segura y puede ser utilizada en protocolos de Ingeniería Tisular para facilitar la generación de nuevos tejidos artificiales. Estos datos fueron posteriormente corroborados con en el estudio in vivo realizado en ratas Wistard, en el que no se apreció ninguna complicación durante el transcurso del experimento.
Posteriormente se estudió la capacidad del secretoma para inducir la proliferación de fibroblastos, hallándose un potencial inductor de proliferación celular superior al de los controles en todos los tipos y concentraciones estudiadas. Cabe mencionar que las diferencias observadas a las 24 horas de cultivo fueron bajas, siendo verdaderamente apreciables a las 48 horas de exposición e incrementándose a las 72 horas de cultivo. Dichos cambios podrían apuntar al requerimiento, por parte de los fibroblastos, de un periodo de adaptación al nuevo medio enriquecido con secretoma.(20)
A pesar de hallarse valores de contaje celular superiores al control en todos los tipos de secretoma, ADSC-s y DPSC-s tendieron a presentar valores más altos, acercándose a cifras que duplicaron el número de células observadas en el control. Curiosamente, cuando se estudió la concentración empleada, ADSC-s presentó contajes celulares superiores cuando se administró la concentración más alta. Por contra, en el caso de DPSC-s y WJSC-s con la concentración más baja se obtuvieron cifras de fibroblastos más altas. Estos datos podrían deberse al requerimiento por parte de los fibroblastos humanos de elementos nutritivos presentes en el medio de cultivo como en el caso del suero bovino fetal (SBF).(21) Sin embargo, se requieren más estudios para poder hallar la concentración más adecuada de cada tipo de secretoma.
El siguiente paso fue analizar el potencial de los secretomas obtenidos para inducir la migración de fibroblastos in vitro. Para ello se valoró la capacidad de los fibroblastos para crecer desde los bordes del pocillo de cultivo hasta ocupar la totalidad de la superficie de estudio, alcanzando una confluencia celular elevada. Todos los secretomas estudiados presentaron tiempos de migración mejores que el control. Sin embargo, ADSC-s y DPSC-s mostraron los mejores resultados en este estudio, especialmente en el caso de la concentración C2 de ADSC-s y la concentración C1 de DPSC-s. Es interesante mencionar que estos tipos de secretoma a estas concentraciones presentaron también mejores valores en el estudio de proliferación celular analizado previamente.
Finalmente, se realizó un estudio in vivo en ratas para valorar los tiempos de curación de heridas generadas en el dorso de los animales. Se apreció una mejoría aparente de las heridas tratadas con los tres tipos de secretoma, siendo especialmente reseñable a partir del décimo día en las heridas tratadas con ADSC-s y DPSC-s. Ningún animal presentó complicaciones locales ni sistémicas derivadas de la aplicación del secretoma en la herida, hecho que refuerza los resultados hallados en el test de viabilidad in vitro previamente analizado.
Finalmente mencionar que, hasta la fecha, no se ha hallado evidencia acerca del potencial oncogénico de la aplicación clínica de factores de crecimiento u otras biomoléculas activas.(22) Existen trabajos que apuntan a un efecto protector debido al potencial inmunomodulador y antitumoral de algunas moléculas presentes en el secretoma de células madre mesenquimales humanas.(23-25) Sin embargo, se requieren más estudios para poder confirmar estos resultados, especialmente a largo plazo.
Como se ha reflejado en los resultados, el secretoma de células madre mesenquimales humanas posee un gran potencial regenerativo. Esto permite desarrollar modelos de piel artificial mediante protocolos de Ingeniería Tisular en tiempos más cortos. Con ello es posible obtener una cobertura cutánea precoz y definitiva reduciendo las complicaciones atribuidas a la demora en el tratamiento.
Por otro lado, la administración de factores de crecimiento presentes en el secretoma de células madre mesenquimales humanas podría aumentar el número de fibroblastos en la dermis y, como consecuencia, aumentaría el espesor de la misma y mejoraría la disposición de las fibras de colágeno y elásticas de la matriz extracelular. Todo ello se traduciría en una mejoría en la calidad de la dermis.(26) Además, las patologías cuya base terapéutica yace en la dermis y en los fibroblastos podrían beneficiarse de las biomoléculas presentes en el secretoma. Así pues, el efecto terapéutico podría mejorar procesos como la cicatrización de heridas, la epitelización de quemaduras o el tratamiento de los queloides.(27)
Por último, es importante mencionar que el secretoma de células madre mesenquimales humanas es una terapia acelular. Esto comporta una serie de ventajas importantes tanto a nivel de investigación básica como para su aplicación clínica(28) dado que habitualmente se trata de productos que no generan un rechazo inmunológico en el huésped y, por lo tanto, podrían ser aplicados a pacientes indistintamente de la fuente a partir de la cual se obtengan.(29)
Conclusiones
Los hallazgos del presente estudio muestran que la aplicación de secretoma procedente de células madre mesenquimales humanas permite mantener cifras de viabilidad celular elevadas e incrementar el ritmo de proliferación celular de fibroblastos en modelos in vitro. Asimismo, no se han evidenciado efectos adversos a corto plazo derivados del uso de secretoma en estudios in vivo.
Declaración
El presente trabajo forma parte de los experimentos realizados por el residente durante los estudios de Doctorado (2018-2022), quien forma parte del grupo CTS-115 (Grupo de Investigación en Ingeniería Tisular de la Universidad de Granada) que desarrolla su actividad en un área emergente de la Medicina y la Biotecnología como es la construcción de tejidos artificiales para el tratamiento de distintas enfermedades.
Comité Coordinador de Ética de la Investigación Biomédica de Andalucía (España): Favorable (protocolo S1900527 “Generación de nuevos modelos de piel medicalizada a partir de la piel artificial de fibrina-agarosa ensayada clínicamente en grandes quemados. Funcionalización con fármacos y nuevos procesos de biofabricación”).
Comité de Ética de Bienestar Animal: Resolución de la Dirección General de la Producción Agrícola y Ganadera por la que se autoriza la Experimentación Animal en el proyecto: “Generación de nuevos modelos de piel medicalizada a partir de la piel artificial de fibrina-agarosa ensayada clínicamente en grandes quemados. Funcionalización con fármacos y nuevos procesos de biofabricación” (cs pe-395-2019).