Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Oncología (Barcelona)
versión impresa ISSN 0378-4835
Oncología (Barc.) vol.28 no.3 mar. 2005
CUIDADOS CONTINUOS EN ONCOLOGÍA RADIOTERÁPICA
Control de síntomas crónicos. Efectos secundarios del tratamiento con radioterapia y quimioterapia
A. Montero; A. Hervás, R. Morera; S. Sancho; S. Córdoba; J. A. Corona; I. Rodríguez; E. Chajón; A. Ramos
Servicio de Oncología Radioterápica. Hospital Ramón y Cajal. Madrid
Introducción
El empleo de radiaciones ionizantes en el tratamiento del cáncer está condicionado por la necesidad de evitar la aparición de complicaciones sobre los tejidos sanos irradiados. Si bien no existe un consenso uniforme, los efectos secundarios de la radioterapia sobre los tejidos normales se han subdividido, tradicional y arbitrariamente, en agudos y tardíos, en función de su aparición durante el tratamiento y/o en los 90 días tras su finalización (efectos agudos) o tras un periodo de latencia superior a 90 días (efectos tardíos)1. Las complicaciones agudas se consideraban reversibles, y por tanto de menor importancia, mientras que las complicaciones tardías eran clasificadas como irreversibles y en muchos casos fatalmente progresivas.
Sin embargo, este concepto parece superado actualmente, y hoy se considera que la toxicidad secundaria a la radioterapia es un fenómeno continuo que se inicia desde el mismo momento en que comienza la irradiación y que se prolonga a lo largo del tiempo de seguimiento del paciente, y cuya expresión clínica en un momento u otro dependerá de factores celulares, tisulares, ambientales e intrínsecos de cada individuo.
La aparición de complicaciones tardías tras la radioterapia continúa siendo la principal limitación de la misma, pese al empleo creciente de estrategias que buscan mejorar el índice terapéutico. En la génesis de las complicaciones tardías tras la radioterapia se han implicado tanto factores relacionados con el propio tratamiento (dosis total, fraccionamiento, volumen de irradiación), como factores dependientes del paciente (trastornos preexistentes en la microcirculación, enfermedades crónicas del tejido conectivo, diabetes mellitus), así como la utilización de cirugía o quimioterapia2.
Clasificación de la toxicidad
Reconocer, clasificar y comunicar adecuadamente la toxicidad asociada a los tratamientos oncológicos es un aspecto crucial tanto de la práctica clínica diaria como de los ensayos clínicos. Los criterios para determinar el grado de intensidad en las complicaciones consideradas tardías están menos definidos que para las complicaciones agudas.
En 1983 el Instituto Nacional del Cáncer de los EE.UU. estableció, en un intento de clasificar la toxicidad secundaria a la quimioterapia, los Common Toxicity Criteria (CTC), que analizaban en su primera versión un total de 18 criterios de toxicidad.
De manera similar, el grupo cooperativo establecido conjuntamente por el Radiation Therapy Oncology Group (RTOG) y el Euoropean Organization for Research and Treatment of Cancer (EORTC) desarrolló en 1984 unas escalas de toxicidad atribuible a la radioterapia, tanto aguda como tardía, y que analizaban un total de 30 criterios3.
En 1995 el RTOG introdujo una nueva escala de medición de la toxicidad tardía por radioterapia, la Escala LENT-SOMA, incluyendo 152 criterios que permitían determinar con mayor exactitud la aparición y grado de severidad en las complicaciones crónicas de la radioterapia4.
En 1998 se publicó la segunda versión del CTC (CTC v2.0) que ya recogía y clasificaba las complicaciones agudas de los tratamientos de radio y quimioterapia en forma de análisis de 250 criterios5.
Finalmente, en 2003 vio la luz la tercera versión del CTC (CTCAE v3.0) que pretende recoger y clasificar la aparición de cualquier acontecimiento adverso acaecido durante el tratamiento y seguimiento posterior del paciente con cáncer. Esta nueva escala pretende además diferenciar entre "acontecimiento adverso" que sería cualquier hecho de nueva aparición, debido o no al tratamiento, del "efecto adverso" que comprendería los hechos secundarios al tratamiento oncológico empleado (radioterapia, quimioterapia o cirugía) y recoge y analiza un total de 570 criterios. Los fenómenos inflamatorios, tanto agudos como tardíos, son el aspecto fundamental de casi todas las toxicidades relacionadas con los tratamientos oncológicos, y forman la base de la mayoría de criterios definidos por el CTCAE v3.0 (Tabla I)6.
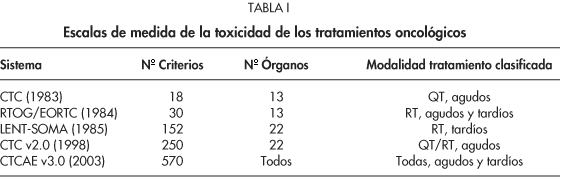
La escala CTCAE v3.0 representa el primer sistema multimodal de clasificación de las complicaciones tanto agudas como tardías al tratamiento del cáncer. Está específicamente diseñada para ser empleada con cualquier modalidad de tratamiento y por vez primera no se establece una separación temporal estricta entre toxicidad aguda y tardía.
La escala completa CTCAE v3.0 puede ser consultada en la dirección: http://ctep.cancer.gov/forms/CTCAEv3.pdf
Fisiopatología de la toxicidad tardía
En el momento actual se considera que la toxicidad es una secuencia dinámica de acontecimientos celulares y efectos titulares específicos que se inicia en el mismo momento de la exposición a la radioterapia. A pesar de que las manifestaciones clínicas varían a lo largo del tiempo, la fisiopatología es la de un fenómeno continuo, progresivo e irreversible, que guarda estrecha relación con los fenómenos fisiológicos del daño y reparación tisular, y que cada tejido expresa no obstante de forma particular.
Si bien el sustrato histopatológico es común, la expresión de la toxicidad en el tiempo dependerá del periodo de renovación del tejido dañado: lento o rápido, tardío o agudo7.
En una reciente revisión publicada sobre este aspecto, Williams et al. afirman que "en el momento del tratamiento, independientemente de la modalidad del mismo (radioterapia, quimioterapia o cirugía) el objetivo primordial es conseguir la muerte o el daño irreparable en la célula tumoral, y todos los acontecimientos que ocurren con posterioridad son, de algún modo, una forma de respuesta a dicho acto"8.
El mecanismo biológico del daño radioinducido debe de ser considerado desde el momento del inicio del mismo. Inicialmente se produce una respuesta aguda a través de la liberación de citoquinas por las células parenquimatosas, inflamatorias, endoteliales y del estroma incluidas en el volumen de tejido irradiado. Este hecho desencadenará una cascada de fenómenos inflamatorios que conducirán al establecimiento de una progresiva fibrosis, que representa el paradigma de la toxicidad tardía severa post-radioterapia, por su carácter irreversible y las dificultades que entraña su tratamiento.
La secuencia de acontecimientos que conducirán a la fibrosis se inicia con la liberación de citoquinas por los tejidos sanos en respuesta al daño inflingido por el tratamiento. La liberación de citoquinas proinflamatorias (TNFa, IL-1, IL-6) tendrá efectos autocrinos y paracrinos. Del mismo modo, su liberación en el compartimiento vascular será lo que provoque el reclutamiento de células del sistema inmune. A continuación se producirá una extravasación de monocitos y macrófagos al espacio extravascular del intersticio condicionando la aparición de una respuesta inflamatoria aguda en la región.
El estímulo continuo y su traducción en forma de liberación constante de citoquinas, así como la interacción de éstas con otras familias de citoquinas, resultará en la expresión de citoquinas profibróticas (activadoras de fibroblastos) que facilitarán el establecimiento de la fibrosis9-12. En este sentido, la superfamilia de citoquinas profibróticas TGF-b ha sido objeto de especial interés, ya que numerosos estudios han incidido en el papel del TGF-b1 en el establecimiento de la fibrosis intestinal radioinducida así como en el posible desarrollo de estrategias anti-TGF-b1 como medio de combatirla13.
Como puede apreciarse, esta secuencia de acontecimientos es el paradigma de los fenómenos normales de cicatrización de los tejidos14. La diferencia fundamental estribaría en la perpetuación de este proceso debido a la desregulación en la expresión de citoquinas.
Manifestaciones clínicas de la toxicidad tardía
Los fenómenos inflamatorios y de fibrosis inducidos por los tratamientos oncológicos ocasionan inicialmente una pérdida en la elasticidad de los tejidos seguida de una progresiva induración asociada a retracción de los mismos.
Dependiendo de los tejidos afectados, se apreciará hipoplasia, sequedad, ulceración e incluso necrosis de los tejidos; fibrosis y atrapamiento de estructuras nerviosas u obliteración de estructuras vasculares. En ocasiones estas manifestaciones se ven exacerbadas por la presencia de traumatismos o infecciones acompañantes. Las alteraciones funcionales acompañantes dependerán de la localización anatómica del área irradiada, e incluirán dolor, linfedema, pérdida de la motilidad, cuadros neuropáticos...
I. Segundos tumores
El desarrollo de segundos tumores en relación con el tratamiento del cáncer primario es una de las complicaciones más devastadoras del tratamiento del cáncer. Se ha observado en niños supervivientes de cáncer un aumento del riesgo de padecer un segundo tumor a 20 años del 8-10%15, 16, que se atribuye al riesgo mutagénico de la radioterapia y/o quimioterapia (especialmente agentes alquilantes y podofilotoxinas) en pacientes que ya posee una cierta predisposición genética para el desarrollo de tumores.
II. Piel y tejido celular subcutáneo
La aparición y desarrollo de fibrosis del tejido celular subcutáneo es una complicación tardía habitual en los pacientes que reciben radioterapia. La repercusión clínica dependerá en gran medida de las estructuras subyacentes a la zona de fibrosis.
III. Linfedema
Se define como la acumulación anormal de un exudado rico en proteínas en algún punto del organismo secundaria a la obstrucción del sistema linfático. Habitualmente afecta a las extremidades, si bien también puede afectar estructuras axiales (mama, abdomen, genitales)o a vísceras. El linfedema en los pacientes con cáncer puede ser de causa primaria (motivada por el tumor) o secundaria bien a causas iatrogénicas (cirugía o radioterapia) o no iatrogénicas (infecciones, traumatismos, compresión extrínseca tumoral). La fibrosis originada por la radioterapia ocasiona con cierta frecuencia la obstrucción de los vasos linfáticos, circunstancia que se puede ver agravada por características intrínsecas al paciente, como insuficiencia venosa o arterial, diabetes mellitus, déficit neurológicos o hipoproteinemia.
Cuando fracasa el sistema linfático, la linfa se acumula en el espacio intersticial provocando un acúmulo de neutrófilos, macrófagos y fibroblastos en dichas zonas que favorecen el establecimiento de una fibrosis que contribuye a agravar el linfedema. Se producen cambios en la piel suprayacente que pierde su capacidad de barrera, favoreciendo la presencia y desarrollo de infecciones bacterianas y fúngicas. El efecto del linfedema severo establecido sobre los pacientes es devastador, provocando llamativos defectos funcionales y condicionando la aparición de importantes secuelas sociales y psicológicas.
IV. Osteonecrosis
El hueso es 1,8 veces más denso que los tejidos blandos, y por tanto absorbe una proporción de irradiación mayor que el mismo volumen de tejido blando. La radioterapia ocasiona el estrechamiento de los canales vasculares y el hueso se convierte en un tejido desvitalizado. En 1922 Ewing et al. describieron por primera vez el daño en la microcirculación de los huesos motivados por la radioterapia. Se observó la presencia de esclerosis en el tejido conectivo de la médula ósea acompañada de endarteritis obliterante. El grado e intensidad de estos cambios estaba en relación directa con la dosis administrada17.
Hoy en día se acepta que la radioterapia causa muerte celular en las células endoteliales, hialinización, trombosis y obliteración vascular. El periostio se fibrosa, se producen fenómenos de necrosis en osteoblastos y osteoclastos y fibrosis del espacio medular. El resultado es un tejido hipocelular, hipovascular e hipóxico, incapaz de desarrollar fenómenos de reparación tras una agresión18, 19.
V. Sistema nervioso central y periférico
El empleo de esquemas de radioterapia, y cada vez más frecuentemente quimioterapia concomitante, se asocia con la aparición de complicaciones tardías sobre el sistema nervioso central así como sobre los nervios periféricos.
Necrosis
La incidencia de necrosis radioinducida en el SNC varía entre el 5-24% de los pacientes20 y se ha relacionado con factores propios del tratamiento como la dosis total, el fraccionamiento o el volumen de irradiación.
El periodo de latencia es variable, desde meses a años, con una media de 4-5 años21. Habitualmente se desarrolla en o cerca de la localización primitiva del tumor y en su génesis se ha implicado al daño ocasionado en la microcirculación que favorecería la ruptura de la barrera hematoencefálica y el desarrollo de edema que finalmente conduce a la necrosis22. La radionecrosis es un proceso dinámico que en ocasiones se resuelve espontáneamente, permanece estable o progresa, siendo indistinguible clínica y radiologicamente del tumor inicial. El reciente empleo de técnicas de RMN espectroscópica y de PET han supuesto una considerable ayuda al diagnóstico diferencial de la necrosis y el tumor23, 24.
Trastornos cognitivos
La irradiación craneal se ha asociado con cuadros de disminución de la atención, enlentecimiento de las reacciones, incapacidad para el aprendizaje de nuevos conocimientos o demencia. Este tipo de trastornos son más frecuentes en niños irradiados antes de los 10 años de edad25 y especialmente en los 3 primeros años de la vida, en los que los procesos de mielinización cerebral aun no están completados. La quimioterapia se ha aconsejado en estos pacientes para retrasar el empleo de radioterapia hasta que se alcance un grado suficiente de maduración cerebral26.
Numerosos fármacos empleados en el tratamiento del cáncer se han relacionado con la aparición de complicaciones neurológicas tardías. Se han descrito cuadros de encefalopatía con metotrexate, BCNU o citarabina27, leucoencefalopatía multifocal con el uso de fludarabina28 o síndromes cerebelosos en pacientes tratados con citarabina o 5 fluoruracilo, especialmente en pacientes con deficiencia de la encima dihidropirimidina dehidrogenasa29, 30. Del mismo modo, el empleo de quimioterapia intratecal se ha asociado con el desarrollo de encefalopatía necrotizante en niños meses o años después de haber recibido tratamiento con metotrexate intratetacal31.
Mielitis
Es una complicación infrecuente pero grave que tiende a ser progresiva y permanente. En su desarrollo se han implicado tanto al daño endotelial de la microcirculación de la médula espinal como al daño directo en las células gliales32, 33.
De acuerdo con estas hipótesis, la radioterapia produciría un daño en la microcirculación que condicionaría la aparición de una necrosis hemorrágica y un área de infarto medular, o bien el daño en las células gliales ocasionaría una desmielinización progresiva y una necrosis de de la sustancia blanca. Este doble origen explicaría la aparición bimodal de la mielopatía post-radioterapia. Dosis por debajo de los 4500 cGy administradas con fraccionamiento convencional de 180-200 cGy/día han sido tradicionalmente consideradas seguras para evitar el riesgo de mielopatía. No obstante, recientes estudios sugieren que dosis superiores a 5000 cGy pueden ser bien toleradas por la medula espinal sin asociarse a la aparición de complicaciones severas33.
También distintos agentes quimioterápicos como cisplatino, carboplatino, oxaliplatino, los alcaloides de la vinca, taxanos o la citarabina se han asociado con el desarrollo de trastornso neurológicos periféricos, principalmente neuropatía axonal sensitiva pura, motora pura, sensitivo-motora o del sistema nervioso autónomo34.
VI. Cabeza y cuello
Trastornos oculares
La irradiación de los ojos y sus anejos puede ocasionar a largo plazo la aparición de cambios estructurales cono entropión o ectropion; queratitis seca, por daño de las glándulas lagrimales; epífora, en respuesta a la queratitis seca o como consecuencia de la fibrosis y obstrucción del conducto lagrimal o cataratas por daño en la zona germinal del cristalino. Otras complicaciones menos frecuentes son la aparición de retinopatía post-radioterapia, caracterizada por la presencia de una microangiopatía oclusiva similar a la retinopatía diabética y la presencia de neuropatía óptica caracterizada por la pérdida brusca e indolora de la visión por uno o ambos ojos secundaria a la lesión del I par craneal.
Trastornos auditivos
Tras la radioterapia pueden aparecer déficit auditivos por daño coclear o neuronal (VII par) caracterizados típicamente por pérdidas de la audición de las frecuencias agudas.
Xerostomía
El efecto de la radioterapia sobre las glándulas salivares se traduce en una pérdida, en ocasiones irreversibles, en la capacidad de producir saliva. La arquitectura normal glandular es reemplazada por un infiltrado inflamatorio que conduce a atrofia y fibrosis con la consiguiente pérdida de la funcionalidad35.
La intensidad y severidad de la xerostomía post-radioterapia dependerá tanto de la dosis administrada como de la cantidad de glándula irradiada. Dosis superiores a 4000 cGy ocasionan un daño permanente en la capacidad de producir saliva36.
Trastornos dentales
Tras la exposición a dosis altas de irradiación la pulpa dental disminuye su vascularización apareciendo fibrosis y atrofia. La respuesta de la pulpa dental a las infecciones, traumatismos y manipulaciones dentales está comprometida e incluso la respuesta dolorosa ante la presencia de caries está disminuida18, 19.
Trastornos tiroideos
Se ha descrito la presencia de hipotiroidismo primario, habitualmente subclínico, en pacientes que reciben radioterapia sobre el cuello, pero también secundario a déficit de la hormona estimulante del tiroides (TSH) tras irradiación de adenomas de hipófisis o de tumores cerebrales primarios.
Más raramente se ha descrito la aparición de cuadros de tirotoxicosis o de tiroiditis de Hashimoto en pacientes con enfermedad de Hodgkin que recibieron irradiación cervical.
VII. Tórax
Esófago
A largo plazo, y tras la recuperación de la esofagitis aguda, aparece engrosamiento de la submucosa, telangiectasias y presencia de fibroblastos atípicos. La capa muscular se fibrosa, especialmente alrededor de los plexos nerviosos. La traducción clínica de la fibrosis submucosa es un estrechamiento de la luz esofágica de variable grado de intensidad37.
Pulmón
La incidencia de neumonitis post-radioterapia varía entre el 5-20% de los pacientes que reciben tratamiento por cánceres de pulmón, y algo menor (5-15%) en pacientes con tumores mediastínicos o cáncer de mama38.
Sin embargo, radiologicamente la mayoría de pacientes presentan numerosas evidencias de fibrosis pulmonar incluyendo contracciones, engrosamiento pleural, elevación de un hemidiafragma o desviación de la traquea y del mediastino hacia el lado irradiado39. Pese a la alta incidencia de cambios radiológicos, no existe relación directa clara entre el grado de anomalía radiológica y su repercusión clínica40.
La neumonitis es el resultado de un proceso de daño sobre los neumocitos tipo II y las células endoteliales. Existe acúmulo de un exudado proteináceo en los alvéolos, descamación de las células epiteliales de las paredes de los alvéolos, edema alveolar e infiltración por células inflamatorias, lo que lleva a una disminución en el intercambio gaseoso y una disminución de la distensibilidad pulmonar.
Clínicamente la neumonitis tardía se caracteriza por un cuadro de disnea progresiva meses o años después de la radioterapia, que precisa de tratamiento con corticoesteroides y oxígeno en muchas ocasiones.
Además de la neumonitis post-radioterapia, se han descrito otras alteraciones como estenosis bronquial, broncomalacia o fibrosis mediastínica41.
Corazón
La irradiación incidental del corazón durante el tratamiento de cánceres localizados en la vecindad (pulmón, mama, esófago, tumores del mediastino) puede ocasionar un amplio espectro de complicaciones tardías. A pesar de que las mejoras técnicas han disminuido el volumen cardiaco irradiado y los daños ocasionados, el creciente uso de esquemas combinados de radioquimioterapia han incrementado el riesgo de toxicidad cardiaca.
Enfermedad coronaria
En pacientes irradiados por Enfermedad de Hodgkin se ha observado un aumento del riesgo relativo de enfermedad coronaria fatal en comparación con la población general.
La aparición de complicaciones cardiovasculares durante el seguimiento en mujeres tratadas por cáncer de mama ha sido ampliamente estudiado en los últimos años. La administración de radioterapia tras cirugía, la utilización de esquemas de quimioterapia conteniendo antraciclinas e incluso la menopausia que el tratamiento sistémico (quimioterapia, hormonoterapia) induce en numerosas pacientes son factores que han sido relacionados con un mayor aumento en la toxicidad cardiaca.
La gran mayoría de los trabajos analizados empleaban técnicas de radioterapia hoy en desuso: ortovoltaje, campos amplios y directos, campos tangenciales profundos o irradiación indiscriminada de todas las áreas ganglionares.
En una reciente revisión de los ensayos a aleatorizados publicados entre 1994 y 2001, Rutqvist et al. analizan 42 trabajos que utilizan técnicas más modernas. La conclusión evidente que se obtiene de esta revisión es que la radioterapia tras cirugía bien sea mastectomía o cirugía conservadora disminuye la incidencia de recidiva local, aumenta el intervalo libre de enfermedad y la supervivencia causa-específica, pero que este beneficio no es tan evidente sobre la supervivencia global debido al incremento en la aparición de fenómenos cardiovasculares. Sin embargo, 3 de los 4 estudios que específicamente inciden en este punto de la toxicidad cardiovascular no observan ninguna diferencia entre aquellas mujeres que reciben radioterapia frente a las que reciben cirugía exclusiva, ni entre las pacientes irradiadas en la mama izquierda o derecha42.
Miocardiopatía
La radioterapia se ha asociado con una disminución a largo plazo en la función diastólica y sistólica del ventrículo izquierdo, distinta de la disminución transitoria en la fracción de eyección del ventrículo izquierdo que se observa de manera aguda tras la radioterapia. En aquellos pacientes que reciben además tratamiento con quimioterapia con antraciclinas predomina la miocardiopatía dilatada, mientras que la miocardiopatía restrictiva es más frecuente en pacientes que no reciben quimioterapia con antraciclinas. La combinación de radioterapia y antraciclinas se asocia con una mayor toxicidad tardía que amabas por separado. La radioterapia produciría daño en el endotelio de los capilares del miocardio originando áreas de isquemia y finalmente fibrosis miocárdica, mientras que las antraciclinas se asociarían con el daño directo del miocito y fibrosis miocárdica difusa.
Pericarditis
Es una de las complicaciones mas frecuentes de la radioterapia del mediastino. Con técnicas modernas de radioterapia, su frecuencia ha disminuido de cerca del 20% de los pacientes a menos de un 2,5%43. Puede ser asintomática o manifestarse con los típicos síntomas de dolor pleurítico, disnea, fiebre, roce pericárdico y cambios electrocardiográficos.
Valvulopatías
Se ha descrito la presencia de valvulopatías en pacientes tratados con radioterapia por Enfermedad de Hodgkin, y de manera más frecuente la insuficiencia valvular que la estenosis44, pero no se ha podido establecer una relación causa-efecto entre la radioterapia y la aparición de valvulopatías ni en humanos ni en modelos animales experimentales.
Anomalías en la conducción
La aparición de arritmias en forma de bradicardia del nodo auriculo-ventricular, bloqueos de todos los tipos o síndrome del seno enfermo se ha relacionado con complicaciones tardías de la radioterapia del mediastino45, 46.
Otras alteraciones
Estenosis, fibrosis de la arteria carótida, de la arteria aorta o de las arterias pulmonares47, quilotórax48.
VIII. Abdomen
Estómago
La irradiación del estómago se ha asociado a largo plazo con el desarrollo de cuadros de dispepsia, gastritis, ulceración y perforación gástrica en relación con la presencia de fibrosis submucosa radioinducida.
Intestino
La presencia de toxicidad tardía intestinal, aunque menos frecuente que la aguda, es sumamente importante por su carácter progresivo y elevada morbimortalidad. Se caracteriza por trastornos en la motilidad intestinal y cuadros malabsortivos, y requiere en muchas ocasiones de tratamiento quirúrgico o nutrición parenteral.
La incidencia y severidad de la enteropatía post-radioterapia dependerá de la dosis total, del fraccionamiento, del volumen de intestino irradiado así como del empleo de quimioterapia concomitante o de la presencia de comorbilidades. Después de la irradiación abdómino-pélvica, se aprecian síntomas o signos de disfunción crónica intestinal en el 60-90% de pacientes, lo que sugiere que la enteropatía crónica intestinal es casi inevitable tras la radioterapia49.
La patogenia de la enteritis crónica es compleja, y comprende cambios en la mayoría de estructuras que forman la pared intestinal: atrofia mucosa, fibrosis intestinal o esclerosis vascular que originan cuadros de malabsorción (intolerancia a la lactosa, déficit de vitamina B-12, esteatorrea) y trastornos en la normal motilidad intestinal (estreñimiento, diarrea)50.
Hígado
La enfermedad hepática radioinducida se manifiesta habitualmente de forma subaguda, pero en ocasiones puede desarrollarse una fibrosis crónica que asemeja fielmente un cuadro de cirrosis micronodular con insuficiencia hepática secundaria.
Riñones
Tras la irradiación de uno o ambos riñones puede observarse, dependiendo del volumen renal normofuncionante irradiado, la aparición de un cuadro de neuropatía tardía caracterizado por proteinuria e hipertensión arterial, que puede ser progresivo hacia el desarrollo de una insuficiencia renal franca.
IX. Pelvis
Recto
La presencia de toxicidad rectal crónica en diferentes grados de severidad es frecuente en pacientes tratados de cáncer de próstata. Aproximadamente un 25% de los pacientes lo experimentan, pero son pocos los que necesitan tratamiento agresivo.
Las manifestaciones clínicas están en relación con la porción de la pared rectal más afectada. Así, en los casos de toxicidad de predominio mucoso, la manifestación clínica será la presencia de heces hematoquécicas como consecuencia del desarrollo de una mucosa rectal extremadamente friable y con telangiectasias. Por otro lado, en los casos en los que predomina la fibrosis de la pared rectal la manifestación más frecuente será la urgencia rectal por disfunción del esfínter ano-rectal.
Vejiga
En la vejiga pueden observarse un amplio espectro de complicaciones, tanto sobre el epitelio de la mucosa como sobre el estroma subyacente. Se desarrolla una fibrosis intersticial que se acompaña de endarteritis y telangiectasias. Los vasos de la submucosa aparecen dilatados y tortuosos in en ocasiones aparecen roturas en la pared de los mismos que condicionas la presencia de hematuria. Si el daño inflingido es grande o la viabilidad de los tejidos está comprometida, pueden producirse ulceraciones o fístulas, que en ocasiones son indistinguibles de una recidiva tumoral. Cuando la necrosis se hace más extensa, se produce la colonización por gérmenes que agravan el cuadro. La presencia prolongada y mantenida de fibrosis e infecciones en la vejiga puede ocasionar reflujo vesicoureteral y pielonefritis con daño renal secundario. [PEARSE Moss Radiation Oncology pp520]
Vulva y vagina
La irradiación de la vulva y vagina puede provocar, a largo plazo y como consecuencia de la fibrosis radioinducida del tejido celular subcutáneo, la aparición de cuadros de atrofia, sequedad o prurito así como la formación de sinequias ocasionando dispareunia.
En ocasiones se ha descrito la aparición de fístulas recto-vaginales o vésico-vaginales tras braquiterapia ginecológica.
Trastornos reproductivos
En mujeres premenopáusicas expuestas a la irradiación de los ovarios como consecuencia de tumores de localización pélvica se ha descrito el desarrollo de menopausia prematura. Del mismo modo, en hombres pueden aparecer cuadros de oligoespermia o azospermia así como cambios hormonales por déficit de testosterona.
Disfunción eréctil
Se han descrito alteraciones en la erección como consecuencia del tratamiento entre el 20-60% de los pacientes que reciben radioterapia externa. Este porcentaje es algo menor (15-25%) en los pacientes tratados con braquiterapia con implante de semillas de I-125. No obstante, la incidencia de disfunción eréctil post-radioterapia dependerá en gran medida de la edad de los pacientes al diagnóstico, del tiempo de seguimiento post-tratamiento así como del método empleado en su medición.
La etiopatogenia de la disfunción eréctil parece estar relacionada con una doble vertiente. Por un lado se ha implicado el daño en la circulación arteriolar que nutre los cuerpos cavernosos, y por otro lado se ha relacionado con el daño radioinducido en los plexos neurovasculares de la raíz del pene. Recientemente se ha demostrado una asociación entre la dosis administrada al bulbo peneano (> ó <52,5 Gy) y la incidencia de impotencia52-54.
Tratamiento de la toxicidad tardía
Numerosas estrategias han sido desarrolladas para combatir las complicaciones crónicas del tratamiento, pero si bien un porcentaje importante de ellos ha demostrado buenos resultados en estudios fase I/II, pocos son los que lo han confirmado en estudios en fase III.
Orgoteina
La superóxido dismutasa (SOD) fue la primera sustancia que demostró disminuir la fibrosis tardía radioinducida. En humanos existen 2 subtipos de SOD, una variedad mitocondrial (MnSOD) y una variedad citoplasmática y nuclear (Cu/ZnSOD). La orgoteina (superóxido dismutasa (SOD)), es una metaloproteína con capacidad para catalizar el radical superóxido a peróxido de hidrógeno y oxígeno impidiendo su acción sobre las membranas celulares y los ácidos nucleicos. Además, posee propiedades antiinflamatorias, antivirales y quimiotácticas55.
Recientemente se ha sugerido que la SOD reduce la expresión de TGF-_1 en los miofibroblastos asociándose a una regulación a la baja en la producción de cadenas de colágeno. La SOD administrada de forma exógena capaz de penetrar en las células y disminuir la expresión de TGF-b1.
La orgoteina es capaz de controlar los efectos secundarios de la radioterapia sin disminuir la eficacia antitumoral. Diversos ensayos han demostrado su eficacia tanto en el tratamiento como en la prevención de la toxicidad tardía, principalmente fibrosis subcutánea, como aguda, especialmente epitelitis, mucositis, enteritis o cistitis56-60.
Pentoxifilina
Es un derivado metilxantínico empleado en el tratamiento de las úlceras por éxtasis venoso, la claudicación intermitente y la insuficiencia cerebrovascular. Los estudios "in vitro" han demostrado que la pentoxifilina disminuye la viscosidad sanguínea, incrementa la flexibilidad de los hematíes y la oxigenación tisular. Al mismo tiempo favorece la desagregación plaquetaria y estimula la liberación de prostaciclinas del endotelio normal que es capaz de inhibir, parcialmente, la cascada de citoquinas liberadas tras el daño tisular al tiempo que inhibe la producción de tromboxano A261.
Por otro lado, otros estudios también han demostrado que la pentoxifilina inhibe la proliferación de fibroblastos dérmicos y la producción de matriz extracelular, aumentando la actividad colagenasa62, 63.
Los estudios "in vivo" no obstante, no han demostrado un beneficio claro en la disminución de la fibrosis radioinducida, pese a haberse comunicado casos aislados64, 65.
Pentoxifilina y vitamina E (Alfa-Tocoferol)
La vitamina E de forma fisiológica neutraliza los radicales libres de oxigeno generados durante los fenómenos de oxidación y protege las membranas celulares de la peroxidación lipídica. En la práctica clínica se ha empleado la vitamina E para disminuir los niveles de colesterol plasmático, y desde hace mas de 50 años se conoce que la carencia de vitamina E se asocia con una reparación anormal del tejido conectivo.
La combinación de pentoxifilina y vitamina E se ha asociado en algunos estudios con una excelente tasa de respuestas (>80%) de la fibrosis radioinducida con aceptable tolerancia66.
Corticoesteroides
Se han empleado ampliamente en el tratamiento de las complicaciones radioinducidas, existiendo una amplia evidencia de su efecto antiinflamatorio pero menos de su utilidad en el tratamiento de la fibrosis radioinducida establecida. Si bien existen estudios de laboratorio que demuestran tanto prevención como reducción de la fibrosis tardía67, 68, su traducción en estudios realizados sobre pacientes es mucho menor.
Modificadores del sistema renina-angiotensina
La angiotensina II condiciones normales aumenta la síntesis y disminuye la degradación de los componentes de la matriz extracelular y su respuesta parece mediada por el TGF-b1.
Los inhibidores de la encima convertidota de la angiotensina (IECA), como el captopril o el enalapril, bloquean la conversión de la angiotensina I en angiotensina II. El IECA captopril tiene además propiedades similares a la SOD69, inhibe la agregación plaquetaria, disminuye la disfunción endotelial pulmonar ocasionada por la radioterapia y la fibrosis pulmonar post-radioterapia70-72.
Igualmente, los antagonistas del receptor de la angiotensina II como losartán o valsartán bloquean selectivamente éste impidiendo la acción de la angiotensina II y pueden ser de utilidad tanto en la prevención como en el tratamiento de la neumonitis y de la nefropatía crónica postradioterapia73.
Sucralfato
El sucralfato es una sal de aluminio no absorbible utilizada en el tratamiento de las úlceras gástricas. Actúa mediante la unión a proteínas de la mucosa formando una barrera mecánica. También posee un una acción cicatrizante mediante la estimulación del crecimiento celular al inducir la síntesis de prostaglandinas y del factor de crecimiento epitelial (EGF) así como incrementando la circulación epitelial y la producción de moco. Por último que actúa como antiinflamatorio local y tiene acción antibacteriana propia.
La eficacia del sucralfato en el tratamiento de la proctitis crónica es superior al obtenido con corticoesteroides o ácido 5-aminosalicílico74.
Ácido hialurónico
Es un polímero natural presente en la dermis en condiciones normales y que actúa en los procesos de cicatrización mediante la estimulación de granulocitos y fibrina y la proliferación de fibroblastos.
Favorece y acelera los procesos de recuperación y cicatrización normal de la mucosa oral, rectal, vesical y vaginal75.
Amifostina
Es un tiofosfato orgánico (WR 2721) que es defosforilado por una encima fosfatasa alcalina presente en la membrana plasmática celular convirtiéndose en el principio activo WR1065. Este metabolito actúa secuestrando los radicales libres que se producen en los fenómenos de interacción entre la radiación ionizante y las moléculas de agua del tejido, así como los radicales libres originados por determinados fármacos citotóxicos. La relativa ausencia de la encima fosfatasa alcalina en la membrana de las células tumorales comparadas con las células normales, sugiere por que su efecto es radioprotector del tejido sano y no del tejido tumoral.
La amifostina se acumula activamente en el tejido de las glándulas salivares, siendo por tanto un eficaz protector de la glándula sana. Numerosos estudios sugieren que su empleo de manera conjunta con la radioterapia en el tratamiento de tumores de cabeza y cuello protege frente al desarrollo de xerostomía crónica, sin aparente pérdida del control tumoral76, 77.
Igualmente, el empleo de amifostina durante la radioterapia de los cánceres de pulmón ha demostrado disminuir la incidencia y severidad de la esofagitis, neumonitis y fibrosis pulmonar asociada78, así como de la enteritis y proctitis aguda cuando se administró en instilación rectal durante la radioterapia79.
Pilocarpina
Se trata de un agonista colinérgico parasimpaticomimético de los receptores muscarínicos que estimulan la secreción salival.
Dos estudios aleatorizados demostraron su eficacia en el tratamiento de la xerostomía tardía radioinducida, observándose una mejoría en la cantidad y calidad de la saliva producida, frente a la administración de placebo80, 81.
Sildenafilo
Es un relajante de la fibra muscular lisa que favorece el llenado de los cuerpos cavernosos del pene incrementando la calidad y duración de la erección. Su administración a pacientes sometidos a radioterapia prostática ha demostrado aumentar la firmeza y duración de la erección hasta en un 70% de ellos. Del mismo modo, también resulta eficaz, si bien en menor medida (40%), en pacientes con disfunción eréctil post-prostatectomía82.
Oxígeno hiperbárico
La disminución del calibre de la microcirculación asociada al efecto de la radioterapia ocasiona una depleción vascular progresiva del lecho de irradiación y una insuficiente oxigenación de los tejidos. Estos fenómenos favorecen el desarrollo de complicaciones tardías como son induración, fibrosis o necrosis. La exposición repetida a oxígeno hiperbárico aumenta la difusión del oxígeno, favorece la síntesis y remodelación del colágeno y estimula la neovascularización. Es plausible pensar que la neovascularización inducida por el oxígeno hiperbárico inducirá una mayor oxigenación y reparación del tejido blando y del hueso dañado por la radioterapia83. La evidencia existente hoy en día sugiere el mayor beneficio del oxígeno hiperbárico en la disminución de la osteoradionecrosis, de la necrosis laríngea84, y de la cistitis hemorrágica y proctitis crónica85.
Otras medidas
En fase de desarrollo y experimentación existen actualmente otros fármacos que podrían ofrecer pronto prometedores resultados en la prevención y tratamiento de las complicaciones tardías post-radioterapia como los ácidos grasos poliinsaturados, la desferroxiamina o el factor estimulante del crecimiento de queratinocitos, palifermin.
Conclusiones
La aparición de complicaciones a largo plazo es, sin lugar a dudas, uno de los principales factores limitantes de la eficacia de los tratamientos oncológicos. En el momento actual existe la imperiosa necesidad de definir con exactitud la incidencia y prevalencia de la toxicidad tardía radioinducida tanto de manera global como relativa a cada órgano, así como las consecuencias médicas, sobre la calidad de vida de los pacientes y el coste económico que estas complicaciones tienen con el fin de poder establecer las prioridades en la prevención y tratamiento de las mismas.
El agente protector ideal sería aquel que posea una alta eficacia, baja toxicidad y bajo coste, y que no se asocie con fenómenos de protección tumoral. La mayoría de medicación disponible en la actualidad no cumple uno o más de estos criterios, por lo que parece razonable limitar su uso a los pacientes con mayor riesgo de desarrollar complicaciones.
Las estrategias de futuro deberán incluir:
• Mejoras técnicas de la radioterapia que permitan disminuir la dosis administrada en órganos sanos: modulación de la intensidad de dosis (IMRT), radioterapia confirmada 4D, simulación virtual funcional mediante planificación con PET-TAC, etc.
• El desarrollo de terapias basados en la inhibición de la cascada de citoquinas desencadenada por RT/QT/Cirugía así como de antagonistas del TGF-b1, parecen las vías más prometedoras tanto para el tratamiento como la prevención de la toxicidad tardía.
Bibliografía
1. Bentzen SM, Dorr W, Anscher MS, et al. Normal tissue effects: Reporting and analysis. Semin Radiat Oncol. 2003;13(3):189-202. [ Links ]
2. Delanian S, Martin M, Housset M. Iatrogenic fibrosis in cancerology (1): descriptive and physiopathological aspects. Bull Cancer. 1993;80(3):192-201. [ Links ]
3. Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys. 1995 ;31(5):1341-6. [ Links ]
4. Rubin P, Constine LS, Fajardo LF, Phillips TL, Wasserman TH. RTOG Late Effects Working Group. Overview. Late Effects of Normal Tissues(LENT) scoring system. Int J Radiat Oncol Biol Phys. 1995;31(5):1041-2. [ Links ]
5. Trotti A, Byhardt R, Stetz J, et al. Common toxicity criteria: version 2.0. an improved reference for grading the acute effects of cancer treatment: impact on radiotherapy. Int J Radiat Oncol Biol Phys. 2000;47(1):13-47. [ Links ]
6. Trotti A, Colevas AD, Setser A, et al. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment. Semin Radiat Oncol. 2003;13(3):176-81. [ Links ]
7. Rubin P, Casarett GW. Clinical radiation pathology as applied to curative radiotherapy. Cancer. 1968 Oct;22(4):767-78. [ Links ]
8. Williams J, Chen Y, Rubin P, Finkelstein J, Okunieff P. The biological basis of a comprehensive grading system for the adverse effects of cancer treatment. Semin Radiat Oncol. 2003;13(3):182-8. [ Links ]
9. Coleman CN, Harris JR. Current scientific issues related to clinical radiation oncology. Radiat Res. 1998 Aug;150(2):125-33. [ Links ]
10. Fedyk ER, Jones D, Critchley HO, et al. Expression of stromal-derived factor-1 is decreased by IL-1 and TNF and in dermal wound healing. J Immunol. 2001;166(9):5749-54. [ Links ]
11. Mercado AM, Padgett DA, Sheridan JF, Marucha PT. Altered kinetics of IL-1 alpha, IL-1 beta, and KGF-1 gene expression in early wounds of restrained mice. Brain Behav Immun. 2002;16(2):150-62. [ Links ]
12. Petak I, Houghton JA. Shared pathways: death receptors and cytotoxic drugs in cancer therapy. Pathol Oncol Res. 2001;7(2):95-106. [ Links ]
13. Zheng H, Wang J, Koteliansky VE, Gotwals PJ, Hauer-Jensen M. Recombinant soluble transforming growth factor beta type II receptor ameliorates radiation enteropathy in mice. Gastroenterology. 2000;119(5):1286-96. [ Links ]
14. Wang JF, Olson ME, Reno CR, Kulyk W, Wright JB, Hart DA. Molecular and cell biology of skin wound healing in a pig model. Connect Tissue Res. 2000;41(3):195-211. [ Links ]
15. Meadows AT, Silber J. Delayed consequences of therapy for childhood cancer. CA Cancer J Clin. 1985;35(5):271-86. [ Links ]
16. Meadows AT, Baum E, Fossati-Bellani F, et al. Second malignant neoplasms in children: an update from the Late Effects Study Group. J Clin Oncol. 1985;3(4):532-8. [ Links ]
17. Ewing J. Radiation osteitis. Acta Radiol 1926;6:399-412. [ Links ]
18. Andrews N, Griffiths C. Dental complications of head and neck radiotherapy: Part 1. Aust Dent J. 2001;46(2):88-94. [ Links ]
19. Andrews N, Griffiths C. Dental complications of head and neck radiotherapy: Part 2. Aust Dent J. 2001;46(3):174-82. [ Links ]
20. Kumar AJ, Leeds NE, Fuller GN, Van Tassel P, et al. Malignant gliomas: MR imaging spectrum of radiation therapy- and chemotherapy-induced necrosis of the brain after treatment. Radiology. 2000;217(2):377-84 [ Links ]
21. Sheline GE. The role of radiation therapy in the treatment of low-grade gliomas. Clin Neurosurg. 1986;33:563-74. [ Links ]
22. Delattre JY, Rosenblum MK, Thaler HT, et al. A model of radiation myelopathy in the rat. Pathology, regional capillary permeability changes and treatment with dexamethasone. Brain. 1988;111 ( Pt 6):1319-36. [ Links ]
23. Davidson A, Tait DM, Payne GS, et al. Magnetic resonance spectroscopy in the evaluation of neurotoxicity following cranial irradiation for childhood cancer. Br J Radiol. 2000; 73(868):421-4. [ Links ]
24. Langleben DD, Segall GM. PET in differentiation of recurrent brain tumor from radiation injury. J Nucl Med. 2000; 41(11):1861-7. [ Links ]
25. Silber JH, Radcliffe J, Peckham V, et al. Whole-brain irradiation and decline in intelligence: the influence of dose and age on IQ score. J Clin Oncol. 1992;10(9):1390-6. [ Links ]
26. Duffner PK, Horowitz ME, Krischer JP, et al. Postoperative chemotherapy and delayed radiation in children less than three years of age with malignant brain tumors. N Engl J Med. 1993 17;328(24):1725-31. [ Links ]
27. Keime-Guibert F, Napolitano M, Delattre JY. Neurological complications of radiotherapy and chemotherapy. J Neurol. 1998;245(11):695-708. [ Links ]
28. Gonzalez H, Bolgert F, Camporo P, Leblond V. Progressive multifocal leukoencephalitis (PML) in three patients treated with standard-dose fludarabine (FAMP). Hematol Cell Ther. 1999 Aug;41(4):183-6. [ Links ]
29. Herzig RH, Hines JD, Herzig GP, Wolff SN, et al. Cerebellar toxicity with high-dose cytosine arabinoside. J Clin Oncol. 1987;5(6):927-32. [ Links ]
30. Tuchman M, Stoeckeler JS, Kiang DT, et al. Familial pyrimidinemia and pyrimidinuria associated with severe fluorouracil toxicity. N Engl J Med. 1985;313(4):245-9. [ Links ]
31. Blay JY, Conroy T, Chevreau C, et al. High-dose methotrexate for the treatment of primary cerebral lymphomas: analysis of survival and late neurologic toxicity in a retrospective series. J Clin Oncol. 1998;16(3):864-71. [ Links ]
32. Rampling R, Symonds P. Radiation myelopathy. Curr Opin Neurol. 1998;11(6):627-32. [ Links ]
33. McCunniff AJ, Liang MJ. Radiation tolerance of the cervical spinal cord. Int J Radiat Oncol Biol Phys. 1989;16(3):675-8. [ Links ]
34. St. Clair WH, Arnold SM, Sloan AE, Regine WF. Spinal cord and peripheral nerve injury: current management and investigations. Semin Radiat Oncol 2003;13:322-332. [ Links ]
35. Mossman K, Shatzman A, Chencharick J. Long-term effects of radiotherapy on taste and salivary function in man. Int J Radiat Oncol Biol Phys. 1982;8(6):991-7. [ Links ]
36. Eneroth CM, Henrikson CO, Jakobsson PA. Effect of fractionated radiotherapy on salivary gland function. Cancer. 1972;30(5):1147-53. [ Links ]
37. Berthrong M, Fajardo LF. Radiation injury in surgical pathology. Part II. Alimentary tract. Am J Surg Pathol. 1981;5(2):153-78. [ Links ]
38. Marks LB, Yu X, Vujaskovic Z, Small W Jr, Folz R, Anscher MS. Radiation-induced lung injury. Semin Radiat Oncol. 2003;13(3):333-45 [ Links ]
39. Marks LB. The pulmonary effects of thoracic irradiation. Oncology (Huntingt). 1994;8(6):89-106. [ Links ]
40. Garipagaoglu M, Munley MT, Hollis D, et al. The effect of patient-specific factors on radiation-induced regional lung injury. Int J Radiat Oncol Biol Phys. 1999;45(2):331-8. [ Links ]
41. Dechambre S, Dorzee J, Fastrez J, et al. Bronchial stenosis and sclerosing mediastinitis: an uncommon complication of external thoracic radiotherapy. Eur Respir J. 1998;11(5):1188-90. [ Links ]
42. Rutqvist LE, Rose C, Cavallin-Stahl E. A systematic overview of radiation therapy effects in breast cancer. Acta Oncol. 2003;42(5-6):532-45. [ Links ]
43. Carmel RJ, Kaplan HS. Mantle irradiation in Hodgkin's disease. An analysis of technique, tumor eradication, and complications. Cancer. 1976;37(6):2813-25. [ Links ]
44. Carlson RG, Mayfield WR, Normann S, Alexander JA. Radiation-associated valvular disease. Chest. 1991;99(3):538-45. [ Links ]
45. Orzan F, Brusca A, Conte MR, Presbitero P, Figliomeni MC. Severe coronary artery disease after radiation therapy of the chest and mediastinum: clinical presentation and treatment. Br Heart J. 1993;69(6):496-500. [ Links ]
46. Slama MS, Le Guludec D, Sebag C, et al. Complete atrioventricular block following mediastinal irradiation: a report of six cases. Pacing Clin Electrophysiol. 1991;14(7):1112-8. [ Links ]
47. Warda M, Khan A, Massumi A, Mathur V, Klima T, Hall RJ. Radiation-induced valvular dysfunction. J Am Coll Cardiol. 1983;2(1):180-5. [ Links ]
48. Van Renterghem D, Hamers J, De Schryver A, Pauwels R, Van der Straeten M. Chylothorax after mantle field irradiation for Hodgkin's disease. Respiration. 1985;48(2):188-9. [ Links ]
49. Yeoh E, Horowitz M, Russo A, et al. A retrospective study of the effects of pelvic irradiation for carcinoma of the cervix on gastrointestinal function. Int J Radiat Oncol Biol Phys. 1993; 26(2):229-37. [ Links ]
50. Husebye E, Hauer-Jensen M, Kjorstad K, Skar V. Severe late radiation enteropathy is characterized by impaired motility of proximal small intestine. Dig Dis Sci. 1994;39(11):2341-9. [ Links ]
51. Pearse HD. The urinary bladder. En: Moss' Radiation Oncology 7th edition. JD Cox, editor, pp 518-555. Mosby, 1994 S. Luis, EE.UU. [ Links ]
52. Roach M, Winter K, Michalski JM, et al. Penile bulb dose and impotence after three-dimensional conformal radiotherapy for prostate cancer on RTOG 9406: findings from a prospective, multi-institutional, phase I/II dose-escalation study. Int J Radiat Oncol Biol Phys. 2004 ;60(5):1351-6. [ Links ]
53. Wernicke AG, Valicenti R, Dieva K, Houser C, Pequignot E. Radiation dose delivered to the proximal penis as a predictor of the risk of erectile dysfunction after three-dimensional conformal radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys. 2004;60(5):1357-63. [ Links ]
54. McLaughlin PW, Narayana V, Meriowitz A, et al. Vessel-sparing prostate radiotherapy: dose limitation to critical erectile vascular structures (internal pudendal artery and corpus cavernosum) defined by MRI. Int J Radiat Oncol Biol Phys. 2005 Jan 1;61(1):20-31. [ Links ]
55. Delanian S, Baillet F, Huart J, et al. Successful treatment of radiation-induced fibrosis using liposomal Cu/Zn superoxide dismutase: clinical trial. Radiother Oncol. 1994;32(1):12-20. [ Links ]
56. Valencia J, Velilla C, Urpegui A, et al.Bascon N, Esco R. The efficacy of orgotein in the treatment of acute toxicity due to radiotherapy on head and neck tumors. Tumori. 2002 Sep-Oct;88(5):385-9. [ Links ]
57. Lefaix JL, Delanian S, Leplat JJ, et al. (Radiation-induced cutaneo-muscular fibrosis (III): major therapeutic efficacy of liposomal Cu/Zn superoxide dismutase) Bull Cancer. 1993 Sep;80(9):799-807. [ Links ]
58. Delanian S, Martin M, Housset M. (Iatrogenic fibrosis in cancerology (1): descriptive and physiopathological aspects) Bull Cancer. 1993 Mar;80(3):192-201. [ Links ]
59. Delanian S, Lefaix JL, Housset M. (Iatrogenic fibrosis in cancerology (2): main etiologies and therapeutic possibilities) Bull Cancer. 1993 Mar;80(3):202-12. [ Links ]
60. Ruiz Martín V, Algara López M, Foro Arnalot A, et al. Eficacia de la orgoteina en el tratamiento de la fibrosis y xerostomía radioinducidas. Oncología 1995; 18:60-64. [ Links ]
61. O'Sullivan B, Levin W. Late radiation-related fibrosis: pathogenesis, manifestations, and current management. Semin Radiat Oncol. 2003;13(3):274-89. [ Links ]
62. Duncan MR, Hasan A, Berman B. Pentoxifylline, pentifylline, and interferons decrease type I and III procollagen mRNA levels in dermal fibroblasts: evidence for mediation by nuclear factor 1 down-regulation. J Invest Dermatol. 1995;104(2): 282-6. [ Links ]
63. Berman B, Wietzerbin J, Sanceau J, et al. Pentoxifylline inhibits certain constitutive and tumor necrosis factor-alpha-induced activities of human normal dermal fibroblasts. J Invest Dermatol. 1992 ;98(5):706-12. [ Links ]
64. Futran ND, Trotti A, Gwede C. Pentoxifylline in the treatment of radiation-related soft tissue injury: preliminary observations. Laryngoscope. 1997;107(3):391-5. [ Links ]
65. Steeves RA, Robins HI. Pentoxifylline treatment of radiation mastitis. Int J Radiat Oncol Biol Phys. 1998;42(5):1177. [ Links ]
66. Delanian S, Balla-Mekias S, Lefaix JL. Striking regression of chronic radiotherapy damage in a clinical trial of combined pentoxifylline and tocopherol. J Clin Oncol. 1999;17(10):3283-90. [ Links ]
67. Evans ML, Graham MM, Mahler PA, Rasey JS. Use of steroids to suppress vascular response to radiation. Int J Radiat Oncol Biol Phys. 1987;13(4):563-7. [ Links ]
68. Geraci JP, Mariano MS, Jackson KL. Amelioration of radiation nephropathy in rats by dexamethasone treatment after irradiation. Radiat Res. 1993;134(1):86-93. [ Links ]
69. Roberts NA, Robinson PA. Copper chelates of antirheumatic and anti-inflammatory agents: their superoxide dismutase-like activity and stability. Br J Rheumatol. 1985;24(2):128-36. [ Links ]
70. Ward WF, Molteni A, Ts'ao CH, et al. Radiation pneumotoxicity in rats: modification by inhibitors of angiotensin converting enzyme. Int J Radiat Oncol Biol Phys. 1992;22(3):623-5. [ Links ]
71. Ward WF, Molteni A, Ts'ao CH, Hinz JM. Captopril reduces collagen and mast cell accumulation in irradiated rat lung. Int J Radiat Oncol Biol Phys. 1990;19(6):1405-9. [ Links ]
72. Ward WF, Kim YT, Molteni A, Solliday NH. Radiation-induced pulmonary endothelial dysfunction in rats: modification by an inhibitor of angiotensin converting enzyme. Int J Radiat Oncol Biol Phys. 1988;15(1):135-40. [ Links ]
73. Molteni A, Moulder JE, Cohen EP, et al. Prevention of radiation-induced nephropathy and fibrosis in a model of bone marrow transplant by an angiotensin II receptor blocker. Exp Biol Med 2001;226(11):1016-23. [ Links ]
74. Kochhar R, Patel F, Dhar A, et al. Radiation-induced proctosigmoiditis. Prospective, randomized, double-blind controlled trial of oral sulfasalazine plus rectal steroids versus rectal sucralfate. Dig Dis Sci. 1991;36(1):103-7. [ Links ]
75. Liguori V, Guillemin C, Pesce GF, et al. Double-blind, randomized clinical study comparing hyaluronic acid cream to placebo in patients treated with radiotherapy Radiother Oncol. 1997;42:155-61. [ Links ]
76. Wasserman T. Radioprotective effects of amifostine. Semin Oncol. 1999 ;26(2 Suppl 7):89-94. [ Links ]
77. Brizel DM, Wasserman TH, Henke M, et al. Phase III randomized trial of amifostine as a radioprotector in head and neck cancer. J Clin Oncol. 2000;18(19):3339-45. [ Links ]
78. Antonadou D, Coliarakis N, Synodinou M, et al. Randomized phase III trial of radiation treatment +/- amifostine in patients with advanced-stage lung cancer. Int J Radiat Oncol Biol Phys. 2001;51(4):915-22. [ Links ]
79. Ben-Josef E, Han S, Tobi M, Vargas BJ, et al. Intrarectal application of amifostine for the prevention of radiation-induced rectal injury. Semin Radiat Oncol. 2002;12(1 Suppl 1):81-5. [ Links ]
80. Johnson JT, Ferretti GA, Nethery WJ, Valdez IH, et al. Oral pilocarpine for post-irradiation xerostomia in patients with head and neck cancer. N Engl J Med. 1993;329(6):390-5. [ Links ]
81. LeVeque FG, Montgomery M, Potter D, et al. A multicenter, randomized, double-blind, placebo-controlled, dose-titration study of oral pilocarpine for treatment of radiation-induced xerostomia in head and neck cancer patients. J Clin Oncol. 1993;11(6):1124-31. [ Links ]
82. Zelefsky MJ, McKee AB, Lee H, Leibel SA. Efficacy of oral sildenafil in patients with erectile dysfunction after radiotherapy for carcinoma of the prostate. Urology. 1999;53(4):775-8. [ Links ]
83. Feldmeier JJ. Hyperbaric oxygen for delayed radiation injuries. Undersea Hyperb Med. 2004;31(1):133-45. [ Links ]
84. Feldmeier JJ, Hampson NB. A systematic review of the literature reporting the application of hyperbaric oxygen prevention and treatment of delayed radiation injuries: an evidence based approach. Undersea Hyperb Med. 2002;29(1):4-30. [ Links ]
85. Mayer R, Klemen H, Quehenberger F, et al. Hyperbaric oxygen—an effective tool to treat radiation morbidity in prostate cancer. Radiother Oncol. 2001;61(2):151-6. [ Links ]














