Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Oncología (Barcelona)
versión impresa ISSN 0378-4835
Oncología (Barc.) vol.29 no.3 mar. 2006
NOTA CLÍNICA
Glioblastoma cerebeloso. Caso clínico
P. Nogués Bara; J. Aguas Valiente; J. Pallarés QuixalI
Hospital Universitari Arnau de Vilanova
Lleida
Servicio de Neurocirugía
IAnatomía Patológica
RESUMEN
INTRODUCCIÓN: El glioblastoma multiforme (GBM) es el más frecuente y maligno de los tumores cerebrales. Su presentación en cerebelo es excepcional.
CASO CLÍNICO: Paciente de 42 años con historia breve de trastorno de la marcha y cefalea.
La resonancia magnética cerebral mostró una lesión de unos 4 cm de diámetro sólida y quística, con edema, en hemisferio cerebeloso dcho. Se extirpó un Glioblastoma multiforme con p53 positiva.
CONCLUSIONES: La edad y la p53 hacen pensar que se trate de una forma secundaria de GBM.
La bibliografía revisada constata que se trata de una localización infrecuente.
El tratamiento inicial es quirúrgico pero las supervivencias son cortas a pesar de la radioterapia y del uso de nuevos quimioterápicos como la Temozolomida.
Palabras clave: Glioblastoma. Proteína p53. Tumor Fosa posterior. Tumor de cerebelo.
SUMMARY
INTRODUCTION: Glioblastoma is the most frequent and malignant of the brain tumours. However, it is exceptionally observed in the cerebellum.
CLINICAL CASE: A case of a 42 year old woman with a short history of gait disturbance and headache is reported. A MRI brain scan showed a 4 cm diameter, solid and cystic tumour with edema in the right cerebellum.
Surgery removed a glioblastoma multiforme with a positive p53.
CONCLUSIONS: Age and positive p53 indicate that it is a secondary form. Bibliography certifies that it is an infrequent location. Initial treatment is surgery, but survival is short in spite of radiotherapy and chemotherapy with temozolamide.
Key words: Glioblastoma. Protein p53. Posterior fossa tumour. Cerebellum tumour.
Introducción
El glioblastoma multiforme (GBM) es el más frecuente y más maligno de los tumores gliales. Supone el 15% de todas las neoplasias intracraneales y el 50-60% de todos los tumores astrocíticos. Su incidencia es de 2,5 casos anuales por cada 100.000 habitantes.
Se clasifican en primarios y secundarios. Los primarios suelen aparecer en mayores de 50 años y se manifiestan de novo sin evidencia clínica ni histológica de lesión maligna precursora. Los secundarios se desarrollan en pacientes algo más jóvenes (<45 años) mediante la progresión maligna de una astrocitoma de bajo grado (Organización Mundial de la Salud (OMS II) o de un astrocitoma anaplásico (OMS III). Se trata de dos vías genéticas distintas que conducen a una histopatologia final común.
Tanto unos como otros, suele localizarse en la sustancia blanca subcortical de los hemisferios cerebrales: 31% temporal, 24% parietal, 23% frontal y 16% occipital, siendo la localización frontotemporal especialmente típica. Mucho menos frecuente es su ubicación en tronco cerebral y está asociada a pacientes pediátricos.
Su presentación en cerebelo es excepcional y está cifrada en un 0.24% del total de glioblastomas, lo que contrasta con la proporción volumétrica que supone el cerebelo con respecto al conjunto del encéfalo (10%).
Biología celular
En una célula normal intervienen los proto-oncogenes que la hacen crecer y desarrollarse y los genes supresores tumorales que paran el sobrecrecimiento y la proliferación.
Un insulto genético, como pueden ser factores químicos, virus, radiaciones externas, etc. pueden convertir un proto-oncogen en un oncogen.
Los proto-oncogenes funcionan como factores de crecimiento y cuando se expresan de manera anómala producen moléculas polipeptídicas que estimulan a sus receptores; este mecanismo se asocia con el crecimiento y desarrollo de los gliomas.
El factor de crecimiento fibroblástico básico (FGF) y el factor de crecimiento endotelial vascular (VEGF) promueven la angiogénesis y la neovascularización de los gliomas.
Los genes supresores tumorales pueden quedar inactivados por pérdida de todo el cromosoma o por pérdida del gen supresor en el cromosoma.
El cambio que se observa con mayor frecuencia en los genes supresores es a nivel del p53 que desempeña numerosas funciones. La respuesta de los gliomas a la Temozolomida se define por la parada a nivel G2-M del ciclo celular. En ella intervendría la proteína p53 que actúa a través de los GADD45 y p21/c1p1 sobre el complejo cdc2-Ciclina B y permite parar en fase G2-M de manera previa a la entrada en mitosis1. La relación entre p53 y el gen PTEN se asociaría a la progresión de los tumores gliales2. La alteración de p53 suele ser previa a la malignización tumoral3. Los glioblastosmas que debutan como tales, glioblastomas primarios o de novo, presentan una muy baja frecuencia de mutaciones de p533.
Presentamos un caso clínico de glioblastoma cerebeloso en una paciente de 42 años que por la edad se incluye dentro del grupo de los secundarios.
Caso clínico
Mujer de 42 años de edad que consultó por historia de cefalea de 10 días de evolución que se acompañaba de inestabilidad a la marcha.
Antecedentes de migraña, parálisis facial periférica "a frigore" hace 20 años y episodios de depresión.
La exploración neurológica mostró una dismetría derecha y una maniobra de Romberg positiva y secuelas de su parálisis facial.
Se practicó tomografía computarizada craneal hallando un proceso expansivo que ocupaba hemifosa posterior dcha. La lesión tenía un componente sólido que se realzaba con el producto de contraste y un componente quístico.
La resonancia magnética cerebral confirmó los hallazgos de la tomografía computarizada. Se encontró una lesión de unos 4 cm de diámetro con un componente sólido y otro quístico, rodeada de edema, localizada en hemisferio cerebeloso dcho (Fig. 1). Esta masa era heterogénea e hipointensa en relación al tejido cerebeloso en T1 e hiperintensa en T2. Se realzaba con el Gadolinio. No se acompañaba de hidrocefalia (Fig. 2).
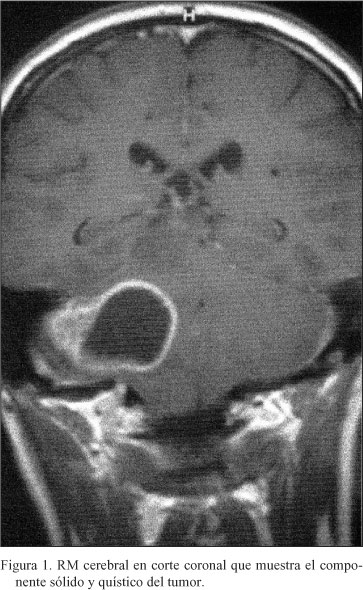
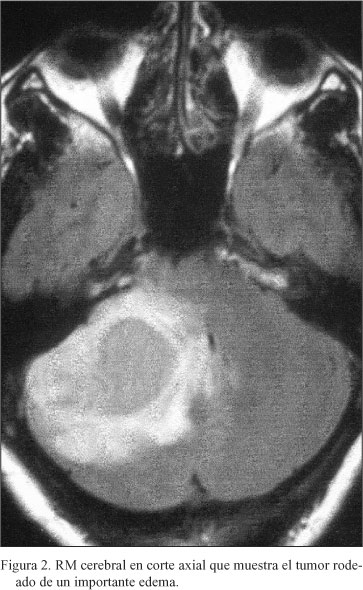
Se intervino practicando una extirpación prácticamente total de la tumoración a través de una craniectomía de hemifosa posterior dcha.
La evolución postoperatoria fue satisfactoria quedando la paciente totalmente asintomática. Una RM cerebral de control mostró una amplia resección de la tumoración con un mínimo resto en la porción más craneal del hemisferio cerebeloso dcho. junto al tronco del encéfalo.
El estudio anatomo-patológico diagnosticó un Glioblastoma multiforme (grado IV, clasificación de la OMS) con extensas zonas de necrosis y abscesificación (Fig. 3). Las células tumorales presentaron positividad nuclear inmunohistoquímica para p53.

Posteriormente la paciente se trató con Radioterapia focal en fosa posterior 60 Gy, 2 Gy/d ICRU (Internacional Comisión on Radiation Units) concomitante con Temozolomida 75 mg/m2 según esquema de la EORTC 22981 (European Organization for Research and Treatment of Cancer).
A los 8 meses de la intervención la paciente se mantiene asintomática, aunque en la RM cerebral de control se evidencia el inicio de una recidiva del tumor.
Discusión y conclusiones
El GBM representa aproximadamente el 15% de todos los tumores intracraneales y el 50-60% de los astrocitarios.
Corresponde al grado IV en la clasificación de la OMS del año 2000 de tumores que afectan al sistema nervioso central.
Se caracteriza por una clínica de instauración rápida y progresiva. Dependiendo de su localización en la fosa posterior de la cavidad craneal su sintomatología puede variar. Si están en línea media predominará la ataxia mientras que si se localizan en los hemisferios cerebelosos lo hará la dismetría. Si en su crecimiento ocluyen el IV ventrículo pueden dar lugar a hidrocefalia que se manifestará con una sintomatología propia de la hipertensión endocraneal (dolor de cabeza, náuseas, vómitos). Cuando se localizan a nivel del tronco del encéfalo se manifiestan con afectación de los pares craneales4.
La sintomatología con la que se presentan no permite el diagnóstico diferencial con otras lesiones como metástasis, abscesos, hemangioblatomas u otros tumores de la serie glial.
El diagnóstico suele hacerse de urgencia mediante TC cerebral que detecta la tumoración y el estudio se completa con RM cerebral.
Suelen ser lesiones heterogéneas, mal delimitadas, de contornos irregulares que pueden presentar zonas quístico-necróticas y hemorragias que pueden acompañarse de calcificaciones.
En la TC suele haber una imagen hipodensa que se realza de forma irregular al administrar el producto de contraste.
En RM suele ser muy aparente el edema que rodea a estas lesiones y que se caracteriza por una zona de alta señal en T2 e hiposeñal en las secuencias T1. En ocasiones se observan imágenes hipointensas e hiperintensas tanto en T1 como en T2 lo que es reflejo de hemorragias intratumorales5. En algunas zonas la celularidad puede ser muy compacta lo que en T2 se muestra como zonas hipointensas6.
La RM con espectroscopia puede ayudar a diferenciarlo de otros trastornos. En el glioblastoma multiforme la relación colina/creatinina puede estar aumentada por encima de 3 a 1 y el pico de N-acetil aspartato reducido.
La disminución del N-acetil aspartato está en relación con la pérdida neuronal por el crecimiento tumoral. La disminución de la creatinina se debe a trastornos metabólicos mientras que el aumento de colina está en relación con el aumento de la síntesis de membranas y células tumorales. El lactato también está aumentado como consecuencia de la hipoxia7.
Las RM de perfusión/diffusión permite discriminar los abscesos de los tumores quístico-necróticos8.
En la revisión de la literatura de los últimos cuarenta años se presentan específicamente 39 casos de glioblastoma cerebeloso, aunque si consideramos las revisiones que dichos trabajos a su vez realizan, podríamos concluir que disponemos de unos cien casos referidos de esta patología. En ellos existen ciertas divergencias en cuanto a si presenta un determinado perfil clínico.
La mayoría de los trabajos le atribuyen un comportamiento similar al glioblastoma supratentorial, pero también se describen supervivencias especialmente prolongadas9.
El GBM puede desarrollarse a través de la transformación anaplásica de un astrocitoma de bajo grado o como un GBM de novo, donde existe pérdida de heterocigosidad del cromosoma 10 y amplificación del gen del factor de crecimiento epidérmico, sin alteración del gen de la p53. La mutación de este gen asociado a pérdida de la heterocigosidad del cromosoma 17p, 9p,13q ó 19q se observa en el proceso de progresión anaplásica de un glioma de bajo grado a glioblastoma multiforme, transición que termina con amplificación de los genes del factor de crecimiento epidérmico10.
Mientras unos casos pertenecen a pacientes de edad avanzada (mayores de 70), los otros aparecen en pacientes de edad media (aproximadamente 40 años). Nuestro caso se incluiría en el grupo de edad de pacientes que corresponden a una evolución secundaria lo que se confirma por la presencia de p53 +.
La excepción la encontramos en un caso descrito por Wisoff y colaboradores11 en el que aparece un GBM en un paciente de 70 años que 5 décadas antes había recibido radioterapia en fosa posterior por tumor cerebeloso. Este caso correspondería a un GBM secundario en un paciente de edad avanzada.
La serie más amplia6 sugiere la frecuencia de hemorragia intratumoral. Nuestro caso presentaba un componente gelatinoso necrótico en su interior que podía ser compatible con hemorragia evolucionada. En cualquier caso la presencia de hemorragia intratumoral no es rara en el conjunto de glioblastomas de otras localizaciones.
También se han comunicado caso esporádicos en niños12, 13.
La mayoría de pacientes afectos de GBM fallecen entre uno y dos años después del diagnóstico. El tratamiento habitual se basa en una resección quirúrgica lo más amplia posible seguida de radioterapia. Las pautas de quimioterapia utilizadas hasta la actualidad no mejoraban la supervivencia de estos pacientes. Últimamente se está utilizando Temozolomida asociada a radioterapia fraccionada y se consiguen supervivencias algo más prolongadas que las obtenidas con las pautas anteriores14, 15.
En nuestra opinión, la clave de la baja frecuencia de glioblastomas a nivel cerebeloso puede estar en una diferente composición astrocítica de su porción subcortical. De hecho, las variedades astrociticas corticales cerebelosas son específicas de la zona (astrocito laminar, célula epitelial de Golgi, etc)16 y no sería de extrañar que también existiesen ciertas peculiaridades en la población astrocitica cerebelosa subcortical.
En tal caso, podría esperarse ciertos matices específicos en los glioblastomas cerebelosos (tal como ocurre con los astrocitomas de bajo grado). Sería de interés agrupar el estudio genético histologico de estos tumores en una serie que permitiese obtener conclusiones.
Bibliografía
1. García-Foncillas López JM, Andion Ibáñez E, Jiménez Uribes E. Biología molecular. En: MA Arraez, I Herruzo, T Acha, M Benavides eds.Tumores del sistema nervioso central en el adulto y en la infancia. Madrid-Barcelona: Nova Sidonia Oncología y Hematología, 2003; 13-36. [ Links ]
2. Kato H, Kato S, Kumabe T, Sonoda Y, Yoshimoto T, Han SY y cols. Functional evaluation of p53 and PTEN gene mutations in gliomas. Clin Cancer Res 2000; 6: 3937-3943. [ Links ]
3. Kleihues P, Burger PC, Collins VP, Newcomb EW, Ohgaki H, Cavene WK. Glioblastoma. En: P. Kleihues and WCavenee eds. Pathology and Genetics. Tumours of the Nervous System. WHO Classification Tumours. Lyon: IARC Press, 2000; 29-39. [ Links ]
4. Demir MK, Hakan T, Akinci O, Berkman Z. Primary cerebellar glioblastoma multiforme. Diagn Inter. Radiol 2005; 11: 83-6. [ Links ]
5. Atlas SW, Grossman RI, Gomori JM, Hackney DB, Goldberg HI, Zimmerman RA, et al. Hemorrhagic intracraneal malignant neoplasms: spin-echo MR imaging. Radiology 1987; 164: 71-7. [ Links ]
6. Kuroiwa T, Numaguchi Y, Rothman MI, Zoarski GH, Morikawa M, Zagardo MT, et al. Posterior Fossa Glioblastoma Multiforme: MR Findings. AJNR Am J Neuroradiol 1995; 16:583-9. [ Links ]
7. Majos C, Alonso J, Aguilera C, Serrallonga M, Perez-Martin J, Acebes JJ, et al. Proton magnetic resonance spectroscopy of human brain tumours: assessment of differences between tumour types and its applicability in brain tumour categorization. Eur Radiol 2003; 13:582-91. [ Links ]
8. Noguchi K, Watanabe N, Nagayoshi T, Kanazawa T, Toyoshima S, Shimizu M, et al. Role of diffusion-weighted echo-planar MRI in distinguishing between brain, brain absces and tumour: a preliminary report. Neuroradiology 1999; 41: 171-4. [ Links ]
9. Hegedus K, Molnar P. Primary cerebellar glioblastoma multiforme with an unusually long survival. J Neurosurg 1983; 58:589-92. [ Links ]
10. Rosenfeld MR, Dalmau J. Tumores cerebrales primarios: realidad y bases moleculares de futuros tratamientos. Neurología 1997; 12:185-96. [ Links ]
11. Wisoff HS, Llena JF. Glioblastoma multiforme of the cerebellum five decades after irradiation of a cerebellar tumor. J Neurooncol 1989; 7:339-44. [ Links ]
12. Kulkarni AV, Becker LE, Jay V, Armstrong DC, Drake JM. Primary cerebellar glioblastomas multiforme in children. Report of four cases. J Neurosurg 1999; 90: 546-50. [ Links ]
13. Katz DS, Poe LB, Winfield JA, Corona RJ Jr. A rare case of cerebellar glioblastoma multiforme in childhood: MR imaging. Clin Imaging 1995; 19: 162-4. [ Links ]
14. Fine HA. Radiotherapy Plus Adjuvant Temozolomide for the Treatment of Glioblastoma - A Paradigm Shift. Nat Pract Oncol 2005; 2: 334-5. [ Links ]
15. Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, et al. Radiotherapy plus Concomitant and Adjuvant Temozolomide for Glioblastoma. N Engl J Med 2005; 352:987-96. [ Links ]
16. Carpenter, M : Neuroanatomía humana. Buenos Aires: Ed. El ateneo; 1992. [ Links ]
 Correspondencia:
Correspondencia:
Dr. P. Nogués Bara
Neurocirugía
Hospital Universitari Arnau de Vilanova
Av. Alcalde Rovira Roure, 80
E-25198 Lleida
pnogues@arnau.scs.es
Recibido: 30.11.05
Revisado: 02.01.06
Aceptado: 27.01.06














