INTRODUCCIÓN
La enfermedad de Parkinson (EP) es el segundo trastorno neurodegenerativo más frecuente, mostrando alta prevalencia en pacientes ancianos1. Actualmente 6.3 millones de personas, que representan el 1% de la población mundial de más de 65 años, son diagnosticadas de EP y en 2030 este número puede aumentar hasta 9,3 millones2. El promedio de edad en que comienza es de unos 60 años, pero se han identificado casos en individuos que tienen entre 20 y 29 años y otros todavía más jóvenes3. En España son muchos los estudios de prevalencia realizados. Los resultados de prevalencia obtenidos varían entre 150 y 1500 /105 habitantes. La prevalencia media de EP en España es de 682,2/105 habitantes con IC (127,4/105-1491,7/105)4. Por otra parte la enfermedad afecta a más de un millón de personas en Estados Unidos5 y Canadá. La incidencia de la enfermedad de Parkinson en los EEUU y Canadá se estima en alrededor de 300/105 habitantes, o alrededor del 3%6.
Aunque la mayoría de los casos de EP parecen ser esporádicos, hay una creciente evidencia de que los factores genéticos juegan un papel en la patogénesis de la EP, particularmente cuando la edad del inicio de los síntomas es menor de 50 años7. Se ha sugerido que el polimorfismo en las enzimas implicadas en el metabolismo oxidativo y la desintoxicación podría estar implicado en la predisposición a la EP2.
El inicio de los síntomas de la EP es típicamente insidioso. Los modelos biológicos sugieren que la progresión de la EP incluye un período pre sintomático largo2.
Varias exposiciones ocupacionales pueden aumentar el riesgo de desarrollar la enfermedad de Parkinson. La exposición a pesticidas es un conocido factor de riesgo para el desarrollo de EP, fue descrita por primera vez en 1983 cuando la administración intravenosa de MPTP, una molécula estructuralmente similar al insecticida paraquat, dio lugar a un síndrome parkinsoniano en adictos a drogas. Desde entonces muchos estudios clínicos han demostrado la conexión entre la exposición a pesticidas y el mayor riesgo de EP. La exposición a pesticidas sola no es suficiente para causar EP, otros factores, como susceptibilidad de diferentes variantes genéticas se cree que son necesarias8.
Estudios recientes sobre la etiología de la enfermedad de Parkinson, señalan principalmente una predisposición genética asociada a una posible participación de neurotoxinas internas y / o externas. Durante la última década, numerosos estudios mostraron la participación de toxinas externas en la génesis de la enfermedad. La evidencia de un rendimiento inadecuado del complejo enzimático del citocromo P-450 en la EP reforzó la idea de la presencia de un metabolismo deficiente de las sustancias xenobióticas, lo que llevó a la hipótesis de que los pacientes parkinsonianos son más vulnerables a la acción de algunas neurotoxinas. Uno de los estudios investigó la participación de los genes del citocromo P-450 2D6 (CYP2S6) y M1 glutatión S-transferasa (GSTM1), cuya acción se basa en la programación de enzimas responsables de la desintoxicación de toxinas externas. Se pudo observar que los individuos que poseen el alelo CYP2D6L tienen 2,4 veces más posibilidades de ser afectados con EP que los controles. Además, si el individuo tiene la M1 glutatión S-transferasa (GSTM1) la posibilidad se incrementa de 11 a 14 veces9. El estrés oxidativo activa GST (y sus variantes M1, T1 y P1) para desintoxicar muchos productos de oxidación de lípidos, ácidos nucleicos y proteínas. GSTM1 y GSTT1 catalizan la desintoxicación de oxígeno reactivo y productos de peroxidación lipídica. Estudios epidemiológicos muestran que los genotipos nulos para GSTM1 y GSTT1 están relacionados con el aumento de la susceptibilidad a enfermedades asociadas al estrés oxidativo. El genotipo nulo para GSTM1 (homocigoto al alelo nulo) aumenta el riesgo de cáncer en algunos tejidos y también se asocia con EP2.
El riesgo de EP individual se ha asociado a la exposición ocupacional a herbicidas y pesticidas. Existe una asociación entre los genotipos de GSTP1 y EP en individuos expuestos a los plaguicidas, lo que demuestra que el GSTP1 posiblemente afecta la respuesta nigroestriatal a las neurotoxinas. Además, los polimorfismos GSTP1 pueden influir en la edad de inicio de la EP1.
The mutidrug resistance protein (MDR1 o ABCB1) es un gen que codifica una glycoproteina-P (P-gp) que protege el cerebro contra neurotóxicos. Algunas variantes genéticas de MDR1 o ABCB1 comprometen la función de este transportador y podría estar asociado con el desarrollo de EP8.
Las mutaciones en el gen de Parkin son las más representativas de las formas de inicio temprano del parkinsonismo. Se han descrito también en formas familiares y esporádicas de inicio tardío. Así mismo algunos polimorfismo de un único nucleótido (SNP) han sido asociados a EP, aunque su función en la patogénesis de la enfermedad no está clara. Se supone que producen leves alteraciones en el gen Parkin y actúan como factor de riesgo para el desarrollo de la EP. Sin embargo, se desconoce de qué forma los SNP en el gen parkin pueden influir en la edad de inicio de la forma esporádica de EP10.
En España se aprobó el Real Decreto 1311/201211, de 14 de septiembre, por el que se establece el marco de actuación para conseguir un uso sostenible de los productos fitosanitarios (pesticidas, herbicidas, etc.). También existe una guía oficial para la vigilancia de la salud de los trabajadores agrarios (MSSSI 2013)12, la principal población de trabajadores expuestos a los riesgos derivados de los fitosanitarios. Patologías derivadas de la fabricación y el uso de plaguicidas e herbicidas figuran en el cuadro de enfermedades profesionales con las correspondientes codificaciones del Real Decreto 1299/2006, de 10 de noviembre, por el que se aprueba el cuadro de enfermedades profesionales en el sistema de la Seguridad Social y se establecen criterios para su notificación y registro13.
OBJETIVOS
Principal
Identificar la evidencia científica de la relación existente entre la exposición a pesticidas y la predisposición genética para la aparición de síndromes Parkinsoniano o enfermedad de Parkinson en el ámbito laboral.
MATERIAL Y MÉTODOS
Revisión sistemática de la literatura científica en el ámbito de la biomedicina, realizada a través de la búsqueda bibliográfica de artículos científicos publicados en los últimos 10 años (hasta el año 2016) en las siguientes bases de datos: MEDLINE (a través de Pubmed), LILACS, IBECS, Red SCIELO, BIBLIOTECA COCHRANE, utilizándose los descriptores, ecuaciones de búsqueda, combinaciones booleanas, términos (MeSH terms) y filtros que figuran en la (Tabla 1). Se efectuaron varias ecuaciones de búsqueda, adaptándose a las diferentes bases de datos con objetivo de recuperar el máximo número de artículos posible.
Tabla 1 Ecuaciones de búsqueda.
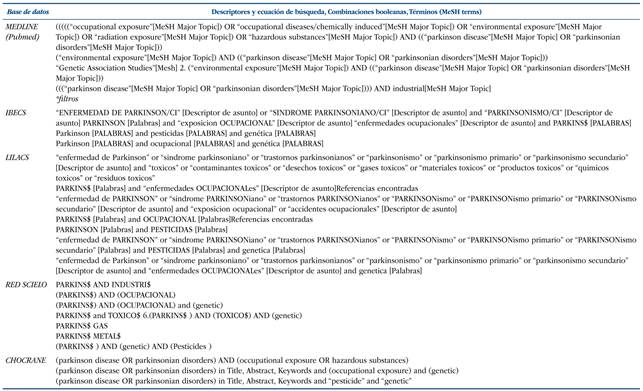
*Filtros usados: humanos, los últimos 10 años, adultos +19 años, español, inglés, portugués, italiano, ruso, búlgaro, catalán.
Los criterios de inclusión y exclusión que se utilizaron para obtener la colección a estudios figuran en la (tabla 2).
En una primera etapa se revisaron los abstracts de los artículos recuperados y se excluyeron aquellos no alineado con el objetivo de la revisión.
A posteriori se procedió a analizar los artículos entre los investigadores de forma independiente para su revisión detallada. Aquellos artículos con dificultad de valorar si cumplen con el objetivo de la revisión, fueron revisados a texto completo.
Se diseñó una tabla de síntesis de evidencia, incluyendo las variables que figuran en (Tabla 3) para que la revisión sistemática de los artículos finalmente seleccionados se realizara de la misma manera por cada investigador, dirimiéndose las controversias mediante revisión conjunta y consenso sobre su inclusión final en la revisión.
Tabla 3 Variables incluidas en la tabla de síntesis de evidencia.
| ID del artículo |
|---|
| Título, autor, revista y año |
| Tipo estudio |
| Población |
| Muestreo |
| N |
| Exposición |
| Diagnóstico |
| Variable |
| Variable genética |
| Método de análisis genético |
| Resultados (asociación) |
| Cofactores |
Una vez terminado el análisis de los artículos, se graduó el nivel de evidencia basado en los criterios de la Scottish Intercollegiate Guidelines Network (SIGN)14.
RESULTADOS
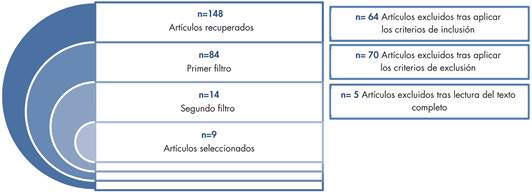
A partir de la estrategia de búsqueda, se recuperaron un total de 148 artículos de las diferentes bases de datos, detallándose en la (tabla 4).
Tabla 4 n de artículos recuperados y seleccionados según la base de datos.
| Base de datos | Artículos recuperados | Artículos seleccionados |
|---|---|---|
| MEDLINE(Pubmed) | n=78 | n=7 |
| IBECS | n=2 | 0 |
| LILACS | n=26 | n=2 |
| RED SCIELO | n=9 | 0 |
| CHOCRANE | n=33 | 0 |
| Total | n=148 | n=9 |
NOTA: Los artículos duplicados no formaron parte de la n=148 de los artículos recuperados.
De los 148 artículos recuperados, 64 fueron excluidos por no ajustarse a los criterios de inclusión. Después de este primer filtro, recuperamos 84 artículos de los cuales, 70 se descartaron por cumplir alguno de los criterios de exclusión, tras la lectura del abstract o texto completo, obteniendo un total de 14 artículos para realizar la revisión sistemática. Finalmente de éstos 14 artículos se descartaron 5 después de la lectura sistemática a texto completo, tras la decisión conjunta de los investigadores. Después de aplicar los filtros previamente descritos, así como los criterios de inclusión/exclusión quedó una colección de 9 artículos (Tabla 5).
La totalidad de los artículos seleccionados para la revisión sistemática son estudios descriptivos con diseño de casos y controles, de los cuales 2 están anidados en una cohorte. El resumen de los resultados y el nivel de evidencia de los artículos incluidos en la revisión sistemática figura en (Tabla 6). En 8 de los nueve estudios se identifica el factor genético predisponente del desarrollo de la EP en combinación a la exposición a pesticidas en el ámbito laboral y uno de ellos trata sobre la el factor genético como inductor a la temprana aparición de los síntomas de EP en trabajadores expuestos a pesticidas.
En el artículo más recientemente publicado por Narayan et al15, 2015, con un diseño de casos y controles, n=1074: casos n=632 y controles n=1238 (población con la enfermedad de Parkinson de Kern, Fresno y Tulare en California central entre 2001 y 2007), disponiendo tanto el genotipo ABCB1 como la información sobre la exposición a pesticidas. Para la exposición ocupacional a plaguicidas y ABCB1 SNP rs1045642, se estima mayor OR de 2,07-3,54 en sujetos expuestos portadores de la variante homozigótica TT y otros portadores de TT de “baja exposición” a pesticidas en comparación con individuos con genotipo no variante, cuando se ajusta para la variante TT en rs2032582 (los individuos con mayor riesgo son los portadores de genotipo TT en rs1045642 y rs2032582). No ajustar para el genotipo rs2032582 no altera apreciablemente los resultados [OR: 2,09-3,74]. Se observa menor OR de 1,89-2,62 para los portadores de la TT SNP rs2032582 con exposiciones a OC o OP ajustado para variante homozigótica de portadores de rs1045642, aunque los resultados fueron mayores sin ajuste [OR: 2,43-3,36]. Entre los profesionales expuestos a los plaguicidas OC o OP, los participantes con mayor riesgo fueron portadores de la variante homocigótica tanto para rs1045642 como rs2032582 [OR = 3,71, IC del 95%: (1,96, 7,02)].
En otro estudio de casos y controles realizado por Pinhel et al 2 en 2013 con muestra n=423. Grupo de casos (SG) - 254, grupo de control (CG) - 169. Los pacientes fueron seleccionados en la Clínica de Trastornos del Movimiento del Hospital de Base de la Facultad de Medicina de São José do Rio Preto (FAMERP). La ausencia de las variantes GSTT1 y GSTM1 (0/0) y la exposición a los plaguicidas prevaleció en los casos (18%) en comparación con los controles (13%, p = 0,014). Este estudio sugiere la asociación entre la EP y la exposición previa a los plaguicidas, cuyo efecto aumenta en combinación con la ausencia de GSTT1 / GSTM1. La distribución de GSTT1 muestra el estándar predicho por el equilibrio de Hardy-Weinberg en SG (χ2 = 1.7; p <0.05) y CG (χ2 = 0.21; p <0.05), lo mismo ocurrió con GSTM1 (SG - χ2 = 33.0, p <0.05 y CG - χ2 = 12,0, p <0,05). La presencia y la ausencia de las variantes genéticas de GSTT1 y GSTM1 fueron similares en pacientes y controles.
Longo et al1 en 2013 publicó un estudio de casos y controles con muestra n=312. Grupo de casos (SG) n = 154, subdividido en grupo de EP familiar (FSG) n = 33 y grupo de EP esporádica (SSG) n = 121, grupo de control (CG) n= 158. Los pacientes fueron atendidos en la Clínica de Neurología Ambulatoria del Hospital de Base de la Facultad de Medicina de São José do Rio Preto (FAMERP), Brasil, en el período de 2007 a 2010. El estudio refleja los polimorfismos del gen GSTP1-Alw26I, localizado en el cromosoma humano 11q13: Genotype (I/I; I/V;V/V) Allele (I; V) como factores de riesgo para la EP en los expuestos a pesticidas. La distribución de los alelos fue similar entre SG (isoleucina (I) = 0,68, valina (V) = 0,31), SSG (I = 0,66, V = 0,33) y GC (I = 0,64; V = 0,35; p> 0,05). Sin embargo, el alelo I fue significativamente mayor en el grupo familiar (FSG = 0,78), en comparación con CG (0,64; p = 0,036). El homocigoto salvaje (I / I) prevaleció en FSG (63,6%) en comparación con SSG (38,0%, p = 0,013). El genotipo I / V predominó en SG, SSG y CG (50,6, 56,1 y 62,0%, respectivamente, p> 0,05); Y V / V, en una frecuencia reducida, mostraron una distribución similar entre los grupos (p> 0,05). FSG exhibió el patrón predicho por el equilibrio de Hardy-Weinberg (χ 2 = 0.29, p = 0.90), diferente de SG (χ 2 = 5.01; p = 0.025), SSG (χ 2 = 7.82; p = 0.005) y CG 2 = 19,9, p < 0,0001).
En el año 2012 Goldman et al16 publicó un estudio de casos y controles. Se reclutaron n=87 sujetos con EP y n=343 controles emparejados (esta anidado al estudio Agricultiural Health Study). Se determinó la asociación de las deleciones genéticas de GSTM1 (GSTM1*0) y GSTT1 (GSTT1*0) y su interacción con el uso de paraquat mediante regresión logística. No hubo interacción con GSMT1, pero por el contrario se observó que la deleción de GSTT1 modifica significativamente la asociación entre el Paraquat y el desarrollo de EP. En hombres con GSTT1 funcional la OR de la asociación de EP y la exposición a paraquat fue de 1.5 con un IC 95% 0.6-3.6. En hombres con la deleción GSTT1*0, el OR fue de 11.1 (IC 95%: 3,0-44.6, P: 0,027).
En el artículo de Zschiedrichet al8 del 2009, con un diseño de casos y controles, con una n=497 (415 casos y 82 controles) se investiga la posible asociación entre las diferentes variantes del gen MDR1 y el riesgo de padecer Enfermedad de Parkinson (población Europea-Alemanes, Serbios, Italianos, Holandeses). En el estudio no se encontró una asociación general entre las alteraciones en SNP (polimorfismos de un único nucleótido) y la EP. Sin embargo se vio que los genotipos 3435CT y 3435TT fueron significativamente más frecuentes en pacientes expuestos que en no expuestos. Específicamente el 3435TT (89.5% vs 64.2% p=0.047; OR=4.744, 95% CI=[1.009;22.306]. Se analizó además la posible relación entre exposición a pesticidas y EP siendo ésta más frecuente 22.1% frente a 9.3% en no expuestos (p=0.038).
Ghione et al10, en el artículo del año 2007, con un diseño de casos y controles con muestra n=59 (33 casos y 26 controles), analiza el descenso en la edad de inicio de la enfermedad de Parkinson asociado a exposición a pesticidas y polimorfismos genéticos. Se estudiaron los genes PARK1, PARK2 y PARK8 en 81 pacientes italianos con EP. Los SNPs encontrados fueron Ser 167Asn, Val380Leu, Asp394Asn Se encontró relación entre la exposición a factores de riesgo y la EP en 33 pacientes (55.9% de los casos) de estos 24(40.7%) vida rural, 15(25.4%) exposición a disolventes orgánicos y 7(11.9%) exposición a pesticidas. Se encontró un descenso significativo de la edad de inicio de EP en pacientes con SNP y exposición a factores de riesgo. (Edad de inicio: 62.18+/-9.5 años) en relación con pacientes sin ninguno de estos factores (edad de inicio 71.62+/-8 años). En los que eran positivos para SNP 68+/-8.68 años y positivos solo para exposición a factores de riesgo 69.9+/-5.55 años.
En el estudio del año 2006, de Wilk et al 17, también con un diseño de casos y controles, con una muestra n=278 (todos ellos con EP, con n=174 expuestos y n=64 no expuestos), se estudian los SNPs del gen GSTP1 que codifica la enzima de detoxificación GSTP1-1 los cuales pueden producir un aumento del riesgo de padecer EP con la exposición a pesticidas (población obtenido del estudio multicentrico The GenePD Study). Se observó que los efectos del alelo menor en el desarrollo de EP eran modificados por la exposición a herbicidas. Resultados: Comparando rs762803-rs1799811. Grupo sin exposición a herbicidas (Haplotipo 2-1): 2.82 años más en la aparición de EP p=0.048. Grupo exposición ocupacional a pesticidas (Haplotipo 2-1): 7.93 años antes en aparición EP p=0.008. Grupo sin exposición a herbicidas (Haplotipo 2-2): 3.86 años menos en la aparición de EP p=0.12. Grupo exposición ocupacional a pesticidas (Haplotipo 2-1): 5,1 años después en aparición EP p=0,25.
En el estudio de Dutheil et al18., del año 2010, es un estudio de casos y controles con una n=689 (207 casos y 482 controles) obtenida de los archivos de la Mutualité Sociale Agricole. En el estudio se clasificaron los sujetos en 3 grupos según el grado de exposición a pesticidas y se genotiparon 2 polimorfismos ABCB1 (exón 21: G2677 [A, T], exón 26: C3435T) asociados con la función alterada de la glicoproteína-P. Entre el total de casos y controles, no se encontró una asociación entre los polimorfismos ABCB1 (C3435T, P=0.43; G2677 [A, T], P=.97). Entre los 101 casos masculinos y 234 controles pareados, el OR para los organoclorados fue 3,5 (intervalo de confianza del 95%, 0,9-14,5) veces más alto entre los portadores homocigóticos de los alelos G2677 (A, T) de la variante que los no portadores. El gen ABCB1 y la exposición a insecticidas organoclorados interactúan para aumentar el riesgo de DP.
Tanneret al19, en el año 2011, con un estudio de casos y controles con cohorte n=468 (110 casos y 358 controles, esta anidado al estudio Agricultiural Health Study) se asoció la EP con el uso de un grupo de plaguicidas que inhiben el complejo mitocondrial I [odds ratio (OR)=1,7; Intervalo de confianza del 95% (IC), 1,0-2,8], incluyendo rotenona (OR=2,5; IC del 95%: 1,3-4,7) y con un grupo de plaguicidas que causan estrés oxidativo (OR=2,0; IC del 95% 3.6), incluyendo paraquat (OR=2,5; IC del 95%, 1,4-4,7) apoyando un papel de estos mecanismos en la fisiopatología de EP concluyendo así mismo que la edad temprana de inicio también es una característica del parkinsonismo genético en el que el estrés oxidativo es un supuesto mecanismo fisiopatológico (las mutaciones alfa-sinucleína, PINK-1, DJ-1 y PARKIN) por lo que se vería afectado por dichas substancias tóxicas.
El diagnóstico de EP en los estudios realizados por Pinhel et al., Longo et al, se ha realizado según los criterios recomendados por Jankovic20, incluyendo bradiquinesia, rigidez, temblor en reposo, inestabilidad postural, inicio unilateral, respuesta a L-dopa durante más de cinco años, disquinesias inducidas por levodopa, trastorno progresivo, asimetría persistente, evolución clínica de diez años o más, así como pruebas complementarias. Publicaciones anteriores describen los criterios diagnósticos de casos de EP en el estudio de Narayan et al. (Kang et al., 200521. Especialistas en trastornos del movimiento de la UCLA confirman la EP idiopática en todos los casos basándose en criterios publicados (Hughes et al., 199222), y la mayoría fueron observados varias veces en un período de 10 años. Entrevistadores llevaron a cabo el Mini-Mental State Examination de forma presencial o vía telefónica, convirtiendo las puntuaciones telefónicas en puntuaciones predichas de forma presencial según lo recomendado por Newkirk et al., 200423. En los estudios de Zschiedrich et al., Wilk et al. y Ghione et al. el diagnóstico de EP fue confirmado por neurólogos con el United Kingdom Brain Bank Criteria24. En el estudio de Dutheil et al. se realizó un cuestionario clínico. El parkinsonismo fue definido por la presencia de al menos dos síntomas cardinales (temblor en reposo, bradicinesia, rigidez y reflejos posturales patológicos), la EP fue definida por la presencia de parkinsonismo tras excluir otras cusas de este25. Tanner et al. y Goldman et al. en sus estudios diagnosticaron la EP por el acuerdo de dos neurólogos tras la revisión independiente de toda la información diagnostica disponible de cada paciente16,19.
La exposición ocupacional a pesticidas se determina mediante entrevistas personales de forma presencial o vía telefónica.
El análisis genético se realiza mediante PCR de sangre y/o saliva, indicando la modalidad tecnológica de la misma en cada estudio correspondiente.
Así mismo, durante la revisión sistemática de los diferentes artículos, hemos recopilado datos que responden a los diferentes objetivos secundarios, planeados en el diseño del trabajo, detallados debidamente en (Tabla 7).
DISCUSIÓN Y CONCLUSIONES
El objetivo principal de esta revisión sistemática es identificar la evidencia científica existente entre la exposición a pesticidas en relación a la predisposición genética para la aparición de síndromes Parkinsoniano o enfermedad de Parkinson en el ámbito laboral. Al inicio del estudio se planteó identificar cuáles son estos genes y sus variables y la expresión proteica de los mismos, así como si existen expresiones genéticas protectoras de la enfermedad. Otras de las cuestiones planteadas fue identificar otros posibles factores intrínsecos/extrínsecos que puedan influir en el desarrollo de EP y conocer las actividades profesionales que incrementan el riesgo (Tabla 7).
Durante la realización de la presente revisión sistemática nos encontramos ciertas limitaciones, la principal fue encontrar artículos que se centraran en la exposición ocupacional en vez de ambiental. Otra de las limitaciones fue que en dos de los artículos se estudia el descenso en la edad de inicio de la enfermedad y no del riesgo de padecerla.
El papel de la exposición a pesticidas y herbicidas como factor de riesgo para el desarrollo de EP es controvertido. Algunos estudios señalan el aumento de riesgo de padecer EP con la exposición ocupacional a pesticidas, mientras que otros estudios no encuentran asociación con éstos17. Además, la exposición a pesticidas como única causa no parece ser suficiente para causar EP, otros factores, como la susceptibilidad de las variantes genéticas se cree que son necesarias para su desarrollo. Los polimorfismos genéticos implicados en la captación, distribución y metabolismo de los xenobióticos, pueden actuar como otro factor de susceptibilidad8.
La glicoproteína-P (P-gp), codificada por el gen ABCB1 (MDR1), es un factor importante para el flujo de xenobióticos a través de la barrera hematoencefálica (BBB) (Mahringer et al., 2011) mediante un mecanismo ATP-dependiente y las variantes genéticas pueden aumentar el riesgo de EP entre los expuestos a plaguicidas8,15.
El autor Narayan et al. afirma que los resultados de su estudio respaldan hallazgos previos de que las variantes genéticas rb1045642 y rs2032582 del gen ABCB1 (MDR1) y la exposición ocupacional a organoclorados y organofosforados, aumentan el riesgo de EP. En conjunto, los genotipos variantes homocigóticos en ambas posiciones parecen conferir el mayor riesgo de EP en aquellos con exposiciones OC y OP. Los individuos con mayor riesgo son los portadores de genotipo TT en rs1045642 y rs203258215.
Así mismo, ZSschiedrich et al. concluye en su estudio que las variantes genéticas del gen ABCB1 (MDR1) probablemente no juegan un papel mayor en alterar la susceptibilidad total en la EP incluso cuando se focaliza en pacientes con inicio temprano de la EP. Sin embargo sí que hay evidencia de que estas variantes puedan actuar como moduladores del riesgo de enfermar en pacientes expuestos a pesticidas8.
En el estudio de Dutheil et al., los hallazgos sugieren que los polimorfismos del ABCB1 (exón 21: G2677 [A, T], exón 26: C3435T) asociados con la función alterada de la glicoproteína-P con una disminución de la capacidad para eliminar xenobióticos del cerebro aumentaron el riesgo de EP en sujetos expuestos a dichos pesticidas. Estos hallazgos apoyan la hipótesis de las interacciones entre genes y pesticidas en la EP18.
Varios estudios que examinaron las asociaciones entre la EP y los polimorfismos en el gen ABCB1 (MDR1) en poblaciones europeas y asiáticas, sin considerar las exposiciones ambientales, obtuvieron resultados inconsistentes (Funke et al. 200926; Furuno et al. 200227; Lee et al. 200428; Lee et al. 200529; Mizuta et al. 200630; Mizuta et al. 200831; Tan et al. 200532; Tan et al. 200433; Toda et al. 200334; Westerlund et al. 200935). Un estudio de casos y controles basado en un hospital italiano sugirió una asociación entre el genotipo TT en rs1045642 y el inicio temprano (edad <45) de EP (Furuno et al., 200227). Un estudio de casos y controles basado en la población polaca encontró evidencia sugestiva de una asociación protectora entre el haplotipo 2677G-3435C (alelo G en rs2032582 y alelo C en rs1045642) y EP (Tan et al., 200433). Un estudio clínico alemán de casos y controles de EP con un aumento del contenido de hierro en la sustancia negra, no encontró asociación entre 10 SNPs en ABCB1 y EP (Funke et al., 2009 26)). Otro estudio de casos y controles basado en un hospital sueco no encontró asociación con EP para rs1045642 o rs2032582 (Westerlund et al., 2009)35. Un metaanálisis de los estudios de asociación del genoma y EP en individuos de ascendencia europea identificó asociaciones en la fase de descubrimiento entre EP y dos SNPs ABCB1, rs28746490 y rs2235043, aunque estos no alcanzaron la significación estadística, con valores de p entre 1 x 10 ^ {- 4} y 0,05 (Nalls et al., 2014)36. En otro estudio japonés (Momose et al. (2002)37 donde se estudió el SNP 3435C/T, no se encontró asociación general con el desarrollo de EP.
Las enzimas glutatión S-transferasas (GST), son una familia de enzimas diméricas que protegen la célula contra el estrés oxidativo, conjugando glutatión reducido a grupos electrofílicos en una variedad de compuestos endógenas y xenobióticos incluyendo pesticidas y herbicidas. GSTs en humanos se dividen en clases según el sustrato específico y el tejido el que se distribuyen. El gen que codifica las enzimas es GST (y sus variantes M1, T1 y P1)2,17.
En el estudio de Pinhel et al., los genotipos nulos para GSTM1 y GSTT1 mostraron similitud entre grupo de casos y grupo de control. La nulidad de GSTM1 y GSTT1 en ambos grupos fue cercana a las frecuencias observadas en un estudio con población paquistaní. Los individuos con origen étnico mixto que fueron seleccionados en el estudio de Pinhel, tanto los pacientes como los controles mostraron una distribución similar de la nulidad de GSTM1 y GSTT1. GSTT1 representa un factor de protección para los individuos, ya que está ampliamente distribuido en ambos grupos (83 y 80% respectivamente). La ausencia de GSTM1 y de GSTT1 también puede actuar sobre el desarrollo de la EP, porque no hay oposición a la oxidación celular. Sin embargo, esta afección es rara en la población general. Estructuralmente y funcionalmente, algunos tipos de pesticidas actúan como inhibidores del complejo mitocondrial I. En estos casos, las evidencias muestran que las neuronas dopaminérgicas son vulnerables a la disfunción mitocondrial. La toxina es capturada por transportadores de dopamina y la noradrenalina permanece almacenada dentro de la célula. Como consecuencia, la muerte de la célula es causada por la formación de especies reactivas de oxígeno y déficit en la cadena respiratoria mitocondrial. Este estudio sugiere la asociación entre la EP y la exposición anterior a los plaguicidas, cuyos efectos parecen ser mejorados cuando se combinan con la nulidad de GSTT1 / GSTM1. La deleción homocigótica de estos genes, que hace a los individuos más propensos a compuestos carcinógenos ambientales, muestra prevalencia de GSTM1 dentro de la población mundial, principalmente en caucásicos, asiáticos, españoles y paquistaníes, mientras que la nulidad para GSTT1 es mucho menor2.
Longo et al. Investiga la variante genética GSTP1-Alw26I. El genotipo heterocigoto (I / V) prevaleció entre pacientes con EP familiar o esporádica, y también en el grupo control. Esta distribución, aunque apoyada por algunos autores, es diferente de otros estudios. El homocigoto V / V no mostró ninguna asociación con la EP, lo que también fue reportado por otros autores. La presencia de la variante alélica Val105 (V) de GSTP1 se asocia con la disminución de la actividad enzimática, lo que favorecería la degeneración de las neuronas dopaminérgicas en la EP. La enfermedad está asociada con la exposición ocupacional a los plaguicidas, que es más común en los hombres. Esto fue confirmado por el análisis de regresión logística que demostró el sexo masculino, la edad> 68 años y la exposición a los pesticidas como factores de riesgo para la EP1.
Goldman et al., concluye que cuando la exposición al paraquat no se consideró, GSTT1 y GSMT1 se asociaron solo marginalmente con el riesgo de EP. Sorprendentemente la delecion GSMT1*0 se asoció inversamente con el riesgo de EP, aunque este hallazgo se debe tomar con precaución porque otros han informado que GSMT1 puede bioactivar xenobioticos aumentando la toxicidad de los plaguicidas y asociado al desarrollo de carcinoma renal. En concordancia con hipótesis etiopatológicas de EP, el paraquat disminuye los niveles de glutatión reducido (GSH) en el SN y el cuerpo estriado, aumentando la peroxidación lipídica y dañando las mitocondrias en el SN y demás16.
Según el artículo de Wilk et al., se concluye que GSTP1 podría tener dos efectos distintos en la edad de comienzo de la EP. Primero los resultados sugieren que la exposición a herbicidas modifica la relación entre los polimorfismos de GSTP 1 y la edad de inicio de la EP. Un estudio de Abel et al.38 muestra que el captan y el captafol, pesticidas usados para el control de hongos en plantas inhibe el GSTP1-1. Recientes hallazgos muestran que el GSTP1-1 media en la biotransformación de atrazine, un herbicida de uso común y sugieren que es improbable que las variantes del gen confieran una especial habilidad para eliminar la atrazina. De todas formas este estudio se realizó en tejido hepático y no está claro que las variantes genéticas expresadas en el tejido cerebral o en la barrera hematoencefálica puedan responder de forma diferente a la exposición a herbicidas, particularmente en EP. Segundo, los resultados indican que en los grupos sin exposición a herbicidas los haplotipos de GSTP1 tienen diferentes efectos en la edad de comienzo de la EP. Esto sugiere que el GSTP1 podría modificar la edad de inicio de EP independientemente de la exposición a herbicidas. Un estudio de Baez S et Al.39 encontró que el GSTP1 (Ile 115) cataliza la conjugación de glutatión en aminocromo y dopacromo productos de la cascada de oxidación de la dopamina y dopa. La conjugación del glutatión previene que estas sustancias entre en el ciclo redox un proceso que normalmente lleva a la acumulación de radicales libres de oxígeno, estrés oxidativo y eventualmente la muerte celular. Esto sugiere que GSTP1 podría ofrecer protección contra el daño oxidativo el cual es hipotéticamente un importante componente de la cascada patogénica de la EP. Los hallazgos del estudio de Wilk et al. sugieren que la diferente capacidad de las variantes específicas de GSTP1 para conjugar glutatión a aminocromo y dopacromo podrían influir en las tasas de muerte celular oxidativa y por tanto en la edad de inicio de la EP.
La disfunción mitocondrial y el estrés oxidativo se han visto implicados como mecanismos fisiopatológicos de la EP. Las formas genéticas de Parkinson asociadas a mutaciones de la alpha-sinucleina, PARKIN, y PINK1 o genes de DJ-1 podrían estar involucradas en estos mecanismos19. Parkin es una E3 ligasa envuelta en la degradación de la ubiquinona por el proteosoma; las mutaciones en el gen parkin se ha demostrado que producen aumento de los niveles de oxidación lipídica, proteica y de DNA10.
La acumulación de proteínas mal plegadas parece ser crucial en la neurodegeneración en EP. Las mutaciones patológicas podrían inducir formas anómalas de proteínas (como parece ser el caso con la α-synuclein) o dañar la capacidad de las células para detectar y degradar las proteínas mal plegadas (Parkin, UCH-L1); el papel de DJ-1 todavía no se ha identificado. El daño oxidativo ligado a la disfunción mitocondrial y el metabolismo anómalo de la dopamina también podría dar lugar a estas proteínas. No está claro como estas proteínas mal plegadas causan toxicidad o dañan las células por la formación de agregados (cuerpos de Lewy). Hay controversia en cuanto a decir si los cuerpos de Lewy promueven toxicidad o protegen a la célula de los efectos nocivos de las proteínas anómalas aislándolas en un compartimento insoluble del estrés oxidativo, depleción de ATP y de la activación de la maquinaria de muerte celular, los cuales se cree que son también factores que desencadenan la muerte de neuronas dopaminérgicas en EP40.
En el artículo de Ghione et al. se concluye que la genética y el ambiente juegan juntas un papel importante en la aparición de EP, cada uno de ellos, individualmente tienen un efecto menor en la anticipación de la clínica. El estudio también sugiere que individuos sin EP con cierto polimorfismo en parkin podrían tener cierta protección frente a la exposición a pesticidas.
En el artículo de Tanner et al., la EP se asoció positivamente con dos grupos de plaguicidas definidos por mecanismos implicados experimentalmente (los que perjudican la función mitocondrial y los que aumentan el estrés oxidativo), apoyando un papel de estos mecanismos en la fisiopatología de PD. Así mismo, podemos concluir que la edad temprana de inicio también es una característica del parkinsonismo genético en el que el estrés oxidativo es un supuesto mecanismo fisiopatológico (las mutaciones alfa-sinucleína, PINK-1, DJ-1 y PARKIN) por lo que se vería afectado por dichas substancias tóxicas. (Henchcliffe and Beal 200841; Klein et al. 200942).
El principal co-factor investigado es el tabaco. Se ha demostrado que el hidrocarburo aromático policíclico benzo [a] pireno, un constituyente del humo del cigarrillo, modula la expresión de P-gp en estudios celulares (Sugihara et al., 200743), y el tabaquismo está inversamente asociado con la EP. Pinhel et al. concluye que la distribución de ambos genotipos (no nulo y nulo) para GSTT1 y GSTM1 no difirió en este estudio al comparar un grupo de riesgo (fumadores y bebedores) con el grupo no expuesto. De acuerdo con la literatura anterior, incluyendo un metanálisis de Tan et al.44 y Kiyohara et al.45 Un estudio inicial de 100 casos de DP y 200 controles informó que el efecto protector del tabaquismo se perdió para los pacientes con deleción de GSTM1. El genotipo nulo de GSTM1 no expresa actividad enzimática se podría especular que la pérdida de actividad enzimática puede potenciar el efecto protector conferido por un metabolito del humo del cigarrillo que no se metaboliza debido a la falta de esta enzima. En consecuencia, Wahner et al.46 observaron una mayor estimación del efecto para los fumadores con la deleción homocigótica en comparación con los fumadores sin la deleción, sin embargo los intervalos de confianza se superponen en gran medida debido a los pequeños tamaños de las muestras de los subgrupos y los análisis de interacción indicaron no apartarse de la multiplicatividad. El polimorfismo GSTP1-Alw26I, cuando se relacionó con el consumo de tabaco y el alcoholismo, fue el mismo en los grupos SG, SSG y CG, así como en otros estudios relacionados con el tabaquismo y la EP. Por otro lado, hay referencias de la protección del tabaco en la EP, incluyendo haplotipos de GSTP1. Asimismo, se encontró asociación entre el genotipo I / I y el alcoholismo en pacientes familiares con EP. El grupo de pacientes con EP mostró una mayor exposición a los plaguicidas, especialmente en lo que se refiere a la combinación de dicha exposición y al genotipo heterocigoto (I / V). Las enzimas GST, principalmente GSTP1, están involucrados en el metabolismo de los plaguicidas1,2.
Con los hallazgos presentes en la revisión realizada pensamos que, por el momento, el abordaje en trabajadores expuestos a pesticidas y genéticamente predispuestos debería realizarse a través de una anamnesis detallada interrogando los antecedentes familiares de aparición de EP, donde pueda sospecharse el factor genético. Además, se podría abrir la puerta a posibles estudios posteriores, considerando la creciente importancia de la genética incluso en el campo de la medicina del trabajo. En el futuro pruebas genéticas podrían incluirse de forma rutinaria como parte del examen médico de la vigilancia de la salud para el screening de posibles alteraciones que podían predisponer los trabajadores en contacto con algunos tóxicos a enfermedades.