Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.96 no.12 Madrid dic. 2004
| TRABAJOS ORIGINALES |
Ampulectomía transduodenal en el tratamiento de los adenomas vellosos y adenocarcinomas de la ampolla de Vater
J. A. Fraguela Mariña
Servicio de Cirugía General y del Aparato Digestivo "A". Complejo Hospitalario Universitario Juan Canalejo. A Coruña
RESUMEN
Introducción: los tumores más frecuentes de la ampolla de Vater son los adenomas. Es conocida su capacidad de malignización mediante la secuencia adenoma-carcinoma, por lo que requieren su resección, tras su diagnóstico. El establecimiento de la técnica adecuada según las características del tumor permitiría no infratratar o sobretratar pacientes, con las graves consecuencias que se derivan de ello, debido a su localización.
Pacientes y métodos: se revisan los adenomas vellosos y adenocarcinomas de ampolla de Vater subsidiarios de resección local desde el 1 de enero de 1998 al 30 de junio de 2003. Se describen los métodos diagnósticos y la técnica de ampulectomía empleada.
Resultados: en los 8 pacientes estudiados se realizó ampulectomía de primera intención, aunque tuvo que completarse con duodenopancreatectomía cefálica en dos casos debido a la proximidad del borde de resección. No existió mortalidad en la serie y la morbilidad se limitó a dos episodios de HDA que fueron controlados mediante electrocoagulación y embolización. El seguimiento medio fue de 28,5 meses (6-72).
Conclusiones: la dificultad del diagnóstico preoperatorio preciso en los adenomas de la ampolla de Vater exige la resección tras su diagnóstico. La ampulectomía es el tratamiento de elección en los adenomas vellosos y adenocarcinomas T1 si se consigue un margen de resección de 1 cm, evitándose la recidiva local.
Palabras clave: Papila de Vater. Tumor papilar. Ampulectomía.
INTRODUCCIÓN
En 1720 Abraham Vater describió una nueva entidad anatómica que hoy reconocemos como ampolla de Vater (1). Está formada en la mayoría de los individuos por la unión de los segmentos terminales del conducto pancreático y del colédoco. En el 25% de los casos la ampolla está formada sólo por la terminación del colédoco, teniendo el Wirsung su propia entrada en el duodeno independiente y adyacente a la ampolla. La ampolla se abre en el duodeno a través de una pequeña elevación mucosa que conocemos como papila de Vater. Los tumores de la ampolla de Vater se denominan ampulomas y representan el 2% de todos los tumores del tracto digestivo (2). Los dos tipos más habituales de tumores son los adenomas (en torno al 70% adenomas vellosos) y los adenocarcinomas (2,3).
El objetivo de este trabajo es intentar identificar los pacientes que se beneficiarían de una ampulectomía transduodenal en el tratamiento de los tumores ampulares reflejando nuestra experiencia en la ampulectomía quirúrgica en el tratamiento de adenomas vellosos y adenocarcinomas de la ampolla de Vater.
PACIENTES Y MÉTODOS
Se realiza una revisión retrospectiva de los pacientes con adenomas vellosos y adenocarcinomas de la ampolla de Vater susceptibles de exéresis local transduodenal y sometidos a ampulectomía entre el 1 de enero de 1998 y el 30 de junio de 2003 en el Servicio de Cirugía General y del Aparato Digestivo "A" del Hospital "Juan Canalejo" de A Coruña, España. Se han intervenido en dicho periodo 28 pacientes con diagnóstico anatomopatológico de adenocarcinoma de la ampolla de Vater y tres adenomas vellosos de la papila, uno de ellos asociado a adenocarcinoma. Hemos tratado mediante ampulectomía transduodenal a 8 pacientes, 5 varones y 3 hembras. El resto fueron sometidos a DPC (duodenopancreatectomía cefálica). La edad media de presentación de los pacientes sometidos a ampulectomía transduodenal fue de 67 años (rango 52 a 78). El síntoma más frecuente fue el dolor abdominal, en 5 casos, seguido de ictericia en 3. La presencia de dichos síntomas condujo a la realización de una bioquímica hepática, y una ecografía abdominal. La colangiopancreatografía retrógrada endoscópica (CPRE) evidenció la presencia de una tumoración de la ampolla y la biopsia de dicha tumoración nos orientó al diagnóstico. En todos los pacientes se realizó tomografía computerizada (TC) abdominal como estudio de extensión y se estudiaron los niveles de antígeno carcinoembrionario (CEA). Ningún paciente fue estadificado mediante ecoendoscopia.
Todos los pacientes fueron intervenidos mediante una incisión subcostal derecha y tras realizar colecistectomía, se cateterizó con un Fogarty la vía biliar a través del cístico para identificar la papila. Tras una duodenotomía vertical se efectuó una inyección submucosa de solución de adrenalina a 1/100.000 para evitar el sangrado y se procedió a la exéresis de la papila dejando un cm de margen en todos los planos, incluido el pancreático. Posteriormente se procedió a reimplantar el colédoco y el conducto pancreático con sutura reabsorbible de 5/0 realizándose a continuación el cierre de la duodenotomía. El espécimen obtenido fue enviado para estudio anatomopatológico intraoperatorio para valorar los bordes de resección. Si el tumor estaba próximo al borde de resección se realizó DPC según la técnica de Whipple. Sólo se realizó linfadenectomía locorregional tras DPC.
RESULTADOS
La bioquímica hepática evidenció un patrón colostásico en todos los casos. La ecografia abdominal permitió identificar dilatación de la vía biliar intra y/o extrahepática en todos los enfermos sin evidenciar nunca la causa. El CEA siempre fue normal y la TC nunca reveló la presencia de extensión de la enfermedad. La ERCP fue diagnóstica en el 100% de los casos y el diagnóstico biópsico fue correcto en dos adenomas vellosos y 5 adenocarcinomas, identificándose un falso negativo de adenoma velloso que resultó presentar componentes de adenocarcinoma.
En todos los pacientes se realizó ampulectomía. Se apreció un tumor próximo al borde de resección en 3 de los 6 adenocarcinomas. Se completó la cirugía mediante DPC en 2 de estos casos. Por ser el tercer paciente un mal candidato para dicha cirugía, no se prosiguió con la intervención y falleció a los 13 meses. Todos los pacientes fueron informados de la posibilidad de continuar con una DPC si existían datos para completar la intervención. Seis de ellos lo aceptaron pero lo rechazó un pacientes en el que el riesgo quirúrgico era alto y otro en el que el diagnóstico inicial era de adenoma velloso pero cuya exéresis confirmó la presencia de un adenocarcinoma.
La mortalidad fue nula y la morbilidad fue de 2 pacientes con hemorragia digestiva alta (HDA) que se solucionaron mediante electrocoagulación endoscópica a las 24 horas en un paciente y por embolización de la arteria gastroduodenal en el otro.
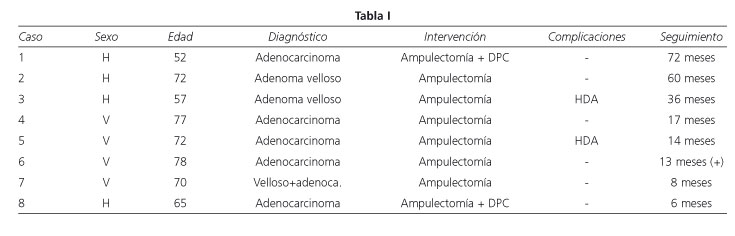
El seguimiento abarca desde los 6 a los 72 meses. Una paciente a la que se realizó DPC por borde de resección de tumor moderadamente diferenciado muy próximo al tumor, presentó a los 58 meses una metástasis en la pared abdominal de la que fue intervenida y requirió nueva intervención por metástasis en la cadena iliaca derecha con compresión del nervio crural de la que fue intervenida 12 meses después. El resto de los pacientes permanecen asintomáticos (Tabla I).
DISCUSIÓN
Los tumores ampulares representan una amplia variedad de entidades patológicas. El tumor más frecuente es el adenoma y su progresión a adenoma velloso y adenocarcinoma está admitida en el mismo sentido que la secuencia adenoma-carcinoma de los pólipos de colon. Los adenomas vellosos de la papila de Vater son considerados lesiones premalignas. Por ello que está indicada su exéresis con el fin de evitar el desarrollo de adenocarcinoma. Esto acontece en el 25 al 40% de los pacientes, aunque en el 40% de los casos se trata de carcinomas son "in situ" 4,5, como sucedió en uno de nuestros tres casos (33%). No existe un único tratamiento deseable para todas las lesiones y además, no todos los adenocarcinomas requieren DPC ni todas las lesiones benignas se beneficiarán de resección local (5). La selección adecuada de los pacientes en los que una resección local fuera segura y eficaz, permitiría un tratamiento apropiado según el tipo de tumor.
Las características anatomopatológicas de la papila y las limitaciones en la toma de biopsia, hace que el diagnóstico histológico preoperatorio correcto mediante endoscopia no sea sencillo ni fiable. La realización de macrobiopsias y citología por cepillado ayudan en la precisión diagnóstica; pero su adecuada catalogación exige la resección completa del tumor y su biopsia extemporánea, ya que es imposible valorar con certeza en cada paciente la presencia de un carcinoma in situ o un carcinoma infiltrante en los adenomas sin su excisión completa (5-7). En nuestra serie sólo un paciente (caso 7) fue diagnosticado inicialmente como benigno, confirmándose la malignidad tras la exéresis total del tumor, lo que confiere una precisión diagnóstica del 87,5%. La ecoendoscopia y la colangiorresonancia, realizadas previamente a la esfinterotomía y a la inserción de una endoprótesis para minimizar errores de interpretación, permiten el estadiaje de la lesión, sobre todo en cuanto al grado de penetración en la pared y en el páncreas, aunque el sobreestadiaje debido a edema de la submucosa por pancreatitis puede llegar a ocurrir en un tercio de las lesiones. Ambas técnicas son menos fiables a la hora de establecer el grado de afectación ganglionar (8,9), aunque podrían identificar a los pacientes que se beneficiarían de una resección endoscópica. En nuestros pacientes realizamos estudio de extensión mediante TC para identificar criterios que contraindicaran la intervención. La biopsia intraoperatoria con exéresis total de la lesión nos permitió establecer el diagnóstico definitivo y el grado de penetración tumoral en la pared sin que haya habido problemas de interpretación de las biopsias en pacientes con papilotomía previa (6), quizás porque todos los pacientes fueron intervenidos entre 3 y 7 días tras la realización de la misma con lo que se minimizan los errores de interpretación debidos a los cambios regenerativos.
Actualmente se considera que todos los tumores ampulares deben ser resecados debido al riesgo de malignización (10). La controversia surge al intentar establecer qué tipo de resección es la adecuada para las características del tumor y del paciente.
La ampulectomía fue descrita por primera vez por Halsted en 1899 (11). Tras su época dorada a principios de siglo, fue progresivamente abandonada debido a su morbimortalidad postoperatoria, su alta tasa de recidivas y la introducción de la DPC. Actualmente se asocia con menor morbimortalidad y menor estancia hospitalaria que la DPC (5,7,12), así como escasa tasa de recidivas si la indicación y la técnica quirúrgica se establecen correctamente, dejando un margen de resección de 1 cm (7) en caso de adenocarcinomas y algo menor en caso de adenomas vellosos. La escisión endoscópica local no permite un margen amplio de resección del borde pancreático, por lo que las posibilidades de recidiva local serían altas, limitándose por tanto su indicación como tratamiento paliativo de pacientes inapropiados para cirugía o que rechazan la intervención (13). En largas series se demostró que el factor pronóstico más importante para la supervivencia es la resección completa del tumor (14-16). En adenomas vellosos y adenocarcinomas pT1, la ampulectomía tiene igual o mejores resultados globales que la DPC (7,17). Nosotros la hemos realizado en 6 pacientes con un seguimiento entre 8 y 60 meses sin signos de recidiva, aunque en dos pacientes se ha producido un episodio de HDA. Esta complicación está descrita como complicación con cierta frecuencia (10), secundaria, probablemente al uso de adrenalina, que aunque facilita la exéresis, posibilita el resangrado tras ser metabolizada. Cuando el borde de resección estaba afectado o muy próximo al tumor, que suele coincidir con tumores poco o moderadamente diferenciados, procedimos a DPC previo consentimiento informado del paciente establecido antes de la cirugía. El paciente correspondiente al caso 7 se negó a proseguir con la DPC si existía indicación para la misma, por lo que, a pesar del que el margen de resección era menor a 1 cm, se realizó simplemente ampulectomía. A los 8 meses de la intervención permanece asintomático sin signos de recidiva en la endoscopia realizada a los 6 meses.
La ampolla de Vater tiene un patrón de drenaje linfático distinto a los tumores de páncreas, afectando a los ganglios próximos retroduodenales, incluso en casos avanzados, por lo que algunos autores abogan por la linfadenectomía local junto con la ampulectomía para mejorar el pronóstico (18,19). Sólo la afectación de ganglios locales en tumores T1 poco diferenciados con margen de resección aceptable, justificarían completar la intervención con DPC (7). En tumores T2 bien diferenciados con margen de resección aceptable sin afectación ganglionar, probablemente la ampulectomía sería así mismo suficiente. La afectación pancreática obligaría a DPC con linfadenectomía locorregional, debido a las características de diseminación linfática tras afectación pancreática como sucedió en dos de nuestros pacientes.
Es importante el seguimiento endoscópico tras ampulectomía, que nosotros realizamos cada 6 meses durante los tres primeros años, y posteriormente con periodicidad anual, para detectar recidivas que obliguen a la realización de DPC.
En conclusión, podemos decir que la ampulectomía transduodenal es el tratamiento adecuado para adenomas vellosos de papila siempre que la exéresis sea completa y podría ser el tratamiento ideal para adenocarcinomas de la papila bien diferenciados, siempre que se consiga un margen de resección en todos los planos de al menos 1 cm.
BIBLIOGRAFÍA
1. Vater A. Disertatio anatomica qua novum bilis diverticulum circa orificium ductus choledochi, at et valvulosum colli vesical fellae constructionem ad discepterdum proponit. Wittenberg, Lit Gerdesianis, 1720. p. 2-32. [ Links ]
2. Seifert W, Schulte F, Stolte M. Adenoma and carcinoma of the duodenum and papilla of Vater: a clinicopathologic study. Am J Gastroenterol 1992; 87: 37-41. [ Links ]
3. Sharp KW, Brandes JL. Local resection of tumors of the ampulla of Vater. Am Surg 1990; 56: 214-7. [ Links ]
4. Seifert E, Schulte F, Stolte M. Adenoma and carcinoma of the duodenum and papilla of Vater: a clinicopathologic study. Am J Gastroenterol 1992; 87: 37-42. [ Links ]
5. Rattner DX, Fernández C, Brugger WR, Warshaw AL. Defining the criteria for local resection of ampullary neoplasms. Arch Surg 1996; 131: 366-71. [ Links ]
6. Rodríguez C, Borda F, Elizalde I, Jiménez FJ, Carral D. ¿Hasta qué punto es seguro el diagnóstico preoperatorio de la biopsia endoscópica en el tumor ampular? Rev Esp Enferm Dig 2002; 94 (10): 585-8. [ Links ]
7. Beger H, Treitschke F, Gansauge F, Harada H, Hiki N, Mattfeldt T. Tumor of the ampulla of Vater. Experience with local or radical resection in 171 consecutively treated patients. Arch Surg 1999; 134: 526-32. [ Links ]
8. Souquet JC, Napoleon B, Pujol B, Ponchon T, Keriven O, Lambert R. Ecoendoscopy prior to endoscopy tumor therapy: more safety? Endoscopy 1993; 25: 475-8. [ Links ]
9. Géier A, Nguyen HN, Gartung C, Matern S. MRCP and ERCP to detect small ampullary carcinoma. Lancet 2000; 356 (9241): 1607-8. [ Links ]
10. Chareton B, Coiffic J, Landen S, Bardaxoglou E, Campion JP, Launois B. Diagnosis and therapy for ampullary tumors: 63 cases. World J Surg 1996; 20: 707-12. [ Links ]
11. Halsted W. Contributions to the surgery of the bile passages especially of the common bile duct. Boston Med Surg 1889; 141: 645-54. [ Links ]
12. Farouk M, Niotis M, Branum G, Cotton PB, Meyers WC. Indications for and the technique of local resection of tumors of the papila of Vater. Arch Surg 1991; 126: 650-2. [ Links ]
13. Tokunaga Y, Hosogi H, Hoppou T, Nagakami M, Tokuka A, Ohsumi K. A case of ampullary carcinoma successfully managed with endoscopic snare resection. Surg Laparosc Endosc Percutan Tech 2002; 12 (4): 273-8. [ Links ]
14. Monson JRT, Donohue JH, McEntee GP. Radical resection for carcinoma of the ampulla of Vater. Arch Surg 1991; 126: 353-7. [ Links ]
15. Matory YL, Gaynor J, Brennan M. Carcinoma of the ampulla of Vater. Surg Gynecol Obstet 1993; 177: 366-70. [ Links ]
16. Allema JH, Reinders ME, van Gulik TM. Results of pancreaticoduodenectomy for ampullary carcinoma and analysis of prognostic factors for survival. Surgery 1995; 117: 247-53. [ Links ]
17. Asbun HJ, Rossi RL, Munson Jl. Local resection for ampullary tumors: is there a place for it? Arch Surg 1993; 128: 515-20. [ Links ]
18. Hanyu F, Imaizumi T, Nakamura M, Yoshikawa T. Proposed definition of early cancer of the papilla of Vater. J Biliary Tract Pancreas 1984; 5: 847-52. [ Links ]
19. Willet CG, Warshaw AL, Convery K, Compton CC. Patterns of faillure after pancreaticoduodenectomy for ampullary carcinoma. Surg Gynecol Obstet 1993; 176: 33-8. [ Links ]











 texto en
texto en