Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Española de Enfermedades Digestivas
versão impressa ISSN 1130-0108
Rev. esp. enferm. dig. vol.97 no.10 Madrid Out. 2005
|
PUNTOS DE VISTA |
Carcinomatosis peritoneal de origen colorrectal. Estado actual
del tratamiento.
Revisión y puesta al día
A. Gómez Portilla, I. Cendoya, I. López de Tejada, I. Olabarría, C. Martínez de Lecea,
L. Magrach,
A. Gil, J. Echevarría,
M. Valdovinos e I. Larrabide
Programa de Carcinomatosis Peritoneal. Policlínica San José. Vitoria
RESUMEN
El cáncer colorrectal es el tumor más frecuente del tracto digestivo. La alta incidencia de diseminación abdominal, el pobre pronóstico de estos pacientes con una mediana de supervivencia entre 5 y 9 meses demostrada repetidamente en todos los estudios de carcinomatosis peritoneal por cáncer colorrectal, el fracaso de los tratamientos sistémicos adyuvantes con quimioterapia con supervivencias máximas de 18 meses independientemente del desarrollo de nuevas drogas citostáticas y las nuevas combinaciones o formas de uso, hacen crucial la investigación y el desarrollo de nuevas estrategias de tratamiento.
Revisamos los principios del protocolo del tratamiento de Sugarbaker, que contempla la combinación de la máxima cirugía radical oncológica citorreductora para el tratamiento de la enfermedad macroscópica diseminada con la máxima quimioterapia de intensificación intraperitoneal perioperatoria para el tratamiento de la enfermedad microscópica residual.
Se presentan los resultados de las publicaciones científicas, de todos los estudios fase II con más de 10 pacientes tratados publicados en la literatura médica por los principales grupos de trabajo en esta línea de tratamiento, junto con el único estudio fase III publicado hasta el momento, y finalmente los resultados de un reciente estudio multicéntrico internacional retrospectivo.
Con esta nueva alternativa terapéutica, la supervivencia media a los 36 meses es del 40, y del 20% a los 5 años. Basados en estos resultados, proponemos esta alternativa de tratamiento como el tratamiento de elección de estos desafortunados pacientes.
Palabras clave: Cáncer colorrectal. Protocolo de tratamiento de Sugarbaker. Alternativa terapéutica.
INTRODUCCIÓN
La enfermedad diseminada metastásica es la mayor causa de muerte de los pacientes con cáncer colorrectal, pero a diferencia de otras patologías, la presencia de enfermedad diseminada de origen colorrectal tanto en cavidad abdominal como a distancia, hígado y pulmón, no impide en la actualidad planteamientos terapéuticos con intención curativa en grupos seleccionados de pacientes.
La alta incidencia del cáncer colorrectal, tumor digestivo más frecuente, la afectación carcinomatosa en el 10-20% de los pacientes bien inicialmente o a lo largo del devenir de la enfermedad, la historia natural de los pacientes afectos de diseminación peritoneal por cáncer colorrectal con supervivencias menores a 6 meses cuando son tratados con esquemas terapéuticos convencionales, el fracaso de la quimioterapia sistémica en el tratamiento de estos desafortunados pacientes a pesar de la aplicación de nuevos fármacos y esquemas de quimioterapia, ha obligado al desarrollo de nuevas actitudes y alternativas terapéuticas.Desde 1982, el Dr. Sugarbaker planteó la diseminación peritoneal como un estadio locorregional de la enfermedad y desarrolló una nueva alternativa terapéutica basada en el tratamiento de la enfermedad macroscópica mediante cirugía citorreductora radical oncológica merced a las peritonectomías por él desarrolladas, seguido del tratamiento de la enfermedad residual microscópica con la aplicación directa intraabdominal, de quimioterapia de intensificación locorregional modulada por hipertermia intraoperatoria y de quimioterapia intraabdominal postoperatoria precoz.
Pues bien, con este nuevo esquema terapéutico su grupo está obteniendo supervivencias a 5 años superiores al 30% tras citorreducciones completas, y en grupos selectos incluso curaciones de enfermos hasta ahora erróneamente considerados terminales (1).
Estos resultados espectaculares nos obligan a presentar la revisión actualizada de las bases y fundamentos de esta alternativa terapéutica que desde el año 1997 venimos implantando y desarrollando de forma pionera en nuestro medio de trabajo aquí en España, y a solicitar que esta alternativa de tratamiento sea considerada por todos los profesionales involucrados en el diagnóstico y tratamiento de estos desafortunados pacientes (2).
HISTORIA NATURAL DE LA CARCINOMATOSIS NO TRATADA
Incidencia de la carcinomatosis peritoneal por cáncer colorrectal
El cáncer colorrectal constituye un problema de salud pública en los países occidentales, al ser la segunda neoplasia más frecuente en el hombre y la tercera en las mujeres. La incidencia de cáncer colorrectal mundial se estima en 945.000 pacientes por año (3). Según los registros de tumores de nuestro país, 19.166 nuevos casos de cáncer colorrectal se registraron en el año 2000 en España (4).
Muchos de estos pacientes se presentan con metástasis y hasta el 50% desarrollarán metástasis a lo largo de su enfermedad. Los lugares de presentación de las metástasis en orden de frecuencia en el cáncer colorrectal son el hígado, el peritoneo, el pulmón, los huesos y el cerebro (5).
La incidencia exacta de carcinomatosis peritoneal como lugar de recurrencia no es conocida con certeza, pues la mayoría de los estudios analíticos y de imagen, utilizados en el seguimiento de los pacientes con cáncer colorrectal no son capaces de detectar la enfermedad en estadios iniciales. Se estima que en el momento del diagnóstico de cáncer de colon, la superficie peritoneal está afecta en un 10-15% y que la recurrencia inicial en el peritoneo es de hasta un 50% en los pacientes después de cirugía curativa exerética por cáncer de colon. Si bien es conocido que la diseminación peritoneal aparece en el 40-70% de los pacientes con enfermedad recurrente, tan sólo el 10-35% de los pacientes presentan enfermedad confinada exclusivamente al peritoneo (6-8). El tratamiento de la enfermedad diseminada peritoneal sigue constituyendo una de las fronteras en oncología (9).
La experiencia aportada por las reoperaciones programadas de Wangesteen desde 1948, permitieron comprobar una recurrencia de 64% a los 6-12 meses de la cirugía inicial, estando esta recurrencia en casi en el 80% de las veces confinada a la cavidad abdominal exclusivamente, afectación de hígado, tejido linfático retroperitoneales con o sin afectación peritoneal (10).
En laparotomías realizadas en pacientes sintomáticos, la diseminación carcinomatosa ha estado presente en la mitad de los pacientes, mientras que ha sido el lugar único de recurrencia en sólo el 2-18% de los casos. La revisión de Brodsky (11) sobre el devenir de los pacientes tratados curativamente por un cáncer colorrectal mostró que 25-35% de los pacientes presentaron una recidiva peritoneal y que el 15% de ellos esta recidiva peritoneal era la única localización metastásica de la enfermedad. Es este pequeño grupo de enfermos, conocidos como pacientes con diseminación peritoneal predominante (12), los que pueden beneficiarse de un tratamiento con intención curativa de la carcinomatosis peritoneal con la condición de que la resección sea completa.
Historia natural de la carcinomatosis de origen colorrectal
El término "carcinomatosis peritoneal" fue empleado inicialmente por Sampson en 1931 (13), para describir la diseminación regional del cáncer en pacientes con carcinoma ovárico, el mecanismo de diseminación se intuyó que se efectuaba principalmente por implantación, aunque la diseminación venosa y linfática se contemplaba en algunos casos. Este concepto se ha mantenido generalmente aceptado hasta la actualidad.
La carcinomatosis peritoneal representa la diseminación locorregional intraabdominal de los cánceres gastrointestinales, ginecológicos y de otros tumores con o sin evidencia de enfermedad metastásica sistémica. Se manifiesta por la presencia de nódulos tumorales de tamaño, número, y distribución variable en la superficie peritoneal. Hay una enorme variedad de manifestarse la enfermedad individualmente, desde la presencia de algunos nódulos pequeños superficiales en la vecindad del tumor primario hasta cavidades abdominales completamente ocupadas por grandes depósitos tumorales invasivos (14).
Esta afectación regional de la enfermedad cancerosa se ha asociado tradicionalmente con mal pronóstico y casi uniformemente con incurabilidad. El tratamiento de estos pacientes ha consistido desde laparotomías para la toma de biopsias hasta resecciones extensas de tumor, siendo los enfermos después referenciados a sus oncólogos para tratamientos con quimioterapia sistémica (15).
La mayoría de estos pacientes sufrían terriblemente y en una media de 9 meses fallecían de obstrucción intestinal o de inanición con caquexia terminal (16).
En ocasiones los pacientes requerían una intervención quirúrgica por oclusión intestinal, hemorragia, perforación y ocasionalmente por ascitis profusa. Si bien, debido a los pobres índices de supervivencia de estos pacientes, algunos cirujanos han abogado por actitudes abstencionistas en casos seleccionados (17,18).
La carcinomatosis peritoneal es la causa de muerte más común en pacientes resecados por cánceres intraabdominales (19). Siendo, según Sugarbaker (20), la persistencia de células tumorales en la cavidad abdominal o en la pelvis las responsables de la muerte del 30-50% de los pacientes que mueren de esta enfermedad.Las metástasis peritoneales del cáncer colorrectal se consideran en el momento actual igual que la enfermedad metastásica a distancia o diseminada, y por tanto es tratada con quimioterapia sistémica o con cirugía junto con quimioterapia sistémica ambas únicamente con intención paliativa (6).
Pocos son los estudios publicados sobre la historia natural de la carcinomatosis de origen colorrectal. La mediana de supervivencia observada en pacientes afectos de carcinomatosis colorrectal fue de 6 meses para Chu y cols. (14), de 5,2 meses en el estudio multicéntrico EVOCAPE de Sadeghi y cols. (15), y de 9 meses en la serie más importante y reciente de Jayne y cols. (21), como queda reflejado en la tabla I.
La carcinomatosis peritoneal es pués, una forma común de progresión de la enfermedad en pacientes con cáncer colorrectal. De 2.756 pacientes con cáncer colorrectal, 349 (13%) fueron identificados con carcinomatosis peritoneal, 214 sincrónica y 135 metacrónicamente. En 125 (58%) de los pacientes con enfermedad sincrónica estaban libres de enfermedad metastásica y 80 de ellos tenían enfermedad con carcinomatosis peritoneal localizada, definida la carcinomatosis como localizada cuando solamente una de las 5 regiones abdomino-pélvicas estaba afectada por tumor. La supervivencia media en enfermedad localizada fue de 9 meses y de 4 meses cuando la enfermedad estaba generalizada. En los pacientes considerados para la operación la extensión de la carcinomatosis parece ser el único indicador de supervivencia (16).
La incidencia de carcinomatosis peritoneal en este estudio fue de 13%, comparable con otros trabajos. Lo más relevante del estudio es el grupo que desarrolla carcinomatosis localizada en ausencia de enfermedad a cualquier otro nivel, seguramente son los pacientes que se puedan beneficiar de la cirugía citorreductora con IPCH (16).
Pestieau y Sugarbaker (1) han hipotizado que si la carcinomatosis de colon es de poco volumen y es tratada mediante cirugía citorreductora con quimioterapia intraperitoneal intraoperatoria, entonces la supervivencia a 5 años mejorará. La citorreducción completa es esencial para conseguir una supervivencia a largo plazo. Si todo el cáncer visible puede ser resecado, entonces la enfermedad residual puede ser erradicada mediante una adecuada quimioterapia intraperitoneal perioperatoria El control efectivo regional pospondrá la muerte en la mayoría de los casos y posiblemente curará algunos de los pacientes (22).
La historia natural de la enfermedad y la heterogeneidad de los pacientes es tal que solamente un estudio randomizado prospectivo contestaría adecuadamente a las preguntas sobre si el tratamiento locorregional prolonga la supervivencia.
Aunque los beneficios de la cirugía citoreductora con quimioterapia intraperitoneal intraoperatoria tienen que ser validados por estudios prospectivos randomizados, hay un interés y entusiasmo creciente por esta nueva alternativa de tratamiento, particularmente a la vista del nefasto pronóstico asociado con los tratamientos convencionales (21).
El 85% de los pacientes con carcinomatosis de origen colorrectal fallecen con enfermedad confinada al abdomen (23).
TRATAMIENTOS ADYUVANTES CON QUIMIOTERAPIA SISTÉMICA EN CÁNCER AVANZADO DE COLON Y RECTO
Durante los últimos 40 años el 5-FU ha sido prácticamente la única opción quimioterápica eficaz en pacientes con cáncer avanzado de colon y recto, y todavía se considera la droga fundamental, aunque en la práctica sólo produce respuestas completas en el 10% de los pacientes, con una media de supervivencia entre 9 y 12 meses y solamente 5% de los pacientes vivos a los 3 años (24).
Un meta-análisis de las publicaciones disponibles en 1992, demostró una respuesta de un 11% para el 5-FU como monoterapia, frente a un 23% cuando se modulaba con Ac. folínico (25). Otro metanálisis comparativo de la forma de administración del 5-FU, demostró una superioridad de la infusión continua frente a los bolus en términos de respuesta y supervivencia (26,27). Las combinaciones de 5-FU/LV con oxaliplatino o irinotecán (CPT-11) son en la actualidad los tratamientos disponibles más activos en el cáncer avanzado colorrectal (28-31).
En los últimos tiempos se están estudiando otros agentes quimioterápicos como las fluorpirimidinas orales (UTF, capecitabina), el raltitrexed (Tomudex®), demostrando equivalencia en tasa de respuestas con mejores tolerancias que los esquemas clásicos, con la ventaja de su administración oral en muchos casos. Sin embargo no se han conseguido mejoras en la supervivencia (32-34). Los principales estudios multicéntricos randomizados fase III de quimioterapia adyuvante quedan reflejados en la tabla II.
Los estudios publicados en terapia sistémica de enfermedad avanzada colorrectal no son por enfermedad peritoneal diseminada, sino que en su mayoría son estudios sobre enfermedad hepática, por ser la forma más fácil de medir la enfermedad. El tratamiento para la enfermedad metastásica no se da con intención curativa excepto en la situación de metástasis hepática o pulmonar. Sólo en pacientes con resecciones hepáticas curativas se han conseguido supervivencias a los 5 años del 25-40%, aunque en el 60-70% de los casos la enfermedad recidivará en hígado o pulmón (41). Los objetivos principales del tratamiento médico de la enfermedad avanzada colorrectal son entonces prolongar la supervivencia y mejorar la calidad de vida del paciente (42). La mayoría de los casos con metástasis peritoneales de origen gastrointestinal son relativamente resistentes a las drogas citostáticas sistémicas, con un claro efecto dosis dependiente (22). La quimioterapia sistémica no es suficiente, pero la cirugía sola tampoco es suficiente (1).
A pesar de los avances en las drogas quimioterápicas, no se dispone de tratamientos satisfactorios para la carcinomatosis peritoneal. La principal razón de estos resultados pesimistas puede ser que las drogas citostáticas administradas no actúan en las metástasis peritoneales en concentraciones suficientemente altas (43).
CIRUGÍA CITORREDUCTORA RADICAL ONCOLÓGICA
El objetivo principal de cualquier tratamiento con intención curativa en cirugía oncológica es la erradicación completa del tejido tumoral maligno. Este principio ha quedado suficientemente demostrado en la cirugía del tumor primario y en la enfermedad metastásica de hígado y pulmón (44).
El objetivo de la cirugía citorreductora es conseguir una extirpación completa de la enfermedad tumoral macroscópica (45). Fue Sugarbaker quien desarrolló la técnica quirúrgica específica que posibilita la realización de esta cirugía citorreductora radical oncológica conocida como peritonectomías mediante el uso de electrocirugía en pacientes con carcinomatosis peritoneal (46). Hasta 6 diferentes peritonectomías pueden ser necesarias para conseguir erradicar la enfermedad, lo que puede requerir entre 8 y 12 horas de cirugía (47). Las peritonectomías se utilizan exclusivamente en áreas con tumor visible y con intención de conseguir dejar al paciente con reducción de la enfermedad a nivel microscópico, sin embargo la cirugía sola no puede ser completa a nivel microscópico (22). El principal inconveniente del tratamiento de la enfermedad peritoneal es la imposibilidad de completar una resección quirúrgica dado que siempre se produce una diseminación invisible en la cavidad abdominal (48). Y es precisamente la persistencia de la enfermedad microscópica residual que el cirujano no ve, lo que finalmente mata al paciente (49).
La experiencia ha demostrado que si se utiliza sola la cirugía, el 100% de los pacientes recidivarán a pesar del hecho aparente de que la enfermedad parece localizada y ha sido completamente resecada (50).
La reimplantación de células malignas en pacientes con carcinomatosis peritoneal en las superficies de las peritonectomías debe ser esperada a menos que se use asociada a quimioterapia intraperitoneal peroperatoria. El respeto por el peritoneo constituye la primera línea defensiva frente a la carcinomatosis, las peritonectomías se utilizan exclusivamente en áreas con tumor visible (20).
La falta de respeto por el peritoneo como primera línea de defensa contra la carcinomatosis produce:
1. Mayor diseminación.
2. Aparición de implantes en estructuras vitales.
3. Los implantes más profundos no pueden ser extirpados mediante peritonectomías.
4. Menos citorreducciones curativas.
Por estos motivos las peritonectomías se utilizan exclusivamente en áreas afectas por tumor, respetando siempre las libres de implantación tumoral (20).
En todos los cánceres, el tratamiento precoz agresivo de la enfermedad diseminada peritoneal en sus niveles mínimos demuestra los mejores resultados (20). En carcinomatosis peritoneal de origen colorrectal, sólo se pueden conseguir supervivencias de largo tiempo después de haber resecado todos los implantes visibles y/o órganos afectos (51).
Sin embargo en ocasiones no es posible la erradicación de la enfermedad. Los principales límites los constituye el peritoneo visceral, tanto a nivel del hilio hepatobiliar, como la retracción del mesenterio y la afectación masiva del intestino delgado por infiltración tumoral (52).
INTERÉS POR LA QUIMIOTERAPIA INTRAPERITONEAL PERIOPERATORIA
El interés por la quimioterapia intraperitoneal no es nuevo, ya en 1955 Weissberger recogía los resultados del tratamiento de 7 pacientes con cáncer de ovario tratados con quimiterapia intraperitoneal con mostaza nitrogenada (53).
Los principales estudios farmacocinéticos fueron realizados por Dedrick en 1978 (54), en ellos encontraron que las drogas citostáticas hidrófilas pueden mantener un gradiente de concentración significativo por la barrera peritoneo-plasmática cuando se añaden en la cavidad abdominal en grandes volúmenes. Sin embargo también en sus estudios demostraron que el mayor factor limitante para el uso clínico de la quimioterapia intraperitoneal era la escasa penetración de las drogas utilizadas en los tejidos tumorales. En la actualidad se cree que la difusión de los citostáticos es máxima entre 1-3 mm en la periferia del tumor (55).
Por estos motivos hoy es aceptado de forma general que solamente los pacientes con enfermedad residual mínima después de la cirugía son candidatos a beneficiarse de la quimioterapia intraperitoneal. A menudo la extirpación completa de la enfermedad tumoral macroscópica no es posible. La mayoría de los grupos consideran que la quimioterapia intraperitoneal es sólo útil si los nódulos residuales tumorales son menores de 3 mm.
La administración de quimioterapia intraperitoneal tiene el beneficio de proporcionar concentraciones más altas de citostáticos localmente en el lugar donde se encuentra el tumor, minimizando mientras los efectos tóxicos sistémicos comparativamente con la administración endovenosa sistémica (56).
La quimioterapia intraperitoneal en el tratamiento y prevención de las enfermedades peritoneales fue introducida en los comienzos de los 80 (20). Ya en 1985, Sugarbaker y cols. aconsejaban la utilización de quimioterapia intraperitoneal en los cánceres avanzados colorrectales (57).
Gilly (58) aporta la primera experiencia en Europa siguiendo la escuela de Fujimoto y Koga (59,60).
Básicamente el grupo occidental liderado por Sugarbaker se superespecializa en carcinomatosis colorrectal y pseudomixoma peritoneal mientras que los investigadores orientales liderados por Yonemura lo hacen en carcinomatosis gástrica.Tres son las causas por las que la utilización de la quimioterapia intraperitoneal ha tenido un éxito limitado y escasa aceptación por los oncólogos:
-La limitada penetración de las drogas en los nódulos tumorales. Solamente las capas celulares más externas son penetradas por los citostáticos, lo que obliga a que la enfermedad microscópica residual sea la enfermedad diana para los protocolos de este tipo de tratamiento.
-La falta de distribución uniforme de los citostáticos en la cavidad abdominal por las adherencias y presencia de gran volumen de tumor.
-La elección inadecuada de los pacientes.
Hoy se ha producido un importante cambio en la utilización de la quimioterapia. Cambio en la ruta de administración, ahora la quimioterapia se administra intraperitonealmente, la quimioterapia actúa donde la enfermedad está. También se produce un cambio en el tiempo, dado que la quimioterapia comienza ha administrarse en el mismo quirófano intraoperatoriamente justo finalizada la extirpación citorreductora de la enfermedad macroscópica, cuando tan sólo existe enfermedad microscópica residual. Finalmente un tercer cambio se produce en los criterios de selección de los enfermos candidatos a este tratamiento, al ser necesaria una citorreducción completa de la enfermedad antes de administrarse los citostáticos, siendo el tamaño de los implantes residuales de crucial importancia (20,47,61).
El mayor cambio está por producirse, y será el cambio de actitud de los oncólogos hacia el tratamiento de la enfermedad avanzada colorrectal, ya que la carcinomatosis peritoneal es potencialmente curable con la aplicación precoz de este nuevo tratamiento combinado (20).
BENEFICIO DE LA QUIMIOTERAPIA INTRAPERITONEAL HIPERTÉRMICA
La utilización terapéutica del calor es conocida desde el aforismo hipocrático (sección VII, # 83) que afirmaba que lo que la medicina no cura, lo cura el hierro (bisturí), lo que no cura el hierro, lo cura el fuego, y aquello que el fuego no cura, es realmente incurable (62).
La hipertermia por sí misma tiene un efecto citotóxico causado por la afectación de la reparación del DNA, la desnaturalización de las proteínas, la inducción de proteínas de shock térmicas, la inducción de la apoptosis y la inhibición de la angiogénesis.
La verdadera hipertermia se define con temperaturas de 41 ºC o mayores. El sinergismo de las citostáticos puede también ocurrir a temperaturas entre 39-41 ºC.No existe un consenso todavía sobre la temperatura óptima durante la quimioterapia hipertérmica. Como se ha señalado anteriormente, el sinergismo comienza a temperaturas de 39 ºC, pero es mayor a temperaturas superiores. Por otro lado, temperaturas por encima de los 43 ºC no demuestran sinergismos mayores y sí la aparición de lesiones en intestino delgado directamente por efecto térmico (63).
Spratt comenzó los estudios experimentales para conseguir un tratamiento local en carcinomatosis que combinara la quimioterapia con la hipertermia. Estos estudios finalmente fructificaron en la primera aplicación de quimioterapia intraperitoneal intraoperatoria en el tratamiento de un pseudomixoma peritoneal en el humano en febrero de 1979 (64,65).
En el momento actual los intercambiadores de calor utilizados en la práctica habitual han sido diseñados para la utilización en circulación extracorpórea y por ello presentan límite de temperatura a 41 ºC, para evitar la lisis de los hematíes. Por esto y por las pérdidas de temperatura de los circuitos utilizados para la administración de la quimioterapia, no puede conseguirse más que una moderada hipertermia con los instrumentos convencionales del mercado. Nosotros hemos conseguido incorporar en el circuito un calentador supletorio que nos asegura una temperatura uniforme de 42 ºC en cavidad durante todo el procedimiento.
La técnica abierta de la quimiohipertermia permite el control continuado de la solución irrigante, evitando los daños que el calor local pueda producir sobre el intestino por contacto prolongado en un mismo punto a la vez que asegura su homogénea distribución por la cavidad sin que queden lugares o recovecos ocultos a su exposición. Los estudios del Instituto del Cáncer de Washington permiten afirmar que no existe ningún riesgo para el personal de quirófano durante la práctica de esta técnica (66).
ELECCIÓN DE LAS DROGAS Y FARMACOCINÉTICA
Las ventajas farmacocinéticas de la quimioterapia intraperitoneal son el factor más importante en el uso racional de la HIPEC en la enfermedad maligna de la superficie peritoneal.
El movimiento de las drogas de peso molecular elevado desde la cavidad peritoneal al compartimento circulatorio del organismo es mucho más lento que el aclaramiento de las drogas desde el compartimento sistémico. Este principio crea un gradiente de concentración debido a la barrera peritoneo-plasmática, fuertemente a favor de la concentración intraperitoneal. Las sustancias de peso molecular grande son confinadas en la cavidad abdominal por largos periodos de tiempo y permite terapias de intensificación. La práctica de peritonectomías con la extirpación del peritoneo parietal, no altera este fenómeno de santuario de la cavidad peritoneal (20).Las drogas citostáticas utilizadas deben reunir las siguientes características:
-Deben tener un elevado peso molecular y ser hidrosolubles.
-Deben ser rápidamente aclaradas de la circulación sistémica y su eficacia debe tener sinergismo con la hipertermia.
-Deben ser drogas no ciclo celulares específicas debido a que son citotóxicas incluso en periodos relativamente cortos de exposición
Las drogas más comúnmente utilizadas y estudiadas como agente quimioterápico intraperitoneal han sido la MMC (mitomicina C) intraoperatoria con un gradiente de concentración peritoneo-plasmático superior a 28, (67,68) junto con el 5-fluorouracilo en régimen de quimioterapia intraperitoneal postoperatoria precoz (69). Recientemente se están estudiando la aplicación intraperitoneal de nuevas drogas consideradas de segunda línea en el tratamiento sistémico de la enfermedad avanzada (70,71). Con estos nuevos esquemas se han conseguido los mejores resultados con supervivencias a 2 años del 74%, postulándose si la adicción de irinotecán al oxaliplatino podrá incluso mejorar en el futuro la eficacia de este tratamiento de intensificación locorregional intraabdominal (72).
Parece que cuanto mayor es la temperatura abdominal, mayor es el gradiente de concentración peritoneo-plasmático. La duración de la perfusión no parece guardar relación con el gradiente peritoneo-plasmático. En la mayoría de los estudios la vida media de la droga es de 90 minutos o menos. No existen estudios suficientes sobre la profundidad de penetración de la MMC después de su administración intraperitoneal, pero sí existen estudios de la penetración tras administración por instilación vesical comprobando su presencia en el urotelio, lamina propia e incluso en capas musculares, lo que sugiere que penetra al menos algunos milímetros (73).
Hay pocos trabajos sobre la dosis máxima tolerada en HIPEC. Los estudios farmacocinéticos realizados en el Instituto del Cáncer de Holanda, han demostrado una inaceptable toxicidad sistémica en dosis de 40 mg/m2, habiendo fijado ellos como límite en su estándar de tratamiento en 35 mg/m2 (6). En la tabla III, se muestran las principales drogas susceptibles de ser utilizadas en tratamientos con HIPEC.
SELECCIÓN DE PACIENTES. ÍNDICES DE CARCINOMATOSIS PERITONEAL
La introducción de la cirugía citorreductora combinada con regímenes de quimioterapia intraperitoneal promete aumentar los tiempos de supervivencia en pacientes seleccionados con carcinomatosis peritoneal (1).
Esta alternativa de tratamiento agresivo en la enfermedad diseminada peritoneal comprende la práctica de peritonectomías para el tratamiento de la enfermedad macroscópica, la administración de HIPEC para el control de la enfermedad microscópica y una selección juiciosa de los pacientes.Los parámetros clínicos necesarios para la selección juiciosa de pacientes incluye: el tipo histológico del tumor (progresión invasiva frente a la expansiva o por aposición), el grado de enfermedad existente y el grado de citorreducción conseguido. Una selección correcta de los pacientes es mandatorio para conseguir optimizar los resultados (46).
Diferentes índices han sido utilizados para el grado de afectación peritoneal y poder así estadiar los pacientes y correlacionarlos con los resultados obtenidos (74).
Gómez Portilla y Sugarbaker (75-77) han desarrollado un método objetivo para determinar el grado de enfermedad existente conocido como índice de carcinomatosis peritoneal (PCI). Con este método se mide la presencia de enfermedad y su tamaño en 13 diferentes regiones abdominales antes de realizar la cirugía citorreductora. Al finalizar la citorreducción se determina el grado de enfermedad residual mediante el índice de citorreducción obtenido que refleja la ausencia de enfermedad macroscópica residual.
Ambos índices, el índice de carcinomatosis peritoneal y el índice de citorreducción conseguida, son los principales factores pronósticos en este tipo de patologías (20).
El uso de estos índices será imprescindible, por cuanto nos ayudará a la selección de los pacientes y evitar cirugías innecesarias en pacientes de alto riesgo que no se beneficiarán de esta modalidad de tratamiento dado que solamente se han conseguido obtener supervivencias prolongadas en pacientes a los que se ha conseguido una citorreducción completa (20). El cirujano debe recordar que no hay supervivientes a largo plazo a no ser que se consiga una citorreducción completa de la enfermedad. La presencia de enfermedad residual en lugares anatómicos difíciles y cruciales puede en ocasiones comprometer un índice de carcinomatosis peritoneal inicialmente favorable (46). Los enfermos con enfermedad sistémica metastásica obviamente no son candidatos a este tratamiento (6). La tabla IV muestra los condicionantes clínicos de la actitud quirúrgica en el tratamiento de la carcinomatosis.
La utilización del PCI, permitirá en el futuro seleccionar los pacientes susceptibles de tratamiento oncoquirúrgico, siendo una contraindicación índices de carcinomatosis peritoneal superiores a 24 (77).
MORBIMORTALIDAD DE LA TÉCNICA
La morbilidad y mortalidad asociada con esta terapia combinada de citorreducción oncológica radical y quimioterapia de intensificación abdominal es alta (1).
Las complicaciones pueden derivar directamente de la cirugía, de la hipertermia o de la quimioterapia o de la suma de todas ellas.Hay una gran variabilidad en la morbilidad y mortalidad publicada, índices de 0-43% de morbilidad e índices de mortalidad entre 0-20% (6,52,74,78-80). Las principales causas de muerte son la perforación intestinal o dehiscencia de suturas. También se han descrito formación de fístulas intestinales, fugas biliares, pancreatitis o hemorragias postoperatorias. Entre las complicaciones sistémicas, además de las habituales a toda cirugía compleja (trombosis venosa profunda, embolia pulmonar, neumotórax, insuficiencia cardiaca o infartos cerebrales), la aplasia medular o el desarrollo de efectos tóxicos hematológicos es la complicación más temida.
Es difícil separar las complicaciones secundarias a la cirugía de las relacionadas con la HIPEC, tanto por el calor como por los citostáticos, pero la mayoría de las complicaciones descritas parecen principalmente relacionadas con el grado de agresión quirúrgica. La complicación intestinal más frecuente sigue siendo la perforación intestinal causada por el trauma quirúrgico sobre la superficie intestinal durante la resección de los implantes viscerales, posiblemente agravado por la acción del calor y de las drogas citostáticas (6). Sin embargo Shido y cols. han demostrado que la hipertermia por sí sola no es responsable del daño visceral cuando se usa en procedimientos con HIPEC (63).
La contribución al diagnóstico postoperatorio con estudios de imagen (81), diferenciando las complicaciones menores debidas a la respuesta inflamatoria que sufren estos pacientes de las complicaciones mayores que requieren tratamiento, fístulas, abscesos, hemoperitoneos, permitirán en el futuro un mejor conocimiento y solución de estos difíciles pacientes.
La aplasia medular es claramente resultado de la aplicación de quimioterapia intraperitoneal y es dosis- y drogo-dependiente. El nadir de la aplasia medular aparece a las dos semanas en la quimio intraperitoneal frente a las 4-6 semanas de la quimioterapia sistémica (82).
La insuficiencia renal tóxica aparece cuando se utilizan esquemas con cisplatino, por lo que precisa siempre la utilización de quelantes tipo tiosulfato.
La mortalidad y morbilidad está en relación directa con la curva de aprendizaje y la técnica quirúrgica empleada, y la magnitud de la citorreducción realizada. Los cirujanos deberán hacer siempre una adecuada reflexión juiciosa entre el balance del riesgo postoperatorio que esta cirugía extensa conlleva y los beneficios de supervivencia y calidad de vida del paciente.
Los estudios de la calidad de vida de estos pacientes indican que los supervivientes toleran razonablemente bien el tratamiento y que después de 3 meses son capaces de volver a su patrón de vida habitual. Un estudio reciente de pacientes con supervivencia mayor de 3 años después de una citorreducción y quimioterapia intraperitoneal perioperatoria, ha demostrado que el 47% de los pacientes habían vuelto a su trabajo habitual, y que el 82% de los pacientes reconocían que llevaban una actividad entre el 90-100% de su actividad previa habitual, y que ninguno de los pacientes renunciaban del tratamiento recibido. Sin duda estos resultados aportan un rayo de esperanza y optimismo a este grupo de pacientes que hasta ahora solamente tenían opciones limitadas y que sin este tratamiento intensivo, a pesar de la morbilidad que conlleva, su supervivencia hubiera sido imposible (83).
ESTUDIOS PUBLICADOS EN LA LITERATURA MÉDICA
Estudios fase II
Los estudios fase II del tratamiento de carcinomatosis por cáncer colorrectal y pseudomixoma son muy numerosos y prometedores (1,6,77-106).
En la tabla V se presentan las series publicadas, excluido el grupo de Sugarbaker, con más de 10 pacientes con carcinomatosis de origen colorrectal tratados mediante citorreducción y quimioterapia intraperitoneal perioperatoria.
Esta revisión bibliográfica sugiere de forma clara que se puede obtener al menos un beneficio y en ocasiones la curación en pacientes hasta ahora previamente considerados solamente para tratamientos paliativos. La aplicación conjunta de cirugía citorreductora con quimioterapia intraperitoneal es un procedimiento factible de realizarse y seguro. El factor determinante pronóstico en todas estas series ha sido el grado de citorreducción obtenido, dado que el sinergismo de la quimioterapia y la hipertermia depende directamente de volumen de enfermedad residual.

Bien es cierto que estos trabajos todos han sido retrospectivos y no randomizados y por ello sometidos a crítica, pero aun así todo apunta a que con esta nueva alternativa terapéutica se están obteniendo los mejores resultados de supervivencia y en ocasiones curaciones hasta ahora inpensables.
Estudio fase III
Hasta ahora la principal objeción que se planteaba a esta alternativa terapéutica era la falta de estudios prospectivos randomizados, pero a pesar de plantearse estudios ética y científicamente correctos, los pacientes se negaban a ser incluidos o no en el tratamiento por el azar, debiendo abandonar estos estudios en varias ocasiones como ocurrió en todos los planteados en el Instituto Gustave Roussy de París (72).
Recientemente Zoetmulder ha presentado los resultados del primer estudio fase III realizado en carcinomatosis de origen colorrectal mediante el estudio de la aplicación de quimioterapia intraperitoneal versus quimioterapia sistémica (107,109) y ya han sido publicados oficialmente (110).
En este estudio, 105 pacientes entraron a formar parte comparando en el grupo control el tratamiento convencional con 5-FU/leucovorín vía sistémica frente al grupo de estudio en el que además de una cirugía citorreductora se aplicaba tratamiento intraoperatorio intraperitoneal con MMC modulada por hipertermia seguido de quimioterapia sístemica con 5-FU/leucovorín. Como refleja la tabla VI.
Las características generales de los pacientes de ambos grupos fueron similares como refleja la
tabla VII.
En el grupo de estudio el grado de citorreducción oncológica obtenido fue completa (R1), sin enfermedad macroscópica residual, en 18 pacientes (38%). La enfermedad residual fue < 2,5 mm (R2a) en 21 de los pacientes (43%), y no se consiguió una citorreducción adecuada, dejando enfermedad macroscópica > 2,5 mm en 9 pacientes (19%).
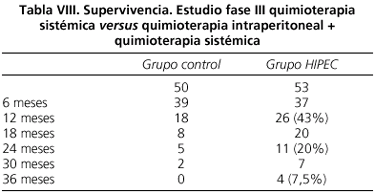
El grado de citorreducción obtenido ha sido el principal factor pronóstico de este estudio y a pesar de conseguir una citorreducción completa tan sólo en menos del 40% de los pacientes, la supervivencia obtenida ha sido superior a cualquier otro tratamiento conocido hasta el momento, como queda reflejado en la tabla VIII.
La mediana de supervivencia de ambos grupos ha sido superior al año. Habiendo sido la mediana de supervivencia en el grupo de citoreducción + quimioterapia intraperitoneal casi el doble de la obtenida en el grupo de tratamiento con quimioterapia sistémica (22,4 meses frente a 12,6 meses), y además a los 2 años el 20% de los pacientes tratados con quimioterapia intraperitoneal estaban vivos.
Estudio multicéntrico internacional
Glehen y cols. (7,8) han presentado en enero de 2004, los resultados del estudio multicéntrico internacional retrospectivo en el que se ha recogido la experiencia mundial sobre esta nueva alternativa de tratamiento en pacientes afectos de carcinomatosis colorrectal excluidos las carcinomatosis de origen apendicular.
Quinientos seis pacientes procedentes de 28 instituciones tratados con cirugía citorreductora y quimioterapia intraperitoneal perioperatoria constituyeron el objeto del estudio. Con un seguimiento medio de 53 meses, la supervivencia media fue de 19,2 meses, con supervivencia al año, tres y cinco años de 72, 39 y 19%, respectivamente. Habiendo 38 pacientes superado los 5 años de supervivencia desde su citorreducción a pesar de tratarse de carcinomatosis difusas peritoneales.
Nuevamente el grado de citoreducción conseguido fue el principal factor determinante pronóstico, tal y como se muestra en la tabla IX.
LÍMITES FUTUROS DE LA CIRUGÍA EN EL CÁNCER AVANZADO DE COLON Y RECTO
Existen sin lugar a dudas razones para continuar con el tratamiento de las carcinomatosis peritoneales de origen colorrectal. Un número en aumento de instituciones y hospitales está adoptando esta estrategia de tratamiento para prevenir y tratar las enfermedades malignas de la superficie peritoneal.
¿Cuándo debe una investigación clínica obtener grado de práctica habitual?, la mayoría de los cirujanos estarían a favor de ensayos fase III para contestar las preguntas que el tratamiento de la carcinomatosis de origen colorrectal plantean, pero tradicionalmente la cirugía no ha progresado en el tratamiento de los tumores gastrointestinales con estudios randomizados, sino que más bien se ha desarrollado mediante un proceso evolutivo; sirva como ejemplo el caso del tratamiento quirúrgico de las metástasis hepáticas, que en ausencia de estudios fase III ha sido validado por muchos grupos y evolucionado con los años, llegando después de muchas discusiones a considerarse un nuevo estándar de práctica médica (1).Durante 30 años ha estado considerándose paliativo el tratamiento de las metástasis hepáticas preconizado por Makuuchi, pero hoy en día nadie duda que el tratamiento quirúrgico radical oncológico de las metástasis es el estándar de tratamiento con el que confrontar cualquier otra alternativa terapéutica. Igualmente se acepta la cirugía de las metástasis pulmonares e incluso en ocasiones la cirugía de las metástasis cerebrales como cirugía con intención curativa.
Confiamos que la revisión tanto de los estudios publicados en fase II, como el estudio fase III de Zoetmulder y cols., o la recopilación multicéntica internacional del estudio de Glehen y cols., permitan que el tratamiento quirúrgico de la diseminación peritoneal en cáncer colorrectal sea admitido también como estándar de tratamiento en estos pacientes, al ofrecer, sin ningún género de dudas, los mejores resultados de supervivencia e incluso que algunos pacientes se encuentren libres de enfermedad más allá de 5 años y por ello potencialmente curados de su enfermedad. En nuestra opinión, nos encontramos tal y como afirma Sugarbaker, en un punto de no retorno dado que esta estrategia de tratamiento es eficaz, y seguro que su validación como estándar de práctica clínica habitual se producirá conforme más estudios fase II sean publicados por más centros e instituciones, o se consiga realizar un estudio fase III multicéntrico.
La presencia de metástasis hepáticas ha supuesto hasta ahora un límite en el tratamiento de enfermos con diseminación peritoneal al considerarla como enfermedad sistémica diseminada vía hematógena portal. Sin embargo Elías (61) ha demostrado que en ocasiones el abordaje simultáneo de la enfermedad peritoneal en el transcurso de cirugías de metástasis hepática ha sido un tratamiento tolerado por sus pacientes y eficiente cuando consigue una citorreducción completa de la enfermedad. Doce de sus pacientes fueron tratados mediante hepatectomía junto con citorreducción completa de la enfermedad peritoneal acompañante y quimioterapia postoperatoria precoz intraperitoneal. No hubo mortalidad en su serie ni complicaciones sistémicas por la quimioterapia y después de un seguimiento medio de 14,4 meses no se ha puesto de manifiesto recurrencia de la enfermedad peritoneal en ninguno de los pacientes y 7 de ellos están libres de enfermedad. La combinación de hepatectomía y cirugía citorreductora en el tratamiento de la enfermedad avanzada del cáncer colorrectal parece ser en el momento actual un tratamiento lógico y realizable consiguiendo unos prometedores resultados de supervivencia. Más recientemente, este grupo de trabajo publicó sus resultados sobre 37 pacientes tratados simultáneamente de recurrencia hepática y enfermedad peritoneal con esta terapia combinada. Hubo un 28% de supervivencia a los 3 años y de 16% a los 5 años, resultados absolutamente impensables hasta ahora (111).
Hoy podemos aseverar que el límite actual del tratamiento de la enfermedad colorrectal es aquel en que estando la enfermedad confinada a la cavidad abdominal (recurrencia locorregional, diseminación linfática retroperitoneal, diseminación peritoneal o metástasis hepáticas), la cirugía asegure una resección radical oncológica de la enfermedad siempre acompañada del tratamiento de la enfermedad microscópica residual mediante la administración simultánea de quimioterapia intraperitoneal perioperatoria.
A la vista de estos espectaculares resultados es de esperar que el excepticismo de la comunidad médica de oncología permita en el futuro que todos los pacientes afectos de carcinomatosis de origen colorrectal sean remitidos a centros con experiencia en esta alternativa terapéutica combinada intraperitoneal, permitiendo la cronificación de su enfermedad y en algunos casos su curación. Igualmente sería deseable que las administraciones sanitarias, faciliten y potencien un programa específico para este tratamiento, con grupos o centros de referencia nacional encargados de su atención y desarrollo.
BIBLIOGRAFÍA
1. Pestieau SR, Sugarbaker PH. Treatment of primary colon cancer with peritoneal carcinomatosis. Comparison of concomitant vs. delayed management. Dis Colon Rectum 2000; 43 (10): 1341-8. [ Links ]
2. Gómez Portilla A. Tratamiento quirúrgico de la carcinomatosis peritoneal de origen colorrectal. Cir Esp 2004; 75 (3): 156. [ Links ]
3. Bottomley A. Metastatic colorectal cancer: treatment challenges and quality of life. Lancet 2002; 359 (4): 1537-8. [ Links ]
4. Ortiz Hurtado H. Tratamiento quirúrgico y resultados del cáncer de colon. Presentación. Cir Esp 2003; 73: (1): 1. [ Links ]
5. Kindler HL, Shulman Kl. Metastatic colorectal cancer. Current Treatment Options in Oncology 2001; 2: 459-71. [ Links ]
6. De Bree E, Witkamp A, Zoetmulder FAN. Intraperitoneal chemotherapy for colorectal cancer. Review article. J Surg Oncol 2002; 79: 46-61. [ Links ]
7. Glehen O, Kwiatkoski M, Sugarbaker PH, Elis D, Levine EA, Gilly FN, et al. Cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for the management of peritoneal carcinomatosis from colorectal cancer. A multi-institutional study of 506 patients. ASCO, 2004; January: 22-4. [ Links ]
8. Glehen O, Kwiatkoski M, Sugarbaker PH, Elias D, Levine EA, Gilly FN, et al. Cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for the management of peritoneal carcinomatosis from colorectal cancer. A multi-institutional study of 506 patients. J Clin Oncol 2004; 22 (3): 284-329. [ Links ]
9. Sticca RP. Peritoneal carcinomatosis: a final frontier. Ann Surg Oncol 2003; 10 (5): 484-5. [ Links ]
10. Gunderson LL, Sosin H, Levitt S. Extrapelvic colon areas of failure in a reoperation series: implications for adjuvant therapy. Int J Radiat Oncol Biol Phys 1985; 11: 731-41. [ Links ]
11. Brodsky JT, Cohen AM. Peritoneal seeding following curative resection of colonic carcinoma: implication for adjuvant therapy. Dis Col Rectum 1991; 34: 723-7. [ Links ]
12. Alonso O, Sugarbaker PH. Adult respiratory distress syndrome occurring in two patients undergoing cytoreductive surgery plus perioperative intraperitoneal chemotherapy. Case reports and a review of the literature. Am Surg 2000; 66: 1032-6. [ Links ]
13. Sampson JA. Implantation peritoneal carcinomatosis of ovarian origin. Am J Pathol 1931; 7: 423-43. [ Links ]
14. Chu DZJ, Lang NP, Thompson C, Osteen PK, Westbrook KC. Peritoneal carcinomatosis in non-gynecological malignancy: a prospective study of prognostic factors. Cancer 1989; 63: 364-7. [ Links ]
15. Sadeghi B, Arvieux C, Glehen O, Beaujard AC, Rivpoire M, Baulieux J, et al. Peritoneal carcinomatosis from non-gynecological malignancies: results of the EVOCAPE 1 multicentric prospective study. Cancer 2000; 88: 358-63. [ Links ]
16. Esquivel J, Angulo F, Bland RK, Stephens AD, Sugarbaker PA. Hemodynamic and cardiac function parameters during heated intraoperative intraperitoneal chemotherapy using the open "coliseum technique". Ann Surg Oncol 2000; 7 (4): 296-300. [ Links ]
17. Scoggins CR, Meszoley IM, Blanke CD, Beauchamp RD, Leach SD. Nonoperative management of primary colorectal cancer in patients wit stage IV disease. Ann Surg Oncol 1999; 6 (7): 651-7. [ Links ]
18. Blair SL, Chu DZJ, Schwartz RE. Outcome of palliative operations for malignant bowel obstruction in patients with peritoneal carcinomatosis from non-gynecological cancer. Ann Surg Oncol 2001; 8 (8): 632-7. [ Links ]
19. Pilati P, Rossi CR, Mocellin S, Foletto M, Scagnet B, Pasetto L, et al. Multimodal treatment of peritoneal carcinomatosis and sarcomatosis. Eur J Surg Oncol 2001; 27: 125-34. [ Links ]
20. Sugarbaker PH. Successful management of microscopic residual disease in large bowel cancer. Cancer Chemother Pharmacol 1999; 43 (Supl.): S15-S25. [ Links ]
21. Jayne DG, Fook S, Loi C, Seow-Choen F. Pritoneal carcinomatosis from colorectal cancer. Br J Surg 2002; 89: 1545-50. [ Links ]
22. Witkamp AJ, De Bree E, Van Goethem AR, Zoetmulder FAN. Antitumor treatment. Rationale and techniques of intra-operative hyperthermic intraperitoneal chemotherapy. Cancer Treatment Reviws 2001; 27: 365-174. [ Links ]
23. Willet CG, Tepper JE, Cohen AM, Orlow E, Welch CE. Failure patterns following curative resection of colonic carcinoma. Surgery 1984; 200 (6): 685-90. [ Links ]
24. Massacesi C, Pistilli B, Valeri M, Lippe P, Rocchi MBL, Cellerino R, et al. Predictors of short- term survival and progression to chemotherapy in patients with advanced colorectal cancer treated with 5-fluorouracil based regimens. Am J Clin Oncol 2002; 25 (2): 140-8. [ Links ]
25. Anonymous: Modulation of fluorouracil by leucovorin in patients with advanced colorectal cancer: evidence in terms of response rate. Advanced colorectal cancer meta-analysis project. J Clin Oncol 1992; 10: 896-903. [ Links ]
26. Anonymous: Efficacy of intravenous continuous infusion of 5-fluorouracil comapared with bolus administration in advanced colorectal cancer: Meta-analysis group in cancer. J Clin Oncol 1998; 16: 301-8. [ Links ]
27. Levy-Piedbois C, Durand-Zaleski I, Juhel H, Schmitt C, Bellanger A, Piedbois P. Cost-effectiveness of second-line treatment with irinotecan or infusional 5-fluorouracil in metastatic colorectal cancer. Ann Oncology 2000; 11 (2): 157-61. [ Links ]
28. Calvo E, Cortés J, González-Cao M, Rodríguez J, Aramendia JM, Fernández-Hidalgo O, et al. Combined irinotecan, oxaliplatin and 5- flourouracil in patients with advanced colorectal caner. A feasibility pilot study. Oncology 2002; 63: 254-65. [ Links ]
29. Anonymous: oxaliplatin and protracted venous infusion of 5-fluorouracil in patients with advanced or relapsed 5- flourouracil pretreated colorectal cancer. B J Cancer 2001; 85: 1258-64. [ Links ]
30. De Gramont A, Figer A, Seymour M, Homerin M, Hmissi A, Cassidy J, et al. Leucovorin and fluorouracil with or without oxaliplatin as first line treatment in advanced colorectal cancer. J Clin Oncol 2000; 18: 2938-47. [ Links ]
31. Borner MM, Dietrich D, Stupp R, Morant R, Honegger H, Wernli M, et al. Phase II study of capecitabine and oxaliplatin in first and second line treatment of advanced or metastatic colorectal cancer. J Clin Oncol 2002; 7: 1759-66. [ Links ]
32. Bliberg H, Hendlisz A. Advanced colorectal cancer treatment in Europe: what have we achieved? Review Paper. Anti-Cancer Drugs 2002; 13: 461-71. [ Links ]
33. Meropol NJ, Niedzwiecki D, Hollis D, Schilsky RL, Mayer RJ. Phase II study of oral eniluracil, 5-fluorouracil, and leucovorin in patients with advanced colorectal carcinoma. Cancer 2001; 91 (7): 1256-63. [ Links ]
34. Van Custem E, Twelves Ch, Cassidy J, Allman D, Bajetta E, Boyer M, et al. Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer. Xeloda Colorectal Cancer Study Group. Results of a large phase III study. J Clin Oncol 2001; 19: 4097-106. [ Links ]
35. De Gramont A, Bosset JF, Milan C, Rougier P, Bouche O, Etienne PL, et al. Randomized trial comparing monthly low-dose leucovorin and fluorouracil bolus with bimonthly high-dose leucovorin and fluorouracil bolus plus continuous infusion for advanced colorectal cancer. A French Intergroup study. J Clin Oncol 1997; 15: 808-15. [ Links ]
36. Lokich JJ, Ahlgren JD, Gullo JJ, Philips JA, Fryer JG. Aprospective randomized comparasion of continuous infusion fluorouracil with conventional bolus schedule in metastatic colorectal carcinoma. A Mid-Atlantic Oncology Program Study. J Clin Oncol 1989; 7: 425-32. [ Links ]
37. Anonymus: Efficacy of intravenous continuous infusion of 5-fluorouracil compared with bolus administration in advanced colorectal cancer. Meta-analysis group in cancer. J Clin Oncol 1998; 16: 301-8. [ Links ]
38. Saltz LB, Cox JV, Blanke C, Rosen LS, Fehrenbacher L, Moore MJ, et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group. N Engl J Med 2000; 343: 905-14. [ Links ]
39. Douillard JY, Cunningham D, Roth AD, Navarro M, Karasek P, Jandik P, et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line tretament for metastatic colorectal cancer. A multicenter randomised trial. Lancet 2000; 355: 1041-7. [ Links ]
40. Tsavaris N, Kosmas Ch, Vadiaka M, Koufos Ch. Raltitrexed (Tomudex) administration in patients with relapsed metastatic colorectal cancer after weekly irinotecan/5-fluorouracil/leucovorin chemotherapy. BMC Cancer 2002; 2 (1): 2-15. [ Links ]
41. Grávalos Castro C, Pérez Escutia MA. Tratamiento adyuvante del cáncer colorrectal. Cir Esp 2003; 73 (1): 38-45. [ Links ]
42. Maughan TS, James RD, Kerr DJ, Ledermann JA, McArdle C, Seymour MT, et al. Comparison of survival, palliation, and quality of life with three chemotherapy regimen in metastatic colorectal cancer: a multicentre randomised trial. Lancet 2002; 359: 1555-63. [ Links ]
43. Yonemura Y, Fujimura T, Fushida S, Takegawa S, Kamata T, Katayama K, et al. Hypoerthermo-chemotherapy combined with cytoreductive surgery for the treatment of gastric cancer with peritoneal dissemination. World J Surg 1991; 15 (4): 530-6. [ Links ]
44. Gertsch P. A historical perspective on colorectal liver metastases and peritoneal carcinomatosis: similar results, different treatments. Surg Oncol Clin N Am 2003; 12: 531-41. [ Links ]
45. Sugarbaker PH. Management of peritoneal-surface malignancy: the surgeon's role. Langenbeck's Arch Surg 1999; 384: 576-87. [ Links ]
46. Sugarbaker PH. Peritonectomy procedures. Ann Surg 1995; 221: 29-42. [ Links ]
47. Sugarbaker PH. Peritonectomy procedures. Surg Oncol Clin N Am 2003; 12: 703-27. [ Links ]
48. Yonemura Y. Principles of the treatment of peritoneal dissemination. In: Yonemura Y, eds. Peritoneal dissemination-molecular mechanisms and the latest therapy. Kanazawa: Maeda Shoten Co, Ltd; 1998. Chapter 11, p. 175-90. [ Links ]
49. Sugarbaker PH. It's what the surgeon doesn't see that kills the patient. Nippon Med Sch 2000; 67 (1): 5-8. [ Links ]
50. Dubé P, Lasser Ph, Elias D. Traitement de la carcinose peritoneale dórigine colorectal. J Chir (Paris) 1997; 134 (5-6): 233-6. [ Links ]
51. Elias DM, Pocard M. Treatment and prevention of peritoneal carcinomatosis from colorectal cancer. Surg Oncol Clin N Am 2003; 12: 543-59. [ Links ]
52. Gilly FN. Rationale for peritonectomy and perioperative intraperitoneal chemotherapy. Peritoneal Surface Malignancy. Third Biannual Masterclass in Peritoneal Surface malignancy. Basingstoke, Dic 2002. [ Links ]
53. Weissberger AS, Levine B, Storaasli JP. Use of nitrogen mustard in treatment of serous effusions of neoplastic origin. JAMA 1955; 159: 1704-7. [ Links ]
54. Dedrick RL, Myers CE, Bungay PM, DeVita VT Jr. Pharmacokinetic rationale drug administration in the treatment of ovarian cancer. Cancer Tret Rep 1978; 62: 1-9. [ Links ]
55. Katz MH, Barone RM. The rationale of perioperative intraperitoneal chemotherapy in the treatment of peritoneal surface malignancies. Surg Oncol Clin N Am 2003; 12: 673-88. [ Links ]
56. Shen P, Levine EA, Hall J, Case D, Russell G, Fleming R, et al. Factors predicting survival after intraperitoneal hyperthermic chemotherapy with mitomycin C after cytoreductive surgery for patients with peritoneal carcinomatosis. Arc Surg 2003; 138: 26-33. [ Links ]
57. Sugarbaker PH, Gianola FJ, Speyer JL, Wesley R, Barofsky I, Myers CE. Prospective, randomized trial of intravenous versus intraperitoneal 5- fluorouracil in patients with advanced primary colon or rectal cancer. Surgery 1985; 98: 414-21. [ Links ]
58. Gilly FN, Sayag AC, Carry PY, Brillon G, Roche M, James I, et al. Chimio- hyperthermie intra-peritoneale (CHIP) dans le traitament des carcinoses peritoneales dórigine digestive. Rapport d'une observation et données physiopathologiques. J Chir (París) 1990; 127 (2): 95-8. [ Links ]
59. Fujimoto S, Shrestha RD, Kokubun M, Ohta M, Takahashi M, Kobayashi K, et al. Intraperitoneal hyperthermic perfusion combined with surgery effective for gastric cancer patients with peritoneal seeding. Ann Surg 1988; 208: 36-41. [ Links ]
60. Koga S, Hamazoe R, Maeta M, Shimizu N, Murakami A, Wakatsuki T. Prophylactic therapy for peritoneal recurrence of gastric cancer by continuous hyperthermic peritoneal perfusion either mitomycine C. Cancer 1988; 61: 232-7. [ Links ]
61. Elias D, Dube P, Bonvalot S, Meshaka P, Manai M, Cavalcanti A, et al. Treatment of liver metastases with moderate peritoneal carcinomatosis by hepatectomy and cytoreductive surgery follow-ed by immediate postoperative intraperitoneal chemotherapy: feasibility and preliminary results. Hepatogastroenterol 1999; 46: 360-3. [ Links ]
62. Sticca RP, Dach BW. Rationale for hyperthermia with intraoperative intraperitoneal chemotherapy agents. Surg Oncol Clin N Am 2003; 12: 689-801. [ Links ]
63. Shido A, Ohmura S, Yamamoto K, Konayashi T, Fujimura T, Yonemura Y. Does hyperthermia induce peritoneal damage in continuous hyperthermic peritoneal perfusion? World J Surg 2000; 24 (5): 507-11. [ Links ]
64. Spratt JS, Adcock RA, Sherill W, Travathen S. Hyperthermic peritoneal perfusion system in canines. Cancer Res 1980; 40: 253-5. [ Links ]
65. Spratt JS, Adcock RA, Muskovin M, Sherrill W, McKeown J. Clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Res 1980; 40: 2563-5. [ Links ]
66. Stuart OA, Stephens AD, Welch L, Sugarbaker PH. Safety monitoring of the coliseum technique for heated intraoperative intraperitoneal chemotherapy with mitomycin C. Ann Surg Oncol 2002; 9 (2): 186-91. [ Links ]
67. Fujimoto S, Shrestha RD, Kokubun M, Kobayashi K, Kiuchi S, Ohta M, et al. Pharmacokinetic analysis of mitomycin C for intraperitoneal hyperthermic perfusion in patients with far-advanced or recurrent gastric cancer. Reg Cancer Treat 1989; 2: 198-202. Gan To Kagaku Ryoho. 1989;16 (7): 2411-5. Japanese. [ Links ]
68. Panteix G, Guillaumont M, Cherpin L, Cuichard J, Gilly FN, Carry PY, et al. Study of the pharmacokinetics of mitomycin C in humans during intraperitoneal chemothermia with special mention of the concentration in local tissues. Oncology 1993; 50: 366-70. [ Links ]
69. Jacquet P, Averbach A, Stephens AD, Stuart OA, Chang D, Sugarbaker PH. Heated intraoperative intraperitoneal mitomycin C and early postoperative intraperitoneal 5- fluorouracil: pharmacokinetic studies. Oncology 1998; 55 (2): 130-8. [ Links ]
70. Elias D, El Otmany A, Bonnay M, Pci A, Ducreux M, Antoun S, et al. Human pharmacokinetic study of heated intraperitoneal oxaliplatin in increasingly hypotonic solutions after complete resection of peritoneal carcinomatosis. Oncology 2002; 63: 346-52. [ Links ]
71. Elias DM, Sideris L. Pharmacokinetics of heated intraoperative intraperitoneal oxaliplatin after complete resection of peritoneal carcinomatosis. Surg Oncol Clin N Am 2003; 12: 755-69. [ Links ]
72. Elias DM, Pocard M. Treatment and prevention of peritoneal carcinomatosis from colorectal cancer. Surg Oncol Clin N Am 2003; 12: 543-59. [ Links ]
73. Wientjes MG, Badalament RA, Wang RC, Hassan F, Au JL. Penetration of mitomycin C in human bladder. Cancer Res 1993; 53: 3314-31. [ Links ]
74. Glehen O, Gilly FN. Quantitative prognostic indicators of peritoneal surface malignancy: carcinomatosis, sarcomatosis, and peritoneal mesothelioma. Surg Oncol Clin N Am 2003; 12: 649-71. [ Links ]
75. Gómez Portilla A, Sugarbaker PH. Segunda cirugía (second look) después de citorreducción y quimioterapia intraperitoneal en la carcinomatosis por cáncer colorrectal: análisis de factores pronósticos. Cir Esp 1997; 61: 240-5. [ Links ]
76. Gómez Portilla A, Deraco M, Sugarbker PH. Clinical pathway for peritoneal carcinomatosis from colon and rectal cancer: guidelines for current practice. Tumori 1997; 83 (Supl.): 725-8. [ Links ]
77. Gómez Portilla A, Sugarbaker PH, Chang D. Second-look surgery after cytoreduction and intraperitoneal chemotherapy for peritoneal carcinomatosis from colorectal cancer: analysis of prognosis features. World J Surg 1999; 23: 23-9. [ Links ]
78. Jacquet P, Stephens AD, Averbach AM, Chang D, Ettinghausen SE, Dalton RR, et al. Analysis of morbidity and mortality in 60 patients with peritoneal carcinomatosis treated by cytoreductive surgery and heated intraoperative intraperitoneal chemotherapy. Cancer 1996; 77: 2622-9. [ Links ]
79. Esquivel J, Vidal-Jove J, Steves MA, Sugarbaker PH. Morbidity and mortality of cytoreductive surgery and intraperitoneal chemotherapy. Surgery 1993; 113: 631-6. [ Links ]
80. Stephens AD, Alderman R, Chang D, Edwards GD, Esquivel J, Sebbag G, et al. Morbidity and mortality analysis of 200 treatments with cytoreductive surgery and hyperthermic heated intraoperative intraperitoneal chemotherapy using the coliseum technique. Ann Surg Oncol 1999; 6: 790-6. [ Links ]
81. Dromain C, Bisdorff A, Elias D, Antoun S, Boige V, Lasser P, et al. Computed tomographic features of peritoneal carcinomatosis treated by intraperitoneal chemohyperthermia. J Comput Assist Tomogr 2003; 27 (3): 327-32. [ Links ]
82. Loggie BW, Fleming RA. Complications of heated intraperitoneal chemotherapy and strategies for prevention. Cancer Treat Res 1996; 82: 221-33. [ Links ]
83. McQuellon RP, Loggie BW, Lehman AB, Russell GM, Fleming RA, Shen P, et al. Long-term survivorship and quality of life after cytoreductive surgery plus intraperitoneal hyperthermic chemotherapy for peritoneal carcinomatosis. Ann Surg Oncol 2003; 10 (2): 155-62. [ Links ]
84. Horsell KW, Merten S, Clingan P, King DW, Morris DL. Peritonectomy and intraperitoneal chemotherapy in appendiceal and colorectal cancer. Aust N Z J Surg 1999; 69 (10): 729-32. [ Links ]
85. Witkamp AJ, de Bree E, Kaag MM, Van Slooten GW, Van Coervorden F, Zoetmulder FAN. Extensive surgical cytoreduction and intra-operative hyperthermic intraperitoneal chemotherapy in patients with pseudomyxoma peritonei. Br J Surg 2001; 88: 458-63. [ Links ]
86. Witkamp AJ, de Bree E, Kaag MM, Boot H, Beijnen JH, van Slooten GW, et al. Extensive cytoreductive surgery followed by intra-operative hyperthermic intraperitoneal chemotherapy with mitomycin-C in patients with peritoneal carcinomatosis from colorectal origin. Eur J Cancer 2001; 37: 979-84. [ Links ]
87. Yamaguchi A, Tsukoika Y, Fushida S, Kurosaka Y, Kanno M, Yonemura Y, et al. Intraperitoneal hyperthermic treatment for peritoneal dissemination of colorectal cancers. Dis Colon Rectum 1992; 35 (10): 964-8. [ Links ]
88. Schneebaum S, Arnold MW, Staubus A, Young DC, Dumond D, Martin EW Jr. Intraperitoneal hyperthermic perfusion with mitomycin C for colorectal cancer with peritoneal metastases. Ann Surg Oncol 1996; 3: 44-50. [ Links ]
89. Sugarbaker PH, Chang D. Results of treatment of 385 patients with peritoneal surface spread of appendiceal malignancy. Ann Surg Oncol 1996; 6 (8) : 727-31. [ Links ]
90. Cavaliere F, Perri P, Di Filippo F, Giannarelli D, Botti C, Cosimelli M, et al. Treatment of peritoneal carcinomatosis with intent of cure. J Surg Oncol 2000; 74: 41-4. [ Links ]
91. Elias D, Dubé P, Blot F, Bonvallot S, Eggenspieler P, Sabourin JC, et al. Peritoneal carcinomatosis treatment with curative intent: the Institute Gustave-Roussy experience. Eur J Surg Oncol 1997; 23: 317-21. [ Links ]
92. Elias D, Gachot B, Bonvallot S, Blot F, Sabourin JC, Ducreux M, et al. Carcinoses peritoneales traitees par exerese complete et chimiotherapie intra-peritoneale postoperatoire immediate (CIPPI). Etude de phase II portant sur 54 malades. Gastroenterol Clin Biol 1997; 21: 181-7. [ Links ]
93. Elias D, Antoun S, Raynard B, Puizillout JM, Sabourin JC, Ducreux M, et al. Traitement des carcinoses peritonelaes par exerese complete et chimiohyperthermie intraperitoneale. Etude de phase I-II permettant de definir la meilleure procedure technique. Chirurgie 1999; 124: 380-9. [ Links ]
94. Elias D, Blot F, El Otmany A, Antoun S, Lasser P, Boige V, et al. Curative treatment of peritoneal carcinomatosis arising from colorectal cancer by complete resection and intraperitoneal chemotherapy. Cancer 2001; 92: 71-6. [ Links ]
95. Loggie BW, Fleming RA, McQuellon RP, Russell GB, Geisinger KR. Cytoreductive surgery with intraperitoneal hyperthermic chemotherapy for disseminated peritoneal cancer of gastrointestinal origin. Am Surgeon 2000; 66: 561-8. [ Links ]
96. Fujimura T, Yonemura Y, Fujita H, Michiwa Y, Kawamura T, Nojima N, et al. Chemohyperthermic peritoneal perfusion for peritoneal dissemination in various intra-abdominal malignancies. Int Surg 1999; 84 (1): 60-6. [ Links ]
97. Beaujard AC, Glehen O, Caillot JL, Francois Y, Bienvenu J, Pantiex G, et al. Intraperitoneal chemohyperthermia with mitomycin C for digestive tract caner patients with peritoneal carcinomatosis. Cancer 2000; 88 (11): 2512-9. [ Links ]
98. Piso P, Bektas H, Werner U, Schlitt HJ, Kubicka S, Bornscheuer A, et al. Improved prognosis following peritonectomy procedures and hyperthermic intraperitoneal chemotherapy for peritoneal carcinomatosis from appendiceal carcinoma. Eur J Surg Oncol 2001; 27: 286-90. [ Links ]
99. Rey Y, Porcheron J, Talabard JN, Szanfnicki K, Balique JG. Carcinoses peritoneales traitees par chirurgie de reduction tumorale et chimiohyperthermie intraperitoneale. Ann Chir 2000; 125: 631-42. [ Links ]
100. Porcheron J, Talabard JN, Breton C, Szafnicki K, Luxembourger O, Dufraisse G, et al. Intraperitoneal chemohyperthermia for peritoneal carcinomatosis: original modelling, clinical tolerance and results study about 30 patients. Hepatogastroenterology 2000; 47: 1411-8. [ Links ]
101. Vaira M, Scuderi S, Castamagna D, Barone R, Aemo B, Mioli PR, et al. Cytoreductive surgery and intraperitoneal hyperthermic-antiblastic therapy (HAPP) in peritoneal carcinomatosis. Minerva Chir 2002; 57 (5): 579-605. [ Links ]
102. Shen P, Levine EA, Hall J, Case D, Russell G, Fleming RA, et al. Factors predicting survival after intraperitoneal hyperthermic chemotherapy with mitomycin C after cytoreductive surgery for patients with peritoneal carcinomatosis. Arch Surg 2003; 138: 26-33. [ Links ]
103. Pilati P, Mocellini S, Rossi CR, Foletto M, Campana L, Nitti D, et al. Cytoreductive surgery combined with hyperthermic intraperitoneal intraoperative chemotherapy for peritoneal carcinomatosis arising from colon adenocarcinoma. Ann Surg Oncol 2003; 10 (5): 508-13. [ Links ]
104. Glehen O, Mithieux F, Osinsky D, Beaujard AC, Freyer G, Guertsch Ph, et al. Surgery combined with peritonectomy procedures and intraperitoneal chemohyperthermia in abdominal cancers with peritoneal carcinomatosis: a phase II study. J Clin Oncol 2003; 21 (5): 799-806. [ Links ]
105. Sugarbaker Ph, Jablonski KA. Prognostic features of 51 colorectal and 130 appendicel cancer patients with peritoneal carcinomatosis treated by cytoreductive surgery and intraperitoneal chemotherapy. Ann Surg 1995; 221: 124-32. [ Links ]
106. Sugarbaker PH, Schellinx MET, Chang D, Koslowe P, Von Meyerfeldt M. Peritoneal carcinomatosis from adenocarcinoma of the colon. World J Surg 1996; 20: 585-92. [ Links ]
107. Zoetmulder FAN, Verwaal V. Hyperthermic intraperitoneal chemotherapy (HIPEC) with mitomycin C significantly improves survival in patients with peritoneal carcinomatosis of colorectal origin (abstract) ASCO Prog Proc 2002; 21: 147a. [ Links ]
108. Zoetmulder FAN. Prevention and treatment of carcinomatosis from colon cancer. Peritoneal Surface Malignancy. Third Biannual Masterclass in Peritoneal Surface Malignancy. Basingstoke Dic 2002. [ Links ]
109. Zoetmulder FAN. Hyperthermic intrapoeritoneal chemotherapy in peritoneal carcinomatosis. XXXVIII Congress of the European Society for Surgical Research, Ghent, Belgium May. 2003. [ Links ]
110. Verwaal VJ, Van Ruth S, De Bree E, Van Slooten GW, Van Tinteren H, Boot H, et al. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J Clin Oncol 2003; 21: 3737-43. [ Links ]
111. Elias D, Ouellet JF, Bellon N, Pignon JP, Pocard M, Lasser P. Extrahepatic disease does not contraindicate hepatectomy for colorectal liver metastases. Br J Surg 2003; 90 (5): 567-74. [ Links ]











 texto em
texto em