Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Española de Enfermedades Digestivas
versão impressa ISSN 1130-0108
Rev. esp. enferm. dig. vol.98 no.6 Madrid Jun. 2006
CARTAS AL DIRECTOR
Pólipo fibroide inflamatorio gástrico
Inflammatory fibroid polyp of the stomach
Palabras clave: Pólipo. Fibroide. Inflamatorio. Estómago.
Key words: Polyp. Fibroid. Inflammatory. Stomach.
Sr. Director:
El pólipo fibroide inflamatorio (PFI) o tumor de Vanek es un tumor mesenquimatoso benigno de origen submucoso no encapsulado cuya localización habitual suele ser el estómago, aunque también se ha descrito en la unión esófago-gástrica, y con menos frecuencia en duodeno, yeyuno e íleon (1,2). Representa el tumor gástrico benigno menos frecuente (1-4%), por detrás, en orden decreciente, del pólipo hiperplásico, el pólipo de glándulas fúndicas, el adenoma gástrico, el tumor carcinoide y el pólipo hamartomatoso (2,3), con los que debe plantearse su diagnóstico diferencial. Su tamaño suele oscilar entre los 0,4 y 5,0 centímetros de diámetro (1). La malignización es excepcional.
Nuestra paciente es una mujer de 55 años de edad con múltiples antecedentes familiares de neoplasias, así como haber sido intervenida de un cáncer ginecológico. Consulta por un cuadro de malestar epigástrico de un año de evolución, vómitos postprandiales de contenido alimenticio y pérdida de peso. En la anamnesis refiere melenas esporádicas por las que no ha consultado, y anemia. Se le practica gastroscopia que informa de gran pólipo antral con características dudosas entre epitelial o submucoso, realizándose biopsia. La ecografía abdominal es informada como tumoración hipoecogénica de antro gástrico, bien delimitada y de bordes lisos, de 4 centímetros, que impresiona como de origen mucoso e independiente de la capa muscular. En la ecoendoscopia se observa una masa hipoecogénica homogénea de origen submucoso. Se practica estudio gastroduodenal baritado en la que se aprecia una pequeña hernia axial por deslizamiento con reflujo gastroesofágico y un estómago con varios defectos de repleción que parecen proceder de un implante en la curvatura menor (pedículo de una masa polilobulada o mamelonada), por lo que debe descartarse adenocarcinoma. La TAC de abdomen identifica una masa antral redondeada de bordes bien delimitados, con características de benignidad y estudio de extensión anodino. La biopsia preoperatoria confirma diagnóstico de pólipo fibroide ulcerado, que coincide con el estudio anatomopatológico intraoperatorio y postoperatorio. Se practica exéresis de gran pólipo antral de 5-6 centímetros de diámetro por gastrotomía longitudinal. La paciente es dada de alta hospitalaria en 6 días sin complicaciones.
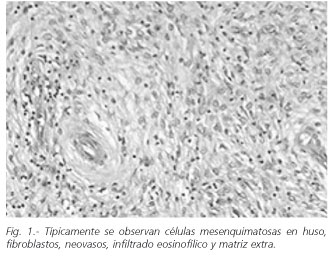
El PFI suele presentarse como un tumor submucoso que protruye hacia la luz gástrica, generalmente en antro (4), o intestinal, con un pedículo más o menos ancho, y que puede presentar fenómenos ulcerativos. Microscópicamente se observan células mesenquimatosas fusiformes, proliferación de fibroblastos y neovasos, un mayor o menor infiltrado inflamatorio rico en eosinófilos, y matriz extracelular (5) (Fig. 1).
Su histogénesis no es bien conocida. Se la ha relacionado con la de los tumores estromales gastrointestinales (GIST) en función de su reactividad frente a diversos marcadores inmunohistoquímicos; esto es, positividad para CD34 y ausencia de reactividad ante c-kit (1,5,6). Las células mesenquimales suelen ser reactivas de manera difusa para anticuerpos CD34 prácticamente en el 100% de los casos, sobre todo cuando el tumor presenta una proliferación estromal concéntrica, es decir, la mayoría, lo cual nos sugiere un origen histológico a partir de un subgrupo de células dendríticas intersticiales localizadas en la muscularis mucosae diferentes a las células de Cajal; un origen a partir de estas supondría inmunorrectividad para bcl-2, la cual no se presenta en este tipo de tumores (6). En cuanto a otros marcadores inmunohistoquímicos, el PFI suele presentar positividad para fascina (marcador de células dendríticas), ciclina D1 (marcador de defecto de regulación del ciclo celular), calponina y vimentina (5). Se ha sugerido que Helicobacter pylori (HP) puede desempeñar un papel en la fisiopatología del PFI debido a los cambios morfológicos como a la reversión de ulceraciones que sufre el tumor al ser tratado el paciente HP positivo con tratamiento erradicador (4). Generalmente, el PFI gástrico suele cursar de manera asintomática en la mayoría de los casos. El debut clínico suele ser en forma de dispepsia o dolor abdominal inespecífico, y a veces náuseas. Cuando se ulcera puede causar hemorragia digestiva alta, y en función de su posible rápido crecimiento puede causar síntomas obstructivos por efecto valvular sobre el píloro. Las exploraciones más fidedignas para llegar a su diagnóstico preoperatorio son la gastroscopia-biopsia y la ecoendoscopia, aunque el diagnóstico definitivo difícilmente se produce preoperatoriamente. La primera de ellas suele poner de manifiesto una tumoración submucosa de moderado tamaño, a veces ulcerada, que protruye a la luz gástrica. La segunda muestra al PFI gástrico como una masa homogénea hipoecoica con márgenes mal definidos. El tratamiento de elección es la polipectomía endoscópica, aunque en función de su tamaño puede realizarse a través de una gastrotomía abierta o laparoscópica.
J. A. Guerra Bautista, F. Ibáñez Delgado J. M. Hernández de la Torre Bustillo y F. Alcántara Gijón
Unidad de Esófago y del Tracto Digestivo Superior.
Servicio de Cirugía General y del Aparato Digestivo.
Hospitales Universitarios Virgen del Rocío. Sevilla
Bibliografía
1. Daum O, Hes O, Vanecek T. Vanek's tumor (inflammatory fibroid polyp). Report of 18 cases and comparison with three cases of original Vanek's series. Ann Diagn Pathol 2003; 7 (6): 337-47.
2. Borch K, Skarsgard J, Franzen L. Benign gastric polyps. Morphological and functional origin. Digest Dis Scien 2003; 48 (7): 1292-7.
3. Muehldorfer SM, Stolte M, Martus P. Diagnostic accuracy of forceps biopsy versus polypectomy for gastric polyps: a prospective multicentrestudy. Gut 2002; 50 (4): 465-70.
4. Nishiyama Y, Koyama S, Andoh A. Gastric inflammatory fibroid polyp treated with Helicobacter pylori eradication therapy. Intern Med 2003; 42 (3): 263-7.
5. Pantanowitz L, Antonioli DA, Pinkus GS. Inflammatory fibroid polyps of the gastrointestinal tract: evidence for a dendritic cell origin. Am J Surg Pathol 2004; 28 (1): 107-14.
6. Kim MK, Higgins J, Cho EY. Expression of CD34, bcl-2, and kit in inflammatory fibroid polyps of the gastrointestinal tract. Appl. Inmunohistochem. Mol Morphol 2000; 8 (2): 147-53.