Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.98 no.10 Madrid oct. 2006
TRABAJOS ORIGINALES
Primera serie nacional de trasplante de intestino en receptores adultos
First Spanish series of intestinal transplantation in adult recipients
J. C. Meneu Díaz, E. Moreno González, J. I.
García García, A. Moreno,
J. C. Montejo1, F. Colina2, B. Pérez, S. Rodríguez3,
M. Abradelos de Usera,
C. Garfia3, Y. Fundora, S. Jiménez Galanes, C. Lumbreras4,
M. León5, F. Pérez Cerdá6 and J. A. Solís-Herruzo3
Servicios de Cirugía General, Aparato Digestivo y Trasplante de Órganos Abdominales,
1Medicina Intensiva,
2Anatomía Patológica,
3Medicina del Aparato Digestivo,
4Unidad de Enfermedades Infecciosas,
5Endocrinología y Nutrición,
6Anestesia y Reanimación. Hospital Universitario 12 de Octubre. Madrid
Dirección para correspondencia
RESUMEN
Introducción: el trasplante de intestino, con la mejoría en los resultados desde finales de los años 90 y desde su cobertura por el Medicare, ha experimentado un crecimiento sustancial a nivel internacional. En la actualidad, según el Registro Internacional (1985-2005), se han realizado un total de 1.292 trasplantes de intestino en 1.210 pacientes en 65 hospitales distribuidos por 20 países.
Objetivo: conocer los resultados a corto plazo (6 meses) en términos de supervivencia del paciente y del injerto de la primera serie nacional de trasplante de intestino en receptores adultos.
Material y métodos: presentamos nuestra experiencia en la evaluación de 20 potenciales candidatos a trasplante intestinal entre junio de 2004 y octubre de 2005. De ellos, fueron desestimados un total 10 pacientes y fueron trasplantados 4, lo que constituye la muestra de nuestro estudio.
Resultados: hasta la fecha se han realizado 5 trasplantes en 4 pacientes (2 retrasplantes, 2 tumores desmoides, y 1 síndrome de intestino corto tras exéresis por isquemia mesentérica). Al final del estudio y tras un seguimiento medio de 180 días (rango, 90-190 días), todos los receptores están vivos, y todos los injertos, a excepción de uno (75%), están funcionando plenamente, con autonomía digestiva completa. Todos los pacientes recibieron inducción con alemtuzumab excepto uno que recibió timoglobulina y en todos se inició la inducción sin esteroides.
Conclusiones: el trasplante intestinal constituye una opción terapéutica aplicable en nuestro medio y válida en receptores en quienes está indicado y que no tienen otra alternativa válida para controlar su insuficiencia intestinal.
Palabras clave: Trasplante de intestino. Indicaciones. Selección. Supervivencia.
Introducción
Los primeros intentos clínicos de trasplante de intestino se realizaron en Boston, en 1964, en dos niños (1); en ambos casos, el órgano trasplantado procedía de la madre. Estos primeros trasplantes fueron un verdadero fracaso, ya que en ambos casos fallecieron los receptores, probablemente fruto de la improvisación y de una preparación insuficiente.
La paternidad del trasplante intestinal corresponde, sin lugar a dudas, a Richard Lillehei. El rigor metodológico de sus trabajos experimentales y la precisión de sus observaciones clínicas, constituyen modelos que no han sido igualados. Su primer trasplante, en marzo de 1967, lo realizó en una mujer de 46 años que había sido sometida a una resección amplia del intestino delgado tras haber sufrido una trombosis venosa mesentérica extensa. Al final de la intervención, tan sólo permanecía el estómago, el bloque duodeno-pancreático y el muñón rectal. Ante esta situación, Lillehei decidió intervenir y trasplantar la totalidad de un yeyuno-íleon obtenido de un sujeto en estado de muerte cerebral. En este primer trasplante, el órgano fue implantado en situación heterotópica. La vena mesentérica inferior del injerto se anastomosó termino-lateralmente a la vena iliaca primitiva izquierda y la arteria mesentérica superior en la cara lateral de la arteria iliaca primitiva izquierda. El postoperatorio inmediato fue especialmente alentador, como lo indicaba la buena recoloración del injerto y la rápida recuperación del peristaltismo. Los dos extremos del intestino se abocaron a la piel en forma de una yeyunostomía y de una colostomía transversal. La enferma falleció unas horas después de la operación; en la autopsia se descubrió que existía una trombosis portal extensa y una trombosis de la cava que obstruía parcialmente el retorno venoso del injerto (2).
Desde aquellas fechas en las que el trasplante de órganos era un acto heroico, el trasplante de intestino, con el advenimiento a comienzos de los años 90 del tacrolimus como fármaco de inmunosupresión básico, ha experimentado un resurgimiento espectacular, liderado preferentemente por el grupo de Pittsburgh que, en el año 2001, publicó un trascendente artículo en el que analizaban sus resultados en 165 trasplantes realizados en 155 pacientes. Estos autores pudieron identificar 6 factores que estaban asociados a un peor pronóstico; entre ellos figuraban las dosis excesivas de inmunosupresores, los esteroides, el estatus serológico del donante y del receptor respecto al CMV y la inclusión de segmentos del colon, entre otros (3). La aceptación de las recomendaciones hechas en este trabajo, así como las modificaciones técnicas y la introducción de nuevos fármacos inmunosupresores, ha permitido la introducción del trasplante intestinal en la clínica, de forma que en la actualidad se practica en más de 60 centros hospitalarios repartidos por 20 países del mundo (4).
En el año 1985 se constituyó el Registro Internacional de Trasplante de Intestino. Desde aquellas fechas hasta nuestros días (1985-2005), según los datos presentados en Bruselas en el IX Simposio Internacional de Trasplante Intestinal en junio de 2005, se estima que se han realizado a nivel mundial un total de 1.292 trasplantes de intestino en 1.210 pacientes. En la mayoría de los casos se trataba de trasplante aislado de intestino, pero también existen trasplantes combinados de intestino e hígado o multiviscerales. Los resultados obtenidos han mejorado con el paso de los años, principalmente en los centros con mayor experiencia, del tal modo que al cabo de 6 meses, el 75% de los pacientes poseen un injerto funcionante y una autonomía digestiva completa.
En nuestro país, el primer trasplante de intestino en un receptor pediátrico se realizó en el Hospital La Paz el 21 de octubre de 1999, por un equipo multidisciplinar que incluía profesionales del Hospital Ramón y Cajal (E. de Vicente y Quijano y cols.) y del Hospital La Paz (M. López Santamaría, P. Jara y cols.). Con posterioridad, el 17 de julio del año 2002, en el Hospital Ramón y Cajal (E. de Vicente y Quijano y cols.), se efectuó en España el primer trasplante de intestino en un adulto.
En nuestro hospital, el primer trasplante de intestino tuvo lugar el 28 de diciembre de 2004 y desde entonces hasta la fecha se han realizado 5 trasplantes en 4 pacientes diferentes. Presentamos la experiencia de nuestro grupo, que hasta la fecha, se trata de la mayor acumulada en España en receptores adultos, ya que nuestro centro es el único a nivel nacional que en este momento está acreditado para este tipo de trasplante.
Material y métodos
Entre julio del año 2004 (fecha de aprobación del protocolo multidisciplinar y definitivo de trasplante intestinal en receptores adultos en el Hospital 12 de Octubre) y octubre de 2005, hemos realizado un total de 5 trasplantes (uno de ellos segundo injerto y otro tercer injerto) entre un grupo de 20 potenciales candidatos que fueron evaluados.
Características de los pacientes evaluados
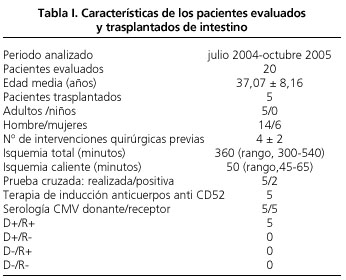
En el presente estudio se han incluido todos los adultos evaluados en la consulta como potenciales candidatos a trasplante intestinal aislado, hepatointestinal o multivisceral. La edad media de los pacientes evaluados fue de 37,07 ± 8,16 años (37 ± 8,77 años en el grupo de trasplantados; p = 0,415) y el 70% de los mismos fueron mujeres (60% en el grupo de los trasplantados; p = 0,414) (Tabla I).
Todos ellos han sido siempre valorados por el mismo equipo médico (cirujanos, gastroenterólogos, infectólogos y dietistas) (Fig. 1).
Indicaciones de trasplante intestinal
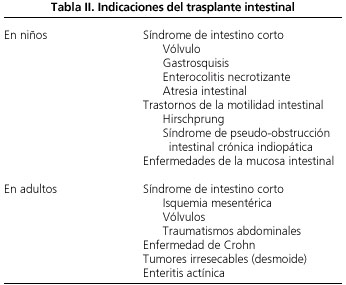
En general, son dos las circunstancias que llevan al fracaso intestinal irreversible y, por ende, que justifican el trasplante de intestino: a) el síndrome de intestino corto; y b) el síndrome de malabsorción intestinal (Tabla II).
En nuestro centro, el trasplante intestinal lo indicamos en pacientes (adultos) portadores de insuficiencia intestinal crónica (incapacidad para mantener la nutrición y/o el balance hidroelectrolítico) e irreversible, dependientes de nutrición parenteral total (NPT), que cumplen al menos uno de los siguientes criterios: a) ausencia de accesos venosos centrales (habitualmente por trombosis) para proseguir con la administración de NPT; b) episodios recidivantes de sepsis y/o sepsis en relación con la administración de NPT que ponen en riesgo la vida del paciente. Consideramos que las sepsis eran frecuentes en los siguientes situaciones: dos o más episodios de sepsis en un año o un episodio de fungemia, shock séptico y/o distrés respiratorio del adulto; c) la presencia de patología de base con pérdidas hidroelectrolíticas potencialmente mortales por deshidratación en caso de interrupción de la NPT; y d) en presencia de hepatopatía grave asociada a la nutrición parenteral total (HANPT) caracterizada por colestasis con o sin fibrosis o cirrosis hepática. El diagnóstico de HANPT se estableció en las siguientes circunstancias: hiperbilirrubinemia (> 3 mg/dl) y/o hipertransaminemia, esplenomegalia, trombopenia, coagulopatía, hemorragia a través del estoma, fibrosis hepática o cirrosis.
Técnica quirúrgica y criterios de selección del donante
En todos los casos de la presente serie, se realizó un trasplante intestinal aislado (Fig. 2). Cuando fue preciso, el trasplante se realizó tras la exéresis de un tumor desmoide mesentérico (Fig. 3). Para ello, se llevó a cabo la extracción del injerto en el donante ideal, una vez perfundido con la solución de la Universidad de Wisconsin (Fig. 4). Los criterios seguidos en nuestro protocolo para la aceptación de un donante de intestino fueron los siguientes: a) edad menor de 40 años; b) estancia en la UCI menor de 1 semana; c) estabilidad hemodinámica (diuresis horaria > 100 ml/horas; tensión arterial media > 120 mmHg; saturación de O2 > 95%, pO2 >100 mmHg con una Fi O2 de 1 y una PEEP < 5 mmHg; d) ausencia de hipotensión prolongada (TAS < 80 mmHg); e) ausencia de parada cardiorrespiratoria; f) peso estimado del donante entre el 50 y el 75% del tamaño del receptor; g) identidad del grupo ABO y Rh; h) idealmente CMV negativo; e i) idealmente, pero no obligatorio, prueba cruzada negativa.
Es indispensable reducir al máximo del tiempo de isquemia fría y caliente del injerto. Por este motivo, tratando de no superar las 8 horas de isquemia total (fría + caliente), tan pronto como el cirujano encargado de realizar la donación estima que el injerto intestinal es adecuado, se traslada al receptor al quirófano para iniciar la intervención y disminuir el tiempo de isquemia fría. Una vez se llega al hospital con el injerto intestinal obtenido del donante ideal, comienza la fase de cirugía de banco (ex situ ex vivo) (Fig. 4). En el transcurso de la misma, se procede a la extirpación del duodeno y al aislamiento e identificación de la arteria mesentérica superior (en su origen aórtico) y de la vena porta, seccionada inmediatamente distal a la conjunción con la vena esplénica.
En el receptor, una vez identificada la vena cava y la aorta en el retroperitoneo, se procede a la anastomosis arterial y venosa, y después a la reperfusión del injerto. En todos los casos se reinstaura la continuidad digestiva mediante una duodeno-(receptor) yeyunostomía-(donante) latero-lateral y se exterioriza el íleon distal del injerto a la piel a modo de ileostomía terminal en fosa iliaca derecha (Fig. 5). El cierre se lleva a cabo mediante una malla de DUAL con el fin de evitar el síndrome compartimental.
Protocolo de inmunosupresión
En nuestro servicio, de las diversas pautas de inmunosupresión aceptables en el trasplante de intestino, se adoptó la doble terapia (alemtuzumab o timoglobulina + tacrolimus) en ausencia de esteroides en al fase de inducción o mantenimiento, salvo en presencia de rechazo agudo o prueba cruzada positiva. El rechazo agudo se trató de forma acorde con el grado del mismo (Tabla III).
1. Mabcampath (de elección): el Mabcampath 1H es un anticuerpo anti CD52 (receptor presente en todos los linfocitos, T/B, NK, y monocitos) que no afecta a los neutrófilos ni a los hematíes. Su administración conlleva una depleción total y mantenida durante al menos 6 meses. Pasados este tiempo se puede apreciar una tendencia a la normalización, aunque nunca se llegan a alcanzar los niveles basales. Antes del trasplante intestinal se administran 1 g de metilprednisolona i.v., 5 mg de dexclorfeniramina maleato i.v. y 1 g de paracetamol i.v. seguido una hora más tarde de 30 mg de alemtuzumab (Mabcampath 1HMR) i.v. a lo largo de 1 hora (inducción).
2. Tacrolimus (FK-506): el tacrolimus (PrografMR) se administra i.v. en perfusión continua a dosis de inicio de 1 mg/24 h con el fin de mantener un nivel óptimo de 8-12 ng/dL (< 6 meses) y de 7-10 ng/dL tras estos 6 meses. Se puede administrar por la yeyunostomía a partir de la primera semana.
Monitorización del injerto intestinal
El control de la evolución del injerto intestinal la realizamos mediante biopsias endoscópicas obtenidas a través del orificio de ileostomía, con toma de un mínimo de 3 muestras a distintos niveles a partir del extremo distal del estoma. La tabla III recoge la frecuencia con la que realizamos estas biopsias según nuestro protocolo. Además, realizamos controles histológicos de la mucosa intestinal cuando el estado clínico del paciente lo aconseja (sospecha de rechazo: débito reducido por ileostomía, diarrea, fiebre, etc.) o exista rechazo intestinal. En este caso, el control lo realizamos al menos dos por semana.
El rechazo agudo del injerto lo clasificamos siguiendo lo establecido en el 8º Simposio Internacional de Trasplante de Intestino Delgado, que se basa en los resultados de las biopsias intestinales. La tabla III recoge esos criterios y el tratamiento que seguimos en cada caso.
Profilaxis de enfermedades infecciosas: la tabla IV recoge de forma esquemática el protocolo que seguimos en nuestro centro para prevenir las infecciones bacterianas, fúngica y vírica, así como un calendario de vacunaciones y un protocolo de detección precoz de infecciones.
Diseño del estudio y análisis estadístico
Se trata de un estudio observacional y prospectivo, resultado de la aplicación práctica de un programa de trasplante de intestino basado en la experiencia experimental y clínica adquirida en nuestro país y en los EE.UU. Las variables (cualitativas y cuantitativas) pertinentes al estudio preoperatorio, postoperatorio e intraoperatorio se obtuvieron, para su análisis, de la base de datos prospectiva creada desde el inicio del programa de trasplante intestinal y multivisceral. Del mismo modo, se realizó una revisión minuciosa de las historias clínicas de los pacientes en busca de datos relevantes, tanto en la descripción operatoria como en los comentarios evolutivos diarios o en las descripciones endoscópicas realizadas con objeto de descartar un rechazo agudo. El estudio descriptivo de las variables cualitativas se realizó mediante porcentajes y en el de las cuantitativas, mediante medias y desviación estándar. Las comparaciones entre grupos de variables cualitativas, se realizaron mediante la prueba del Chi cuadrado y las cuantitativas, mediante la t de Student. No se pudieron realizar estudios de probabilidad de supervivencia (Kaplan Meier) debido al escaso número de eventos (pérdida del injerto y del paciente) en cada grupo.
Resultados
Epidemiología y etiología del fracaso intestinal
El presente estudio incluye los 20 pacientes que fueron evaluados en nuestro Servicio entre julio 2004 y octubre 2005 (Tabla I, Fig. 1). La edad media fue de 37,07 ± 8,16 años y el 70% de los mismos fueron mujeres. El 70% de los pacientes evaluados presentaban un síndrome de intestino corto secundario a una resección intestinal masiva en el contexto de una trombosis mesentérica (30%), una enfermedad de Crohn (5%) u otras causas (20%). Por otra parte, el 30% presentaban un tumor desmoide no resecable sin extirpación de la raíz del mesenterio. Tras el periodo de evaluación, el 50% de los pacientes fueron considerados candidatos a trasplante intestinal.
NPT y complicaciones relacionadas con la misma
Un total de 14 pacientes (70%) precisaban NPT en el momento de ser evaluados; dos de ellos presentaban una analítica normal y biopsia hepática con cambios histológicos inespecíficos; dos, una cirrosis asociada a la NPT; otros dos, colestasis asociada a la NPT; y ocho, citolisis y colestasis bioquímica sin repercusión histológica.
En los portadores de NPT, la media de episodios de sepsis asociada a catéteres fue de 1,7 ± 1,5/año (rango, 0-5/año) y en la mitad de ellos se trató de un episodio grave que precedió a su evaluación para trasplante intestinal. En 7 pacientes, existieron episodios de deshidratación a pesar del tratamiento con NPT con una media anual de episodios graves de 1,30 ± 1,34/año (rango, 0-4/año). Finalmente, fueron trasplantados 2 pacientes (uno con colestasis histológica y el otro con biopsia normal).
Evolución postevaluación. Tiempo de espera en lista
Después de completado el protocolo de candidatos a trasplante de intestino, el 50% de los pacientes fueron considerados adecuados para el procedimiento y, tras firmar el correspondiente consentimiento informado, fueron incluidos en la lista de espera. Hasta la fecha, y considerando el total de pacientes que acudieron a nuestra consulta, han fallecido durante esta espera, sin poder ser trasplantados, el 10%; continúan en la espera el 15% y se han trasplantado el 25%. El tiempo medio de espera previo el trasplante fue de 3,60 ± 1,14 meses, lo cual se diferencia significativamente (p = 0,005) de los que ocurrió en los fallecidos sin trasplante (7 ± 1,41 meses) o en los pacientes que aún aguardan su oportunidad (2,33 ± 0,58 meses).
Características del donante
En todos los casos, los donantes ofertados por la Organización Nacional de Trasplantes (ONT) fueron evaluados siguiendo el protocolo ya mencionado. La edad mediana de los donantes fue de 14 años (rango, 12-36 años), el peso mediano de 35 kg (rango, 37-60 kg) y la estancia mediana en UCI de los mismos fue de 2 días (rango, 0-4 días). Todos los injertos fueron perfundidos con la solución de Wisconsin y, en todas las ocasiones, la extracción fue multiorgánica, obteniéndose e implantándose los siguientes órganos (en los hospitales receptores de los mismos): hígado, corazón, ambos riñones, intestino, páncreas (en un caso) y pulmones (en dos casos). El tiempo mediano de isquemia fría fue de 360 minutos (rango, 300-540 minutos) y el de isquemia caliente de 50 minutos (rango, 45-65 minutos).
Vascularización del injerto intestinal, reconstrucción de la continuidad digestiva y cierre de la pared abdominal
En todos los casos, se procedió a la disección de la aorta y de la cava infrarrenal para realizar las anastomosis vasculares (Fig. 2). La arterialización se llevó a cabo mediante anastomosis mesentérico-aórtica término lateral; el drenaje venoso del injerto se realizó a la circulación sistémica, mediante anastomosis porto-cava término lateral. La anastomosis digestiva proximal (duodeno-yeyunostomía latero lateral) se realizó con sutura no reabsorbible, puntos entrecortados calibre 4/0. En ningún caso se realizó anastomosis digestiva distal y se estableció, de forma deliberada una ileostomía terminal en fosa iliaca derecha, a través de la cual se practicaron las endoscopias protocolizadas para el cribado del rechazo agudo. En la actualidad, tras un seguimiento mediano de 180 días (rango, 90-190 días), todos los pacientes son portadores de una ileostomía terminal y en ningún paciente se ha procedido al cierre de la misma. En dos ocasiones se procedió al cierre primario de la pared abdominal y en tres pacientes fue precisa la utilización de biomateriales (mallas) para evitar el síndrome compartimental intraabdominal (Fig. 5).
Evolución postoperatoria
Todos los pacientes están vivos (mortalidad 0%) y todos los injertos son funcionates a excepción de uno (75% función del injerto intestinal) (Fig. 7). Los portadores del injerto mantienen autonomía digestiva, la cual se alcanzó tras una mediana postoperatoria de 33 días (rango, 28-35 días). La estancia mediana en la UCI fue de 2 días (rango, 2-45 días) y desde ella los pacientes fueron transferidos a una unidad de cuidados intermedios dependiente del Servicio de Cirugía General y Aparato Digestivo con una estancia mediana de 20 días (rango, 16-23 días). La estancia mediana intrahospitalaria global ha sido de 160 días (rango, 75-190 días). De los 5 pacientes trasplantados, al final del presente estudio, permanecen hospitalizados 3 pacientes y 2 han sido dados de alta tras una estancia global de 75 y 170 días.
En 3 casos (60%) se diagnosticaron episodios de rechazo. En dos pacientes fueron del grado II (tratados eficazmente con 10 ml/i.v./24 horas de OKT3 durante 10 días) y en uno de grado III que fue refractario a OKT3 y alemtuzumab y que obligó a la exéresis del injerto intestinal.
En relación con las complicaciones infecciosas postrasplante, se comprobó la existencia de 1,02 ± 1,03 episodios de infección del catéter central durante el primer mes postoperatorio. En un paciente, se presentó en el día 45 postrasplante una reactivación grave de una infección por CMV (que remitió tras tratamiento con ganciclovir, i.v.). En otro, se presentó en la semana 6 del postoperatorio una infección intraabdominal por cándida que requirió su drenaje quirúrgico mediante laparotomía.
Discusión
El fracaso intestinal, definido como la incapacidad para mantener un estado nutricional adecuado en ausencia de NPT, tiene lugar en los adultos por dos razones principales (5): a) síndrome de malabsorción intestinal (enteritis actínica u pseudobstrucción intestinal crónica); y b) el síndrome de intestino corto (SIC).
La causa predominante es el síndrome de intestino corto (SIC) secundario a resecciones intestinales masivas por isquemia mesentérica, traumatismos, enfermedad de Crohn o tumores del intestino o mesenterio (desmoides). Por tanto, el SIC tiene lugar cuando en un paciente (de forma congénita o debido a intervenciones quirúrgicas) se mantienen tan sólo 200 cm de intestino delgado funcional (6).
La absorción de nutrientes está íntimamente relacionada con la cantidad total de superficie de absorción y, por ello, el riesgo de desarrollar insuficiencia intestinal depende también de la presencia o no de intestino grueso adicional. Se estima que durante un periodo variable de entre 1 y 2 años, el intestino remanente se puede adaptar a la nueva situación mediante la hipertrofia de sus vellosidades, las cuales incrementan su diámetro y longitud con el objeto de aumentar la absorción de nutrientes. La dieta oral estimula este proceso y son factores facilitadores del mismo la mayor longitud del intestino, la presencia de intestino sano y de colon. Así, se establece comúnmente que los pacientes de mayor riesgo son: a) los portadores de duodenostomía o de una anastomosis yeyuno-ileal con tan sólo 35 cm de intestino remanente; b) portadores de anastomosis yeyuno-cólicas o íleo-cólicas con menos de 60 cm de remanente; y c) los portadores de yeyunostomía terminal con menos de 115 cm de intestino funcional.
El aspecto más importante en el manejo médico de los pacientes con síndrome de intestino corto es proporcionar de manera adecuada los macro-, micronutrientes y fluidos necesarios para evitar la malnutrición energética, las deficiencias de nutrientes específicos y la deshidratación, además de corregir los desórdenes hidroelectrolíticos y del equilibrio ácido base (7). En este sentido el desarrollo de la NPT, a comienzos de los años 60, abrió una nueva era en las posibilidades terapéuticas de los pacientes con fracaso intestinal crónico. Con anterioridad, la mayoría de los pacientes fallecían por malnutrición y deshidratación; el desarrollo de fórmulas alimentarias de administración intravenosa junto con el desarrollo de accesos vasculares centrales de larga duración, fueron piezas angulares en la implantación de la NPT primero hospitalaria y, con posterioridad, domiciliaria. De hecho, se han publicado supervivencias con NPT que alcanzan los 30 años. Sin embargo, la NPT conlleva una serie de complicaciones que, en un número considerable de pacientes, condicionan la imposibilidad de poder continuar con la misma.
La HANPT (8) se presenta entre el 3% de los pacientes a los 5 años y el 15% a los 19 años. No obstante, aunque algunos autores han referido prevalencias tan altas como del 50% a los 6 años. Aunque la mortalidad asociada a la aparición de la misma es significativa (12,5%), lo verdaderamente relevante es que el 50% de los pacientes que fallecen en el transcurso de la NPT, lo hacen por HANPT. Además, el 100% de los pacientes que la presentan, fallecen en los 10,8 ± 7 meses que siguen al ascenso de la bilirrubina plasmática.
La trombosis venosa asociada a catéter (9) representa el 12% de las relacionadas con la NPT (66% de ellas asintomáticas y detectadas en los cambios de catéter). La incidencia de trombosis es de 0,2 episodios/1.000 catéteres/día y el manejo de los episodios repetidos, obliga a la utilización de anticoagulantes orales, lo cual es especialmente dificultoso de manejar, debido a la insuficiente absorción de los dicumarínicos y al riesgo de hemorragia.
La sepsis asociada a catéter central (10) puede poner en peligro la vida del paciente. La prevalencia se ha establecido en 0,8 infecciones/1.000 catéter/año en adultos, representando el 61% de las complicaciones asociadas a la NPT. Conlleva el 50% de las muertes asociadas a NPT, además del hecho de que las infecciones de repetición contribuyen al progreso de HANPT.
Ante este panorama, el papel de la cirugía en los pacientes con SIC puede englobarse en tres epígrafes: a) restablecimiento de la continuidad intestinal, destinada a realizar anastomosis íleo/yeyunocólicas, con el objeto de facilitar el proceso de adaptación y potencialmente, anular la dependencia de la NPT; b) procedimientos encaminados a duplicar la superficie absortiva, partiendo del intestino delgado remanente (técnica de Bianchi); y c) trasplante intestinal (multivisceral).
Hasta la fecha, el trasplante de intestino se ha realizado en los pacientes que han desarrollado complicaciones atribuibles a su insuficiencia intestinal o a complicaciones derivadas de la NPT. En los EE.UU., desde el mes de octubre del año 2000, el Medicare (11) ha aprobado el pago del trasplante intestinal en pacientes en quienes la NPT ha fracasado lo cual a contribuido decisivamente a la implantación de esta modalidad terapéutica.
El primer trasplante de intestino en un receptor adulto realizado en nuestro hospital fue en diciembre de 2004. Se trata pues de un programa joven pero que acumula la mayor experiencia en adultos a nivel nacional. En apenas un año, hemos evaluado a una veintena de pacientes enviados de otros centros como potenciales receptores de trasplante intestinal. De forma mayoritaria, se trataba de mujeres de menos de 40 años de edad, lo cual coincide con lo publicado por otros centros internacionales con experiencia más prolongada.
Hemos desestimado para el trasplante al 50% de los candidatos y, de los aceptados, hasta la fecha, se han trasplantado el 50%. Estos datos reflejan las enormes posibilidades de expansión que tiene este procedimiento en nuestro país, debido a que la tasa de donaciones es la más alta del mundo (34,6 dmp en el año 2004). La mayoría de los pacientes trasplantados (70%) presentaban un SIC, pero, a diferencia de otros grupos, hemos tenido la oportunidad de evaluar un porcentaje elevado (30%) de pacientes portadores de un tumor desmoide. En estos casos el trasplante se realizó inmediatamente tras la resección del tumor, evitando la espera en fase anentérica, los problemas derivados de la NPT y de la pérdida de derecho a domicilio que serían inherentes a un tratamiento en dos fases: extirpación del tumor y, meses más tarde, trasplante del intestino.
Hemos comprobado igualmente, que un porcentaje elevado de pacientes evaluados (70%) eran dependientes de la NPT y entre ellos hemos encontrado las complicaciones asociadas a la NPT, tales como infecciones, trombosis venosas y HANPT. Además, en el 50% de los pacientes se dieron episodios graves de deshidratación a pesar de la NPT, con una media de 1,3 episodios, lo cual traduce la dificultad de proporcionar el equilibrio hidroelectrolítico preciso para evitar el trasplante de intestino.
Siendo nuestro grupo el único actualmente acreditado en España para receptores adultos y considerando la alta tasa de donaciones existente en nuestro país, los pacientes fueron trasplantados tras una espera de apenas 4 meses. Esto se diferencia de lo publicado por otros grupos donde este tiempo se prolongó hasta los 12 meses. Este hecho ofrece varias ventajas: a) nos ha permitido mantener la indicación de trasplante intestinal aislado; b) no ha sido necesaria la realización de trasplantes combinados hepato-intestinales por cirrosis hepática asociada a la NPT; y c) permite reservar los órganos, especialmente el hígado, para otros pacientes en lista de espera. Por este motivo, creemos relevante que los especialistas implicados en el tratamiento de pacientes con síndrome de intestino corto (cirujanos, gastroenterólogos, dietistas, endocrinólogos, etc.) consideren la posibilidad de indicar el trasplante de intestino en etapas más tempranas, con el objeto de optimizar la situación del paciente de cara a los resultados después del trasplante.
De acuerdo con los datos publicados en el 1er Congreso de la FESNAD (12), se identificaron un total de 86 pacientes en 17 hospitales de nuestro país que seguían NPT domiciliaria. Por tanto, el número de pacientes trasplantados en un año apenas alcanza un tercio de los que podrían haberse beneficiado del procedimiento.
Desde el punto de vista técnico, en todos nuestros pacientes se realizó una derivación porto cava, ya que el hígado nativo recibía flujo esplácnico a través de la vena esplénica y de las tributarias gástricas. En teoría, el drenaje portal sería más fisiológico al asegurar los efectos hepatotróficos del paso directo de la sangre intestinal a través del hígado. Sin embargo, son numerosos los artículos publicados en la última década, tanto en humanos como en animales de experimentación, que ponen en duda la superioridad funcional, metabólica e inmunológica de este tipo de anastomosis venosa (13,14). De hecho, Berney y cols. demostraron que no había diferencias significativas entre el drenaje cava y el portal en términos de mortalidad, morbilidad, rechazo, funcionalidad y supervivencia de paciente e injerto (15).
La forma más aceptada de reconstruir el tránsito tras el trasplante incluye una anastomosis proximal (duodeno-yeyunal) y otra distal con una "ileostomía en chimenea" (Bishoop-Koop) (15). En nuestra serie, la reconstrucción se realizó en todos los casos mediante anastomosis duodeno-yeyunal latero-lateral y se conformó una ileostomía terminal en la fosa iliaca derecha para realizar el seguimiento endoscópico y biópsico. En este primer acto quirúrgico no se realizó anastomosis distal, la cual se pospuso a la fase de cierre de la ileostomía. De esta forma se evitan los problemas derivados de una potencial dehiscencia en el postrasplante inmediato.
El cierre de la pared abdominal tras el trasplante continúa siendo problemática debido a la llamada "pérdida del derecho a domicilio" del contenido intestinal y al peligro de desarrollar un síndrome compartimental intraabdominal (16,17). Este es el motivo por el cual, en aquellos pacientes en quienes no pudo realizarse el cierre primario de la pared, se procedió a la utilización de un material protésico, que secuencialmente, fue reducido hasta el cierre definitivo da la pared. No hubo complicaciones relevantes relacionadas con el uso de dichos materiales.
El rechazo ha sido considerado clásicamente el mayor problema del trasplante de intestino (18,19). Hoy continúa siéndolo pero gracias a la introducción del tacrolimus y, especialmente, de los anticuerpos monoclonales (alemtuzumab, timoglobulina), las tasas de rechazo y su gravedad se han visto reducidas considerablemente. En nuestra experiencia, el 60% de los casos presentaron un episodio de rechazo (3 pacientes); en 2 de ellos se controló con la utilización de OKT3 y en el tercero, siendo refractario al uso del mismo y al alemtuzumab, fue precisa la extirpación del injerto.
Al final del presente estudio y tras un seguimiento mediano de 180 días (rango, 90-190 días), todos los injertos son funcionantes a excepción de uno (75%) y ningún paciente ha fallecido. Estas cifras coinciden con los datos publicados en la literatura y con los presentados en el Registro Internacional de Trasplante de Intestino. Todos los pacientes se encuentran con autonomía digestiva y la estancia postoperatoria ha sido prolongada debido a problemas derivados del cierre de la pared abdominal.
Por tanto, aunque somos conscientes de lo reducido de esta serie, se trata sólo del comienzo de una nueva opción terapéutica en nuestro país, que demuestra que el trasplante intestinal es una realidad que debe ofrecerse a pacientes seleccionados que reúnen una serie concreta de criterios. Se trata de pacientes que dependen de la NPT, pero que por ella han desarrollado complicaciones graves que imposibilitan su mantenimiento y, en consecuencia, que tienen unas posibilidades de supervivencia muy limitadas.
Agradecimientos
Este estudio fue subvencionado en parte por las ayudas de investigación 012/2004 y 08/2005 de la "Fundación Mutua Madrileña", Madrid.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Juan Carlos Meneu Díaz
C/Azalea, 389. Urbanización Soto Azalea
28109 Alcobendas, Madrid
Fax: 91 390 85 23
E-mail: jcmeneu@hotmail.com
Recibido: 16-05-06
Aceptado: 04-09-06.
Bibliografía
1. Mittal NK, Tzakis AG, Kato T, Thompson JF, et al. Current status of small bowel transplantation in children: update 2003. Pediatr Clin North Am 2003; 50: 1419-33. [ Links ]
2. Todo S, Tzakis AG, Abu-Elmagd K, Reyes J, Nakamura K, Casavilla A, et al. Intestinal transplantation in composite visceral grafts or alone. Ann Surg 1992; 216: 223-33. [ Links ]
3. Abu-Elmagd K, Reyes J, Bond G, Mazariegos G, Wu T, Murase N, et al. Clinical intestinal transplantation: a decade of experience at a single center. Ann Surg 2001; 234: 404-16. [ Links ]
4. Small Bowell Transplant Registry. IXth Internacional Small Bowell Transplantation Symposium, Brussels, June 30-July 2005. [ Links ]
5. Abu-Elmagd K, Reyes J, Todo S, Rao A, Lee R, Irih W, et al. Clinical intestinal transplantation: new perspectives and immunologic considerations. J Am Coll Surg 1998; 186: 512-25. [ Links ]
6. American Gastroenterological Association Medical Position Statement: Short Bowel Syndrome and Intestinal Transplantation. Gastroenterology 2003; 124: 1105-10. [ Links ]
7. Van Gossum A, Vahedi K, Abdel-Malik, Staun M, Pertkiewicz M, Shaffer J, et al. Clinical, social and rehabilitation status of long-term home parenteral nutrition patients: results of a European multicentre survey. Clin Nutr 2001; 20: 205-10. [ Links ]
8. Chan S, McCowen KC, Bistrian BR, Thibault A, Keane-Ellison M, Forse RA, et al. Incidence, prognosis and etiology of end-stage liver disease in patients receiving total parenteral nutrition. Surgery 1999; 126: 28-34. [ Links ]
9. DeCicco M, Matovic M, Balestreri L, Panarello G, Fantin D, Morassut S, et al. Central venous thrombosis: an early and frequent complication in cancer patients bearing long-term silastic catheters. A prospective study. Thromb Res 1998; 86: 101-13. [ Links ]
10. Planas M, Castella M, León M y Grupo NADYA: Nutrición Parenteral Domiciliaria (NPD): registro NADYA; 2000. [ Links ]
11. Disponible en: http://www.cms.hhs.gov/manuals/pm_trans/AB00130. pdf. These are the Medicare guidelines for coverage of intestinal transplantation. [ Links ]
12. Registro de la Nutrición Parenteral Domiciliaria (NPD) del año 2003. Planas Vila M, Grupo NADYA. Nutrición Hospitalaria. Vol. XX Suplemento 1; 2005. [ Links ]
13. Liu H, Teraoka S, Kawai T, Hayashi T, Fuchinove S, Nozawa M, et al. Comparative evaluation of systemic vs. portal venous drainage in long-term surviving rats with orthotopic small bowel transplantation. Transplant Proc 1992; 24: 1505-6. [ Links ]
14. Stratta R, Shokouh-Amiri MH, Egidi MF, Grewal HP, Kizilisik AT, Nezakatgco N, et al. A prospective comparison of simultaneous kidney-pancreas transplantation with systemic-enteric versus portal-enteric venous drainage. Ann Surg 2001; 233: 740-51. [ Links ]
15. Bueno J, Abu-Elmagd K, Mazariegos G, Madariaga J, Fung J, Reyes J, et al. Composite liver-small bowel allografts with preservation of donor duodenum and hepatic biliary system in children. J Pediatr Surg 2000; 35: 291-6. [ Links ]
16. Alexandrides IJ, Liu P, Marshall DM, Nery JR, Tzakis AG, Thaller SR, et al. Abdominal wall closure after intestinal transplantation. Plast Reconstr Surg 2000; 106: 805. [ Links ]
17. Levi DM, Tzakis AG, Kato T, Madariaga J, Mittal NK, Nery J, et al. Transplantation of the abdominal wall. Lancet 2003; 361: 2173-6. [ Links ]
18. Tzakis AG, Nery JR, Thompson J, Webb MG, Khan FA, Khan RT, et al. New immunosuppressive regimens in clinical intestinal transplantation. Transplant Proc 1997; 29: 683-5. [ Links ]
19. Abu-Elmagd K, Fung J, McGhee W, Martin D, Mazariegos G, Schaefer N, et al. The efficacy of daclizumab for intestinal transplantation: preliminary report. Transplant Proc 2000; 32: 1195-6. [ Links ]











 texto en
texto en