Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.99 no.1 Madrid ene. 2007
Tumores de la estroma gastrointestinal (GIST): aspectos clínicos
Gastrointestinal stromal tumors (GIST): clinical aspects
L. I. Fernández Salazar, T. Álvarez Gago1, A. Sanz Rubiales2, B. Velayos Jiménez,
R. Aller de la Fuente y J. M. González Hernández
Servicios de Aparato Digestivo, 1Anatomía Patológica y 2Oncología. Hospital Clínico Universitario. Valladolid
Dirección para correspondencia
RESUMEN
Introducción: los tumores GIST son los tumores mesenquimales más frecuentes del tubo digestivo. Se caracterizan por la expresión del receptor c-KIT/CD 117.
Objetivos y métodos: pretendemos describir las manifestaciones clínicas, las exploraciones que llevan al diagnóstico, los aspectos histológicos e inmunohistoquímicos, la evolución y factores predictores de esta a partir de una serie de pacientes.
Resultados: se han diagnosticado 17 casos de GIST entre diciembre de 1999 y abril de 2005. La edad media de los pacientes fue 64,5 años (± 11,9). El 47% eran mujeres. La localización de los tumores por paciente fue: yeyuno-íleon en el 52,9%, gástrica en el 29,4%, duodenal en el 11,7% y mesentérica en el 5,8%. Los tumores medían 6,0 cm (± 5,0). El 47% eran tumores asintomáticos, menos frecuentemente produjeron dolor abdominal o hemorragia digestiva. El 94,1% de los tumores expresaba CD 117. Se diagnosticaron principalmente durante una laparotomía o con ecografía. Se extirparon el 94,1% de los tumores. En el 35,2% (6/17) de los pacientes había criterios de alto riesgo de malignidad según el consenso establecido. A lo largo de 25,6 meses (± 22,5) las metástasis o la recidiva tumoral se dieron en el 23,5% (4/17) de los pacientes y en estos fueron más frecuentes: los criterios de alto riesgo, los tumores sintomáticos, los de mayor tamaño y los que no expresan CD 117. Los tres pacientes con recidiva recibieron imatinib mesilato. Tres pacientes fallecieron por causa del tumor. Otros 4 pacientes fallecieron por otras causas no relacionadas con el GIST.
Conclusiones: se diagnosticaron aproximadamente 12 casos por millón de habitantes y año. Su diagnóstico con frecuencia es casual. Son malignos en cerca de la cuarta parte de los casos. Existe la posibilidad de predecir la evolución en función de diferentes aspectos.
Palabras clave: GIST. Tumor mesenquimal. C-KIT.
ABSTRACT
Introduction: gastrointestinal stromal tumors (GISTs) are the most common mesenchymal tumors in the gastrointestinal tract. One of their features is the expression of the c-KIT / CD117 receptor.
Aims and methods: we will focus on describing the symptoms, clinical studies prior to diagnosis, histologic and immunohistochemical characteristics, as well as the progression of disease in a group of patients.
Results: seventeen cases were diagnosed between December 1999 and April 2005. Mean age of patients was 64.5 (± 11.9); 47% were women. Tumor location was as follows: 52.9% in the jejunum or ileum, 29.4% were gastric, 11.7% were in the duodenum, and 5.8% were located in the mesentery. Tumor size was 6.0 cm on average (± 5.0); 47% were asymptomatic, and to a lesser degree caused abdominal pain or digestive bleeding; 94.1% of tumors expressed CD117. Most of them were discovered while performing a laparotomy or ultrasound scan; 94.1% of tumors were removed; 35.2% (6 out of 17) of patients suffering from GIST met consensus criteria for aggressive behavior. Over 25.6 months (± 22.5) metastasis or tumor relapse occurred in 23.5% (4 out of 17) of patients - those with more frequent high-risk criteria, symptomatic and bigger tumors, and tumors not expressing CD117. The three patients with tumor relapse were prescribed imatinib mesylate. Three patients died because of the tumor, and four from other causes unrelated to GIST.
Conclusions: GIST was diagnosed in around 12 cases per million a year. Its diagnosis was usually an incidental finding during a medical evaluation, and tumors were malignant in nearly one fourth of cases. We can predict its outcome depending on different aspects.
Key words: GIST. Mesenchymal tumor. c-KIT.
Introducción
Los tumores GIST son los tumores mesenquimales más frecuentes en el tracto gastrointestinal (1,2). La incidencia anual varía entre 10 y 20 casos por millón de habitantes en países desarrollados, y entre el 20 y el 45% son malignos (3-5). La expresión del receptor de membrana c-KIT/CD 117 con actividad tirosin-quinasa sintetizado a partir del proto-oncogén c-kit caracteriza a estos tumores (1-6). La expresión de c-KIT y de CD 34 común a los tumores GIST y a las células intersticiales de Cajal y las similitudes ultraestructurales ha llevado a considerar que estos tumores se originan de estas células o de sus precursores (2,6,7). El receptor c-KIT es fundamental en el reconocimiento de los GIST, base molecular de la carcinogénesis y de la respuesta al tratamiento con imatinib mesilato (1-3,7-9).
Objetivos
Describir las localizaciones y variabilidad clínica de este tumor, las exploraciones que llevan al diagnóstico, los aspectos histológicos e inmunohistoquímicos y su evolución. También se ha pretendido confirmar, como dicen otros autores, si la clínica o la histología predice una mayor agresividad de los tumores.
Material y métodos
A partir de la base de datos del Servicio de Anatomía Patológica de nuestro hospital que atiende a una población rural y urbana de 260.000 personas, se han revisado las historias clínicas de los pacientes con diagnóstico de GIST. El diagnóstico se realizó en base a los criterios de consenso (histológicos e inmunohistoquímicos) para el diagnóstico de tumor GIST (1-3) a partir del estudio del tumor extirpado en 16 pacientes. La extirpación quirúrgica fue completa en todos ellos (Tabla I). Una mujer no fue operada y se llegó al diagnóstico mediante una endoscopia digestiva y la toma de biopsias. Se han obtenido los datos referidos al sexo y edad al diagnóstico, antecedentes y enfermedades concomitantes, síntomas, exploraciones con las que se llegó al diagnóstico y los datos referidos al estudio histológico y a la inmunohistoquímica (CD 117, CD 34, actina de músculo liso, S-100 y vimentina). Se ha comprobado el comportamiento maligno de los tumores por la presencia de metástasis o la recidiva a lo largo de un tiempo medio desde el diagnóstico de 25,6 (± 22,5) meses. Se ha analizado si los siguientes factores: edad, sexo, diagnóstico casual o clínica en su caso, localización y tamaño del tumor, tipo celular del tumor (fusiforme, epitelioide o mixto), presencia de necrosis intratumoral, número de mitosis por 50 campos de gran aumento (CGA) e inmunohistoquímica se asocian al comportamiento maligno del tumor. Las prueba utilizadas han sido la prueba t de Student para la comparación de medias y la de Chi cuadrado para variables cualitativas. El programa de estadística utilizado ha sido SPSS 11.5 para Windows.
Resultados
Se diagnosticó tumor GIST a diecisiete pacientes desde diciembre de 1999 hasta abril de 2005. La edad media de los pacientes fue 64,5 años (± 11,9) (entre 44 y 87 años). El 47% eran mujeres. Una paciente que padecía una neurofibromatosis de von Recklinghausen tenía cuatro pequeños GIST intestinales, el resto de los pacientes padecía un único tumor. La localización de los tumores por paciente fue: yeyuno o íleon en el 52,9%, gástrica en el 29,4%, duodenal en el 11,7% y mesentérica en el 5,8%. Los tumores tenían un tamaño medio de 6,0 ± 5,0 cm (de 0,4 a 17 cm).
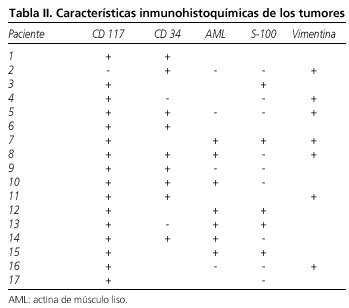
Las enfermedades asociadas, manifestaciones clínicas y las exploraciones que permitieron llegar al diagnóstico se resumen en la tabla I. El tipo celular predominante ha sido el fusiforme en el 69,2% de los casos, seguido el tipo mixto en el 23,0% y el epitelioide en el 7,6%. Las características inmunohistoquímicas de los tumores se resumen en la tabla II (Figs. 1 y 2).
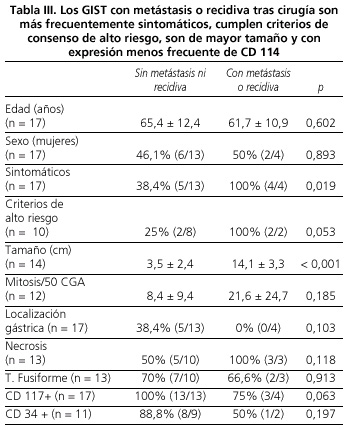
En el 35,2% de los pacientes ha habido criterios de riesgo de malignidad (más de 10 mitosis por 50 CGA, tamaño superior a 10 cm o tamaño superior a 5 cm con más de 5 mitosis por 50 CGA) según el consenso establecido (1-3). El comportamiento maligno (metástasis o recidiva) de los tumores se ha dado en el 23,5% de los pacientes (Tabla I). En estos pacientes fueron más frecuentes: a) los tumores con criterios de alto riesgo (p = 0,053; RR: 2,0, IC: 0,751-5,329); b) los tumores sintomáticos (p = 0,031; RR: 1,8, IC: 1,003-3,229); y c) los tumores con ausencia de CD 117 (p = 0,063; RR: 5,333, IC 1,923-14,790) (Tabla III).
Los tres pacientes con recidiva tumoral han recibido tratamiento con imatinib mesilato: una mujer de 70 años con un tumor mesentérico operado, reintervenida por recidiva a los 30 meses que presentó una segunda recidiva 18 meses después y recibió imatinib (400 mg al día), sobreviviendo 6 meses más. Y una mujer y un hombre de 47 y 60 años con GIST en intestino delgado que tuvieron recidiva local y metástasis hepáticas a los 17 y 22 meses de la cirugía respectivamente. Ambos fueron reoperados de la recidiva local y recibieron imatinib (400 mg al día). En el caso de la mujer hubo una detención inicial de la progresión de la enfermedad y una supervivencia de 42 meses hasta su fallecimiento por progresión tumoral pese a haber incrementado la dosis de imatinib a 800 mg al día. Al hombre se le detectaron además metástasis pulmonares a los dos meses de la reintervención y con imatinib el tumor no había progresado tras 29 meses desde la reintervención.
Tras 25,6 ± 22,5 meses (entre 0 y 66 meses) desde el diagnóstico han fallecido por el tumor un paciente con metástasis hepáticas al diagnóstico que falleció en el postoperatorio y dos pacientes con recidiva y progresión tumoral. Otros 4 pacientes han fallecido por otras causas no relacionadas con el GIST (isquemia mesentérica, postoperatorio tras una coloplastia esofágica, neoplasia de mama, neoplasia de colon).
Discusión
La incidencia anual de los tumores de tipo GIST es de 10 a 20 casos por millón de habitantes en países como EE.UU., Holanda o Suecia (3-5). Nuestros datos supondrían una incidencia aproximada similar a la descrita en estos países, alrededor de 12,4 casos por millón de habitantes y año.
Aunque en la mayoría de los trabajos la localización gástrica se considera la más frecuente, en nuestra serie no ha sido así (8,10,11). De la misma manera, en nuestra serie la gastroscopia sólo ha conducido al diagnóstico en dos de los pacientes siendo la laparotomía y la ecografía abdominal los medios con los que con más frecuencia se ha detectado el tumor. El 23,5% de los pacientes padecía alguna otra enfermedad tumoral y el 29,4% padecía lesiones premalignas (pólipos gástricos o de colon, o esófago de Barrett). Esta posible asociación entre tumores de tipo GIST y otras lesiones tumorales ya ha sido descrita por otros autores (12,13). Creemos que esta asociación explica el elevado número de GIST de nuestra serie con diagnóstico casual en el transcurso de pruebas diagnósticas o de laparotomías indicadas por otros motivos. La coexistencia de otras enfermedades también explica que el 23,5% de los pacientes haya fallecido en menos de 2 años por motivos diferentes al tumor GIST.
En nuestra serie, además de la hemorragia digestiva o el dolor abdominal que son junto con el efecto de masa abdominal las manifestaciones clínicas más frecuentes, también hay casos de hemoperitoneo, de abdomen agudo y un diagnóstico a partir de la detección de metástasis hepáticas que son formas descritas por otros autores (14-18).
La característica inmunohistoquímica principal de los tumores GIST es la positividad frente al antígeno c-KIT / CD 117 en el 90-95% de los casos. El CD 34 se expresa en el 60 al 70% de los tumores y la actina de músculo liso en el 30 al 40%. La positividad para vimentina también caracteriza a estos tumores (1,3,5,6,8,9). La inmunohistoquímica permite el diagnóstico diferencial con otros tumores mesenquimales como los schwanomas o leiomiomas (1,3,5). En nuestra serie hay un único paciente con inmunohistoquímica negativa para CD 117, y positiva para CD 34 y vimentina. El que sea también negativa para S-100 y actina de músculo liso nos hace pensar que se trata de un tumor GIST CD 117 negativo. La expresión más frecuente de lo esperado en nuestra serie de actina de músculo liso y de S-100 se explicaría por el elevado número de tumores localizados en el intestino delgado en los que estos marcadores están presentes con más frecuencia (3,19) (Figs. 3 y 4).
El tamaño y número de mitosis por 50 CGA constituyen los criterios para clasificar a los GIST en función del riesgo de agresividad (1-3), pero también la localización extragástrica, la presencia de necrosis tumoral, el tipo histológico diferente al fusiforme, la ausencia de marcadores inmunohistoquímicos como CD 117 y CD 34 y la expresión de diferentes reguladores del ciclo celular son más frecuentes en tumores con comportamiento maligno (1-3,5,11,14,20-25). Nosotros también hemos comprobado que los tumores que metastatizan o recidivan son más frecuentemente sintomáticos al diagnóstico, de mayor tamaño y con expresión menos frecuente de CD 117 (Tabla III). Sin embargo se recomienda un seguimiento indefinido de todos los pacientes por el riesgo de recidiva o metástasis independientemente de que se cumplan criterios de malignidad (2).
El tratamiento indicado es la resección quirúrgica completa. No es necesaria la linfadenectomía ya que no suele haber invasión ganglionar (26). La resección completa supone que el paciente esté libre de enfermedad a los 2 años en el 67% y a los 5 años en el 34 al 60% (14,27). El 66,6% de los pacientes de nuestra serie operados que no han fallecido por otros motivos diferentes al tumor, están libres de enfermedad tras un seguimiento medio de algo más de 2 años.
El imitanib mesilato es un inhibidor potente y selectivo de la tirosin-quinasa KIT y del receptor PDGFRa (28). Su uso en casos de GIST irresecable o metastásico ha mejorado la evolución de los pacientes, deteniendo la progresión de la enfermedad entre el 44 y el 50% de los casos durante 2 años y aumentando la supervivencia que puede ser del 85% al año y del 69 al 78% a los dos años de tratamiento (29-31). En nuestra serie dos de los tres pacientes con recidiva tumoral han tenido una supervivencia superior a los dos años desde el inicio del tratamiento. La dosis recomendada es 400 mg al día y se debe mantener de por vida o hasta que haya progresión de la enfermedad (29,30,32). Puede haber resistencia al inicio del tratamiento o una vez obtenida una respuesta, como en la evolución descrita en uno de los pacientes, debido a la aparición de otras mutaciones (33-36). Esta resistencia puede tratarse incrementando al doble la dosis de imatinib y en un futuro próximo con otros inhibidores de la tirosinquinasa como el sumitinib (37).
Bibliografía
1. Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastrointestinal stromal tumors (GISTs): a review. Eur J Cancer 2002; 33: S39. [ Links ]
2. Solis-Herruzo JA, Solis-Muñoz P. GISTs: from the molecular knowledge to the rational treatment. Rev Esp Enferm Dig 2003; 95: 677-82. [ Links ]
3. Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol 2002; 33: 459-65. [ Links ]
4. Nilsson B, Bumming P, Meis-Kindblom JM, Orden A, Dortok A, Gustavsson B, et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era- a population-base study in western Sweden. Cancer 2005; 103: 821-9. [ Links ]
5. Goettsch WG, Bos SD, Breekveldt-Postma N, Caspaire M, Herings RM, Hogendoorn PC. Incidence of gastrointestinal stromal tumors is underestimated: results of a nation-wide study. Eur J Cancer 2005; 41: 2868-72. [ Links ]
6. Sircar K, Hewlett BR, Huizinga JD, Chorneyko K, Berezin I, Riddell RH. Interstitial cells of Cajal as precursors of gastrointestinal stromal tumors. Am J Surg Pathol 1999; 23: 377-89. [ Links ]
7. Sanders KM. A case of interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract. Gastroenterology 1996; 111: 492-515. [ Links ]
8. Miettinen M, Lasota J. Gastrointestinal stromal tumors -definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchow Arch 2001; 438: 1-12. [ Links ]
9. Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 1988; 279: 577-80. [ Links ]
10. Miettinen M, Monihan JM, Sarlomo-Rikala M, Kovatich AJ, Carr NJ, Emory TS, et al. Gastrointestinal stromal tumors /smooth muscle tumors / GISTs in the omentum and mesentery -clinicopathologic and immunohistochemical study of 26 cases. Am J Surg Pathol 1999; 23: 1109-18. [ Links ]
11. Emory TS, Sobin LH, Lukes L, Lee DH, O´Leary TJ. Prognosis of gastrointestinal smooth muscle (stromal) tumors: dependence on anatomic site. Am J Surg Pathol 1999; 23: 82-7. [ Links ]
12. Agaimy A, Wuensch PH. Gastrointestinal stromal tumors in patients with other-type cancer: a mere coincidence or an etiological association? A study of 97 GIST cases. Z Gastroenterol 2005; 43: 1025-30. [ Links ]
13. Kalmar K, Tornoczky T, Poto L, Illenyi L, Kalmar Nagy K, Kassaie M, et al. Gastrointestinal stromal tumors in a single institute: is there an association to other gastrointestinal malignanacies? Mgy Seb 2004; 57: 251-6. [ Links ]
14. De Matteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brenan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg 2000; 231: 51-8. [ Links ]
15. Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long term follow-up. Am J Surg Pathol 2005; 29: 52-68. [ Links ]
16. De Francisco R, Díaz G, Cadahía V, Velázquez RF, Giganto F, González O, et al. Lower GI bleeding secondary to a stromal rectal tumor (rectal GIST). Rev Esp Enferm Dig 2006; 98: 387-8. [ Links ]
17. Pesqueira Fontán PM, Molinos Castro S, Caro Narrillos C, Pardavila Gómez R. Hepatic metastases: a way of GIST presentation. Rev Esp Enferm Dig 2006; 98: 147-9. [ Links ]
18. Pardo Martínez C, Mayol Martínez J, Hernández Pérez C, Álvarez Fernández-Represa J. Gastric stromal tumors: clinical presentation and clinical options. Rev Esp Enferm Dig 2004; 96: 578-81. [ Links ]
19. Miettinen M, Sobin LH, Sarlomo-Rikala M. Immunohistochemical spectrum of GISTs at different sites and their differential diagnosis with a referente to CD 117 (KIT). Mod Pathol 2000; 13: 1134-42. [ Links ]
20. Hasegawa T, Matsuno Y, Shimoda T, Hirohashi S. Gastrointestinal stromal tumor: Consistent CD117 immunostaining for diagnosis, and prognostic classification based on tumor size and MIB-1 grade. Hum Pathol 2002; 33: 669-76. [ Links ]
21. Singer S, Rubin BP, Lux ML, Chen CJ, Demetri GD, Fletcher CD, et al. Prognostic value of KIT mutation type, mitotic activity, and hystologic subtype in gastrointestinal stromal tumors. J Clin Oncol 2002; 20: 3898-905. [ Links ]
22. Koay MH, Goh YW, Iacopetta B, Grieu F, Segal A, Sterrett GF, et al. Gastrointrestinal stromal tumours (GISTs): a clinicopathological and molecular study of 66 cases. Pathology 2005; 37: 22-31. [ Links ]
23. Tzen CY, Mau BL. Analysis of CD117-negative gastrointestinal stromal tumors. World J Gastroenterol 2005; 11: 1052-5. [ Links ]
24. Feakins RM. The expression of p-53 and bcl-2 in gastrointestinal stromal tumors is associated with anatomical site, and p53 expression is associated with grade and clinical outcome. Histopathology 2005; 46: 270-9. [ Links ]
25. Nakamura N, YamamotoH, Yao T, Oda Y, Nishiyama K, Imamura M, et al. Prognostic significance of cell-cycle regulatory proteins in gastrointestinal stromal tumor and the relevance of the risk grade. Hum Pathol 2005; 36: 828-37. [ Links ]
26. Aparicio T, Boige V, Sabourin JC, Crenn P, Ducreux M, Le Cesne A, et al. Prognostic factors alter surgery resectable gastrointestinal stromal tumors. Eur J Surg Oncol 2004; 30: 1098-103. [ Links ]
27. Connolly EM, Gaffney E, Reynolds JV. Gastrointestinal stromal tumors. Br J Surg 2003; 90: 1178-86. [ Links ]
28. Emile JF, Theou N, Tabone S, Cortez A, Terrier P, Chaumette, MT, et al. Clinicopathologic phenotypic and genotypic characteristics of gastrointestinal mesenchymal tumors. Clin Gastroenterol Hepatol 2004: 2: 597-605. [ Links ]
29. Verweij J, Casali PG, Zalcberg J, Le Cesne A, Reichardt P, Blay JY, et al. Progression-free survival in gastrointestinal stromal tumors with high-dose Imatinib: a randomised trial. Lancet 2004; 364: 1127-34. [ Links ]
30. Rankin C, von Mehren M, Blanke C, et al. Dose effect of Imatinib in patients with metastatic GIST-Phase III Sarcoma Intergroup Study (abstract). Proc Am Soc Clin Oncol 2004; 23: 815a. [ Links ]
31. Fernández A, Aparicio J. Imatinib and gastrointestinal stromal tumor (GIST): a selective targeted therapy. Rev Esp Enferm Dig 2004; 96: 723-6. [ Links ]
32. Blay JY, Bonvalot S, Casali P, Choi H, Debiec-Richter M, Dei Tos AP, et al. Consensus meeting for the management of gastrointestinal stromal tumors. Report of the GIST Consensus conference of 20-21 march 2004, under the auspices of ESMO. Ann Oncol 2005; 16: 566-78. [ Links ]
33. Chen LL, Sabripour M, Andtbacka RH, Patel SR, Feig BW, Macapinlae HA, et al. Imatinib resistance in gastrointestinal stromal tumors. Curr Oncol Rep 2005; 7: 293-9. [ Links ]
34. Van Glabbeke M, Verweij J, Casali PG, et al. Initial and late resistance to imatinib in advanced gastrointestinal stromal tumors are predicted by different prognostic factors: a European Organisation for research and treatment of cancer-Italian sarcoma group-Australasian gastrointestinal trials group. J Clin Oncol 2005; 23: 5795-804. [ Links ]
35. Antonescu CR, Besmer P, Guo T, Arkun K, Hom G, Koryotowski B, et al. Acquired resistance to imatinib in gastrointestinal stromal tumors through secondary gene mutation. Clin Cancer Res 2005; 11: 4182-90. [ Links ]
36. Zalcberg JR, Verweij J, Casali PG, Le Cesne A, Reichardt P, Blay JY, et al. Outcome of patients with advanced gastro-intestinal stromal tumors crossing over to a daily imatinib dose of 800 mg alter progression on 400 mg. Eur J Cancer 2005; 41: 1751-7. [ Links ]
37. Demetri GD, Desai J, Fletcher JA. SU11248, a multi-targeted tyrosine kinase inhibitor, can overcome Imatinib resistance caused by diverse genomic mechanisms in patients with metastatic gastrointestinal stromal tumor (abstract). Proc Am Soc Clin Oncol 2004; 22: 195s. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
L. I. Fernández Salazar.
C/ Gamazo, 4, 3ºB.
47004 Valladolid.
e-mail: luisfersal@wanadoo.es
Recibido: 24-02-06.
Aceptado: 25-09-06.