Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.100 no.3 Madrid mar. 2008
TRABAJOS ORIGINALES
Factores pronósticos de complicaciones postoperatorias en el trasplante hepático
Prognostic factors associated with postoperative complications in liver transplantation
A. Rodríguez-Ariza, A. Monrobel, E. Martínez-Galisteo1, C. Alicia Padilla1, J. A. Bárcena1, E. Fraga, G. Costán, P. Barrera, A. Poyato, J. L. Montero, P. López-Cillero2, J. Muntané y M. de la Mata
Sección de Hepatología. Hospital Universitario Reina Sofía. 1Departamento de Bioquímica y Biología Molecular. Universidad de Córdoba. 2Servicio de Cirugía. Hospital Universitario Reina Sofía. Córdoba
Dirección para correspondencia
RESUMEN
Objetivo: la evolución postoperatoria de los pacientes sometidos a trasplante hepático ortotópico (THO) se encuentra frecuentemente asociada a la aparición de diversas complicaciones tales como disfunción renal, rechazo agudo, infecciones y complicaciones neurológicas. Estas complicaciones constituyen las causas más significativas de morbilidad y mortalidad tempranas en pacientes que reciben un THO. El propósito del presente estudio es la identificación de factores relacionados con las distintas complicaciones postoperatorias del THO. Diseño experimental: se llevó a cabo un estudio prospectivo.
Pacientes: se analizaron 78 variables en 32 pacientes consecutivos sometidos a THO. Utilizando un análisis de regresión logística se identificaron aquellos factores asociados de forma independiente con la aparición de complicaciones postoperatorias.
Resultados: el análisis multivariante demostró que los niveles pretrasplante en suero de malondialdehído y creatinina estaban asociados con el desarrollo de disfunción renal. Los niveles pretrasplante de hemoglobina y las unidades de plaquetas administradas durante la cirugía fueron factores pronósticos de infecciones. El rechazo agudo fue pronosticado por los niveles séricos de γ-glutamil transpeptidasa y de bilirrubina total. Los niveles pretrasplante de sodio y glutaredoxina en suero estuvieron asociados con complicaciones neurológicas.
Conclusiones: proponemos estos marcadores para la identificación de pacientes de alto riesgo, permitiendo una vigilancia y/o tratamiento anticipados que mejorarán la morbilidad y la supervivencia en pacientes sometidos a THO.
Palabras clave: Trasplante hepático. Disfunción renal. Infecciones. Rechazo agudo. Factores predictivos.
ABSTRACT
Objectives: the postoperative evolution of patients submitted to orthotopic liver transplant (OLT) is frequently associated with the appearance of different types of complications such as renal failure, graft rejection, infections, and neurological disorders. These complications are the most significant causes of early morbidity and mortality in patients undergoing OLT. The purpose of the present study was the identification of factors related to the different postoperative complications after OLT. Experimental design: a prospective study was carried out.
Patients: seventy-eight variables were analyzed in 32 consecutive patients undergoing OLT. The factors independently associated with the appearance of postoperative complications were identified using a stepwise logistic regression analysis.
Results: the multivariate analysis showed that malondialdehyde and creatinine pretransplant serum levels were associated with the development of renal dysfunction. The pretransplant levels of haemoglobin and the units of platelets administered during surgery were prognostic factors of infections. Acute graft rejection was predicted by γ-glutamyl transpeptidase and total bilirubin serum levels. The pretransplant sodium and glutaredoxin levels in serum were associated with neurological complications.
Conclusions: we propose these markers for the identification of high-risk patients allowing an early surveillance and/or treatment to improve morbidity and survival in patients submitted to OLT.
Key words: Liver transplant. Renal failure. Infections. Graft rejection. Predictive factors.
Introducción
El trasplante hepático ortotópico (THO) es el tratamiento de elección para enfermedades hepáticas agudas o crónicas en estadio final. Sin embargo, el seguimiento de los pacientes sometidos a THO se encuentra frecuentemente asociado a la aparición de varias complicaciones, incluyendo disfunción del injerto, rechazo, infecciones, insuficiencia renal y complicaciones neurológicas (1). La disfunción renal complica frecuentemente el curso de la enfermedad hepática avanzada y contribuye de manera muy significativa a la morbilidad postrasplante. Esta complicación aparece a menudo como resultado del daño nefrotóxico ocasionado por la variedad de agentes terapéuticos necesarios para combatir el rechazo y las infecciones, particularmente antibióticos y fármacos supresores (2-4). Las infecciones son una complicación muy común tras el THO, y aunque se han producido mejoras en la profilaxis, diagnóstico y tratamiento, todavía permanecen como causa significativa de morbilidad y mortalidad en pacientes sometidos a THO (5). Los episodios de rechazo celular agudo aparecen con una incidencia del 20 al 40% durante las primeras semanas tras el THO (6,7) y si se confirma esta complicación mediante biopsia debe iniciarse el tratamiento con esteroides. La aparición de complicaciones neurológicas es también muy común tras el THO. Entre el 30 y el 60% de pacientes sometidos a THO experimentan trastornos neurológicos que pueden ser causados por alteraciones metabólicas, infecciones o por la toxicidad de los fármacos inmunosupresores (8,9).
No existe consenso acerca de la mayoría de factores que predisponen a la aparición de estas complicaciones tras el THO. En este estudio hemos analizado parámetros que potencialmente pueden predisponer a la aparición de rechazo agudo, infecciones, disfunción renal y complicaciones neurológicas en los 40 días siguientes al THO. Para ello hemos analizado un elevado número de variables preoperatorias, intraoperatorias y postoperatorias. La identificación de aquellos casos de alto riesgo permitirá una vigilancia y/o tratamiento anticipados que mejorarán la morbilidad y la supervivencia en pacientes sometidos a THO.
Pacientes y métodos
Se evaluaron y se seleccionaron de manera prospectiva treinta y dos pacientes consecutivos sometidos a THO en nuestro hospital. Los pacientes incluidos cumplieron los siguientes criterios: edad > 18 años, trasplante primario y un régimen basado en ciclosporina o tacrolimus como principales agentes inmunosupresores tras el THO. El estudio fue aprobado por el Comité Ético del Hospital Universitario Reina Sofía (Córdoba, España) y se obtuvo el consentimiento informado de cada uno de los pacientes incluidos.
Trasplante hepático
El trasplante ortotópico de hígado se llevó a cabo mediante los procedimientos estándar. Se recogieron datos preoperatorios, intraoperatorios y postoperatorios de cada paciente. A todos ellos se les administraron 1.000 mg de metilprednisolona durante el periodo intraoperatorio (día 0) y posteriormente las dosis fueron reducidas a 3 mg/kg (día 1), 2,5 mg/kg, (día 2), 2 mg/kg (día 3), 1,5 mg/kg (día 4), 1 mg/kg (día 5), 0,5 mg/kg (día 6) y 20 mg el día 7.
Los pacientes tratados con ciclosporina recibieron 10-15 mg/kg por día con un ajuste diario de la dosis para mantener un nivel de 300-350 ng/ml en sangre durante los 30 días postrasplante. En los pacientes que recibieron tacrolimus la dosis fue de 0,15 mg/kg por día y la dosis se corrigió diariamente para obtener un nivel en sangre entre 10 y 15 ng/ml.
Evaluación de las complicaciones postoperatorias
Se consideró que existía una disfunción renal cuando la creatinina fue 2 mg/dl o superior. La aparición de infecciones por bacterias, hongos o virus se confirmó mediante el aislamiento o cultivo de los microorganismos en al menos una de las muestras del paciente, bien de extracciones programadas o de extracciones complementarias no programadas por sospecha clínica. A los pacientes cuyos datos clínicos y bioquímicos indicaban rechazo agudo se realizó una biopsia para obtener confirmación histológica. Los criterios histológicos fueron: a) infiltrado inflamatorio mixto de predominio mononuclear en el área portal; b) inflamación subendotelial de venas portales; y c) inflamación y/o daño del epitelio biliar. La evaluación de complicaciones neurológicas se basó en la aparición de síntomas como temblores, agitación, desorientación, crisis convulsivas o coma en cualquier grado.
El seguimiento para este estudio se realizó a todos los pacientes hasta que recibieron el alta hospitalaria. Cuatro pacientes (14,5%) murieron durante el estudio, siendo las causas fallo multiorgánico en tres de los casos y hemorragia digestiva alta masiva en uno.
Determinación de citoquinas
Las citoquinas se cuantificaron en suero mediante un ensayo inmunoenzimático (ELISA) previamente descrito (10). Las citoquinas y sus correspondientes anticuerpos policlonales se obtuvieron de Genzyme Diagnostic® (Cambridge, Massachusetts, EE.UU.). Se determinaron los siguientes parámetros: para la reproducibilidad, la precisión interensayo (1,2 ± 0,03%), la precisión intraensayo (2,9 ± 0,90%) y el coeficiente de variación intraensayo (1,9%); para el paralelismo la proporción entre pendientes (0,94 ± 0,030%); y para la sensibilidad la dosis mínima detectable (0,08 pg/ml).
Los pocillos de las placas de ELISA se recubrieron con TNF-α (0,5 ng), IL-1α (1 ng), o IL-6 (3 ng) durante 1 h a 37 ºC. Después se realizó un bloqueo con albúmina sérica bovina al 2% en tampón fosfato 10 mM (NaCl 137 mM, KCl 2,7 mM y Na2HPO4 4,3 mM), Tween 0,05% (PBS-Tween) a pH 7,4. Se incubaron las muestras y los anticuerpos anti-TNF-α (32 ng/ml) o anti-IL-1α (1 μg/ml) o anti-IL-6 (1,34 μg/ml) durante 2 h a 37 ºC, y la mezcla se añadió a los pocillos recubiertos de antígeno. Tras incubación durante 2 h a 37 ºC, los pocillos se lavaron con PBS-Tween® y se incubaron con los anticuerpos secundarios biotinilados (125 pg/ml) (Zymed®, San Francisco, California, EE.UU.) durante 1 h a 37 ºC. Se lavaron los pocillos con tampón Tris-HCl 100 mM a pH 7,6 y se incubaron con una solución estreptavidina-fosfatsa alcalina (Master Diagnóstica®, Granada, España) durante 30 min a 37 ºC. Finalmente los pocillos se lavaron y se incubaron con p-nitrofenil fosfato (Sigma®, Madrid, España) durante 1 h a 37 ºC y se determinó la absorbancia a 405 nm en un lector ELISA (Teknika 510 ELISA reader®, Dublín, Irlanda).
Determinación de tioredoxina y glutaredoxina
Los niveles de tioredoxina (Trx) y glutaredoxina (Grx) en suero se determinaron mediante un ensayo ELISA competitivo indirecto descrito anteriormente (11,12). Los pocillos se recubrieron con 50 ng de Grx recombinante o de Trx y se incubaron toda la noche a 37 ºC. Después se bloquearon los pocillos con albúmina sérica bovina en tampón carbonato y se lavaron con suero fetal bovino al 10% en Tween-PBS®. El ensayo competitivo se realizó incubando los patrones o las muestras con los correspondientes anticuerpos anti-Grx recombinante o anti-Trx (250 μg/l). La mezcla de competición (100 μl) se transfirió a los pocillos y se incubó 1 h a 37ºC. Los pocillos se lavaron 3 veces con Tween-PBS® y se incubaron 1 h a temperatura ambiente con anticuerpos secundarios marcados con fosfatasa alcalina. Finalmente, los pocillos se lavaron 5 veces con Tween-PBS® y se incubaron con p-nitrofenil fosfato (Sigma®, Madrid, España) durante 1 h a 37 ºC y se determinó la absorbancia a 405 nm en un lector ELISA (Teknika 510 ELISA reader®, Dublín, Irlanda).
Determinación de los niveles de óxido nítrico, glutatión y malondialdehído
Los niveles séricos de óxido nítrico se determinaron indirectamente mediante la cuantificación de sus productos finales nitrito y nitrato (13). En el ensayo el nitrato se convirtió a nitrito mediante la nitrato reductasa y el nitrito total se determinó mediante la reacción de Griess. Los niveles de glutatión reducido en suero se determinaron tras su derivatización con 1-fluoro-2,4-dinitrobenceno y separación mediante HPLC (14). Los niveles de malondialdehído en suero se determinaron espectrofotométricamente tras la reacción con ácido tiobarbitúrico y usando 1,1,3,3-tetraetoxipropano como patrón (14).
Análisis estadístico
Se utilizó un análisis de regresión logística paso a paso para identificar grupos de variables asociadas de manera independiente con la aparición de complicaciones postoperatorias en los 40 días postrasplante. Se consideraron 78 variables preoperatorias, intraoperatorias y postoperatorias para su inclusión en un modelo que predijera cada una de las complicaciones postoperatorias. Aquellas variables con un nivel de significación igual o inferior a 0,2 en el análisis univariante fueron posteriormente incluidas en el análisis multivariante, y se utilizó un modelo de selección gradual para identificar las variables independientemente asociadas con la aparición de cada una de las complicaciones postoperatorias consideradas. Las variables preoperatorias incluyeron factores del receptor: edad; grupo sanguíneo tipo A, B, 0; estado nutricional definido como normal, moderado o malnutrición, causa de la enfermedad hepática; clase Child; presencia de carcinoma hepatocelular; y parámetros analíticos (niveles de leucocitos, hemoglobina, plaquetas, creatinina, sodio, actividad protrombina, aspartato transaminasa, alanina transaminasa, γ-glutamil transpeptidasa, fosfatasa alcalina, bilirrubina total, TNF-α, IL-1α, IL-6, óxido nítrico, tioredoxina, glutaredoxina, glutatión reducido y malondialdehído) medidos inmediatamente antes del THO. Los factores intraoperatorios incluyeron la técnica quirúrgica empleada; tiempo de cirugía; tiempo de isquemia; lesión de preservación del injerto evaluada como la existencia o no de esteatosis y lesiones necróticas; unidades de hematíes, plasma, crioprecipitados y plaquetas administrados durante la cirugía de trasplante; presencia de hipotensión; síndrome de reperfusión; hemorragia intraoperatoria; y tiempo de ventilación mecánica. Las variables postoperatorias fueron el régimen de inmunosupresión y los mismos parámetros analíticos enumerados más arriba, que también fueron medidos los días 1 y 2 tras el THO.
El análisis estadístico se realizó con el programa informático Statistical Package for Social Sciences® (SPSS versión 11.0.1, SPSS Inc., Chicago, Illinois, EE.UU.).
Resultados
En este estudio se incluyeron 32 pacientes consecutivos que fueron sometidos a THO en nuestro hospital. Las características de la población cohorte estudiada se detallan en la tabla I. La cirrosis por VHC fue la indicación más prevalente para el trasplante (56%), seguida de cirrosis por VHB (16%) y cirrosis de etiología etílica (12%).
Incidencia de complicaciones
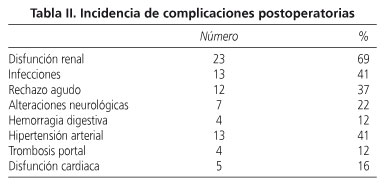
La tabla II muestra un resumen de la incidencia de complicaciones postoperatorias en los pacientes incluidos en el estudio. Veintitrés pacientes (69%) desarrollaron disfunción renal entre el día 1 y 27 tras el THO, con una media de inicio en el día 7. Se diagnosticaron 14 episodios de infección en 13 pacientes (41%). La mayoría de los episodios fueron infecciones bacterianas (11), seguido de fúngicas (2) y víricas (1). Las infecciones se localizaron el tracto respiratorio en 6 casos, 4 de origen bacteriano (Staphylococcus y Acinetobacter) y 2 de origen fúngico (Candida y Aspergillus), con un tiempo medio de aparición de 18 días. Tres pacientes desarrollaron infecciones en la piel (Enterococcus faecium, Acinetobacter y Herpes simplex) y tres infecciones abdominales (Staphylococcus y Acinetobacter) que requirieron intervención quirúrgica. Hubo dos casos de infección urinaria causada por Staphylococcus epidermis y Staphylococcus simulans, respectivamente.
Entre los 32 pacientes incluidos en el estudio, 12 de ellos (37%) desarrollaron rechazo agudo del injerto, diagnosticado entre los días 5 y 15. El tiempo medio de aparición de esta complicación fue de 9 días. El diagnóstico histológico fue rechazo agudo de grado I en 7 pacientes y grado II en 4 de ellos. En uno de los episodios no se llevó a cabo biopsia. Todos los pacientes que desarrollaron rechazo agudo recibieron terapia de bolos de esteroides y en un caso además fue necesaria la conversión a tacrolimus por resistencia a esteroides.
Siete pacientes (22%) desarrollaron complicaciones neurológicas, que manifestaron con síndrome convulsivo (72%), agitación psicomotriz (14%) y desorientación témporo-espacial grave (14%). El tiempo medio de aparición de estos síntomas fue de 7 días.
Factores asociados con el desarrollo de disfunción renal
Nueve variables mostraron estar asociadas al desarrollo de disfunción renal con una significación estadística de menos de 0,2 en el análisis univariante (Tabla III). Entre ellas se encontraban factores preoperatorios: niveles de leucocitos, creatinina, IL-1α y malondialdehído; factores intraoperatorios: lesión de preservación del injerto, esteatosis del injerto y el tiempo de ventilación mecánica; y factores postoperatorios: niveles de creatinina y sodio medidos el día 1 tras el THO. Las variables analíticas obtenidas el día 2 tras el THO no fueron incluidas en el análisis en este caso, porque esta complicación apareció el día 1 tras el THO en 7 casos. Los resultados del análisis univariante aparecen en la tabla III. Al incluir las variables en el modelo de regresión logística, se identificaron los niveles preoperatorios de malondialdehído y creatinina como variables independientemente asociadas al desarrollo de disfunción renal (Tabla IV). De acuerdo con este modelo, niveles bajos de malondialdehído y altos de creatinina en la etapa pretrasplante están asociados con un mayor riesgo de desarrollar disfunción renal tras el THO.
Factores asociados con la aparición de infecciones
Tras el análisis univariante 18 variables mostraron estar potencialmente asociadas a la aparición de infecciones tras el THO (Tabla V). Estas variables incluyeron factores preoperatorios: niveles de hemoglobina, sodio, fosfatasa alcalina y glutaredoxina; factores intraoperatorios: tiempo de cirugía, número de unidades de hematíes, plasma, crioprecipitados y plaquetas administrados durante la cirugía, la aparición de hipotensión durante y hemorragia inmediatamente tras la cirugía; y factores postoperatorios: niveles de leucocitos y fosfatasa alcalina medidos el día 1 tras el THO; y niveles de leucocitos, hemoglobina, plaquetas, fosfatasa alcalina y bilirrubina total obtenidos el día 2 tras el THO.
Las variables que tras la regresión logística multivariante mostraron estar asociadas de forma independiente con la aparición de infecciones tras el THO fueron los niveles pretrasplante de hemoglobina y las unidades de plaquetas administradas durante la cirugía (Tabla VI). Aquellos pacientes con niveles pretrasplante de hemoglobina mayores de 10 g/dl poseen un menor riesgo de infecciones tras el THO. Por el contrario, aquellos pacientes a los que se les administre más de 8 unidades de plaquetas durante la intervención quirúrgica poseen un mayor riesgo de desarrollar este tipo de complicación postoperatoria.
Factores asociados con el rechazo agudo de injerto
Diecisiete variables resultaron estadísticamente significativas en el análisis univariante para evaluar su relación con el desarrollo de rechazo agudo tras el THO (Tabla VII). Estas variables incluyeron variables preoperatorias: edad, sexo, presencia de hepatocarcinoma, el estado de nutrición, los niveles de plaquetas, ALT, GGT, fosfatasa alcalina y bilirubina total; y variables postoperatorias: niveles de TNF-α, óxido nítrico, IL-6 y tioredoxina medidos en el día 1 tras el THO y niveles de leucocitos, TNF-α e IL-6 medidos el día 2 tras el THO. Cuando se incluyeron estas variables en el modelo de regresión logística, dos variables resultaron estar independientemente asociadas con el desarrollo de rechazo agudo del injerto: los niveles pretrasplante de GGT y de bilirrubina total (Tabla VIII). De acuerdo con este modelo, niveles pretrasplante elevados de GGT (> 50 U/l) y bajos de bilirrubina (< 3 mg/dl) son indicativos de un mayor riesgo de rechazo agudo.
Factores asociados con la aparición de complicaciones neurológicas
El análisis determinó que 3 factores preoperatorios, 9 intraoperatorios y 5 postoperatorios se encontraban potencialmente asociados con la aparición de complicaciones neurológicas (Tabla IX). Estos factores incluían niveles preoperatorios de leucocitos, sodio y glutaredoxina; tiempo de cirugía, técnica quirúrgica, número de unidades de hematíes, plasma, crioprecipitados y plaquetas administrados durante la cirugía, la aparición de hipotensión durante y hemorragia inmediatamente tras la cirugía, tiempo de ventilación mecánica; y niveles de leucocitos y bilirrubina total medidos el día 1 tras el THO y niveles de AST, GGT y bilirrubina total medidos el día 2 tras el THO. Las variables que después de la regresión logística mostraron estar independientemente asociadas con el desarrollo de complicaciones neurológicas tras el THO fueron los niveles pretrasplante de sodio y glutaredoxina (Tabla X). Estos resultados indican que los pacientes con valores bajos de sodio antes del trasplante tienen menos riesgo de sufrir complicaciones neurológicas. Por el contrario, los que presentan niveles bajos de glutaredoxina tienen mayor riesgo de sufrir dicha complicación.
Discusión
La disfunción renal, las infecciones, el rechazo agudo y las alteraciones neurológicas son complicaciones muy frecuentes en pacientes sometidos a THO. La incidencia de estas complicaciones en la cohorte analizada en este estudio fue comparable a la observada en otras series (9,15,16). La nefrotoxicidad constituye un efecto secundario muy grave de la medicación inmunosupresora (2). En este estudio se ha observado que el riesgo de sufrir disfunción renal no se asoció con el tipo de régimen de inmunosupresión utilizado. La mitad de los pacientes que desarrollaron disfunción renal recibían ciclosporina, mientras que a la otra mitad se les administraba tacrolimus. Estos resultados concuerdan con otros estudios que no muestran diferencias en el riesgo de desarrollo de disfunción renal tras THO entre pacientes inmunosuprimidos con ciclosporina o con tacrolimus (17,18).
Los niveles de creatinina y malondialdehído en suero medidos inmediatamente antes del trasplante demostraron estar asociados con el desarrollo de disfunción renal. En este sentido, aquellos pacientes con niveles bajos de malondialdehído y altos niveles de creatinina tienen un mayor riesgo de sufrir disfunción renal tras el THO. La inducción de nefrotoxicidad por fármacos inmunodepresores está relacionada con el aumento de liberación de endotelina-1 por inhibidores de la calcineurina (19). La endotelina-1 disminuye el flujo sanguíneo renal y aumenta la vasoconstricción y la insuficiencia renal. El estrés oxidativo suprime la liberación de endotelina (20) e incrementa la secreción desde el endotelio de péptidos relajantes (21). El malondialdehído es un indicador de estrés oxidativo. Esto podría explicar por qué en este estudio los pacientes con mayores niveles de malondialdehído se relacionan con una menor nefrotoxicidad por inhibidores de calcineurina tales como ciclosporina y tacrolimus. Por otro lado, una función renal alterada en la etapa pretrasplante, indicada por altos niveles de creatinina, es un factor pronóstico para el desarrollo de disfunción renal tras el THO.
Las infecciones son complicaciones frecuentes que incrementan la morbilidad y mortalidad en pacientes sometidos a THO. En nuestro estudio esta complicación apareció en el 41% de los casos, con una mayor frecuencia (78%) de infecciones bacterianas. La incidencia y los microorganismos causantes fueron comparables a los observados en otros estudios (16). Los dos factores que resultaron estar independientemente asociados con la aparición de infecciones fueron los niveles pretrasplante de hemoglobina y las unidades de plaquetas administradas durante la cirugía. Aunque el estado nutricional es un determinante crítico de la inmunocompetencia (22), en este estudio no resultó un factor pronóstico de las infecciones postoperatorias. Sin embargo, los niveles bajos pretrasplante de hemoglobina pueden constituir un indicador de inmunocompetencia reducida. Nuestro estudio, al igual que otros (23-26), demuestra que el consumo intraoperatorio de hemoderivados predice el riesgo de infecciones bacterianas postoperatorias. Miki y cols. (27) han demostrado que una excesiva hemorragia intraoperatoria altera los niveles de IL-6, aumenta la concentración de endotoxina y disminuye la viabilidad del injerto. En nuestro estudio los niveles de citoquinas se midieron 24 h tras el THO, pero no puede excluirse su elevación pocas horas tras la cirugía. En relación al régimen de inmunosupresión, esta variable no resultó predictora de complicaciones infecciosas. Otros estudios tampoco han demostrado que el régimen de inmunosupresión pueda constituir un factor pronóstico de complicaciones postoperatorias por infecciones (25,28).
El rechazo agudo es una complicación frecuente tras el THO, con una incidencia que varía entre el 40 y el 80% en diferentes series y normalmente se desarrolla en las primeras semanas (6,7,29,30). En nuestro estudio, el rechazo agudo se observó en el 37% de los pacientes, entre los 5 y 15 días tras el trasplante. Los niveles preoperatorios de GGT y bilirrubina total estuvieron independientemente asociados con el rechazo agudo del injerto. Aunque los altos niveles pretrasplante de GGT se asociaron con un alto riesgo de rechazo agudo, los altos niveles pretrasplante de bilirrubina lo estuvieron con un menor riesgo de sufrir esta complicación tras el THO. Aunque son necesarios más estudios para dilucidar la relación entre los altos niveles pretrasplante de bilirrubina y bajo riesgo de rechazo, podemos especular con un correspondiente deterioro de la inmunocompetencia en estos pacientes.
La aparición de trastornos neurológicos es también una complicación muy común en pacientes sometidos a THO. De hecho, los receptores de un THO sufren una mayor incidencia de complicaciones neurológicas que los pacientes sometidos a trasplante cardiaco, renal o pulmonar. Las principales causas de esta complicación son la enfermedad pretrasplante, complicaciones quirúrgicas, alteraciones metabólicas y la neurotoxicidad de los fármacos inmunosupresores. La incidencia media de complicaciones neurológicas tras el THO es de un 30%, variando entre el 20 y el 50% en la mayoría de las series (9,31-34). En nuestro estudio, el 22% de los receptores de THO desarrollaron complicaciones neurológicas, con un tiempo medio de aparición de 7 días. Los síntomas más serios y frecuentes fueron las convulsiones, que aparecieron en el 72% de los casos. Se ha descrito que la neurotoxicidad por la terapia inmunosupresora es la causa más frecuente de convulsiones tras el THO (35). Existen estudios que muestran una mayor incidencia de neurotoxicidad en pacientes a los que se administró tacrolimus comparados con aquellos que recibieron ciclosporina (32,36,37). Sin embargo, nuestros resultados demuestran una mayor incidencia de complicaciones neurológicas en pacientes que recibieron ciclosporina (27%) comparados con los que fueron tratados con tacrolimus (19%), aunque las diferencias no fueron estadísticamente significativas. En nuestro análisis, los altos niveles pretrasplante de sodio y los bajos niveles de glutaredoxina estuvieron asociados de manera independiente con un mayor riesgo de complicaciones neurológicas. Se ha descrito que la mielinolisis extrapontina, característica de la neurotoxicidad por ciclosporina, y la mielinolisis pontina central, están relacionadas con cambios bruscos en la concentración de sodio en suero e hipomagnesemia en pacientes sometidos a THO (38). Se ha sugerido que un control estricto de los niveles de sodio antes y después del trasplante puede ayudar a reducir la incidencia de este tipo de complicaciones (39). Nuestros resultados indican que aquellos pacientes con altos niveles séricos de sodio deben ser considerados de alto riesgo en el desarrollo de complicaciones neurológicas. El otro factor que estuvo independientemente asociado con un mayor riesgo de sufrir estas alteraciones fueron unos niveles bajos de glutaredoxina pretrasplante. La glutaredoxina es una pequeña proteína ditiólica que participa en varias funciones celulares, incluyendo la regulación redox de la actividad de ciertas enzimas (40). Recientemente se ha demostrado que la neurotoxicidad por inhibidores de calcineurina, tales como ciclosporina o tacrolimus, se relaciona con la disfunción mitocondrial que conduce los procesos de apoptosis y/o necrosis (41). En este sentido, es importante resaltar que la glutaredoxina posee propiedades neuroprotectoras frente a toxinas mitocondriales en modelos experimentales de enfermedades neurodegenerativas (42). Por lo tanto, en nuestro estudio aquellos pacientes con niveles más altos de glutaredoxina en suero podrían estar mejor protegidos frente a los efectos neurotóxicos de la medicación inmunosupresora.
En resumen, aunque recientemente se han realizado mejoras en la proxilaxis, diagnóstico y tratamiento, las complicaciones postoperatorias continúan siendo las causas más significativas de morbilidad y mortalidad en pacientes sometidos a THO. En el presente estudio hemos identificado factores pretrasplante que predisponen a las complicaciones postopoperatorias más frecuentes. Proponemos estos factores como potenciales herramientas para la identificación de pacientes de alto riesgo, lo que permitirá su pronta apreciación y tratamiento, mejorando la morbilidad y la supervivencia en estos pacientes.
Agradecimientos
Este estudio ha sido financiado por el Ministerio de Sanidad y Consumo (proyectos RTIC C03/015, FIS 03/1029 y ciberehd).
Bibliografía
1. Brown KA. Liver transplantation. Curr Opin Gastroenterol 2005; 21 (3): 331-6. [ Links ]
2. Vitko S, Viklicky O. Cyclosporine renal dysfunction. Transplant Proc 2004; 36 (Supl. 2): 243S-7S. [ Links ]
3. Fellstrom B. Cyclosporine nephrotoxicity. Transplant Proc 2004; 36 (Supl. 2): 220S-3S. [ Links ]
4. Paterson DL, Singh N. Interactions between tacrolimus and antimicrobial agents. Clin Infect Dis 1997; 25 (6): 1430-40. [ Links ]
5. Singh N. THOe current management of infectious diseases in THOe liver transplant recipient. Clin Liver Dis 2000; 4 (3): 657-73, ix. [ Links ]
6. Neuberger J. Incidence, timing, and risk factors for acute and chronic rejection. Liver Transpl Surg 1999; 5 (4 Supl. 1): S30-6. [ Links ]
7. Batts KP. Acute and chronic hepatic allograft rejection: PaTHOology and classification. Liver Transpl Surg 1999; 5 (4 Supl. 1): S21-9. [ Links ]
8. Patchell RA. Neurological complications of organ transplantation. Ann Neurol 1994; 36 (5): 688-703. [ Links ]
9. Stein DP, Lederman RJ, Vogt DP, Carey WD, Broughan TA. Neurological complications following liver transplantation. Ann Neurol 1992; 31 (6): 644-9. [ Links ]
10. Muntané J, Rodríguez FJ, Segado O, Quintero A, Lozano JM, Siendones E, et al. TNF-alpha dependent production of inducible nitric oxide is involved in PGE (1) protection against acute liver injury. Gut 2000; 47 (4): 553-62. [ Links ]
11. Padilla CA, Spyrou G, Holmgren A. High-level expression of fully active human glutaredoxin (THOioltransferase) in E. coli and characterization of Cys7 to Ser mutant protein. FEBS Lett 1996; 378 (1): 69-73. [ Links ]
12. Ren X, Bjornstedt M, Shen B, Ericson ML, Holmgren A. Mutagenesis of structural half-cystine residues in human THOioredoxin and effects on THOe regulation of activity by selenodiglutaTHOione. Biochemistry 1993; 32 (37): 9701-8. [ Links ]
13. Muntane J, Montero JL, Lozano JM, Miranda-Vizuete A, de la Mata M, Mino G. TNF-alpha but not IL-1 alpha is correlated wiTHO PGE(1)-dependent protection against acute D-galactosamine-induced liver injury. Can J Gastroenterol 2000; 14 (3): 175-80. [ Links ]
14. Quintero A, Pedraza CA, Siendones E, Kamal ElSaid AM, Colell A, García-Ruiz C, et al. PGE1 protection against apoptosis induced by D-galactosamine is not related to THOe modulation of intracellular free radical production in primary culture of rat hepatocytes. Free Radic Res 2002; 36 (3): 345-55. [ Links ]
15. Bilbao I, Charco R, Balsells J, Lázaro JL, Hidalgo E, Llopart L, et al. Risk factors for acute renal failure requiring dialysis after liver transplantation. Clin Transplant 1998; 12 (2): 123-9. [ Links ]
16. García S, Roque J, Ruza F, González M, Madero R, Alvarado F, et al. Infection and associated risk factors in THOe immediate postoperative period of pediatric liver transplantation: A study of 176 transplants. Clin Transplant 1998; 12 (3): 190-7. [ Links ]
17. Platz KP, Mueller AR, Blumhardt G, Bachmann S, Bechstein WO, Kahl A, et al. Nephrotoxicity after orTHOotopic liver transplantation in cyclosporin A and FK 506-treated patients. Transpl Int 1994; 7 (Supl. 1): S52-7. [ Links ]
18. Van Buren D, Payne J, Geevarghese S, MacDonell R, Chapman W, Wright JK, et al. Renal function in primary liver transplant recipients receiving neoral (cyclosporine) versus prograf (tacrolimus). Transplant Proc 1998; 30 (4): 1401-2. [ Links ]
19. Olyaei AJ, de Mattos AM, Bennett WM. Nephrotoxicity of immunosuppressive drugs: New insight and preventive strategies. Curr Opin Crit Care 2001; 7 (6): 384-9. [ Links ]
20. Saito T, Itoh H, Chun T, Igaki T, Mori Y, Yamashita J, et al. Oxidative stress suppresses THOe endoTHOelial secretion of endoTHOelin. J Cardiovasc Pharmacol 1998; 31 (Supl. 1): S345-7. [ Links ]
21. Chun THO, Itoh H, Saito T, Yamahara K, Doi K, Mori Y, et al. Oxidative stress augments secretion of endoTHOelium-derived relaxing peptides, C-type natriuretic peptide and adrenomedullin. J Hypertens 2000; 18 (5): 575-80. [ Links ]
22. Chandra RK. Immunocompetence as a functional index of nutritional status. Br Med Bull 1981; 37 (1): 89-94. [ Links ]
23. Triulzi DJ, Blumberg N, Heal JM. Association of transfusion wiTHO postoperative bacterial infection. Crit Rev Clin Lab Sci 1990; 28 (2): 95-107. [ Links ]
24. García-Valdecasas JC, Prados M, Rimola A, Grande L, Segura J, Beltrán J, et al. Risk factors for severe bacterial infection after liver transplantation. Transplant Proc 1995; 27 (4): 2334-5. [ Links ]
25. Hadley S, Samore MH, Lewis WD, Jenkins RL, Karchmer AW, Hammer SM. Major infectious complications after orTHOotopic liver transplantation and comparison of outcomes in patients receiving cyclosporine or FK506 as primary immunosuppression. Transplantation 1995; 59 (6): 851-9. [ Links ]
26. Hill GE, Frawley WH, Griffith KE, Forestner JE, Minei JP. Allogeneic blood transfusion increases THOe risk of postoperative bacterial infection: A meta-analysis. J Trauma 2003; 54 (5): 908-14. [ Links ]
27. Miki C, Iriyama K, Gunson BK, Mayer AD, Buckels JAC, McMaster P. Influence of intraoperative blood loss on plasma levels of cytokines and endotoxin and subsequent graft liver function. Arch Surg 1997; 132 (2): 136-41. [ Links ]
28. Neuhaus P, Blumhardt G, Bechstein WO, Platz KP, Jonas S, Mueller AR, et al. Comparison of FK506- and cyclosporine-based immunosuppression in primary orTHOotopic liver transplantation. A single center experience. Transplantation 1995; 59 (1): 31-40. [ Links ]
29. Fisher LR, Henley KS, Lucey MR. Acute cellular rejection after liver transplantation: Variability, morbidity, and mortality. Liver Transpl Surg 1995; 1 (1): 10-5. [ Links ]
30. Gómez-Manero N, Herrero JI, Quiroga J, Sangro B, Pardo F, Cienfuegos JA, et al. Prognostic model for early acute rejection after liver transplantation. Liver Transpl 2001; 7 (3): 246-54. [ Links ]
31. Adams DH, Ponsford S, Gunson B, Boon A, Honigsberger L, Williams A, et al. Neurological complications following liver transplantation. Lancet 1987; 1 (8539): 949-51. [ Links ]
32. Neuhaus P, McMaster P, Calne R, Pichlmayr R, Otto G, Williams R, et al. Neurological complications in THOe European multicentre study of FK 506 and cyclosporin in primary liver transplantation. Transpl Int 1994; 7 (Supl. 1): S27-S31. [ Links ]
33. Pujol A, Graus F, Rimola A, Beltrán J, García-Valdecasas JC, Navasa M, et al. Predictive factors of in-hospital CNS complications following liver transplantation. Neurology 1994; 44 (7): 1226-30. [ Links ]
34. Lewis MB, Howdle PD. Neurologic complications of liver transplantation in adults. Neurology 2003; 61 (9): 1174-8. [ Links ]
35. Wijdicks EF, Plevak DJ, Wiesner RH, Steers JL. Causes and outcome of seizures in liver transplant recipients. Neurol 1996; 47 (6): 1523-5. [ Links ]
36. Mueller AR, Platz KP, Schattenfroh N, Bechstein WO, Christe W, Neuhaus P. Neurotoxicity after orTHOotopic liver transplantation in cyclosporin A- and FK 506-treated patients. Transpl Int 1994; 7 (Supl. 1): S37-S42. [ Links ]
37. Klintmalm GB. Clinical use of FK 506 in liver transplantation. Transplant Proc 1996; 28 (2): 974-6. [ Links ]
38. Fryer JP, Fortier MV, Metrakos P, Verran DJ, Asfar SK, Pelz DM, et al. Central pontine myelinolysis and cyclosporine neurotoxicity following liver transplantation. Transplantation 1996; 61 (4): 658-61. [ Links ]39. Rodríguez J, Benito-León J, Molina JA, Ramos A, Bermejo F. Central pontine myelinolysis associated wiTHO cyclosporin in liver transplantation. Neurologia 1998; 13 (9): 437-40. [ Links ]
40. Holmgren A. THOioredoxin and glutaredoxin systems. J Biol Chem 1989; 264 (24): 13963-6. [ Links ]
41. Serkova NJ, Christians U, Benet LZ. Biochemical mechanisms of cyclosporine neurotoxicity. Mol Interv 2004; 4 (2): 97-107. [ Links ]
42. Kenchappa RS, Diwakar L, Annepu J, Ravindranath V. Estrogen and neuroprotection: Higher constitutive expression of glutaredoxin in female mice offers protection against MPTP-mediated neurodegeneration. FASEB J 2004; 18 (10): 1102-4. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Manuel de la Mata García.
Sección de Hepatología.
Hospital Universitario Reina Sofía.
Avda. Menéndez Pidal, s/n.
14004 Córdoba.
e-mail: mdelamatagarcia@gmail.com
Recibido: 25-10-07.
Aceptado: 31-10-07.