Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.100 no.6 Madrid jun. 2008
Hallazgos colonoscópicos del estudio piloto de cribado de cáncer colorrectal realizado en Cataluña
Colonoscopic findings from a pilot screening study for colorectal cancer in Catalonia
M. Navarro1,2, M. Peris1,2, G. Binefa1,2, J. M. Nogueira2,3, J. M. Miquel2,3, J. A. Espinás4, J. M. Borrás4 y el Grupo Catalán del Programa Piloto en Cribado de Cáncer Colorrectal
1Servicio de Prevención y Control del Cáncer. Institut Català d'Oncologia. L'Hospitalet de Llobregat, Barcelona.
2Instituto de Investigación Biomédica de Bellvitge (IDIBELL). L'Hospitalet de Llobregat, Barcelona.
3Servicio de Gastroenterología. Hospital Universitario de Bellvitge. L'Hospitalet de Llobregat, Barcelona.
4Plan Director de Oncología. Departament de Salut. Generalitat de Catalunya
Dirección para correspondencia
RESUMEN
Objetivo: evaluar las lesiones detectadas en las dos rondas ya finalizadas del Programa Piloto de Cribado en Cáncer Colorrectal (CCR) llevado a cabo en L'Hospitalet de Llobregat (Barcelona).
Material y métodos: el programa de cribado de CCR se inició en el año 2000. La población, comprendida entre 50 y 69 años residentes en el área, fue invitada a participar a través de la determinación bienal de sangre oculta en heces mediante el test guaiaco y colonoscopia en los participantes con test positivo. Se realizó polipectomía de las lesiones detectadas o biopsias cuando no era posible la extirpación. Los pólipos se clasificaron según criterios de la Organización Mundial de la Salud.
Resultados: se realizaron 442 colonoscopias de los 495 test positivos. En 213 individuos, se detectaron: 36 cánceres invasivos, 121 adenomas de alto riesgo, 29 adenomas de bajo riesgo y 27 pólipos hiperplásicos. En el 25,8% de los casos, el tamaño de los adenomas fue < 10 mm. La mayoría de las lesiones diagnosticadas (37,2%) estaban localizadas en el colon distal, el 5,7% a nivel proximal y ambas localizaciones en el 5,2%. Las neoplasias avanzadas se asociaron significativamente al sexo masculino y la localización distal. La prevalencia de neoplasias avanzadas a nivel proximal entre los pacientes sin pólipos distales fue del 5,1%.
Conclusiones: los adenomas de alto riesgo de localización distal han sido las lesiones detectadas con mayor frecuencia. El cribado poblacional mediante la determinación de sangre oculta en heces es un método factible para detectar pequeñas lesiones precancerosas, factor clave para disminuir la incidencia de CCR.
Palabras clave: Cáncer colorrectal. Programa de cribado. Riesgo poblacional. Test de sangre oculta en heces. Test guaiaco. Neoplasia avanzada.
ABSTRACT
Objective: to evaluate lesions detected in two screening rounds performed in a pilot screening program for colorectal cancer in Catalonia, Spain.
Material and methods: a colorectal cancer screening program was initiated in 2000. The target population included men and women aged 50-69 years. Screening consisted of biennial guaiac-based fecal occult blood testing (FOBT), and colonoscopy for participants with a positive FOBT. Any polyps found were removed, and biopsies were performed for any masses.
Results: Colonoscopies were performed in 442 of 495 people with positive FOBT. In 213 (48.2%), 36 invasive cancers, 121 high-risk adenomas, 29 low-risk adenomas, and 27 hyperplastic polyps were diagnosed. Lesion size was smaller than 10 mm in 25.8% of cases. Most detected lesions (37.2%) were located in the distal colon, followed by the proximal colon (5.7%) and both locations (5.2%). Advanced neoplasm was significantly associated with male gender and distal location. The prevalence of advanced proximal neoplasms among patients with no distal polyps was 5.1%.
Conclusions: the most common lesions detected by colonoscopy were high-risk adenomas located in the distal colon. FOBT is a suitable method for detecting small precancer lesions during population screening, and is thus a key factor in reducing the incidence of colorectal cancer.
Key words: Colorectal cancer. Screening program. Average risk. Fecal occult blood test. Guaiac test. Advanced neoplasm.
Introducción
El cáncer colorrectal (CCR) es la tercera causa más frecuente de cáncer en el mundo después del cáncer de pulmón y el de mama (1). En el año 2006, fue el segundo más frecuente diagnosticado en Europa teniendo en cuenta ambos sexos y el segundo en mortalidad después del cáncer de pulmón (2). La tendencia reciente del CCR en España muestra un modelo similar a la mayoría de países europeos, no sólo en incidencia sino también en tasas de mortalidad (3).
Uno de los avances más importantes en los últimos años ha sido el reconocimiento de que la mayoría de los casos de CCR ocurre de una manera escalonada, a través de alteraciones genéticas que controlan la replicación, diferenciación, apoptosis celular, así como los mecanismos de reparación del ADN (4). El CCR es una enfermedad susceptible de cribado, dada su historia natural conocida, representa un problema de salud pública por su elevada incidencia y mortalidad, se dispone de métodos diagnósticos que permiten detectar la enfermedad en fases iniciales o premalignas (5) y el pronóstico es favorable cuando se trata en estadios precoces (6).
El objetivo principal del cribado de CCR es la reducción de la mortalidad mediante el diagnóstico de la enfermedad en fase más precoz (7,8). Existe consenso a nivel internacional sobre la importancia del cribado de CCR en la población sin factores de riesgo a partir de los 50 años (5,9). Sin embargo, las guías de cribado publicadas no se ponen de acuerdo en el método mejor de cribado (9,10). La eficacia de la prueba de detección de sangre oculta en heces (SOH) mediante el test guaiaco ha sido ampliamente demostrada en ensayos clínicos randomizados (7,11,12), con una reducción estimada de la mortalidad por CCR que oscila entre el 15 y 33%. El seguimiento de uno de esos ensayos randomizados ha demostrado también que el test reduce la incidencia de CCR (8). La recomendación de sigmoidoscopia flexible como prueba de cribado (13) se basa en el estudio de The Veterans' Affairs Cooperative Study Group (14), en el que el test de SOH positivo se relacionó con el 24% de los CCR y el 7% de los adenomas. Sin embargo, la efectividad del cribado mediante sigmoidoscopia para detectar neoplasias avanzadas de localización proximal dependerá de la asociación entre adenomas proximales y distales y el porcentaje de pacientes con lesiones sólo a nivel proximal.
La Unión Europea, en base a los estudios realizados en Reino Unido (11), Dinamarca (15), Francia (16) e Italia (17), recomendó en el año 2000 a todos sus estados miembros la implementación del cribado de CCR en la población comprendida entre los 50 y 74 años (18). Ese mismo año, el Departament de Salut de la Generalitat de Cataluña puso en marcha un estudio piloto para conocer la viabilidad y aceptación por parte de la población de un programa de cribado de CCR mediante la determinación de SOH. Presentamos el análisis realizado de las lesiones detectadas en las dos rondas llevadas a cabo hasta el momento actual, en función de su localización y distribución por edad y sexo.
Métodos
El programa piloto de cribado de CCR está dirigido a la población comprendida entre 50 y 69 años residentes en L'Hospitalet, ciudad de 239.000 habitantes del área metropolitana de Barcelona. El protocolo ha sido descrito en una publicación previa (19). En la primera ronda realizada entre febrero de 2000 y abril de 2002, participaron 11.011 personas de las 63.880 invitadas. En la segunda ronda realizada entre febrero de 2003 y marzo de 2005, participaron 14.818 de las 66.534 personas invitadas.
Como prueba de cribado, se utilizó la determinación de sangre oculta en heces mediante el test guaiaco (TSOH), que consiste en recoger 2 muestras de heces de 3 deposiciones diferentes sin restricción dietética inicial. Si se detectaba la presencia de sangre en menos de 5 muestras (resultado débil positivo), se aconsejaba repetir el test con restricción dietética. Cuando 5 ó 6 muestras eran positivas en el test inicial o cualquiera de las muestras tras su repetición con restricción dietética, se recomendaba colonoscopia bajo sedación. Durante dicha prueba, si no existía contraindicación médica, se procedía a la exéresis de los pólipos detectados, así como a la biopsia de las masas halladas o bien de aquellos pólipos no tributarios de exéresis endoscópica. Se documentó la localización y tamaño de las lesiones extirpadas. En los casos con más de un pólipo, se tuvo en cuenta la lesión más avanzada en términos patológicos. Se denominó localización proximal a todas las lesiones detectadas en la zona intestinal comprendida entre el inicio del colon transverso y el ciego; distal, a las lesiones localizadas en el colon izquierdo (ángulo esplénico, colon descendente y sigma); y recto a la porción intestinal localizada a menos de 15 cm del margen anal.
Para la clasificación histológica de los pólipos, se utilizaron los criterios de la Organización Mundial de la Salud (20). Un adenoma de alto riesgo (AAR) fue definido como cualquier pólipo adenomatoso de tamaño superior a 10 mm o más de 2 adenomas, presencia de histología tubulovellosa o vellosa y/o presencia de displasia de alto grado. Se consideraron adenomas de bajo riesgo (ABR) las lesiones de menor tamaño con histología tubular y displasia de bajo grado. Los carcinomas in situ fueron clasificados como AAR. Las neoplasias avanzadas incluyeron el cáncer invasivo y los AAR. Todos los casos de cáncer invasivo detectados fueron remitidos a un comité interdisciplinar para tratamiento oncológico adecuado, estadiándose según el sistema TNM (21). El programa prevé colonoscopias de seguimiento para aquellos sujetos con adenomas detectados en el cribado. El intervalo de las mismas varía en función de la radicalidad del procedimiento endoscópico y del tipo de adenoma detectado (22).
Las diferencias entre variables categóricas fueron comparadas con el test Chi cuadrado y las diferencias en la detección de neoplasias avanzadas mediante regresión logística. Los resultados se expresaron como odds ratio (OR) con intervalos de confianza del 95% (IC 95%). Las diferencias fueron consideradas estadísticamente significativas con una p < 0,05. Todos los análisis se llevaron a cabo mediante los programas Stata®, versión 9.2 de (StataCorp, College Station, TX, EE.UU.) y SPSS® (versión 13.0 para Windows).
Resultados
Se realizó un total de 25.829 test de SOH en 18.405 individuos (8.389 hombres y 10.016 mujeres), 7.424 personas fueron cribadas en las 2 rondas. El porcentaje global de test positivos fue del 3,4% en la primera ronda y del 0,8% en la segunda.
Se realizaron colonoscopias en 442 de los 495 participantes con TSOH positivo (334 de la primera ronda y 108 de la segunda). La colonoscopia fue normal en 229 sujetos, 185 (55,4%) de la primera ronda y 44 (40,7%) de la segunda, detectándose 410 lesiones en 213 individuos (48,2%). Los pacientes fueron clasificados según la histología más avanzada de las lesiones encontradas en: 36 (8,1%) de cáncer invasivo, 121 (27,4%) AAR, 29 (6,6%) ABR y en 27 (6,1%) participantes, el hallazgo más importante fue un pólipo hiperplásico. La tabla I muestra las características de las lesiones detectadas por ronda de cribado. Dada la diferencia entre las 2 rondas con respecto al número de colonoscopias que detectan alguna lesión, la proporción de neoplasias avanzadas diagnosticadas fue mayor en la segunda que en la primera (p < 0,001). El tipo histológico más común de los adenomas fue el tubulovelloso y el 25,8% de las lesiones extirpadas era de tamaño inferior a los 10 mm.
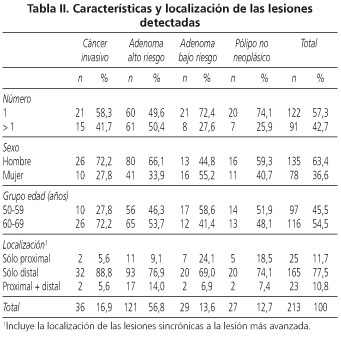
La tabla II resume las características de las lesiones detectadas en función del sexo, edad y localización. El cáncer invasivo fue detectado con mayor frecuencia en el grupo de edad comprendido entre 60-69 años. Se diagnosticó casi el doble de neoplasias avanzadas en el hombre con respecto a la mujer. Por localización, el 79,6% de las neoplasias avanzadas estaba en el colon distal (125 de 157), un 8,3% (13 de 157) en el colon proximal y un 12,1% (19 de 157) en ambas localizaciones. El 42,7% de los pacientes (91 de 213) tenía más de un pólipo, siendo los AAR las lesiones más avanzadas en el 67% (61 de 91). La tabla III muestra la distribución de pacientes con más de un pólipo detectado según edad, sexo y localización.
En la tabla IV se muestra la prevalencia de las neoplasias avanzadas proximales en función de los hallazgos en el colon distal. Entre los individuos sin lesiones distales (229 con colonoscopia de cribado normal y 25 con sólo pólipos proximales), la prevalencia de neoplasia avanzada proximal fue del 5,1% (IC 95% 2,4 a 7,8), incrementándose en los pacientes que tenían además una neoplasia avanzada distal al 6,9%. Cuando analizamos el riesgo de que una neoplasia avanzada proximal pudiera detectarse si sólo se examinara el colon distal, encontraríamos que el 45,8% (11 de 24) de los pacientes tendría al menos un adenoma en el colon distal y que esa lesión sería una neoplasia avanzada en el 41,7% de los casos (10 de 24 pacientes).
En el análisis bivariado, las neoplasias avanzadas se asociaron significativamente con el sexo masculino (OR: 1,93, IC 95% [1,03-3,60]) y la localización distal (OR: 2,33, IC 95% [1,05-5,15]). En el análisis multivariado, sólo la localización distal fue un factor de riesgo de las neoplasias avanzadas (OR: 2,48, IC 95% [1,10-1,59]) (Tabla V).
La distribución de los 36 cánceres invasivos por estadios (E) fue la siguiente: 15 E I (41,7%), 7 E II (19,4%), 10 E III (27,8%) y 4 E IV (11,1%). En la segunda ronda, se detectaron en estadios más precoces que en la primera con mayor número de E I (53,8 versus 34,8%) y menor de E III (15,4 versus 34,8%).
Discusión
El porcentaje de neoplasias avanzadas detectadas en nuestro estudio piloto no difiere de los obtenidos en ensayos randomizados ya publicados (7,11-12). Los puntos críticos de nuestros resultados en cuanto a participación y tasa de detección han sido recientemente analizados (19).
Aunque se acepta de manera general que el riesgo de CCR es similar en hombres que en mujeres, existen diferencias epidemiológicas importantes en función del sexo. La incidencia y mortalidad por edad es menor en mujeres que en hombres (1,23). Como en otros programas de cribado (13,24), la prevalencia de neoplasias avanzadas detectadas en nuestro estudio fue mayor en hombres que en mujeres. Es esperable que en un futuro podamos conocer si esa diferencia epidemiológica es suficientemente relevante como para determinar la mejor edad de inicio del cribado de CCR en función del sexo.
El mayor número de adenomas, comparado con cánceres invasivos en el grupo de edad comprendido entre los 50 y 59 años, es esperable en base a la secuencia adenoma-carcinoma en el desarrollo de la mayoría de CCR (4). En consonancia con otros estudios que utilizan el mismo test (11-12,25), se ha diagnosticado un porcentaje mayor de AAR con respecto a los ABR. La proporción de colonoscopias que detectan esas lesiones fue del 27,4% para los AAR y sólo del 6,6% para los ABR. Estos hallazgos sugieren una tendencia superior al sangrado por parte de las neoplasias avanzadas, por lo que la determinación de SOH puede seleccionar pólipos con mayor riesgo de progresar a carcinoma. La detección de adenomas de alto riesgo juega un papel incuestionable en la prevención de futuros CCR (26).
La asociación entre adenomas distales y proximales ha sido analizada en varios estudios publicados que utilizan la colonoscopia como prueba de cribado (24,27-30) y algunos de ellos han estimado el riesgo de detección de adenomas localizados a nivel proximal en aquellos pacientes en los que no se detectan lesiones en el colon distal. Existe una asociación clara entre la presencia de adenomas distales y adenomas proximales. Dicha asociación puede variar en función del tamaño de la muestra cribada, en la inclusión de pacientes con historia familiar de cáncer de colon (27) y, fundamentalmente, si se define el colon distal como la porción intestinal que puede visualizarse mediante una sigmoidoscopia o bien el segmento de colon cuyo límite superior es el ángulo esplénico (28,29). La prevalencia de neoplasias avanzadas proximales en nuestros pacientes y la probabilidad de tener adenomas en el colon distal son similares a los descritos en los estudios mencionados. Aunque nuestros resultados deben analizarse teniendo en cuenta que las colonoscopias sólo fueron realizadas en aquellos pacientes con TSOH positivo, trece de veinticuatro neoplasias avanzadas proximales (54,2%) no habrían sido detectadas si sólo se hubiera examinado el colon distal.
El cáncer invasivo se detectó en el 8,1% de las colonoscopias realizadas y en estadio más precoz de lo esperable para la población estudiada. Así, mientras que el 41,7% de los cánceres diagnosticados por cribado son estadios I, esta posibilidad es sólo del 11% en la población general de la misma zona según datos del registro hospitalario de cáncer del Hospital Universitario de Bellvitge, centro de referencia al que pertenece la población cribada (31). La tendencia al diagnóstico en estadio más precoz en la segunda ronda está acorde con los resultados de otras series (13,32) en las que el 50% del cáncer invasivo detectado se diagnostica en estadio I.
Los inconvenientes del test guaiaco han conducido a un aumento del cribado mediante colonoscopia. Las guías americanas reconocen que, aunque no hay estudios controlados randomizados, existen evidencias de que la colonoscopia es el mejor método de cribado para la detección de la mayoría de cánceres en estadios precoces y la resección de lesiones con potencial maligno (5). Si asumimos que el cribado de CCR ha de formar parte de los programas de prevención incluidos en nuestro sistema sanitario (18,33), deberán analizarse las cuestiones relacionadas con la colonoscopia, como son el coste, riesgos, adherencia de la población y capacidad de nuestro Sistema de Salud Público para asumir las originadas del cribado. A pesar de las cuestiones pendientes, un estudio llevado a cabo por el US Center for Disease Control and Prevention concluyó que el sistema sanitario en Estados Unidos sólo tiene capacidad suficiente para realizar cribado a toda su población a partir de 50 años mediante la determinación de SOH seguida de colonoscopia para los test positivos (34). Aunque la colonoscopia puede ser una opción en el cribado de cáncer de colon, los datos actuales sugieren que es un método poco viable en programas de cribado poblacional, debiendo reservarse para individuos de mayor riesgo (35). Consideramos que la determinación de sangre oculta en heces es, en el momento actual, el método de elección para el cribado poblacional cumpliendo las recomendaciones de la Organización Mundial de la Salud (36) como test para la detección precoz de una enfermedad.
En conclusión, los resultados de nuestro estudio no difieren de forma sustancial de los ya publicados. El cribado poblacional mediante el test guaiaco puede detectar pequeñas lesiones con potencial maligno, factor clave para disminuir la incidencia de CCR. En un futuro próximo es posible que el cribado de CCR sea adaptado al riesgo individual en función de la edad y sexo. Un programa en Cataluña basado en el modelo utilizado en nuestro estudio piloto es posible y puede reducir la mortalidad por CCR de manera similar a la observada en los ensayos randomizados. La realización de colonoscopia tras un TSOH positivo es aceptada por los pacientes y asumible por nuestro sistema de salud.
Grupo catalán del Programa piloto en Cribado de Cáncer Colorrectal
El Grupo Catalán del Programa Piloto en Cribado de Cáncer Colorrectal incluye a: M. Peris, G. Binefa, M. Navarro, J. A. Espinás, J. M. Borrás, I. Blanco, A. Clopés, V. Moreno, G. Capellà (Institut Català d'Oncologia), J. M. Miquel, J. M. Nogueira, J. Martí-Ragué, X. Sanjuán (Hospital Universitario de Bellvitge), P. Barrios (Hospital Cruz Roja, L'Hospitalet de Llobregat) y S. Calero (Institut Català de la Salut).
Bibliografía
1. Ferlay J, Bray F, Pisani P, Parkin DM. GLOBOCAN 2002: Cancer incidence, mortality and prevalence worldwide. IARC Cancer Base No. 5 version 2.0. Lyon; IARC; 2004. [ Links ]
2. Ferlay J, Autier P, Boniol M, Heanue M, Colombet M, Boyle P. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol 2007; 18: 581-92. [ Links ]
3. Levi F, Lucchini F, Negri E, Boyle P, la Vecchia C. Cancer mortality in Europe, 1995-1999, and overview of trends since 1960. Int J Cancer 2004; 110: 155-69. [ Links ]
4. Cho KR, Vogelstein B. Genetic alterations in the adenoma-carcinoma sequence. Cancer 1992; 70 (6): 1727-31. [ Links ]
5. Smith RA, Cokkinides V, Eyre HJ. American Cancer Society guidelines for the early detection of cancer. Cancer J Clin 2003; 53: 27-43. [ Links ]
6. Ciccolallo L, Capocaccia R, Coleman MP, Berrino F, Coebergh JW, Damhuis RA, et al. Survival differences between European and US patients with colorectal cancer: Role of stage at diagnosis and surgery. Gut 2005; 54: 268-73. [ Links ]
7. Mandel JS, Bond JH, Church TR, Snover DC, Bradley GM, Shuman LM, et al. Reducing mortality from colorectal cancer by screening for fecal occult blood. Minnesota Colon Cancer Control Study. N Engl J Med 1993; 328: 1365-71. [ Links ]
8. Mandel JS, Church TR, Bond JH, Ederer F, Geisser MS, Mongin SJ, et al. The effect of faecal occult-blood screening on the incidence of colorectal cancer. N Engl J Med 2000; 343: 1603-7. [ Links ]
9. Winawer SJ, Fletcher R, Miller L, Godlee F, Stolar MH, Mulrow CD, et al. Colorectal cancer screening: Clinical guidelines and rationale. Gastroenterology 1997; 112: 594-642. [ Links ]
10. Rex DK, Johnson DA, Lieberman DA, Buró RW, Sonnenberg A. Colorectal cancer prevention 2000: Screening recommendation of the American Collage of Gastroenterology. Am J Gastroenterol 2000; 95: 868-77. [ Links ]
11. Hardcastle JD, Chamberlain JO, Robinson MH, Moss SM, Amar SS, Balfour TW, et al. Randomised controlled trial of faecal-occult blood screening for colorectal cancer. Lancet 1996; 348: 1472-7. [ Links ]
12. Kronborg O, Fenger C, Olsen J, Jorgensen OD, Sondergaard O. Randomized study of screening for colorectal cancer with faecal-occult blood test. Lancet 1996; 348: 1467-71. [ Links ]
13. Weissfeld JL, Schoen RE, Pinsky PF, Bresalier RS, Church T, Yurgalevitch S, et al. Flexible sigmoidoscopy in the PLCO Cancer Screening Trial: Results from the baseline screening examination of a randomized trial. J Natl Cancer Inst 2005; 97 (13): 989-97. [ Links ]
14. Lieberman DA, Weiss DG. One-time screening for colorectal cancer with combined fecal occult blood testing and examination of the distal colon. Veterans Affairs Cooperative Study Group 380. N Engl J Med 2001; 345: 555-60. [ Links ]
15. Kewenter J, Brevinge H, Engaras B, Haglind E, Hhren C. Results of screening, rescreening, and follow-up in a prospective randomized study for detection of colorectal cancer by fecal blood testing. Results for 68,308 subjects. Scand J Gastroenterol 1994; 29: 468-73. [ Links ]
16. Tazi MA, Faivre J, Dassonville F, Lamour J, Milan C, Durand G. Participation in faecal occult blood screening for colorectal cancer in a well defined French population: Results of five screening rounds from 1988 to 1996. J Med Screen 1997; 4 (3): 147-51. [ Links ]
17. Segnan N, Senore C, Andreoni B, Aste H, Bonelli L, Crosta C, et al. Baseline findings of the Italian multicenter randomized controlled trial of "once-only sigmoidoscopy" SCORE. J Natl Cancer Inst 2002; 94 (23): 1763-72. [ Links ]
18. Advisory Committee on Cancer Prevention. Recommendations on cancer screening in the European Union. Eur J Cancer 2000; 36: 1473-8. [ Links ]
19. Peris M, Espinás JA, Muñoz, L, Navarro M, Binefa G, Borrás, JM. Lessons learned from a population-based pilot programme for colorectal cancer screening in Catalonia (Spain). J Med Screening 2007; 14: 81-6. [ Links ]
20. Jass JR, Sobin LH. Histological typing of intestinal tumors. 2nd ed. New York: Springer; 1989. [ Links ]
21. Greene FL, Page DL, Fleming ID, Fritz A, Balch DM, Haler DG, et al., editors. AJCC (American Joint Committee on Cancer) Cancer Staging Manual. 6th ed. New York: Springer-Verlag; 2002. [ Links ]
22. Winaver SJ, Zauber AG, Fletcher RH, Stillman JS, O'Brien MJ, Levin B, et al. Guidelines for colonoscopy surveillance after polipectomy: A consensus update by the US Multisociety Task Force on colorectal. Cancer and the American Cancer Society. CA Cancer J Clin 2006; 56: 143-59. [ Links ]
23. Brenner H, Hoffmeister M, Arndt V, Haug U. Sex differences in colorectal cancer: Implications for age at initiation of screening. Br J Cancer 2007; 96: 828-31. [ Links ]
24. Weller D, Coleman D, Robertson R, Butler P, Melia J, Campbell C, et al. The UK colorectal cancer screening pilot: Results of the second round of screening in England. Br J Cancer 2007; 97: 1601-5. [ Links ]
25. Zorzi M, Grazzini G, Senore C, Vettorazzi M. Screening for colorect-al cancer in Italy: 2004 survey. Epidemiol Prev 2006; 30: 39-48. [ Links ]
26. Winawer SJ, Zauber AG, Ho MN, O'Brien MJ, Gottlieb LS, Sternberg SS, et al. Prevention of colorectal cancer by colonoscopic polypectomy. N Engl J Med 1993; 329: 1977-83. [ Links ]
27. Imperiale TF, Wagner DR, Lin CY, Larkin GN, Rogge JD, Ransohoff DF. Risk of advanced proximal neoplasms in asymptomatic adults according to the distal colorectal findings. N Engl J Med 2000; 343: 169-74. [ Links ]
28. Levin TR, Palitz A, Grossman S, Conell C, Finkler L, Ackerson L, et al. Predicting advanced proximal colonic neoplasia with screening sigmoidoscopy. JAMA 1999; 281: 1611-7. [ Links ]
29. Lewis JD, Ng K, Hung KE, Bilker WB, Berlin JA, Brensinger C, et al. Detection of proximal adenomatous polyps with screening sigmoidoscopy. Arch Intern Med 2003; 163: 413-20. [ Links ]
30. Rex DK, Lehman GA, Hawes RH, Ulbright TM, Smith JJ. Screening colonoscopy in asymptomatic average-risk persons with negative fecal occult blood test. Gastroenterology 1991; 100: 64-7. [ Links ]
31. Martí-Ragué J, Pares D, Biondo S, Navarro M, Figueras J, de Oca J, et al. Survival and recurrence in the multidisciplinary approach of colorectal cancer. Med Clin 2004; 123 (8): 291-6. [ Links ]
32. Morikawa T, Kato J, Yamaji Y, Wada R, Mitsushima T, Shiratori Y. A comparison of the immunochemical fecal occult blood test and total colonoscopy in the asymptomatic population. Gastroenterology 2005; 129: 422-8. [ Links ]
33. Brosseuk D, Oosthuizen J, Pinchbeck M. Initial experience with a general population colorectal cancer screening clinic. Am J Surgery 2006; 191: 669-72. [ Links ]
34. Seeff LC, Manninen DL, Dong FB, Chattopadhyay SK, Nadel MR, Tangka FKL, et al. Is there endoscopy capacity to provide colorectal cancer screening to the unscreened population in the United States? Gastroenterology 2004; 127: 1661-9. [ Links ]
35. Menges M, Fischinger J, Gartner B, Georg T, Woerdehoff D, Maier M, et al. Screening colonoscopy in 40- to 50-year-old first-degree relatives of patients with colorectal cancer is efficient: A controlled multicentre study. Int J Colorectal Dis 2006; 21: 301-7. [ Links ]
36. Strong K, Wald N, Miller A, Alwan A. Current concepts in screening for noncommunicable disease: World Health Organization Consultation Group report on methodology of noncommunicable disease screening. J Med Screen 2005; 12: 1912-31. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Mercé Peris.
Servicio de Prevención y Control del Cánacer.
Institut Català d'Oncologia.
Gran Via s/n, km 2'7.
08907 L'Hospitalet de Llobregat, Barcelona.
e-mail: m.peris@iconcologia.net
Recibido: 11-03-08.
Aceptado: 17-03-08.