Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.101 no.5 Madrid may. 2009
Evaluación de la fibrosis hepática en la hepatitis crónica por virus C mediante la aplicación prospectiva del Sabadell's NIHCED score (Sabadell's Non Invasive, Hepatitis C Related-Cirrhosis Early Detection Score)
Prospective evaluation of liver fibrosis in chronic viral hepatitis C infection using the Sabadell NIHCED (non-invasive hepatitis C related cirrhosis early detection) index
G. Bejarano1,2, M. Vergara1,2, M. Gil1,2, B. Dalmau1,2, J. Puig2,3, M. R. Bella4, D. Suárez5 y X. Calvet1,2
1Servicio de Aparato Digestivo. 2CIBERehd. Instituto Carlos III. 3Unitad de Diagnóstico de Alta Tecnología. 4Servicio de Anatomía Patológica. 5Unidad de Estadística y Epidemiología. Universitat Autònoma de Barcelona. Corporació Sanitària Parc Tauli. Sabadell, Barcelona
Soporte financiero: este estudio ha sido financiado en parte por la Beca CIR de la Corporaciò Parc Taulí, Código CEIC: 2004112 y por el Instituto de Salud Carlos III (C03/02 y PI 05/1157 y CIBERehd).
Dirección para correspondencia
RESUMEN
Introducción: la hepatitis crónica por VHC cursa de forma asintomática desarrollando cirrosis hepática y sus complicaciones en un 20-40% de los casos. En estudios previos se ha demostrado que la fibrosis avanzada es un factor pronóstico fundamental. El método gold standard para la valoración del grado de fibrosis es la biopsia hepática. Nuestro grupo ha validado un índice predictivo, el NIHCED (Sabadell's Non Invasive, Hepatitis C related-Cirrosis Early Detection Score), basado en datos demográficos, analíticos y ecográficos para determinar la presencia de cirrosis.
Objetivo: nuestro objetivo es el de evaluar si el NIHCED predice la presencia de fibrosis avanzada en los pacientes con hepatitis crónica por virus C.
Material y métodos: estudio prospectivo donde se incluyeron pacientes con hepatitis crónica por VHC. Se les realizó una biopsia hepática y el NIHCED. El grado de fibrosis se correlacionó con el valor del NIHCED mediante curva de ROC y el coeficiente de correlación de Spearman.
Resultados: se incluyeron un total de 321 pacientes (ratio hombre/mujer 1,27) con una edad media de 48 ± 14 años. La biopsia hepática mostró que 131 (30,5%) no tenían fibrosis o era expansión portal, mientras que 190 (69,5%) tenían fibrosis avanzada o cirrosis. Para un punto de corte de 6 puntos, la sensibilidad fue del 72%, especificidad del 76,3%, VPP del 81%, VPN del 63,7% y una precisión diagnóstica del 72,5%, con un área bajo la curva fue de 0,787 y un coeficiente de correlación de Spearman de r = 0,65.
Conclusiones: el NIHCED predice la presencia de fibrosis avanzada en un elevado porcentaje de pacientes sin necesidad de realizar biopsia hepática.
Palabras clave: Hepatitis por virus C. Fibrosis avanzada. Índice predictivo. Índice NIHCED.
ABSTRACT
Introduction: liver disease resulting from chronic hepatitis C virus (HCV) infection follows an asymptomatic course towards cirrhosis and its complications in 20-40% of cases. Earlier studies demonstrated that advanced fibrosis is a prognostic factor. The "gold standard" for the evaluation of fibrosis grade is liver biopsy. Our group validated a predictive index - NIHCED - based on demographic, laboratory parameters, and echoghraphic data to determine the presence of cirrhosis.
Objective: our objective is to evaluate whether the NIHCED score predicts the presence of advanced fibrosis in patients with chronic HCV infection.
Material and methods: this prospective study included patients with chronic HCV infection who underwent liver biopsy and were administered the NIHCED score. Fibrosis grade correlated with the NIHCED score using the ROC curve analysis and Spearman's correlation coefficient.
Results: in total 321 patients were included (male/female ratio 1.27) with a mean age of 48 ± 14 years. Liver biopsy showed that 131 (30.5%) had no fibrosis or had portal expansion while 190 (69.5%) had advanced fibrosis or cirrhosis. At a cut-off point of 6, sensitivity was 72%, specificity was 76.3%, positive predictive value (PPV) was 81%, negative predictive value (NPV) was 63.7%, and diagnostic accuracy was 72.5%, with an area under the curve (AUC) of 0.787, and a Spearman's correlation coefficient of r = 0.65.
Conclusions: the NIHCED score predicts the presence of advanced fibrosis in an elevated percentage of patients with a need of liver biopsy.
Key words: Hepatitis C virus liver disease. Advanced fibrosis. Predictive index. HIHCED index.
Lista de abreviaturas
VHB: Virus de la hepatitis B.
VIH: Virus de la inmunodeficiencia humana.
IST: Índice de saturación de transferrina.
ANA: Anticuerpos antinucleares.
CBP: Cirrosis biliar primaria.
FA: Fosfatasa alcalina.
AMA: Anticuerpos antimitocondriales.
GGT: Gamma glutamil transpeptidasa.
ALT: Alanina transaminasa.
AST: Aspartato aminotransferasa.
Introducción
En la actualidad el virus de la hepatitis C (VHC) constituye la causa más prevalente de hepatitis crónica en los países desarrollados. Se estima que el 3% de la población mundial (170 millones de personas) sufre una infección crónica por VHC. En España, se calcula una prevalencia que oscila entre el 1,6 y el 2,6% de la población y aumenta de forma progresiva con la edad, alcanzando el 4,1% en los mayores de 65 años (1,2). Evoluciona a la cronicidad de forma asintomática y por tanto en muchos casos no es detectada.
El 80% de los pacientes infectados por VHC son portadores crónicos (3,4). Un tercio de ellos desarrollarán una cirrosis hepática en los siguientes 20 años, y hasta un 7% de los pacientes con cirrosis presentarán un carcinoma hepatocelular (4,5). Sin embargo, aproximadamente dos tercios de los portadores crónicos presentarán una infección crónica clínicamente asintomática, que en ausencia de otros factores adyuvantes (consumo de alcohol, co-infección por VHB y/o VIH) se mantendrá estable o con una lenta evolución del grado de fibrosis hepática (6).
Se ha demostrado en diferentes estudios que son los factores del huésped, más que los factores virales, los que influyen en la progresión de la lesión histológica. En concreto, la edad, el consumo de alcohol y el sexo masculino parecen tener mayor valor pronóstico que el genotipo o la carga viral (7).
El método diagnóstico gold estándar para valorar el grado de evolución de la hepatitis crónica por virus C es la biopsia hepática. Algunos autores aconsejan la realización de biopsias hepáticas periódicas (8) en los pacientes con hepatitis crónica por virus C. Sin embargo, la práctica seriada de biopsias hepáticas es difícil de plantear dada la morbilidad (3%), mortalidad (0,03%) y difícil aceptación (9). Por otro lado, es importante detectar de forma precoz el desarrollo de cirrosis hepática, para incluir estos pacientes en un seguimiento adecuado de detección de complicaciones.
Hasta la actualidad, se han publicado diversos marcadores predictivos de cirrosis hepática que incluyen datos clínicos, analíticos o ecográficos (10-19). En nuestra Unidad hemos elaborado y validado un índice predictivo de hepatitis crónica por virus C (NIHCED- Sabadell's non Invasive, Hepatitis C related-Cirrhosis Early Detection Score). El índice evalúa una serie de parámetros demográficos, analíticos y ecográficos (20) (Tabla I). Un índice igual o superior a 22 tiene una sensibilidad del 86%, una especificidad del 90%, un valor predictivo positivo del 68%, un valor predictivo negativo del 96,4% y una exactitud diagnóstica del 90% (20).
El objetivo del presente estudio fue el de evaluar la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo y precisión diagnóstica del NIHCED para determinar la presencia de fibrosis avanzada en los pacientes con hepatitis crónica por VHC.
Material y métodos
Se ha desarrollado un estudio clínico unicéntrico, prospectivo con pacientes diagnosticados de hepatitis por VHC. El estudio se ha realizado en el Hospital Parc Taulí de Sabadell (Barcelona), hospital comarcal con 800 camas y una población de referencia de 414.152 habitantes (11 municipios).
Selección de pacientes
Se seleccionaron de forma prospectiva y consecutiva aquellos pacientes con hepatitis crónica por VHC evaluados en la Unidad de Enfermedades Hepáticas del Hospital Parc Taulí (Sabadell, Barcelona) desde enero de 1993 hasta julio de 1999.
Criterios de inclusión
-Pacientes asintomáticos diagnosticados de hepatitis crónica por VHC con niveles de RNA-VHC elevados en sangre.
-Pacientes que aceptarán la realización de una biopsia hepática para conocer el grado de fibrosis.
Criterios de exclusión
-Presencia de enfermedad con posible afectación hepática concomitante: hemocromatosis, enfermedad de Wilson, hepatitis crónica por virus B, fármacos hepatotóxicos. HIV positivo, hepatitis autoinmune, o hepatitis alcohólica. A todos los pacientes se les realizaron serologías para VHB y VIH, estudio de hemocromatosis (hierro, ferritina e IST), hepatitis autoinmune (ANA, anticuerpos anti-músculo liso), CBP (FA, AMA), enfermedad de Wilson (ceruloplasmina) y déficit de alfa-antitripsina (niveles de antitripsina).
-Presencia de otra enfermedad (neoplasia diseminada, insuficiencia renal avanzada...) con mal pronóstico vital a corto plazo.
-Cirrosis hepática ya establecida (presencia de hipertensión portal en forma de varices esofágicas, ascitis o hepatocarcinoma).
-Consumo de alcohol > 20 g/día o de otras drogas.
El protocolo de estudio fue aprobado por el Comité de Ética del Hospital Parc Taulí de Sabadell (Barcelona) y diseñado según las guías éticas de 1975 de la Declaración de Helsinki revisada en 1983.
Metodología clínica
Se incluyeron un total de 321 pacientes. A todos los pacientes se les realizó una historia clínica y una exploración física por aparatos. Una vez aceptada su inclusión en el estudio, se les realizó una analítica, una ecografía hepática y una biopsia hepática para el estudio del grado de fibrosis de la hepatitis por VHC.
Metodología de laboratorio
Se realizaron las siguientes determinaciones: hemograma completo con recuento de leucocitos totales con el porcentaje de neutrófilos y linfocitos, hemoglobina, volumen corpuscular medio, recuento de plaquetas, tiempo de protrombrina (ratio), albúmina (mg/dl), bilirrubina total y directa (U/l), creatinina (mg/dl), urea (mg/dl), FA (U/l), GGT (U/l), ALT (U/l); AST (U/l), AST/ALT ratio y gamma globulinas.
Metodología de la ecografía hepática
Se realizó una ecografía-doppler hepática estudiando 13 variables ecográficas. El estudio estadístico que dio lugar al NIHCED, dio como resultado que las variables estadísticamente avanzadas relacionadas con el grado de fibrosis hepática fueron:
-Hipertrofia del lóbulo caudado (diámetro > 4 cm).
-Atrofia del lóbulo hepático derecho (diámetro longitudinal < 9 cm).
-Esplenomegalia (> 13 cm).
El estudio ecográfico fue realizado usando el equipo Toshiba 140 y Aloka SSD-650 (Toshiba Medical systems, Zoetermer, Netherlands; Aloka España SL, Madrid; España), con 3,5 ó 3,75 MHz. Todas las pruebas fueron realizadas por un único y experimentado ecografista del centro UDIAT del Hospital Parc Taulí de Sabadell.
Con los datos obtenidos de la analítica y la ecografía hepática se calculó el NIHCED en cada paciente. El intervalo máximo entre la determinación del índice NIHCED y la biopsia hepática fue de tres meses.
Metodología de la biopsia hepática
A todos los pacientes se les realizó una biopsia hepática guiada por ecografía mediante aguja de tru-cut y fijados en FAA (formaldehído, alcohol, y ácido acético) y embebidas en parafina. Las secciones hepáticas biopsiadas presentaban un tamaño medio de 11,6 mm con un número medio de tractos fibrosos de 12,2, y fueron teñidas con hematoxilina-eosina, tricromo de Masson y rojo pricosirio solución al 1%. Todas las muestras fueron revisadas por un patólogo experimentado de la Unidad de Anatomía Patológica del Hospital Parc Taulí de Sabadell, el cual desconocía la historia clínica y los resultados de laboratorio de los pacientes. El grado de fibrosis fue evaluado según la escala de Knodell, que clasifica la fibrosis en cuatro estadios (F0, ausencia de fibrosis; F1, expansión fibrosa; F3, puentes de fibrosis porto-portales; F4, cirrosis), considerando los estadios ≥ F3 como "fibrosis avanzada".
Metodología estadística
Los datos obtenidos se procesaron con el paquete SPSS 15.0 para Windows (SPPS Inc., Chicago, EE. UU.).
Se utilizó la t de Student para la comparación entre variables continuas. Cuando no fue posible asumir normalidad o cuando el tamaño muestral resultó inferior a 10 observaciones en algún grupo, se aplicó el test de la U de Mann Withney. Para la comparación de proporciones se utilizó la prueba de Chi-cuadrado para las variables categóricas. Cuando en la tabla de 2 x 2 alguno de los valores esperados fue inferior a 5 se aplicó la prueba exacta de Fisher. La correlación de variables cuantitativas (NIHCED score) con variables ordinales (fibrosis hepática Knodell) se testó mediante el coeficiente ρ de Spearman. Un valor de p menos de 0,05 fue considerado como estadísticamente significativo.
El grado de fibrosis según el índice de Knodell se correlacionó con el valor del NIHCED score mediante curva ROC. Se calculó la sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN), diferenciando a los pacientes en dos grupos: aquellos con histológicamente tenían ausencia de fibrosis (F0) o únicamente expansión fibrosa portal (F1) de los que presentaban fibrosis avanzada (F3) o cirrosis establecida (F4) según el índice de Knodell.
Resultados
Datos demográficos
Se incluyeron un total de 321 pacientes con una edad media de 48 ± 14 años y una ratio hombre-mujer de 1,27.
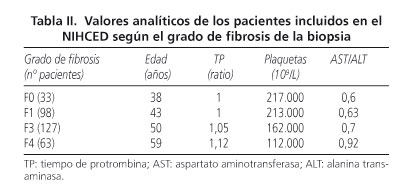
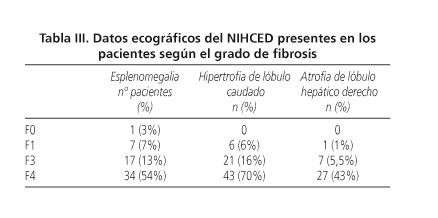
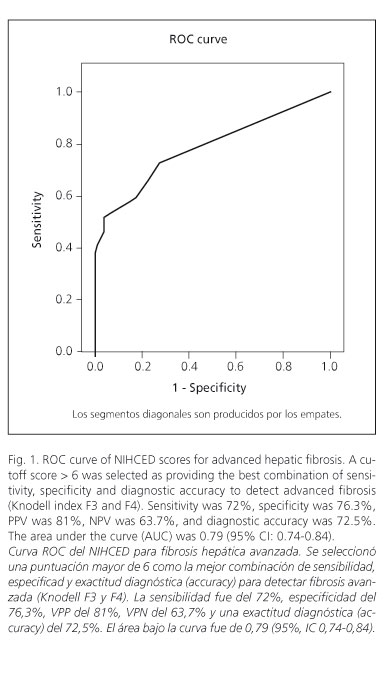
Análisis del NIHCED score como predictor de la presencia de fibrosis avanzada en los pacientes con hepatitis crónica por virus C Los 321 pacientes se clasificaron en dos grupos: aquellos con un índice de fibrosis no significativo (Knodell F0 y F1) con un total de 131 pacientes (30,5%), y otro grupo de pacientes con fibrosis avanzada (Knodell F3 y F4) con un total de 190 pacientes (69,5% del total). En la tabla II se muestran los valores analíticos incluidos en el NIHCED de los pacientes según el grado de fibrosis de la biopsia. En la tabla III se muestran los datos ecográficos del NIHCED presentes en los pacientes según el grado de fibrosis. Sobre estos datos y su curva ROC, se seleccionó una puntuación mayor de 6 como la mejor combinación de sensibilidad, especificad y exactitud diagnóstica (accuracy) para detectar fibrosis avanzada (Knodell F3 y F4). La sensibilidad fue del 72%, especificidad del 75%, VPP del 81%, VPN del 63,7% y una exactitud diagnóstica (accuracy) del 72,5%. El área bajo la curva fue de 0,79 (95%, IC 0,74-0,84). Se calcularon las razones de verosimilitud positiva y negativa del test (likelihood ratio) con resultado de LR (+) 3,04 y LR (-) 0,37 (Fig. 1). Se realizó el estudio de correlaciones entre el índice de fibrosis hepática Knodell vs. el NIHCED score mediante la correlación de Spearman con un coeficiente de r = 0,65. Análisis del NIHCED score como predictor de fibrosis avanzada: cohorte de estimación y cohorte de validación Los 321 pacientes se dividieron de forma aleatoria en 2 grupos, la cohorte de estimación, formada por 217 pacientes y la cohorte de validación, formada por 104 pacientes. Se realizaron curvas ROC en el grupo de estimación y en el de validación para el punto de corte mayor de 6. La cohorte de estimación presentaba una sensibilidad del 70%, especificidad del 74% y una exactitud diagnóstica (accuracy) del 72% con una AUC 0,77 (95%, IC 0,71-0,83). Se calcularon las razones de verosimilitud positiva y negativa del test (likelihood ratio) con resultado de LR (+) 2,7 y LR (-) 0,40. La cohorte de validación presenta una sensibilidad del 76%, especificidad del 76,3% y una exactitud diagnóstica (accuracy) del 76% con una AUC 0,82 (95%, IC 0,74-0,90). Se calcularon las razones de verosimilitud positiva y negativa del test (likelihood ratio) con resultado de LR (+) 3,21 y LR (-) 0,31 (Tabla IV). Discusión Diversos autores han desarrollado índices no invasivos para el diagnóstico de cirrosis o fibrosis avanzada obviando la realización de la biopsia hepática (21-23). La biopsia hepática continúa siendo la prueba gold standard para valorar la fibrosis, a pesar de que puede presentar un porcentaje no despreciable de falsos positivos y falsos negativos, determinado por el error muestral y por la diferencia inter-observador. A pesar de todos estos inconvenientes y de la existencia de múltiples índices predictivos o del fibroscan todavía ninguno de ellos ha logrado sustituir a la biopsia como sistema ideal. Algunos autores sugieren la combinación de varios índices como un método no invasivo de diagnóstico (24,25), si bien, a pesar de ello continúa habiendo algunos casos que precisan de biopsia hepática para su total caracterización. Leroy y cols. (24) compararon los resultados histológicos obtenidos en 180 pacientes con hepatitis crónica por VHC con seis diferentes índices no invasivos. Sus resultados mostraron que únicamente un tercio de los pacientes quedaban clasificados de forma correcta cuando se combinaba el FibroTest (26) y el APRI (22). Castera y cols. (27) señalaron que cuando el resultado del FibroTest se combina con el de la elastometría transitoria y los resultados son coincidentes, lo que sucede en un 70-80% de los pacientes, la realización de la biopsia hepática se podría evitar en el 77% de los pacientes con fibrosis avanzada. Por tanto, todos los índices no invasivos permiten detectar con bastante exactitud los valores extremos, pero para los pacientes con valores intermedios ofrecen sólo una información parcial sobre la fibrosis hepática siendo la biopsia hepática la prueba gold standard. Un gran inconveniente de algunos de estos índices no invasivos como el FibroTest (28), es que las determinaciones que se han de realizar no son rutinarias, dado que es una fórmula matemática que combina cinco variables: bilirrubina total, GGT, haptoglobina, alfa 2-microglobulina y apolipoproteína A1. Por tanto, es difícil de determinar en la mayoría de centros hospitalarios, siendo además su coste económico elevado por lo que no se puede realizar de forma habitual en los pacientes con hepatitis crónica por VHC. Un grupo de la Universidad de Sydney (29) ha propuesto un modelo no invasivo de predicción de la fibrosis que incluye junto con la edad, AST, colesterol y consumo de alcohol, la resistencia a la insulina como factor que influye en la progresión de la enfermedad (30), Romera y cols. validaron el índice de Sydney en pacientes con hepatitis presentando un valor predictivo negativo del 70%, frente al 93% comunicado por los autores (31), por lo que no parece que añadir el índice de resistencia a la insulina, que es una prueba de un coste económico superior añada ventajas al índice validado por nuestro grupo. El NIHCED, al igual que otros índices no invasivos como el de Forns (21), utiliza parámetros habituales en la clínica diaria para valorar el seguimiento de los pacientes con hepatitis crónica por VHC, lo que hace que económicamente sea posible en la práctica habitual. La hepatitis crónica por VHC, como ya se ha comentado previamente es una infección altamente prevalente en nuestro medio afectando al 2-3% de la población española. Eso significa que un seguimiento exhaustivo de todos los pacientes infectados por parte del especialista colapsaría la atención especializada en hepatología. Muchos de estos pacientes y debido a que la infección es asintomática, simplemente no son conocidos al no estar diagnosticados. Por otro lado, hay un grupo amplio de pacientes asintomáticos y jóvenes con una vida laboral activa que no se controlan de forma periódica o lo realizan a través de su médico de familia. El NIHCED está diseñado con la intención de ofrecer una herramienta asequible a los médicos de familia (fácil de puntuar y de evaluar) que sirva para detección precoz de fibrosis avanzada, que implicaría que el subgrupo de pacientes con fibrosis avanzada sería el que tendría que ser derivado para control especializado. Muchos autores previamente han mostrado que la fibrosis avanzada es un factor pronóstico fundamental en los pacientes con hepatitis crónica por VHC. Su presencia en una biopsia indicaría que la progresión en estos pacientes es más rápida que en aquellos que la biopsia muestra ausencia de fibrosis o únicamente expansión fibrosa (32). El NIHCED aporta los datos de la ecografía hepática que permite añadir factores pronósticos a los obtenidos propiamente como valor absoluto del índice. Vale la pena hacer notar que en 27% de los pacientes diagnosticados de novo de hepatocarcinoma en nuestro medio, no se conocía previamente que presentarán fibrosis avanzada o cirrosis y fue la ecografía hepática la que aportó el diagnóstico para iniciar el tratamiento (33). Un inconveniente que puede presentar la elaboración y validación de un índice que valora datos ecográficos es el sesgo interobservador. En el NIHCED únicamente un radiólogo fue el que realizó todas las ecografías y evaluó todos los signos incluidos en las mismas. Los resultados de nuestro estudio suponen que todos los pacientes mayores de 65 años tienen una alta probabilidad de presentar fibrosis avanzada. Los estudios realizados previamente avalarían esta conclusión dado que uno de los principales factores que influiría en la progresión de la enfermedad es el tiempo de evolución que obviamente aumenta con la edad (34-36). La combinación de datos de laboratorio y ecográficos permite que en pacientes con una analítica estrictamente normal, la presencia de datos radiológicos significativos incluidos en nuestro índice: hipertrofia del lóbulo caudado, esplenomegalia o atrofia del lóbulo hepático derecho nos permitan sospechar con una alta sensibilidad y especificidad que el paciente puede presentar una fibrosis avanzada. En la actualidad hay lagunas en el uso de estos métodos no invasivos. Una es la escasez de estudios en pacientes con hepatopatías no debidas a VHC, es decir, sabemos cómo funcionan estos índices con pacientes infectados con hepatitis C, pero si presentan otros mecanismos que interfieren en la lesión hepatocitaria como hepatitis B o alcohol no se conoce su fiabilidad. La capacidad del NIHCED para distinguir entre fibrosis avanzada y fibrosis ausente o expansión portal (puntuación de corte mayor de 6) presenta una sensibilidad del 72%, especificidad del 76,3%, VPP del 81%, VPN del 63,7% y una precisión diagnóstica del 72,5% y un área bajo la curva fue de 0,79 (intervalo de confianza 0,74-0,84). Estos resultados son, por otro lado, equivalentes a los obtenidos con otros métodos no invasivos. En conclusión, el NIHCED es tan eficaz como otros índices no invasivos para determinar la presencia de fibrosis avanzada. Asimismo aporta datos ecográficos que permiten añadir factores pronósticos a la información obtenida y por otro lado y en comparación con los otros métodos no invasivos es sencillo y fácil de aplicar en cualquier consulta externa, ya sea del especialista o del médico de familia. Futuros estudios habrían de estar dirigidos a la evaluación prospectiva de la utilidad de estos métodos no invasivos para el seguimiento a largo plazo de los pacientes con hepatitis crónica por VHC. Bibliografía 1. Domínguez A, Bruguera M, Vidal J, Plans P, Salleras L. Community-based seroepi-demiological survey of HCV infection in Catalonia, Spain. J Med Virol 2001; 65: 688-93. [ Links ] 2. Riestra S, Fernández E, Leiva P, García S, Ocio G, Rodrigo L. Prevalence of hepatitis C virus infection in the general population of northern Spain. Eur J Gastroenterol Hepatol 2001; 13: 477-82. [ Links ] 3. Di Bisceglie AM. Hepatitis C. Lancet 1998; 9099: 351-5. [ Links ] 4. Alter HJ, Seeff LB. Recovery, persistence, and sequelae in hepatitis C virus infection: a perspective on long-term outcome. Semin Liver Dis 2000; 20(1): 17-35. [ Links ] 5. Di Bisceglie AM. Hepatitis C and hepatocellular carcinoma. Hepatology 1997; 26(3 Supl. 1): 34S-38S. [ Links ] 6. Alberti A, Vario A, Ferrari A, Pistis R. Chronic hepatitis C - natural history and cofactors. Aliment Pharmacol Ther 2005; 22 (Supl. 2): 74-8. [ Links ] 7. Poynard T, Bedossa P, Opolon P, for the OBSVRIC, METAVIR, CLINIVIR and DOSVIRC group. Natural history of liver fibrosis progression in patients with chronic hepatitis C. Lancet 1997; 349: 825-32. [ Links ] 8. Dienstag JL. The role of liver biopsy in chronic hepatitis C. Hepatology 2002; 36: S152-S160. [ Links ] 9. Garcia-Tsao G, Boyer JL. Outpatient liver biopsy: how safe is it? Ann Intern Med 1993; 118: 150-3. [ Links ] 10. Sheth SG, Flamm SL, Gordon FD, Chopra S. AST/ALT ratio predicts cirrhosis in patients with chronic hepatitis C virus infection. Am J Gastroenterol 1998; 93: 44-8. [ Links ] 11. Reedy DW, Loo AT, Levine RA. AST/ALT ratio > 1 is not diagnostic of cirrhosis in patients with chronic hepatitis C. Digestive Dis Sci 1998; 43: 2156-9. [ Links ] 12. Kaul V, Friedenberg FK, Braitman LE, Anis U, Zaeri N, Fazili J, et al. Development and validation of a model to diagnose cirrhosis in patients with hepatitis C. Am J Gastroenterol 2002; 97: 2623-8. [ Links ] 13. Oberti F, Valsesia E, Pilette C, Rousselet MC, Bedossa P, Aubé C, et al. Noninvasive diagnosis of hepatic fibrosis or cirrhosis. Gastroenterology 1997; 113: 1609-16. [ Links ] 14. Forns X, Ampurdanès S, Llovet JM, Aponte J, Quintó L, Martínez-Bauer E, et al. Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model. Hepatology 2002; 36: 986-92. [ Links ] 15. Bonacini M, Hadi G, Govindarajan S, Lindsay L. Utility of a discriminant índex for diagnosing advanced fibrosis or cirrhosis in patients with chronic hepatitis C virus infection. Am J Gastroenterol 1997: 92; 1302-4. [ Links ] 16. Colli A, Fraquelli M, Andreoletti M, Marino B, Zuccoli E, Conte D. Severe liver fibrosis or cirrhosis: accuracy of US for detection- Analysis of 300 cases. Radiology 2003; 227: 89-94. [ Links ] 17. Aubé C, Oberti F, Korali N, Namour MA, Loisel D, Tanguy JY, et al. Ultrasonographic diagnosis of hepatic fibrosis or cirrhosis. J Hepatol 1999; 30: 472-8. [ Links ] 18. Gaiani S, Gramantieri L, Venturoli N, Piscaglia F, Siringo S, D´Errico A, et al. What is the criterion for differentiating chronic hepatitis from compensated cirrhosis? A prospective study comparing ultrasonography and percutaneous liver biopsy. J Hepatol 1997; 27: 979-85. [ Links ] 19. Gomez, de la Cámara A. All that neurologists would like to know about sensitivity, specificity and predictive values. Neurología 2003; 18 (Supl. 2): 11-8. [ Links ] 20. Obrador BD, Prades MG, Gómez MV, Domingo JP, Cueto RB, Rué M, et al. A predictive index for the diagnosis of cirrhosis in hepatitis C based on clinical, laboratory, and ultrasound findings. Eur J Gastroenterol Hepatol 2006: 18: 57-62. [ Links ] 21. Forns X, Ampurdanes S, Llovet JM, Aponte J, Quintó L, Martínez-Bauer E, et al. Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model. Hepatology 2002; 36: 986-92. [ Links ] 22. Wai CT, Greenson JK, Fontana RJ, Kalbfleisch JD, Marrero JA, Conjeevaram HS, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003; 38: 518-26. [ Links ] 23. Lok AS, Ghany MG, Goodman ZD, Wright EC, Everson GT, Sterling RK, et al. Predicting cirrhosis in patients with hepatitis C based on standard laboratory tests: results of the HALT-C cohort. Hepatology 2005; 42: 282-92. [ Links ] 24. Colloredo G, Guido M, Sonzogni A, Leandro G. Impact of liver biopsy size on histological evaluation of chronic viral hepatitis: the smaller the sample, the milder the disease. J Hepatol 2003; 39: 239-44. [ Links ] 25. Leroy V, Hilleret MN, Sturm N, Trocme C, Renversez JC, Faure P, et al. Prospective comparison of six non-invasive scores for the diagnosis of liver fibrosis in chronic hepatitis C. J Hepatol 2007; 46: 775-82. [ Links ] 26. Sebastiani G, Vario A, Guido M, Noventa F, Plebani M, Pistis R, et al. Stepwise combination algorithms of non-invasive markers to diagnose significant fibrosis in chronic hepatitis C. J Hepatol 2006; 44: 686-93. [ Links ] 27. Castera L, Vergniol J, Foucher J, Le Bail B, Chanteloup E, Haaser M, et al. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology 2005; 128: 343-50. [ Links ] 28. Imbert-Bismut F, Ratziu V, Pieroni L, Charlotte F, Benhamou Y, Poynard T. Biochemical markers of liver fibrosis in patients with hepatitis C virus infection: a prospective study. Lancet 2001; 357: 1069-75. [ Links ] 29. Sud A, Hui JM, Farrell GC, Bandara P, Kench JG, Fung C, et al. Improved prediction of fibrosis in chronic hepatitis C using measures of insulin resistance in a probability index. Hepatology 2004; 39: 1239-47. [ Links ] 30. Fartoux L, Poujol-Robert A, Guechot J, Wendum D, Poupon R, Serfaty L. Insulin resistance is a cause of steatosis and fibrosis progression in chronic hepatitis C. Gut 2005; 54: 1003-8. [ Links ] 31. Romera M, Corpas R, Romero-Gómez M. La resistencia a la insulina en la valoración no invasiva de la fibrosis en pacientes con hepatitis C: Estudio comparativo de métodos bioquímicos. Rev Esp Enferm Dig 2006; 98: 161-9. [ Links ] 32. Alberti A, Chemello L, Benvegnù. Natural history of hepatitis C. EASL Internacional Consensus Conference on Hepatitis C. J Hepatol 1999; 31(Supl. 1): 17-24. [ Links ] 33. Vergara M, Gil M, Dalmau B, Ribot R, Navarro C, Martín A, et al. Historia natural del carcinoma hepatocelular en una cohorte de pacientes de un hospital comarcal. Rev Esp Enferm Dig 2008; 100: 682-7. [ Links ] 34. Angulo P, Keach JC, Batts KP, Lindor KD. Independent predictors of liver fibrosis in patients with non-alcoholic steatohepatitis. Hepatology 1999; 30: 1356-62. [ Links ] 35. Alberti A, Vario A, Ferrari A, Pistis R. Chronic hepatitis C - natural history and cofactors. Aliment Pharmacol Ther 2005; 22(Supl. 2): 74-8. [ Links ] 36. Thomas DL, Astemborski J, Rai RM, Anania FA, Schaeffer M, Galai N, et al. The natural history of hepatitis C virus infection: host, viral and environmental factors. JAMA 2000; 284: 450-6. [ Links ] Recibido: 04-11-08. ![]() Dirección para correspondencia:
Dirección para correspondencia:
Guillermina Bejarano-Redondo.
Servicio de Digestivo. Hospital de Sabadell.
Institut Universitari Parc Taulí. Universitat Autònoma de Barcelona.
Parc Taulí, s/n. 08208 Sabadel. Barcelona, España.
e-mail: gbejarano@tauli.cat
Aceptado:24-02-2009.











 texto en
texto en