Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.102 no.4 Madrid abr. 2010
CARTAS AL DIRECTOR
Pólipo fibroide inflamatorio gástrico
Giant fibroid inflammatory polyp
Palabras clave: Pólipo fibroide inflamatorio. Tumor submucoso gástrico. Ecoendoscopia radial.
Key words: Fibroid inflammatory polyp. Subepithelial gastric tumor. Radial endoscopic ultrasound.
Sr. Director:
El pólipo fibroide inflamatorio (PFI), también llamado tumor de Vanek, es una tumoración benigna, de localización submucosa, no encapsulada y poco frecuente caracterizada histológicamente por una proliferación de células fusocelulares estromales, de citoplasma mal delimitado. La localización habitual suele ser el estómago distal (70%) ocasionalmente en íleon distal (20%) y muy raramente en esófago y colon (1). Representa el tumor gástrico benigno menos frecuente (1-4%) con una frecuencia similar en hombres y mujeres y un pico de incidencia a partir de la sexta década de la vida siendo la malignización un evento excepcional (2).
Caso clínico
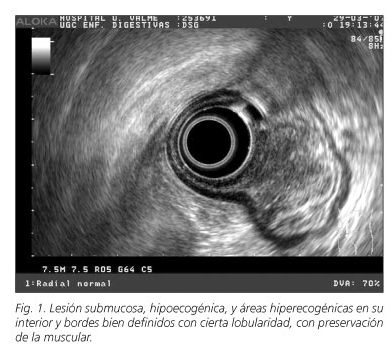
Mujer de 45 años remitida por cuadro de epigastralgias de larga evolución resistente a tratamiento con inhibidores de la bomba de protones a la que se le realiza endoscopia digestiva alta apreciando a nivel de cara anterior de antro una lesión polipoidea de unos 20 milímetros de diámetro, pseudopediculada, dura al tacto, con una mucosa hiperémica y cierta umbilicación central. Las biopsias demostraron una gastritis crónica atrófica leve sin signos de actividad ni evidencia de Helicobacter pylori. La paciente fue referida para ecoendoscopia empleando para ello el tipo radial (Olympus GF-UE160-Al5) donde se identificó una lesión polipoidea, de base ancha (15 milímetros), ulcerada en su centro, que surgía de la submucosa, hipoecogénica, áreas hiperecogénicas en su interior y bordes bien definidos con cierta lobularidad, en íntimo contacto con la muscular sin llegar a infiltrarla, sugestivo de tumor carcinoide. Se volvieron a tomar biopsias que resultaron inespecíficas. La TAC abdominal demostró a nivel antral una lesión de 20 x 14 milímetros de diámetro de densidad partes blandas, realce periférico sin infiltración de grasa adyacente ni signos de diseminación linfática local ni a distancia. La paciente fue enviada a cirugía realizándose una gastrectomía parcelar. La biopsia de la pieza describió una formación polipoidea con proliferación fibromixoide con componente inflamatorio sin evidencia de malignidad sugestivo de pólipo fibroide inflamatorio.
Discusión
La etiología de los PFI es desconocida; se ha propuesto que pudieran ser causados por una reacción alérgica a un estímulo inflamatorio tipo bacteriano en respuesta a la infección por H. pylori, estímulo químico o bien una lesión reactiva de naturaleza fibro-miofibroblástica (3).
El aspecto endoscópico típico es el de una lesión polipoidea, pediculada o semipediculada, cubiertas por una mucosa normal, localizadas en antro o región prepilórica (4) y en ocasiones deprimida o ulcerada, presentando ocasionalmente una mucosa recubierta de un exudado blanquecino en su ápex (5).
La ecoendoscopia (EE) es un excelente método diagnóstico para los PFI. El patrón ultrasonográfico más común es de una lesión de márgenes mal definidos, hipoecogénica, homogéneo y localizada en la segunda y/o tercera capa permaneciendo intacta la cuarta capa de la pared gástrica (6). En ocasiones se han descrito áreas hiperecogénica en el interior de la lesión que algunos autores sugieren que correspondería con una zona más hipervascularizada de la misma (7) y que son evidentes en nuestra paciente.
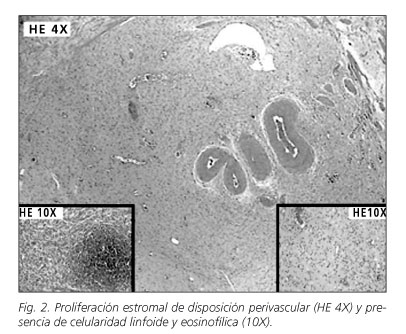
A nivel microscópico están formados por células principalmente mononucleares y mesenquimales con citoplasma fusocelular dispuestas a menudo en disposición perivascular siendo llamativa la presencia de eosinófilos. La celularidad proliferante se sitúa habitualmente en la submucosa profunda por lo que las muestras procedentes de biopsias estándar en muy pocas ocasiones dan el diagnóstico (8). Los estudios inmunohistoquímicos muestran positividad difusa para vimentina en las células fusocelulares estromales y reactividad variable para actina, CD34, CD68, desmina, CD117 y prot-S100 (9).
La mayor parte de los PFI gástricos presentan un curso clínico silente siendo hallazgos casuales por otras causas, no obstante pueden manifestarse con de dolor abdominal, pérdida de peso, hemorragia digestiva alta de origen oscuro, anemia ferropénica e intususcepción (10).
La resección endoscópica es el tratamiento de elección por su seguridad y eficacia. No obstante, en función del tamaño esta puede realizarse a través de una cirugía abierta o laparoscópica. Los PFI no recurren tras la resección.
En conclusión, aunque los PFI son poco frecuentes, debemos considerar su diagnóstico ante un paciente con un tumor submucoso gástrico. Dado que el diagnóstico rara vez puede ser estrictamente endoscópico la EE tiene un papel principal permitiendo conocer su origen, dimensiones, características así como cuando estas lesiones deben ser tratadas y mediante qué técnica.
C. Ortiz-Moyano1, R. C. Martínez-García2, D. Sánchez-Muñoz1 y M. Romero-Gómez1
1Unidad Gestión Clínica Enfermedades Digestivas y
2Departamento de Anatomía Patológica. Hospital Universitario de Valme. Sevilla
Bibliografía
1. Mori M, Tamura S, Enjoji M, Sugimachi K. Concomitant presence of inflammatory fibroid polyp and carcinoma or adenoma in the stomach. Arch Pathol Lab Med 1988; 112: 829-32. [ Links ]
2. Borch K, Skarsgard J, Franzen L. Benign gastric polyps. Morphological and functional origin. Digest Dis Scien 2003; 48(7): 1292-7. [ Links ]
3. Hirasaki S, Matsubara M, Ikeda F, Taniguchi H, Suzuki S. Gastric inflammatory polyp treated with Helicobacter pylori eradication therapy. Intern Med 2007; 46(12): 855-8. [ Links ]
4. Matsushita M, Takakuwa H, Nishio A. Characteristic endosonographic features of gastric inflammatory fibroid polyps. Endoscopy 2001; 33(8): 729-30. [ Links ]
5. Sadamoto Y, Kubo H, Tanaka M, Harada N, Takata M, Nawata H. Gastric inflammatory fibroid polyp. J Gastroenterol Hepatol 2001; 16: 1069. [ Links ]
6. Matsushita M, Hajiro K, Okazaki K, Takakuwa H. Gastric inflammatory fibroid polyps: endoscopic ultrasonographic analysis in comparison with the histology. Gastrointest Endosc 1997; 46: 53-7. [ Links ]
7. Aydin A, Tekin F, Gunsar F, Tuncyurek M. Gastric inflammatory fibroid polyp. Gastrointest Endosc 2004; 60(5): 802-3. [ Links ]
8. Ozolek JA, Sasatomi E, Swalsky PA, Rao U, Krasinskas A, Finkelstein SD. Inflammatory fibroid polyps of the gastrointestinal tract: clinical, pathologic, and molecular characteristics. Appl Immunohistochem Mol Morphol 2004; 12(1): 59-66. [ Links ]
9. Kolodziejczyk P, Yao T, Tsuneyoshi M. Inflammatory fibroid polyp of the stomach. A special reference to an immunohistochemical profile of 42 cases. Am J Surg Pathol 1993; 17(11): 1159-68. [ Links ]
10. Paikos D, Moschos J, Tzilves D, Koulaouzidis A, Kouklakis G, Patakiouta F, et al. Inflammatory fibroid polyp or Vanek's tumour. Dig Surg 2007; 24(3): 231-3. [ Links ]














