Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Española de Enfermedades Digestivas
versão impressa ISSN 1130-0108
Rev. esp. enferm. dig. vol.103 no.5 Madrid Mai. 2011
https://dx.doi.org/10.4321/S1130-01082011000500009
Amiloidosis y enfermedad de Crohn
Amyloidosis and Crohn's disease
Antonio Guardiola Arévalo1, Mariano Alcántara Torres1, Julio Valle Muñoz1, Rufo Humberto Lorente Poyatos4, Marta Romero Gutiérrez1, Rufo Rodríguez Merlo2, Alejandro Pérez Martínez3 y José María Carrobles Jiménez1
Servicios de 1Aparato Digestivo, 2Anatomía Patológica y 3Radiodiagnóstico. Hospital Virgen de la Salud. Toledo.
4Servicio de Aparato Digestivo. Hospital General de Ciudad Real. Ciudad Real
Dirección para correspondencia
RESUMEN
La amiloidosis sistémica adquirida es una complicación rara pero grave de la enfermedad inflamatoria intestinal crónica, pudiendo condicionar el pronóstico más que la propia enfermedad de base. Debido al mejor conocimiento de la asociación de amiloidosis secundaria a enfermedad inflamatoria intestinal, el diagnóstico temprano se hace cada vez con mayor frecuencia, pero su tratamiento continúa siendo un reto.
Describimos 4 casos clínicos de pacientes con enfermedad de Crohn (EC) y amiloidosis diagnosticados en las Unidades de EIIC de Toledo y Ciudad Real, lo que representa el 0,68% de los caso de EC de nuestras áreas sanitarias. No se ha descrito ningún caso de amiloidosis en pacientes con colitis ulcerosa. En los 4 pacientes la AA estaba claramente relacionada con la EC, y predominaron las formas estenosantes-perforantes. El cuadro clínico de presentación de la amiloidosis en la mayoría de los casos fue un síndrome nefrótico. Los pacientes respondieron al tratamiento médico-quirúrgico de la EC y a la colchicina, con lo que mejoró la función renal en todos los casos salvo en uno que precisó trasplante renal.
Palabras clave: Amiloidosis. Amiloidosis secundaria. Enfermedad inflamatoria intestinal. Enfermedad de Crohn. Síndrome nefrótico. Insuficiencia renal.
ABSTRACT
Secondary amyloidosis is a rare but serious complication of inflammatory bowel disease that may influence the prognosis even more than the underlying disease. Due to a better knowledge of the association of secondary amyloidosis to inflammatory bowel disease, early diagnosis of this complication is becoming more frequent, but it's treatment continues to pose a challenge.
We report 4 cases of patients with Crohn's disease and amyloidosis diagnosed in the inflammatory bowel disease Units of Toledo and Ciudad Real, which represent 0.68% of the patients with Crohn's disease of our health areas. There have been not cases of amyloidosis in patients with ulcerative colitis. In our 4 patients the secondary amyloidosis was clearly related to Crohn's disease, which was often of fistulising type. The predominant clinical picture of amyloidosis was nephrotic syndrome. The patients responded to medical and surgical treatment of Crohn's disease and colchicine, which improved renal function in all cases except in one who required kidney transplantation.
Key words: Amyloidosis. Secondary amyloidosis. Inflammatory bowel disease. Crohn´s disease. Nephrotic syndrome. Renal failure.
Introducción
La amiloidosis es una entidad clínica que se produce por el depósito a nivel extracelular de un material proteico de bajo peso molecular, insoluble, rígido, amorfo, de estructura fibrilar (amiloide) y disposición beta-plegada. Esta causa una desorganización de la estructura de los órganos y tejidos donde asienta, con la consiguiente alteración de la funcionalidad de los mismos (1).
La amiloidosis secundaria o amiloidosis A (AA) tiene como precursor los fragmentos N-terminal de la proteína sérica amiloide o amiloide sérico (SAA). Este es un reactante de fase aguda que aparece en situaciones de inflamación mantenida como en neoplasias, enfermedades -infecciosas (tuberculosis, fiebre mediterránea familiar, bronquiectasias u osteomielitis, entre otras) y enfermedades inflamatorias crónicas -reumatológicas principalmente, pero también en la enfermedad inflamatoria intestinal crónica (EIIC) (2,3).
La AA es una asociación infrecuente, pero grave de la EIIC, siendo más frecuente en la enfermedad de Crohn (EC) que en la colitis ulcerosa (CU) (2,4), pudiendo llegar a condicionar el pronóstico más que la propia enfermedad de base (4,5).
Material y métodos
Se han revisado las historias existentes en las Unidad de EIIC del Hospital Virgen de la Salud de Toledo (HVST) y del Hospital General de Ciudad Real (HGCR) hasta diciembre de 2009. En total se han revisado 1.140 historias de pacientes con EIIC, siendo 920 historias del HVST (457 con EC, y 463 con CU) y 220 historias del HGCR (130 con EC y 90 con CU). Se seleccionaron los pacientes que habían desarrollado amiloidosis en el contexto de la EIIC, analizándose sus antecedentes personales, familiares, forma de presentación, tratamientos pautados y evolución clínica.
Encontramos 4 casos con EIIC a los que se les había diagnosticado de AA (3 del HVST y 1 del HGCR), siendo todos ellos pacientes con EC, no habiéndose diagnosticado a ningún paciente con CU de AA.
El diagnóstico de EIIC se realizó con criterios clínicos, analíticos, radiológicos, endoscópicos y anatomopatológicos. En todos los casos se confirmó histológicamente la amiloidosis.
Casos clínicos (Tabla I)
Caso clínico 1
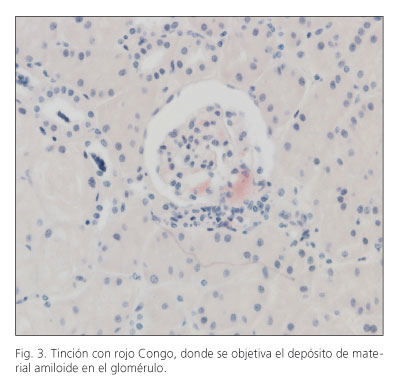
Varón de 28 años, con hipotiroidismo primario como único antecedente personal de interés, que es diagnosticado a esa edad de EC cólica patrón inflamatorio a nivel de colon ascendente. De forma simultánea comenzó con clínica y analítica compatible con síndrome nefrótico. Ante la sospecha de una posible AA renal concomitante con la EC se decidió realizar biopsia renal, que confirmó dicha sospecha (Figs. 1, 2 y 3). Se pautó tratamiento corticoideo para la EC, y colchicina para la AA, con buena evolución posterior. Tras 12 años de seguimiento el paciente sólo ha estado tratado con 5-ASA, sin necesidad de colchicina ni de corticoides, presentando EC en remisión clínica y endoscópica, función renal normal y proteinuria en rango no nefrótico.
Caso clínico 2
Varón de 41 años, fumador, que con 26 años fue diagnosticado de EC íleo-cólica. Durante el seguimiento presentó una fístula perianal y un cuadro de suboclusión -intestinal secundario a un brote de su EC, objetivando fístula entero-vesical, que requirió intervención quirúrgica (resección íleo-cólica). Coincidiendo con el cuadro de suboclusión comenzó con edemas en miembros inferiores, deterioro de la función renal y proteinuria en rango nefrótico, realizándosele biopsia renal que confirmó la sospecha de AA renal. Recibió tratamiento con colchicina con mejoría clínica y de la función renal. La EC recidivó en la anastomosis siendo tratado con azatioprina, con lo que ha controlado la enfermedad intestinal, aunque persiste la fístula perianal de forma oligosintomática. En la actualidad mantiene tratamiento con azatioprina más mesalacina, presentando función renal normal, con persistencia de proteinuria en rango no nefrótico.
Caso clínico 3
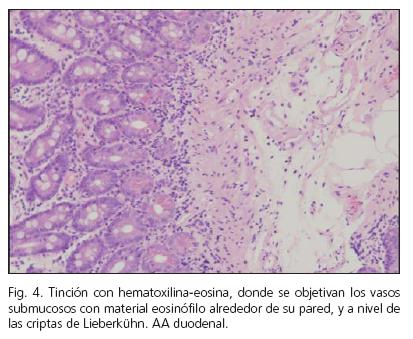
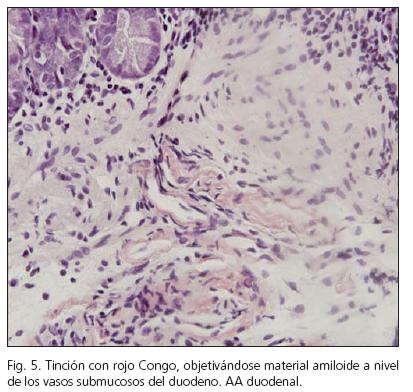
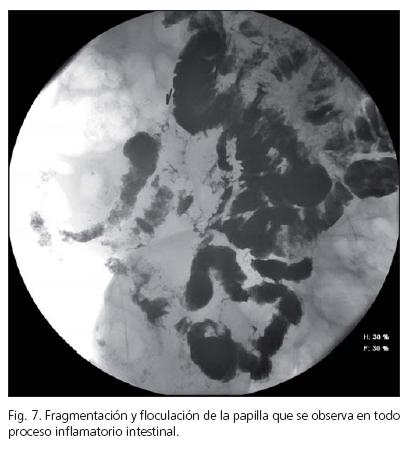
Varón de 58 años, exfumador, y diagnosticado de tumor germinal retroperitoneal a los 32 años con necesidad de intervención quirúrgica y tratamiento quimioterápico con cisplatino. Comenzó cuatro meses antes con cuadro de dolor abdominal difuso, náuseas, y algún vómito, junto con diarrea sin productos patológicos. En la analítica se objetiva anemia de trastornos crónicos, deterioro de la función renal y proteinuria en rango nefrótico. En el tránsito intestinal presenta patrón de edema-estenosis de asas de íleon distal (Figs. 4 y 5). Se le realizó gastroscopia siendo normal, tomándosele biopsias de segunda porción duodenal. La colonoscopia fue sugestiva de EC ileal, confirmándose en las biopsias, y diagnosticándosele a su vez de AA intestinal tanto a nivel duodenal como en colon (Figs. 6 y 7). Recibió tratamiento con corticoides y colchicina en el brote agudo. La EC en la actualidad está en remisión clínica y endoscópica, recibiendo tratamiento con 5-aminosalicilatos, pero persistiendo la proteinuria en rango no nefrótico y un deterioro leve de la función renal.
Caso clínico 4
Mujer de 48 años, alérgica a penicilinas, hipotiroidismo en tratamiento sustitutivo, gastritis crónica erosiva H. pylori positiva erradicado, y anemia microcítica refractaria a tratamiento con hierro. Con 40 años es diagnosticada de EC de íleon terminal mediante TAC abdominal y colonoscopia, con patrón estenosante-inflamatorio, pautándose tratamiento con 5-ASA. A los 43 años se objetiva insuficiencia renal progresiva. Se retiró 5-ASA sin mejoría de la función renal, iniciándose tratamiento con azatioprina teniendo que ser suspendida por reacción alérgica. Ha necesitado múltiples tratamientos con budesonida y prednisona. Es seguida por el servicio de nefrología por el empeoramiento de la función renal, decidiendo la realización de biopsia renal, siendo diagnosticada de AA renal. No presentó mejoría con tratamiento farmacológico, aunque no recibió tratamiento con colchicina, con necesidad de hemodiálisis por progresión de la enfermedad y trasplante renal a los 47 años. En la actualidad está en tratamiento con suplementos de nutrición enteral, tacrólimus y ácido micofenólico, con evolución favorable tanto de su EC como del trasplante renal.
Discusión
La AA secundaria a EC es una asociación poco frecuente, siendo descrita por primera vez por Moschkowitz en 1936 (6), y posteriormente a finales de los años cuarenta por Olsan y Sussman (7). En las series con mayor número de pacientes publicadas la incidencia fue menor del 1% (2,4), siendo en nuestra serie similar, un 0,68%. No hemos diagnosticado ningún paciente con AA y colitis ulcerosa, dato hasta cierto punto razonable, pues la prevalencia publicada de esta asociación es todavía menor, con una incidencia en torno al 0,07% (8).
El tiempo de desarrollo de la AA después del diagnóstico de EC es muy variable oscilando entre 1 y 42 años (4). En ocasiones el diagnóstico de AA se hace de forma simultánea con el de la EC. En nuestra serie el tiempo medio hasta el diagnóstico de AA fue de dos años, siendo esto así pues de nuestros 4 casos hay dos en los que el diagnóstico de ambas enfermedades se realizó de forma simultánea, no siendo esta forma de presentación tan infrecuente, como se describe en la literatura (3,9,10).
Se ha objetivado que existe una mayor frecuencia de esta asociación en el sexo masculino (1-4,10), concordando nuestra serie de casos con estos datos (75% de nuestros pacientes son varones), sin que se haya podido explicar todavía este hecho.
El patrón clínico que más se relaciona con esta asociación es el estenosante-fistulizante y generalmente acompañado de complicaciones supurativas (2,4). En nuestra serie presentaron patrón estenosante 3 de los 4 pacientes descritos, presentando 1 de ellos (caso 2) complicación con fístula. La AA se suele asociar con mayor frecuencia a localización ileal, siendo también la localización más frecuente en nuestra serie (75%).
No se ha objetivado que los pacientes con EII que desarrollan AA presenten más manifestaciones extraintestinales que los pacientes que no desarrollan AA (2,4,5). Ninguno de nuestros 4 pacientes presentaban manifestaciones extraintestinales.
La presentación clínica más frecuente es la AA renal, llegando en algunas series hasta el 90% (4,11-15). Se manifiesta como insuficiencia renal, proteinuria, pudiendo progresar a síndrome nefrótico como en todos nuestros pacientes, e incluso llegar a fallo renal grave con necesidad de diálisis y trasplante renal como se describe en el caso 4 de nuestra serie. Datos que ayudan en el diagnóstico diferencial del fracaso renal agudo son que presentan hipotensión arterial en vez de hipertensión, y además el tamaño y morfología de ambos riñones es normal (13).
La sustancia amiloide también se puede depositar en el tracto gastrointestinal, como en el caso 3 de nuestra serie, lo que causa malabsorción, debiendo sospecharse si esta es mayor a lo que cabría esperar si se tuviera únicamente la EC o si persiste tras la resección quirúrgica de la zona afecta.
El diagnóstico requiere de la confirmación histológica del órgano diana, como en nuestros casos con biopsia renal (casos 1, 2 y 4), presentando una alta eficacia diagnóstica. En el caso de no poderse obtener biopsias del órgano en teoría afecto se pueden obtener muestras de localizaciones más accesibles y de menor riesgo como son la grasa abdominal o el recto, pero con una menor sensibilidad diagnóstica (11). En el caso 3 de nuestra serie se obtuvieron muestras de duodeno y colon que mostraron amiloidosis en dichas localizaciones, no realizándose biopsias renales por el riesgo de las mismas, siendo el diagnóstico de amiloidosis renal muy probable por la clínica y la localización de AA en las localizaciones descritas. En el estudio histológico se realiza tinción con rojo Congo, que muestra birrefringencia verde típica con el microscopio de luz polarizada, y a su vez se realiza inmunohistoquímica específica para AA, que permite diferenciar entre los diferentes tipos de amiloide.
El diagnóstico precoz de la asociación entre la EII y la AA mejora el pronóstico de estos pacientes pues les permite beneficiarse cuanto antes del tratamiento más conveniente en cada caso, y evitar así una mayor pérdida de la función del órgano sobre el que asienta.
El objetivo del tratamiento en estos pacientes es doble: en primer lugar, tratar la enfermedad de base, la EC, para evitar la formación de la proteína precursora del amiloide (amiloide sérico, SAA), que luego se depositará en los tejidos; y en segundo lugar, tratar la AA ya establecida en el órgano afecto.
Aunque las series descritas son cortas se ha objetivado en múltiples publicaciones la eficacia de la colchicina en la AA con buenos resultados (5,15-17), como se objetiva en los casos 1, 2 y 3 de nuestra serie, con estabilización, mejoría o incluso normalización de la función renal.
También se ha usado el dimetilsulfóxido como tratamiento de la AA secundaria a la EII, con mejoría de la proteinuria y del aclaramiento de creatinina, manteniendo la mejoría un año después de haber finalizado dicho tratamiento (18).
En los últimos años se están publicando casos en los que se describe buena respuesta de la AA al tratamiento con antifactor de necrosis tumoral alfa (anti-TNF-alfa), en concreto con infliximab (IFX) (19-22). Todo ello se ha basado en la buena respuesta que los anti-TNF-alfa han tenido en la AA a artritis inflamatoria en diferentes trabajos (23-25). En los diferentes casos publicados se consigue disminuir o incluso normalizar los niveles séricos de SAA, y se disminuyen las cifras de proteinuria, pero la mejoría en la función renal es más discreta. Aunque no se ha demostrado, algunos autores sugieren que el anti-TNF-alfa no sólo reduciría la síntesis de SAA, sino que además reduciría el amiloide ya depositado (26). Ninguno de los pacientes que presentamos recibió tratamiento biológico.
Aunque en algunos casos la mejoría que se objetiva con anti-TNF-alfa no es suficiente y el paciente puede terminar necesitando hemodiálisis y/o trasplante renal de forma inevitable, este tratamiento sí puede servir de puente para que los pacientes lleguen en mejores condiciones a la diálisis y/o al trasplante renal en pacientes con fallo renal moderado o severo (22).
La diálisis y el trasplante renal son las únicas alternativas que les quedan a los pacientes en los que no se controla la enfermedad con el tratamiento médico, progresando hasta llegar a insuficiencia renal terminal (1,14). Así ocurrió en el caso 4 de nuestra serie, pero pueden evolucionar bien tras el trasplante ya que los fármacos inmunosupresores necesarios para el mantenimiento del trasplante también ayudan a mantener la EC inactiva.
Un tema en discusión continúa siendo si tiene algún papel beneficioso la resección del intestino afecto por la EII en evitar la progresión de la AA. Se han descrito casos de regresión de la amiloidosis tras la resección quirúrgica (27-29), como podría ser en el caso 2 de nuestra -serie, aunque en nuestro caso no podemos atribuir directamente este beneficio sólo a la resección realizada, ya que el paciente también recibió tratamiento farmacológico para la EC y la AA. En otros estudios publicados el beneficio es dudoso, y no se puede obviar que la mortalidad operatoria puede ser mayor en pacientes con amiloidosis y EII (4,14,30), aunque no haya habido mortalidad en el paciente de nuestra serie intervenido.
Es verdad que en la actualidad se conoce más esta asociación, por lo que se diagnostica antes, pasando de ser un diagnóstico postmortem (31), a ser un diagnóstico en vida, y además tenemos tratamientos y alternativas terapéuticas que han mejorado el pronóstico de dichos pacientes. Pero no hay que olvidar que sigue siendo una -enfermedad potencialmente letal como se describe en diferentes publicaciones (14,15,32,33), siendo el nivel sérico de creatinina lo que se ha asociado más fuertemente con la supervivencia (4,34), por lo que ante todo paciente con EC que comience con deterioro de la función renal se debe tener presente en el diagnóstico diferencial esta asociación.
En resumen podemos concluir que la amiloidosis en pacientes con EC es una complicación infrecuente, siendo mucho más rara en pacientes con CU. Predomina en el sexo masculino con EC ileal o ileocólica y con formas clínicas severas. La amiloidosis suele manifestarse como un deterioro de la función renal y un síndrome nefrótico, diagnosticándose a veces de forma simultánea con la EC. El tratamiento se basa en colchicina y el control médico-quirúrgico de la EC, consiguiendo en la mayoría de las ocasiones evitar la progresión y mejorar la evolución de ambas enfermedades.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Antonio Guardiola Arévalo.
Servicio de Aparato Digestivo.
Hospital Virgen de la Salud.
Avda. Barber, 30. 45004 Toledo
e-mail: tonig2004@terra.es
Recibido: 14-06-10.
Aceptado: 31-08-10.
Bibliografía
1. Lovat LB, Madhoo S, Pepys MB, Hawkins PN. Long-term survival in systemic amyloid A amyloidosis complicating Crohn's disease. Gastroenterology 1997;112:1362-5. [ Links ]
2. Wester AL, Vant MH, Fausa O. Secundary amyloidosis in inflammatory bowel disease: a study of 18 patients admitted to Rikshospitalet University Hospital, Oslo, from 1962 to 1998. Inflammatory Bowel Diseases 2001;7:295-300. [ Links ]
3. Fernandez-Castroagudín J, Brage-Varela A, Lens-Neo XM, Martínez-Castro J, Abdulkader I. Amiloidosis renal como manifestación clínica inicial de la enfermedad de Crohn. Gastroenterol Hepatol 2002;25:395-7. [ Links ]
4. Greenstein AJ, Sachar DB, Panday AK, Dikman SH, Meyer S, Herman T, et al. Amyloidosis and inflammatory bowel disease. A 50-year experience with 25 patients. Medicine 1992;71:261-70. [ Links ]
5. Garrido-Serrano A, Guerrero-Igea JF, Hierro-Guilmain C, Ruiz-Lupiañez E, Palomo-Gilá S. Respuesta favorable a la colchicina en la amiloidosis secundaria a la enfermedad inflamatoria intestinal. Gastroenterol Hepatol 2001;24:196-8. [ Links ]
6. Moschkowitz E. The clinical aspects of amyloidosis. Ann Intern Med 1936;10:73-89. [ Links ]
7. Olsan ES, Sussman ML. Nonspecific enterocolitis. Am J Roentgenol 1948;60:471-85. [ Links ]
8. Triviño A, Sanchez Lombraña JL, Linares A, Pérez R, Herrero Zapatero A, Rodrigo L. Ulcerative colitis and amiloidosis. Presentation of a case and review of the literature. Rev Esp Enferm Dig 1992;82: 117-20. [ Links ]
9. Martínez JG, Saus C, Morey A, Alarcón A. Enfermedad de Crohn y amiloidosis renal. Fracaso renal agudo. Nefrología 2002; 22(4):397. [ Links ]
10. Rashid H, Blake D, Gokal R, Gooptu D, Kerr DNS. The association of renal amyloidosis with regional enteritis (Crohn's disease). Report of two cases and review of the literature. Clinical Nephrol 1980;14: 154-7. [ Links ]
11. Palma CL, Grünholz D. Osorio G. Clinical features of patients with the pathological diagnosis of amiloidosis. Rev Med Chil 2005; 133 (6):655-61. [ Links ]
12. Falk RH, Comenzo RL, Skinner M. The systemic amyloidoses. N Engl J Med 1997;337(13):898-909. [ Links ]
13. Khan MF, Falk RH. Amyloidosis. Postgrad Med J 2001;77(913) 686-93. [ Links ]
14. Iñarrairaegui Bastarrica M, Arín Letamendia A, Zozaya Urmeneta JM, Rodríguez Gutiérrez C, Castán Martínez B, Amat Villegas I, et al. Inflammatory bowel disease and amiloidosis. Gastroenterol Hepatol 2004;27(4):260-3. [ Links ]
15. Seijo Ríos S, Barreiro de Acosta M, Vieites Pérez-Quintela B, Iglesias Canle J, Forteza J, Domínguez Muñoz J.E. Secondary amyloidosis in Crohn's disease. Rev Esp Enferm Dig 2008;100(12):792-7. [ Links ]
16. Rubinow A, Celli BR, Cohen AS, Ridgen BG, Brody JS. Localized amyloidosis of the lower respiratory tract. Am Rev Respir Dis 1978; 118:603-11. [ Links ]
17. Utz JP, Swenswn SJ, Gertz MA. Pulmonary amyloidosis: the Mayo clinic experience from 1980 to 1993. Ann Intern Med 1996; 124:407-13 [ Links ]
18. Efstratiandis G, Mainas A, Leontsini M. Renal amyloidosis complicating Crohn's disease: case report and review of the literature. J Clin Gastroenterol 1996;22:308-10. [ Links ]
19. Larvol L, Cervoni JP, Besnier M, Duponet L, Beaufils H, Clauvel JP, et al. Reversible nephrotic syndrome in Crohn's disease complicated with renal amyloidosis. Gastroenterol Clin Biol 1998;22:639-41. [ Links ]
20. Iwakiri R, Sakemi T, Fujimoto K. DMSO for renal disfunction caused by systemic amiloidosis complicating Crohn's disease. Gastroenterology 1999;117:1031-2. [ Links ]
21. Bosca MM, Perez-Baylach CM, Solis MA, Antón R, Mayordomo E, Pons S, et al. Secondary amyloidosis in Crohn's disease: treatment with tumour necrosis factor inhibitor. Gut 2006;55:294-5. [ Links ]
22. Iizuka M, Konno S, Horie Y, Itou H, Shindo K, Watanabe S. Infliximab as a treatment for systemic amiloidosis associated with Crohn's disease. Gut 2006;55:744-5. [ Links ]
23. Fernandez-Nebro A, Ureña I, Irigoyen MV, García-Vicuña R. Anti-TNF-alpha for treatment of amiloidosis associated with Crohn's disease. Gut 2006;55(11):1666-7. [ Links ]
24. Park YK, Han DS, Eun CS. Systemic amyloidosis with Crohn's disease treated with infliximab. Inflamm Bowel Dis 2008;14(3):431-2. [ Links ]
25. Elkayam O, Hawkins PN, Lachmann H, Yaron M, Caspi D. Rapid and complete resolution of proteinuria due to renal amyloidosis in a patient with rheumatoid arthritis treated with infliximab. Arthritis Rheum 2002;46(10):2571-3. [ Links ]
26. Gottenberg JE, Merle-Vincent F, Bentaberry F, Allanore Y, Berenbaum F, Fautrel B, et al. Anti-tumor necrosis factor alpha therapy in fifteen patients with AA amyloidosis secondary to inflammatory arthritides: a follow up report of tolerability and efficacy. Arthritis Rheum 2003;48(7):2091-24. [ Links ]
27. Fernández-Nebro A, Tomero E, Ortiz-Santamaría V, Castro MC, Olivé A, de Haro M, et al. Treatment of rheumatic inflammatory disease in 25 patients with secondary amyloidosis using tumor necrosis factor alpha antagonists. Am J Med 2005;118(5):552-6. [ Links ]
28. Verschueren P, Lensen F, Lerut E, Claes K, De Vos R, Van Damme B, et al. Benefit of anti-TNF alpha treatment for nephrotic syndrome in a patient with juvenile inflammatory bowel disease associated spondyloarthropathy complicated with amyloidosis and glomerulonephritis. Ann Rheum Dis 2003;62:368-9. [ Links ]
29. Fitchen JH. Amyloidosis and granulomatous ileocolitis: regression after surgical removal of the involved bowel. N Engl J Med 1975; 292:352-3. [ Links ]
30. Mandelstam P, Simmons DE, Mitchell B. Regression of amyloid in Crohn's disease after bowel resection. J Clin Gastroenterol 1989; 11:324. [ Links ]
31. Leiper K, Howse ML, Bell GM. Resolution of nephritic syndrome caused by amyloidosis following surgery for Cron's disease. Hop Med 2000;61(11):802-3. [ Links ]
32. Mir-Madjlessi SH, Brown CH, Hawk WA. Amyloidosis associated with Crohn's disease. Am J Gastroenterol 1972;58:563-77. [ Links ]
33. Wether JL, Schapira A, Rubinstein O, Janowitz HD. Amyloidosis in regional enteritis. Am J Med 1960;29:416-26. [ Links ]
34. Shorvon PJ. Amyloidosis and inflammatory bowel disease. Am J Dig Dis 1977;22:209-13. [ Links ]
35. Westerman IT, Biemond I, Peña AS. Mortality and causes of death in Crohn's disease. Review of 50 years experience in Leiden University Hospital. Gut 1990;31:1387-90. [ Links ]
36. Gertz MA, Kyle LA. Secondary systemic amiloidosis: response and survival in 64 patients. Medicine 1991;70:246. [ Links ]











 texto em
texto em