My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.104 n.3 Madrid Mar. 2012
https://dx.doi.org/10.4321/S1130-01082012000300006
Situación actual en el tratamiento del cáncer gástrico
Current management of gastric cancer
Antonio Viúdez Berral1, Coro Miranda Murua2, Fernando Arias de la Vega3, Irene Hernández García1, Alicia Artajona Rosino2, Álvaro Díaz de Liaño2 y Ruth Vera García1
1Servicio de Oncología Médica, 2Área de Cirugía. Unidad de Cirugía Esófago-Gástrica y 3Servicio de Oncología Radioterápica. Complejo Hospitalario de Navarra. Pamplona
Dirección para correspondencia
RESUMEN
El cáncer gástrico es un tumor de alta incidencia y mortalidad en nuestro medio, y su pronóstico está íntimamente relacionado con la situación neoplásica al diagnóstico, que incluye su extensión en el grosor de la pared gástrica, sobre los ganglios linfáticos locorregionales y su capacidad de generar metástasis a distancia, extensión basada en la clasificación TNM.
En aquellos tumores localizados al diagnóstico, caracterizados por la invasión únicamente de mucosa-submucosa, la supervivencia a 5 años se establece entre el 70 y el 95% con manejo quirúrgico exclusivo, sin embargo, cuando la extensión en la pared es mayor y/o existe afectación ganglionar locorregional, la supervivencia disminuye al 20-30% a 5 años.
Actualmente en centros con alto volumen de pacientes, la extensión de la gastrectomía se individualiza en función de varios parámetros, optándose, en cada vez más casos, por la realización de una gastrectomía total con linfadenectomía D2 y preservación esplenopancreática, pues esta aumenta las posibilidades de conseguir una cirugía R0 y mejora la relación entre ganglios resecados y ganglios afectados, lo que se traduce en una disminución del riesgo de recidiva locorregional a largo plazo.
Con el objetivo de mejorar estos resultados, se han ensayado distintas estrategias terapéuticas de quimioterapia o quimiorradioterapia asociadas a la cirugía. Entre todas ellas destaca el ensayo 0116 del intergroup, publicado en el 2001, que cambió la práctica clínica asistencial en Estados Unidos, ya que demostró que un tratamiento de quimiorradioterapia tras la cirugía mejoraba la supervivencia (de 26 a 37 meses de mediana) de estos pacientes. En Europa es la quimioterapia perioperatoria el tratamiento estándar habitual, desde que se publicaron dos estudios aleatorizados fase III que demostraron un aumento en la supervivencia a 5 años en el grupo tratado con quimioterapia.
Palabras clave: Cáncer gástrico. Cirugía del cáncer gástrico. Quimioterapia perioperatoria. Quimioterapia adyuvante. Quimiorradioterapia adyuvante.
ABSTRACT
Gastric cancer is a disease with high incidence and mortality in our population. The prognosis of patients with this disease is closely related to the neoplasm stage at diagnosis, including the following characteristics of the tumor: extension into the gastric wall thickness, spread to locoregional lymph nodes and the ability to generate distant metastases, as described by the TNM classification.
For localized tumors characterized only by invasion of mucosa or submucosa at diagnosis, survival at 5 years is between 70 and 95% with exclusive surgical management; however, when extension into the gastric wall is higher and/or there is locoregional nodal involvement, survival decreases to 20-30% at 5 years.
Currently, at high-volume centers, the extent of gastrectomy is individualized based on several parameters, which in an increasing number of cases allows a total gastrectomy with D2 lymphadenectomy and preservation of the spleen and pancreas. This improved procedure increases the chance of R0 surgery and improves the relationship between resected and affected lymph nodes, resulting in a decreased risk of the long-term locoregional recurrence.
To improve these results, different therapeutic strategies combining chemotherapy or chemoradiotherapy with surgery have been tested. Previously, the Intergroup 0116 clinical trial, published in 2001, which changed clinical practice in the United States, showed that adjuvant chemoradiotherapy improved survival (from 26 to 37 months overall survival) of these patients. In Europe, perioperative chemotherapy has been considered the standard treatment, since the publication of two randomized phase III trials showed an increase at 5 years survival in the group treated with chemotherapy.
Key words: Gastric cancer. Gastric cancer surgery. Perioperative chemotherapy. Adjuvant chemotherapy. Adjuvant chemoradiotherapy.
Introducción
Durante la segunda mitad del siglo pasado, el cáncer de estómago ha sido el tumor del aparato digestivo más frecuentemente diagnosticado en ambos sexos. Actualmente, el aumento de la incidencia de los tumores colorrectales, ha colocado al cáncer gástrico en segundo lugar entre los tumores digestivos, tanto en tasas de mortalidad como de incidencia, en los países desarrollados. Existen grandes variaciones geográficas en su distribución, tanto entre países como entre regiones dentro de los mismos (1). El cáncer gástrico se diagnostica más frecuentemente en hombres, con una razón de masculinidad de dos (2).
En el continente europeo, el cáncer gástrico ocupa el sexto lugar en incidencia en hombres, y el quinto en mujeres. España presentaba una tasa estimada para 2006 de 23,04 casos por 100.000 habitantes, algo superior a la media de la Unión Europea. Sin embargo, al analizar la mortalidad en España, este tumor se sitúa en el quinto puesto en importancia en hombres (por detrás del cáncer de pulmón, colorrectal, próstata y vejiga) así como en mujeres (después del cáncer de mama, colorrectal, pulmón y páncreas). Según los últimos datos publicados por el Instituto Nacional de Estadística (INE), el cáncer gástrico fue la causa principal de muerte en 2006 en 3.533 hombres y en 2.170 mujeres, lo que supone una tasa estandarizada por edad en España de 13 por 100.000 habitantes en hombres y 5,5 en mujeres. Su supervivencia sigue siendo mala, inferior al 28% a los 5 años en nuestro país (3).
En España, el análisis de la tendencia temporal de la mortalidad muestra un fuerte descenso desde 1975, de un 3% anual, con un patrón bastante similar en hombres y en mujeres. La distribución geográfica de este tumor es muy característica dentro del estado, existiendo importantes diferencias regionales. A pesar de la disminución de la mortalidad que se ha producido en las últimas décadas en prácticamente todas las provincias, sigue apareciendo un patrón "costa-interior" (4). Así, destacan las tasas correspondientes a Castilla-León y municipios de la costa de Galicia, que se encuentran entre las más altas de Europa.
Los factores conocidos como causa de la evolución de la epidemia de cáncer gástrico a nivel internacional, se relacionan con el nivel socioeconómico de los individuos; así, el descenso de las tasas de incidencia y mortalidad relacionados con el cáncer gástrico, se interpreta como consecuencia del desarrollo propio de los países industrializados. El nivel socioeconómico está relacionado con la exposición a distintos factores, como son el tipo de dieta, las infecciones por Helicobacter pylori, el tabaco, y ciertas exposiciones laborales. Sin embargo, el hecho de que un país como Japón tenga unas tasas muy elevadas de cáncer de estómago, indica que el nivel socioeconómico no es una variable única que recoja adecuadamente todas las exposiciones de riesgo para el cáncer gástrico, y que factores culturales inherentes a los distintos estilos de vida, como la dieta, probablemente tengan una importancia considerable. Esto ayudaría a explicar también las diferencias considerables observadas en España entre algunas provincias. Entre otros factores de riesgo relacionados con este tumor destacan los antecedentes de gastrectomía parcial, la historia previa familiar de cáncer gástrico, la anemia perniciosa, el grupo sanguíneo A y la exposición a radiaciones ionizantes (5).
Tratamiento
Los principales tratamientos oncológicos del carcinoma gástrico se basan en la cirugía, las terapias sistémicas y la radioterapia. Lógicamente, también la paliación activa supone una parte importante del tratamiento oncológico, e incluye la colocación de endoprótesis, las derivaciones quirúrgicas y las medidas de soporte. El manejo del cáncer gástrico requiere, obviamente, un enfoque multidisciplinar (1).
Tratamiento de la enfermedad resecable
En nuestro medio, en el momento del diagnóstico, solo el 40% de los pacientes serán diagnosticados en un escenario de enfermedad resecable. De estos casos, que son intervenidos, solo la tercera parte se filiaran dentro de un estadio precoz (IA y IB) y en el resto, el análisis histológico de la pieza quirúrgica mostrará una enfermedad que, aunque resulte ser resecable, se considerará ya localmente avanzada (II, III y M0). El otro 60% de los pacientes no serán subsidiarios de cirugía oncológica radical, la mitad de ellos por padecer una enfermedad localmente avanzada irresecable y la otra mitad por ser diagnosticados en contexto metastásico (6).
Globalmente el 60% de los pacientes en los que se logra una resección quirúrgica completa (R0) recaerán, de forma que, en términos absolutos, la cirugía aportará la curación del 16% de todos los pacientes diagnosticados de cáncer gástrico.
En cuanto al lugar de recidiva, esta se considera locorregional hasta en el 70% de los casos, peritoneal en el 25-50%, hepática en el 30% y extra-abdominal en el 30-50%. Se ha intentado mejorar estos resultados añadiendo diversos tratamientos complementarios, bien sea después de la cirugía (quimioterapia y quimio-radioterapia adyuvantes), antes de la cirugía (quimioterapia y quimio-radioterapia neoadyuvantes), o antes y después de la cirugía (quimioterapia perioperatoria).
Tratamiento quirúrgico
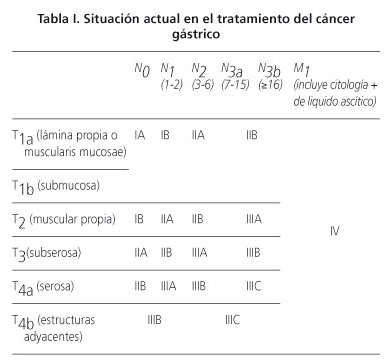
La estadificación preoperatoria tiene como finalidad determinar la extensión de la enfermedad, con el fin de establecer un plan terapéutico personalizado. Se basa en las directrices marcadas por la 7a Edición de la clasificación TNM, avalada por la UICC y la AJCC en el 2010.
La agrupación por estadios, según dicha clasificación, se muestra en la tabla I.
El diagnóstico preoperatorio se sustenta en la confirmación de la enfermedad y en el diagnóstico de la extensión de la misma. La endoscopia, con toma de biopsia, es la prueba que permite la confirmación histológica de malignidad. La ecoendoscopia, cuya fiabilidad depende del especialista que la realiza (7), ofrece una sensibilidad para la estadificación clínica T entre el 65-92%, variando para el estadio N entre el 50-95%, y puede llegar a generar un cambio en el manejo terapéutico en, aproximadamente, un 25% de las ocasiones (8). La TAC (tomografía axial computarizada) se emplea para el diagnóstico de extensión a distancia de la enfermedad, con una sensibilidad para el estadiaje clínico T entre el 43-82%. La PET no ha demostrado una adecuada sensibilidad en el diagnóstico preoperatorio del carcinoma gástrico, sin embargo, en algunas ocasiones, asociado a la TAC, puede ser útil (9).
La laparoscopia exploradora es un procedimiento de estadificación preoperatoria en pacientes potencialmente resecables, especialmente en aquellos sometidos a tratamiento neoadyuvante, en pacientes con elevación inexplicable de los marcadores y en pacientes con diagnóstico de linitis plástica. Varios son los estudios que sitúan la posibilidad de diagnóstico de enfermedad avanzada, con laparoscopia, en torno al 30% (10).
El objetivo del tratamiento quirúrgico es la resección completa de la enfermedad y de los ganglios linfáticos locorregionales, así como la reconstrucción de la continuidad digestiva, con un máximo de seguridad y un mínimo de complicaciones y/o secuelas. El tipo de tratamiento se establece, de manera consensuada, dentro de unidades multidisciplinares, en función de la localización anatómica del tumor, la estadificación preoperatoria y la comorbilidad asociada a cada paciente (1).
La presencia de afectación ganglionar, con confirmación histológica, de los niveles 3 y 4 según la clasificación de la Japanese Research Society for Gastric Cancer (11), la invasión de estructuras vasculares mayores, y la diseminación a distancia, hepática y/o peritoneal (incluido la citología peritoneal positiva), son criterios de irresecabilidad quirúrgica.
De acuerdo con la UICC, el tratamiento quirúrgico con intención curativa persigue eliminar toda la enfermedad tumoral, consiguiendo márgenes de seguridad sin restos microscópicos de enfermedad, lo que se denomina cirugía R0 y comporta un mejor control de la enfermedad a largo plazo. El tratamiento quirúrgico se considera R1 cuando persisten restos microscópicos de enfermedad o R2 cuando los restos tumorales son macroscópicos.
La cirugía con intención curativa puede clasificarse en cuatro entidades: a) resección estándar, b) resección no estándar, en la que la extensión de la gastrectomía y/o de la linfadenectomía se modifica de acuerdo con determinadas características del tumor, c) resección modificada, en la que se reduce la extensión de gastrectomía y/o linfadenectomía y d) gastrectomía extendida, en la que se contempla la resección en bloque de órganos vecinos, o linfadenectomía, en la que se disecan niveles ganglionares superiores a D2 (12). En cambio, la resección con intención paliativa se aplica en las complicaciones generadas por el tumor primario o la recaída, bien en forma de hemorragia o de obstrucción.
En los tumores de antro pilórico, la gastrectomía subtotal ha demostrado idénticos resultados en supervivencia y mortalidad que la gastrectomía total, con un índice de complicaciones y desórdenes nutricionales menor (13,14). Las guías de tratamiento del cáncer gástrico recomiendan un margen macroscópico, desde el borde del tumor hasta el sección gástrica, de al menos, 5 cm (1,15,16), ya que la afectación microscópica del borde de resección es un factor bien establecido de mal pronóstico, pues conlleva un mayor riesgo de recaída locorregional, y con ello menor supervivencia (17,18). Por ello, en el caso de márgenes amenazados en gastrectomía subtotal o en gastrectomía total de tumores cardiales, se recomienda el estudio intraoperatorio de los bordes de resección.
Diferentes estudios aleatorizados, han demostrado que la resección profiláctica de bazo no debe realizarse, pues genera un incremento en la morbilidad sin implicar una mejoría de la supervivencia (19,20). La resección en bloque de órganos vecinos tan solo es recomendable en caso de invasión directa de los mismos, ya que dicha resección implica un incremento de la morbimortalidad, que solo es asumible si con ello se obtiene una cirugía R0.
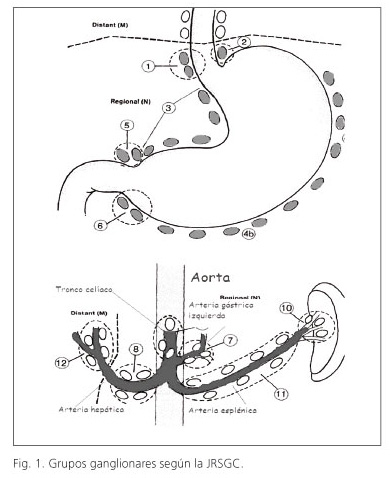
Los niveles ganglionares de la linfadenectomía son definidos por la clasificación JRSGC (11), clasificación también recomendada por la AJCC y la IUAC. Dicha clasificación define 16 grupos ganglionares (Fig. 1): ganglios del nivel 1 (N1), que son los ganglios de la curvadura menor (grupos 1,3 y 5), y de la curvatura mayor (grupos 2,4 y 6). Los ganglios del nivel 2, son los de arteria gástrica izquierda (grupo 7), arteria hepática común (grupo 8), tronco celíaco (grupo 9), hilio esplénico (grupo 10) y arteria esplénica (grupo 11). La clasificación Japonesa, en su última edición, subdivide los ganglios del grupo 11 en "11p" que son aquellos situados desde el origen de la arteria esplénica hasta la mitad del cuerpo pancreático, y el grupo "11d", definidos como los ganglios periarteriales desde la mitad del cuerpo hasta el hilio esplénico (21).
La extensión de la linfadenectomía, y la definición prequirúrgica de ganglio tumoral (22), son temas ampliamente debatido en la literatura, por sus repercusiones en la supervivencia y al ser empleados como parámetros de control de calidad de la técnica quirúrgica. Se considera que para realizar una linfadenectomía D1 adecuada, y con ello una estadificación postoperatoria correcta, se deben analizar un mínimo de 15 ganglios, siendo superior a 20 cuando la linfadenectomía es una D2 (23).
Los grupos de trabajo asiáticos han sido los principales impulsores del análisis de las disecciones ganglionares pormenorizadas, de manera que la gastrectomía total con linfadenectomía D2 es el tratamiento de elección en estos países. En un estudio japonés controlado y aleatorizado, el JCOG9501, se comparó la linfadenectomía D2 sobre la linfadenectomía D2 extendida, incluyendo la disección de los grupos ganglionares paraaórticos (D3). Los resultados de dicho estudio demostraron que la supervivencia a los cinco años de la linfadenectomía extendida es similar (70,3%) a la de linfadenectomía D2 (69,2%), observándose una mayor morbilidad en el primer grupo (24). Otro estudio demostraba una mayor supervivencia en la linfadenectomía D2 extendida a los grupos para-aórticos en comparación con linfadenectomía D1 (25).
Paradójicamente, estos datos publicados por investigadores japoneses no se han reproducido, en su mayoría, en los estudios realizados en países occidentales. En el estudio desarrollado por el British Cooperative Group que comparó la linfadenectomía D2 sobre la D1, la supervivencia a los cinco años fue similar (33 vs. 31%) apreciándose una mayor morbimortalidad en el grupo sobre el que se realizó linfadenectomía D2 (26). Resultados similares fueron publicados por otros grupos (27-30). De entre todos ellos destaca el estudio desarrollado por el Dutch Gastric Cancer Group, que comparaba la linfadenectomía D2 respecto a la D1, mostrando una mayor morbilidad (43 vs. 25%) y mortalidad postoperatoria (10 vs. 4%) en el grupo con linfadenectomía D2, sin apreciarse diferencias en supervivencia acumulada a los cinco años (35 vs. 30%) (28). Sin embargo, en el análisis del seguimiento de dicho estudio a los 15 años, se halló una menor tasa de recurrencia local y de mortalidad por la enfermedad en el grupo con linfadenectomía D2 comparado con D1, destacando la diferencia observada en los pacientes con enfermedad ganglionar N2 (19 vs. 0%) (31). Los factores relacionados con una mayor morbilidad en el grupo D2 fueron: la edad mayor de 65 años, el sexo masculino, el tipo de gastrectomía, así como la realización de esplenectomía y/o pancreatectomía. El incremento de la mortalidad postoperatoria secundaria a la esplenopancreatectomía, oscurece el beneficio potencial de la linfadenectomía D2 sobre la D1 (19,20,31). Por ello, diferentes grupos cooperativos propugnan la linfadenectomía D2 con preservación esplenopancreática, preservando los grupos ganglionares 10 y 11d, salvo en los tumores localizados en la curvatura mayor, con invasión directa de estos órganos o con afectación metastásica ganglionar en estos niveles. En la última guía de la Japanese Gastric Cancer Association de 2010, se contempla la esplenectomía en bloque solo en tumores clínicos T2-T4 con invasión de la curvatura mayor o en tumores cardiales; en cambio, no se recomienda asociarla en tumores con otras localizaciones, al menos hasta que no se obtengan resultados concluyentes de los estudios en desarrollo (16).
La resección laparoscópica de tumores gástricos ofrece ventajas indudables respecto a la cirugía abierta, como son la menor pérdida de sangre, el mejor control analgésico postoperatorio, la menor estancia hospitalaria y una reincorporación más rápida a la vida ordinaria. En este sentido, un estudio europeo prospectivo (32) y un meta-análisis español (33), sugieren resultados similares del procedimiento laparoscópico, en términos de supervivencia y de morbimortalidad postoperatoria, respecto al procedimiento abierto (30), aunque, lógicamente, son necesarios más estudios prospectivos, que reúnan mayor número de casos y en los que se evalúen los resultados a largo plazo en cuanto al control de la enfermedad (34,35).
En nuestro centro hospitalario, el esquema de tratamiento quirúrgico con intención curativa de los pacientes con tumores distales, de un tamaño menor de 3 centímetros, sin invasión serosa y de tipo histológico intestinal, es la gastrectomía subtotal. En el resto de los casos, se realiza una gastrectomía total con reconstrucción del tránsito con asa desfuncionalizada en Y de Roux. En aquellos diagnósticos con tumores clínicos T1, o en casos de pacientes de edad muy avanzada, la resección gástrica elegida se asocia a una linfadenectomía D1. Por último, en aquellos casos en situación clínica T2-T4 o N (+), dependiendo de la edad, la gastrectomía escogida se realiza asociada a una linfadenectomía D2 con preservación esplenopancreática, salvo en aquellos casos, como se comentó anteriormente, con tumores de la curvatura mayor, invasión directa de dichos órganos, o afectación ganglionar de niveles 10 y/o 11d, en los que la resección esplenopancreática se hace necesaria (36).
Quimioterapia adyuvante
El tratamiento sistémico del cáncer gástrico ha llevado un desarrollo distinto en Occidente y en Oriente. Los fármacos utilizados en Japón, Corea y otros países asiáticos, han demostrado un comportamiento cinético diferente en la población oriental respecto a la caucásica (37). Este hecho es importante, porque la diferencia de polimorfismos entre ambas poblaciones condiciona la tolerancia y eficacia de estos fármacos.
Durante las últimas tres décadas, se han publicado múltiples estudios en fase III que comparaban la quimioterapia adyuvante a la cirugía frente a observación, con resultados discordantes. Dos estudios han roto esta tendencia, el primero, realizado sobre 1.059 pacientes con cáncer gástrico resecado y linfadenectomía D2, estadios II-III, demostró un aumento significativo en la supervivencia en el brazo con S-1 (fluoropirimidina oral) adyuvante en comparación con el brazo tratado solo con cirugía (supervivencia a 3 años: 80 vs. 70%; HR: 0,68, IC 95%: 0,52-0,87, p: 0,003) (38). En base a dichos resultados, se hace perentorio confirmarlos en la población occidental. El segundo estudio presentado recientemente, llamado CLASSIC, justifica la aplicación del esquema XELOX (capecitabina y oxaliplatino) por 8 ciclos tras cirugía en estadio IIIA y IIIB, al mostrar una disminución absoluta del evento de progresión a los 3 años de un 14% (39). En los últimos años también se han publicado varios meta-análisis para contestar esta cuestión, y todos ellos sugieren que la quimioterapia adyuvante podría aportar un pequeño beneficio en supervivencia, estimándose entre el 3 y el 8% en términos absolutos (40-45). Destaca, por el número de pacientes analizados, el GASTRIC meta-análisis (45), que mostró un beneficio absoluto en supervivencia del 5,8% a los 5 años (del 49,6 al 55,3%) y del 7,4% a los 10 años (del 37,5 al 44,9%) en aquellos pacientes tratados con quimioterapia adyuvante, sobre todo cuando esta se basaba en fluoropirimidinas.
Quimiorradioterapia adyuvante
No han surgido grandes novedades tras la publicación en el 2001 del estudio fase III SWOG 9008/INT 0116 (46), en el que 556 pacientes con adenocarcinoma gástrico o de la unión esófago-gástrica, estadios IB a IV-M0, sometidos a una resección curativa, fueron aleatorizados a cirugía sola versus cirugía seguida de quimiorradioterapia (5-Fluoruracilo en bolus de 5FU + leucovorin). En dicho estudio se observó como la aplicación de tratamiento adyuvante se traducía en un aumento significativo de la supervivencia libre de enfermedad y la supervivencia global a los 3 años, impresión que se ha confirmado tras un seguimiento superior a los 10 años, con un HR de 1,32 (p = 0,004) para supervivencia y de 1,51 (p < 0,001) para supervivencia libre del evento de recaída. Dicho beneficio se mantuvo en todos los subgrupos, excepto en el subtipo histológico difuso (47). Las limitaciones de este estudio se centran en el tipo de cirugía realizada, ya que en el 54% de los pacientes esta fue subóptima (disección ganglionar menos que D1), planteándose la duda de si la quimiorradioterapia postoperatoria podría haber compensado esa resección ganglionar escasa de la mayoría de los casos. Con la intención de aclarar esta cuestión, se publicó en el 2002 un análisis de subgrupos del INT 0116 (48), en el cual se observó como el beneficio en supervivencia de la quimiorradioterapia adyuvante se mantenía similar en las disecciones ganglionares D0 y D1, siendo más dudosa la ganancia en supervivencia en las disecciones D2, si bien el escaso número de pacientes en este último subgrupo dificultaba extraer conclusiones taxativas. Un estudio observacional coreano sobre más de 500 pacientes (12), demostró el beneficio de la quimiorradioterapia adyuvante incluso tras cirugía D2. Diferentes estudios han demostrado que la adición de citotóxicos a 5FU según el esquema MacDonald, no se traduce en beneficio de la supervivencia (49,50).
La planificación de los campos tratamiento de radioterapia requiere experiencia, así como un sistema de calidad asegurada. En ello influye la conformación en 3D (3D-CRT) o la radioterapia de intensidad modulada (IMRT), pues reducen las toxicidades. La dosis total de radiación se establece en 45 Gy administradas en 25 fracciones de 1,8 Gy. La delimitación de los volúmenes debe cumplir las directrices marcadas por las Guías de la RTOG y de la EORTC, e incluyen el lecho tumoral, los ganglios celiacos y los ganglios para-aórticos superiores.
Tratamiento perioperatorio
Tras la publicación de los resultados definitivos del estudio ingles en fase III MAGIC (51), con un incremento en la supervivencia acumulada a los 5 años del 13%, muchos profesionales consideran el esquema clásico ECF (epirubicina, cisplatino y 5FU) perioperatorio, empleado en dicho estudio, como el nuevo tratamiento estándar en este tipo de pacientes.
Por otra parte, el grupo ACCORD presentó los resultados de su estudio FFCD 9703 (52), en el que se demostró que la administración de cisplatino y 5-FU de forma perioperatoria también aumenta la supervivencia libre de enfermedad (SLE) y la supervivencia global en pacientes con adenocarcinoma gástrico resecable cuando se compara con el control tratado con cirugía sola, con resultados, en sí, muy similares a los observados en el estudio MAGIC.
Recientemente, dos estudios meta-análisis examinaron el papel de la quimioterapia neoadyuvante. En uno de ellos se observó una disminución del riesgo absoluto de muerte a los 5 años del 32% a favor de la neoadyuvancia (53). En el segundo, dicha disminución fue menor, del 18%, a expensas, fundamentalmente, del beneficio observado en pacientes con tumores de la unión esófago-gástrica tratados con neoadyuvancia (54). En base a los resultados del estudio REAL-2, la sustitución de cisplatino por oxaliplatino y de 5FU por capecitabina, está también fundamentada en el contexto perioperatorio (55).
Tratamiento de la enfermedad avanzada
Se establece como cáncer gástrico avanzado aquellos casos que se diagnostican con enfermedad irresecable, bien por enfermedad localmente avanzada (el 30% de los casos al diagnóstico), o por enfermedad metastásica (otro 30%), así como los enfermos con recaídas (el 60% de los resecados). Globalmente, en torno al 84% de los pacientes con cáncer gástrico, se encontrarán en situación de enfermedad avanzada a lo largo de la evolución de su enfermedad.
Primera línea
La administración de quimioterapia paliativa tiene un claro impacto en la supervivencia cuando se compara con el mejor tratamiento de soporte (HR = 0,39; 95 CI: 0,28-0,52), generando, además, una mejoría franca en la calidad de vida de aquellos pacientes que son tratados. Dicho beneficio se aprecia, fundamentalmente, en aquellos pacientes con estado funcional preservado. Actualmente, no existe ningún régimen de quimioterapia que se pueda considerar estándar a nivel internacional (56-58), por lo que la elección depende, esencialmente, del perfil del paciente.
Entre los años 1997 y 2000, varios estudios evidenciaron que los regímenes basados en cisplatino eran superiores a otros esquemas que no lo empleaban (59,60). Tanto CF (cisplatino/5FU) como ECF (4-epirrubicina, cisplatino y 5FU) se pueden considerar como regímenes de referencia. Estos esquemas aportan tasas de respuestas radiológicas que oscilan entre el 20 y el 40%, aunque, desgraciadamente, este beneficio suele prolongarse por poco tiempo, con medianas de tiempo hasta la progresión en torno a 4-5 meses y muy pocas respuestas completas (alrededor del 5%), siendo la mediana de supervivencia de tan solo 7-10 meses. Dicho beneficio se focaliza, como se señalo anteriormente, en aquellos pacientes con buen estado general; a pesar de que la toxicidad e incomodidad del tratamiento (especialmente la de los esquemas con cisplatino) no es, en absoluto, despreciable.
El estudio V-325 (61) comparó el régimen DCF (docetaxel, cisplatino y 5FU) con CF. El objetivo principal del estudio era el tiempo a la progresión, y entre los objetivos secundarios, destacaba la supervivencia global. El estudio fue positivo para su objetivo principal, cuya mediana fue de 5,6 meses en el brazo de TCF frente a 3,7 meses en el brazo de CF. También fueron estadísticamente superiores los resultados en el brazo de TCF con respecto a la supervivencia, supervivencia a 2 años y tasa de respuestas. En cuanto a la toxicidad, la neutropenia grado 3-4, la neutropenia febril y la diarrea fueron más frecuentes con TCF que con cisplatino/5FU. Es de destacar que la neutropenia febril del esquema TCF disminuyó del 30 al 12% con la administración de factores estimulantes de colonias. Dicha toxicidad obliga a añadir docetaxel esencialmente en pacientes seleccionados por su buen estado funcional.
El estudio REAL 2 (62) comparó cuatro esquemas diferentes, sustituyendo el cisplatino por oxaliplatino y el 5FU por capecitabina. No se observaron diferencias estadísticamente significativas en la tasa de respuestas ni en la supervivencia libre de progresión. El esquema EOX (epirubicina, oxaliplatino y capecitabina) fue superior a ECF en supervivencia global (11,2 vs. 9,9 meses, p = 0,02). Las tasas de respuesta fueron 40,7, 46,4, 42,4 y 47,9% para los esquemas ECF, ECX, EOF y EOX. Otros estudios han demostrado la ausencia de inferioridad de capecitabina frente a 5FU y de oxaliplatino frente a cisplatino (63).
En el estudio TOGA (64), un 22,1% de los pacientes analizados (810 pacientes) fueron positivos para c-erb-2 (IHQ 3+ o FISH+), siendo dicha positividad mayor en el subtipo intestinal de Lauren (32%) y en tumores de la unión esófago-gástrica (32,2%). La combinación de trastuzumab con quimioterapia en pacientes c-erb-2 positivo, otorgó un incremento de la supervivencia cercana a los 3 meses (13,8 vs. 11,1 meses). Ese beneficio fue sustantivamente mayor en pacientes IHQ 2+FISH+ y en IHQ 3+, donde se alcanzaron una mediana de supervivencia de 16 meses. Dicho beneficio se produjo, también, en el incremento de la tasa de respuestas radiológicas y del intervalo libre de progresión, sin generar la adición de trastuzumab una mayor toxicidad.
Segunda línea
La aplicación de una segunda línea de tratamiento puede estar justificada en pacientes con estado funcional mantenido. Dos estudios aleatorizados han valorado el rol de la quimioterapia en segunda línea. El primero, un estudio alemán, fue interrumpido prematuramente por falta de reclutamiento. Aún así, el estudio demostró un beneficio en supervivencia en aquellos pacientes tratados con irinotecan trisemanal (HR: 0,48; 95% CI: 0,23-0,92; p = 0,023) (65). El segundo, es un estudio aleatorizado coreano, cuyos datos han sido recientemente presentados, y que también demuestra el beneficio de la aplicación en segunda línea de irinotecan o docetaxel (HR: 0,64; 95% CI: 0,466-0,86392; p = 0,009) (66). La determinación de variables como el estado funcional, la hemoglobina basal, el tiempo a la progresión con la primera línea (mayor o menor a 6 meses), niveles de CEA y el número de localizaciones con metástasis (mayor o menor de 3), ayudan a establecer el beneficio esperable a una segunda línea de tratamiento (67-69).
Agradecimientos
Quisiéramos agradecer al Dr. Miguel Muñoz su colaboración en la redacción del presente artículo.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Antonio Viúdez Berral.
Servicio Oncología Médica.
Complejo Hospitalario de Navarra.
C/ Irunlarrea, 3.
31008. Pamplona.
e-mail: antonio.viudez.berral@navarra.es
Recibido: 10-11-11.
Aceptado: 11-11-11.
Bibliografía
1. Allum WH, Blazeby JM, Griffin SM, Cunningham D, Jankowski JA, Wong R. Guidelines for the management of oesophageal and gastric cancer. Gut 2011;60:1449-72. [ Links ]
2. Cabanes Domenech A, Pérez-Gómez B, Aragonés N, Pollán M, López-Abente G. La situación del cáncer en España, 1975-2006. Madrid: Instituto de Salud Carlos III, 2009. [ Links ]
3. Sant M, Allemani C, Santaquilani M, Knijn A, Marchesi F, Capocaccia R, EUROCARE-4. Survival of cancer patients diagnosed in 1995-1999. Results and commentary: Eur J Cancer 2009;45:931-91. [ Links ]
4. Lopez-Abente G, Pollan M, Escolar A, Errezola M, Abraira V. Atlas de mortalidad por cáncer y otras causas en España, 1978-1992. Madrid: Instituto de Salud Carlos III; 2001. [ Links ]
5. Cunningham D, Jost LM, Purkalne G, Oliveira J, Coordinating authors for the ESMO Guidelines Task Force: ESMO Minimum Clinical Recommendations for diagnosis, treatment and follow-up of gastric cancer. Ann Oncol 2005;16(Supl.1):22-3. [ Links ]
6. Brennan MF, Karpeh MS Jr. Surgery for gastric cancer: the American view. Semin Oncol 1996;23:352-9. [ Links ]
7. Matsumoto Y, Yanai H, Tokiyama H, Nishiaki M, Higaki S, Okila K. Endoscopic ultrasonography for diagnosis os submucosal invasion in early cancer. J Gastroenterol 2000;35:326-31. [ Links ]
8. Repiso A, Gómez-Rodríguez R, López-Pardo R, Lombera MM, Romero M, Aranzana A, et al. Usefulness of endoscopic ultrasonography in preoperative gastric cancer staging: diagnostic yield and therapeutic impact. Rev Esp Enferm Dig 2010;102:413-20. [ Links ]
9. Kwee RM, Kwee TC. Imaging in assessing lymph node status in gastric cancer. Gastric Cancer 2009;12:6-22. [ Links ]
10. Sarela AI, Lefkowitz R, Brennan MF, Karpeh MS. Selection of patients with gastric adenocarcinoma for laparoscopic staging. Ann J Surg 2006;191:134-8. [ Links ]
11. Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma-2nd English ed. Gastric Cancer 1998;1:10-24. [ Links ]
12. Kim S, Lim DH, Lee J, Kang WK, MacDonald JS, Park CH, et al. An observational study suggesting clinical benefit for adjuvant postoperative chemoradiation in a population of over 500 cases after gastric resection with D2 nodal dissection for adenocarcinoma of the stomach. Int J Radiat Oncol Biol Phys 2005;63:1279-85. [ Links ]
13. Bozzetti F, Marubini E, Bonfanti G, Miceli R, Piano C, Gennari L, et al. Subtotal versus total gastrectomy for gastric cancer: five-year survival rates in a multicenter randomized Italian trial. Italian Gastrointestinal Tumor Study Group. Ann Surg 1999;230:170-8. [ Links ]
14. Gouzi JL, Huguier M, Fagniez PL, Launois B, Flamant Y, Lacaine F, et al. Total versus subtotal gastrectomy for adenocarcinoma of the gastric antrum. A French prospective controlled study. Ann Surg 1989;209:162-66. [ Links ]
15. Okines A, Verheij M, Allum W, Cunningham D, Cervantes A. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. On behalf of the ESMO Guidelines Working Group. Annals of Oncology 2010;21(Sup.5):50-4. [ Links ]
16. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver.3). Gastric Cancer 2011;14:113-23. [ Links ]
17. Songun I, Bonenkamp JJ, Hermans J, van Krieken JH, van de Velde CJ. Prognostic value of resection-line involvement in patients undergoing curative resections for gastric cancer. Eur J Cancer 1996;32:433-7. [ Links ]
18. Kim SH, Karpeh MS, Klimstra DS, Leung D, Brennan MF. Effect of microscopic resection line disease on gastric cancer survival. J Gastrointest Surg 1999;3:24-33. [ Links ]
19. Csendes A, Burdiles P, Rojas J, Braghetto I, Diaz JC, Maluenda F. A prospective randomized study comparing D2 total gastrectomy versus D2 total gastrectomy plus splenectomy in 187 patients with gastric carcinoma. Surgery 2002;131:401-07. [ Links ]
20. Yu W, Choi GS, Chung HY. Randomized clinical trial of splenectomy versus splenic preservation in patients with proximal gastric cancer. Br J Surg 2006;93:559-63. [ Links ]
21. Japanese classification of gastric carcinoma: 3rd English ed. Gastric Cancer 2011;14:101-12. [ Links ]
22. Espín F, Bianchi A, Llorca S, Pulido L, Felíu J, de-la-Cruz J, et al. Large lymph node size harvested as prognostic factor in gastric cancer? Rev Esp Enferm Dig 2010;102:169-75. [ Links ]
23. Schwarz RE, Smith DD. Clinical impact of lymphadenectomy extent in resectable gastric cancer of advanced stage. Ann Surg Oncol 2007;14:317-28. [ Links ]
24. Sasako M, Sano T, Yamamoto S, Kurokawa Y, Nashimoto A, Kurita A, et al. D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer. N Engl J Med 200;359:453-62. [ Links ]
25. Wu C-W, Hsiung CA, Lo SS, Hsieh MC, Chen JH, Li AF, et al. Nodal dissection for patients with gastric cancer: a randomised controlled trial. Lancet Oncol 2006;7:309-15. [ Links ]
26. Cuschieri A, Weeden S, Fielding J, Bancewicz J, Craven J, Joypaul V, et al. Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Surgical Co-operative Group. Br J Cancer 1999;79:1522-30. [ Links ]
27. Dent DM, Madden MV, Price SK. Randomized comparison of R1 and R2 gastrectomy for gastric carcinoma. Br J Surg 1988;75:110-2. [ Links ]
28. Hartgrink HH, van de Velde CJ, Putter H, Bonenkamp JJ, Klein Kranenbarg E, Songun I, et al. Extended lymph node dissection for gastric cancer: who may benefit? Final results of the randomized Dutch gastric cancer group trial. J Clin Oncol 2004;22:2069-77. [ Links ]
29. Robertson CS, Chung SC, Woods SD, Griffin SM, Raimes SA, Lau JT, et al. A prospective randomized trial comparing R1 subtotal gastrectomy with R3 total gastrectomy for antral cancer. Ann Surg 1994;220:176-82. [ Links ]
30. Degiuli M, Sasako M, Calgaro M, Garino M, Rebecchi F, Mineccia M, et al. Morbidity and mortality after D1 and D2 gastrectomy for cancer: interim analysis of the Italian Gastric Cancer Study Group (IGCSG) randomized surgical trial. Eur J Surg Oncol 2004;30:303-8 [ Links ]
31. Songun I, Putter H, Kranenbarg EM, Sasako M, van de Velde CJ. Surgical treatment of gastric cancer: 15 years follow-up results of the randomized nationwide Dutch D1D2 trial. Lancet Oncol 2010;11:439-49. [ Links ]
32. Huscher CG, Mingoli A, Sgarzini G, Sansonetti A, Di Paola M, Recher A, et al. Laparoscopic versus open subtotal gastrectomy for distal gastric cancer: five-year results of a randomized prospective trial. Ann Surg 2005;241:232-7. [ Links ]
33. Martínez-Ramos D, Miralles-Tena JM, Cuesta MA, Escrig-Sos J, Van der Peet D, Hoashi JS, et al. Laparoscopy versus open surgery for advanced and resectable gastric cancer: a meta-analysis. Rev Esp Enferm Dig 2011;103:133-41. [ Links ]
34. Memon MA, Butler N, Memon B. The issue of lymphadenectomy during laparoscopic gastrectomy for gastric carcinoma. World J Gastrointest Oncol 2010;2:65-7. [ Links ]
35. Shinohara T, Kanaya S, Taniguchi K, Fujita T, Yanaga K, Uyama I. Laparoscopic total gastrectomy with D2 lymph node dissection for gastric cancer. Arch Surg 2009;144:1138-42. [ Links ]
36. Díaz de Liaño A, Yárnoz C, Artieda C, Aguilar R, Viana S, Artajona A, et al. Results of R0 surgery with D2 lymphadenectomy for the treatment of localised gastric cancer. Clin Transl Oncol 2009;11:178-82. [ Links ]
37. Ajani JA, Faust J, Ikeda K, Yao JC, Anbe H, Carr KL, et al. Phase I pharmacokinetics study of S1 plus cisplatin in patients with advanced gastric carcinoma. J Clin Oncol 2005;3:6957-65. [ Links ]
38. Sakuramoto S, Sasako M, Yamaguchi T, Kinoshita T, Fujii M, Nashimoto A, et al. Adjuvant chemotherapy for gastric cancer with S1, an oral fluoopyrimidine. N Eng J Med 2007;357:1810-20. [ Links ]
39. Bang Y, Kim YW, Yang H, Chung HC, Park YK, Lee KH, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial. Lancet. 2012;379:315-21. [ Links ]
40. Hermans J, Bonenkamp JJ, Boon MC, Bunt AM, Ohyama S, Sasako M, et al. Adjuvant therapy after curative resection for gastric cancer: meta-analysis of randomized trials. J Clin Oncol 1993;11:1441-7. [ Links ]
41. Earle CC, Maroun JA. Adjuvant chemotherapy after curative resection for gastric cancer in non-Asian patients: revisiting a meta-analysis of randomised trials. Eur J Cancer 1999;35:1059-64. [ Links ]
42. Mari E, Floriani I, Tinazzi A, Buda A, Belfiglio M, Valentini M, et al. Efficacy of adjuvant chemotherapy after curative resection for gastric cancer: a meta-analysis of published randomised trials. A study of the GISCAD (Gruppo Italiano per lo Studio dei Carcinomi dell'Apparato Digerente. Ann Oncol 2000;11:837-43. [ Links ]
43. Panzini I, Gianni L, Fattori PP, Tassinari D, Imola M, Fabbri P, et al. Adjuvant chemotherapy in gastric cancer: A meta-analysis of randomized trials and a comparison with previous meta-analysis. Tumori 2002;88:21-7. [ Links ]
44. Janunger KG, Hafstrom L, Glimelius B. Chemotherapy in gastric cancer: a review and updated meta-analysis. Eur J Surg 2002;168:597-608. [ Links ]
45. Sakamoto J Paoletti X, on behalf of the Global Adv/Adj Stomach Tumor Research through International Collaboration (GASTRIC). Meta-analyses of randomized trials assessing the interest of postoperative adjuvant chemotherapy in gastric cancer. J Clin Oncol 2008;26:18S(abstr 4543). [ Links ]
46. Macdonald JS, Smalley SR, Benedetti J, Hundahl SA, Estes NC, Stemmermann GN, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001;345:725-30. [ Links ]
47. Macdonald JS, Benedetti J, Smalley S, Haller D, Hundahl S, Jessup J, et al. Chemoradiation of resected gastric cancer: a 10-year follow-up of the phase III trial INT0116 (SWOG 9008). J Clin Oncol 2009; 27(Supl.15):Abstract 4515. [ Links ]
48. Macdonald JS, Smalley S, Benedetti J. Postoperative combined radiation and chemotherapy improves disease-free survival (DFS) and overall survival (OS) in resected adenocarcinoma of the stomach and gastroesophageal junction: Update of the results of Intergroup Study INT-0116 (SWOG 9008). ASCO 2004 (abstr 6). [ Links ]
49. Ortidura M, De Vita F, Muto P, Vitiello F, Murino P, Lieto E, et al. Adjuvant chemoradiotherapy in patients with stage III or IV radically resected gastric cancer: A pilot study. Arch Surg 2010;145:233-8. [ Links ]
50. Leong T, Joon DL, Willis D, Jayamoham J, Spry N, Harvey J, et al. Adjuvant chemoradiation for gastric cancer using epirubicin, cisplatin and 5 -fluorouracil before and after three-dimensional conformal radiotherapy with concurrent infusional 5-fluorouracil: a multicenter study of the Trans-Tasman Radiation Oncology Group. Int J Radiat Oncol Biol Phys 2011;79:690-5. [ Links ]
51. Cunningham D, Allum W H, Stening SP, Weeden S. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006;355:11-20. [ Links ]
52. Ychou M, Boige V, Pignon JP, Conroy T, Bouché O, Lebreton G, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 2011;29:1715-21. [ Links ]
53. Li H, Cao Y, Zhai L, et al. Meta-analyses of randomized trials assessing the effect of neoadjuvant chemotherapy in locally advanced gastric cancer. J Clin Oncol 2010;28(Supl.7):Abstract 4042. [ Links ]
54. Ronellenfitsch U, Schwarbach M, Hofheinz R, Kienle P, Hohenberger P, Jensenet K, et al. Meta-analysis ofpreoperative chemotherapy (CTX) versus primary surgery for locoregionally advanced adenocarcinoma of the stomach, gastroesophageal junction, and lower esophagus (GE adenocarcinoma). J Clin Oncol 2010;28(Supl.7):Abstract 4022. [ Links ]
55. Van Cutsem E, Dicato M, Geva R, Arber N, Bang Y, Benson A, et al. The diagnosis and management of gastric cancer: expert discussion and recommendations from the 12th ESMO/World Congress on Gastrointestinal Cancer, Barcelona, 2010. Ann Oncol. 2011;Supl.5:1-9. [ Links ]
56. Wagner AD, Grothe W, Haerting J, Kleber G, Grothey A, Fleig WE, et al. Chemotherapy in advanced gastric cancer: A systematic review and meta-analysis based on aggregate data. J Clin Oncol 2006;24:2903-9. [ Links ]
57. Sastre J, García-Saenz JA, Díaz-Rubio E. Chemotherapy for gastric cancer. World J Gastroenterol 2006;14:204-13. [ Links ]
58. Rivera F, Vega-Villegas ME, López-Brea M. Chemotherapy of advanced gastric cancer. Cancer Treatment Reviews 2007;33:315-24. [ Links ]
59. Webb A, Cunningham D, Scarffe JH, Harper P, Norman A, Joffe JK, et al. Randomized trial comparing epirubicin, cisplatin, and 5FU vs. 5FU, doxorubicin, and methotrexate in advanced esophagogastric cancer. J Clin Oncol 1997;15:261-7. [ Links ]
60. Vanhoefer U, Rougier P, Wilke H, Ducreux MP, Lacave AJ, Van Cutsem E, et al. Final results of a randomized phase III trial of sequential high-dose methotrexate, fluorouracil, and doxorubicin versus etoposide, leucovorin, and 5FU versus infusional 5FU and cisplatin in advanced gastric cancer: a trial of the European Organization for Research and Treatment of Cancer Gastrointestinal Tract Cancer Cooperative Group. J Clin Oncol 2000;18:2648-57. [ Links ]
61. Van Cutsem E, Moiseyenko VM, Tjulandin S, Majlis A, Constenla M, Boni C, et al. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol 2006;24:4991-7. [ Links ]
62. Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F, et al. Upper Gastrointestinal Clinical Studies Group of the National Cancer Research Institute of the United Kingdom Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med 2008; 358:36-46. [ Links ]
63. Okines AF, Norman AR, McCloud P, Kang YK, Cunningham D. Meta-analysis of the REAL-2 and ML17032 trials: evaluating capecitabine-based combination chemotherapy and infused 5-fluorouracil-based combination chemotherapy for the treatment of advanced oesophago-gastric cancer. Ann Oncol 2009;20:1529-34. [ Links ]
64. Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, radomised controlled trial. Lancet 2010;376:687-97. [ Links ]
65. Thuss-Patience P, Deist T, Hinke A, et al. Irinotecan versus best supportive care as second-line therapy in gastric cancer: a randomized phase III study of the Arbeitsgemeinschaft Internistische Onkologie (AIO). J Clin Oncol 2009;27u(Supl.15):Abstract 4540. [ Links ]
66. Park SH, Lim DH, Park K. A multicenter, randomized phase III trial comparing second-line chemotherapy (SLC) plus best supportive care (BSC) with BSC alone for pretreated advanced gastric cancer (AGC). ASCO 2011 Abstract 4004. [ Links ]
67. Catalano V, Graziano F, Santini D, D'Emidio S, Baldelli AM, Rossi D, et al. Second-line chemotherapy for patients with advanced gastric cancer: who may benefit? Br J Cancer 2008;99:1402-7. [ Links ]
68. Ji SH, Lim do H, Yi SY, Kim HS, Jun HJ, Kim KH, et al. A retrospective analysis of second-line chemotherapy in patients with advanced gastric cancer. BMC Cancer 2009;9:110 [ Links ]
69. Stahl M, Müller C, Koster W, Wilke H. Second-line chemotherapy of advanced disseminated gastric cancer after cisplatin, infusional 5-fluorouracil, folinic acid (PLF): benefit dependent on progression-free interval after first-line therapy. Onkologie 2005;28:499-502. [ Links ]











 text in
text in