Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.104 no.6 Madrid jun. 2012
https://dx.doi.org/10.4321/S1130-01082012000600009
Cáncer gástrico hereditario difuso: estrategias para disminuir el riesgo tumoral
Hereditary diffuse gastric cancer: strategies to reduce tumoral risk
Maite Herráiz1, Víctor Valenti2, Jesús Sola3, Pilar Pérez-Rojo1, Fernando Rotellar2 y Javier A.-Cienfuegos2
1Unidad de Prevención y Consulta de Alto Riesgo de Tumores Digestivos. Departamento de Digestivo
2Departamento de Cirugía General y Digestiva
3Departamento de Anatomía Patológica. Clínica Universidad de Navarra. Pamplona, Navarra
Dirección para correspondencia
RESUMEN
La Consulta de Alto Riesgo de Tumores Digestivos tiene como objetivo fundamental identificar individuos con mayor riesgo de desarrollar tumores para hacer un diagnóstico presintomático de los mismos detectándolos en estadios en los que son potencialmente curables. Presentamos el caso de una paciente asintomática perteneciente a una familia con síndrome de cáncer gástrico hereditario difuso en la que se detectó una mutación de significado patológico en el gen de la cadherina-E. Al no disponer de ninguna herramienta diagnóstica de eficacia probada en la vigilancia tumoral de este síndrome, la recomendación aceptada hoy en día para un individuo asintomático con mutación conocida es realizar cirugía profiláctica. A esta paciente se le realizó una gastrectomía total por vía laparoscópica, detectándose en la pieza quirúrgica un foco microscópico de tumor. Las estrategias para disminuir el riesgo tumoral en el síndrome de cáncer gástrico hereditario difuso son limitadas, pero es necesario conocerlas para poder tratar a estos pacientes de la manera más adecuada según las evidencias disponibles.
Palabras clave: Cáncer hereditario. Cáncer gástrico. Cáncer gástrico hereditario. Gastrectomía profiláctica. Cadherina-E. CDH1.
ABSTRACT
The main goal at a High-Risk Gastrointestinal Cancer Clinic is to identify individuals at increased risk of developing tumors for diagnosis them in presymptomatic stages, when they are potentially curable. We report an asymptomatic patient belonging to a family with hereditary diffuse gastric cancer syndrome with a novel pathogenic mutation in the E-cadherin gene. In the absence of any proven diagnostic tool in surveillance tumor of this syndrome, the recommendation accepted today for an asymptomatic individual with known mutation is to perform prophylactic surgery. This patient underwent total laparoscopic gastrectomy. A microscopic focus of tumor was detected in the surgical specimen. Strategies to reduce the tumor risk in the hereditary diffuse gastric cancer syndrome are limited, but it is necessary to recognize them in order to treat these patients accordingly to the available evidence.
Key words: Hereditary cancer. Gastric cancer. Hereditary gastric cancer. Prophylactic gastrectomy. E-cadherin. CDH1.
Introducción
El cáncer gástrico hereditario difuso (CGHD) se define como un síndrome de predisposición heredada al cáncer con un patrón de herencia autosómico dominante. Está causado por una mutación germinal en el gen CDH1 que codifica para la proteína de adhesión tisular cadherina-E (1). Las mutaciones del gen CDH1 tienen una alta penetrancia (> 80%) de tal forma que los individuos portadores de una mutación patológica en la cadherina-E tienen un riesgo vital de desarrollar cáncer gástrico mayor del 80% y un riesgo elevado también para desarrollar cáncer de mama del tipo lobular (2). Esta tasa tan elevada de riesgo de cáncer gastrico demanda estrategias de prevención eficaces, lo cual sigue siendo el mayor problema en el manejo de familias con CGHD (3). Hasta la fecha, ningún estudio ha demostrado la utilidad de diferentes técnicas de imagen en la vigilancia de estos pacientes incluyendo: la endoscopia digestiva alta con múltiples biopsias, la endoscopia de alta definición, la cromoendoscopia, la ultrasonografía endoscópica, la tomografía computarizada abdominal y la tomografía por emisión de positrones (4). El manejo clínico del CGHD incluye la realización de test genéticos, recomendándose practicar una gastrectomía total profiláctica a los portadores asintomáticos de mutaciones patológicas debido a la presencia prácticamente universal de focos microscópicos de tumor en estos individuos (3).
Presentamos el caso de una mujer que acudió a la consulta de prevención de tumores digestivos por múltiples antecedentes familiares de primer grado de cáncer gástrico difuso.
Caso clínico
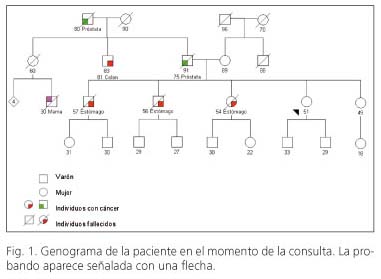
Mujer de 51 años de edad sin antecedentes personales de interés y asintomática desde el punto de vista digestivo. Consultó para valoración de riesgo de cáncer gástrico. Como antecedentes familiares (Fig. 1) refería que su hermano mayor había sido diagnosticado de un adenocarcinoma de estómago con células en anillo de sello a los 57 años, falleciendo un año después. El siguiente hermano fue diagnosticado de un adenocarcinoma de estómago diseminado de tipo difuso a los 56 años, y falleció en pocos meses. Una hermana de 54 años acababa de ser diagnosticada de un adenocarcinoma difuso de estómago con células en anillo de sello, presentado afectación ovárica bilateral al diagnóstico y carcinomatosis peritoneal. A esta hermana se le había realizado una gastroscopia seis meses antes del diagnóstico por unas molestias epigástricas inespecíficas sin encontrar hallazgos relevantes. Tenía otra hermana menor de 49 años, sana, y dos hijos varones sanos. El padre había fallecido a los 91 años con un tumor de próstata diagnosticado 17 años antes y la madre vivía con 89 años, sin enfermedad tumoral conocida.
Ante la presencia de tres familiares de primer grado diagnosticados de adenocarcinoma gástrico de tipo difuso (comprobado en los informes patológicos aportados por la paciente) en edades relativamente tempranas se aconsejó descartar la presencia de un síndrome de cáncer gástrico hereditario difuso. Para ello se indicó realizar estudio genético mediante secuenciación de CDH1 en su hermana recién diagnosticada de cáncer de estómago. El resultado fue positivo encontrándose la mutación c.336 del C presente en el gen CDH1 que produce un codón de parada en la posición 117 dando lugar a una proteína truncada, considerándose por tanto como causante del riesgo de padecer cáncer gástrico. Con este resultado, se propuso a la paciente realizar estudio mutacional dirigido que confirmó que era portadora de la misma mutación. El análisis dirigido en la hermana de 49 años, descartó la mutación.
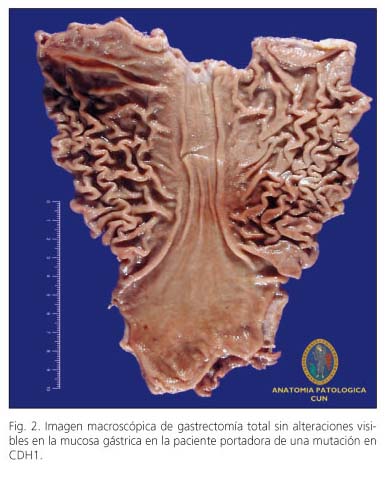
Se realizó una gastroscopia con un endoscopio de alta definición utilizando NBI (Olympus GIF-H180) y una ultrasonografía endoscópica alta para descartar la presencia de lesiones macroscópicas. Ambas técnicas no mostraron alteración y se le propuso realizar una gastrectomía total profiláctica que la paciente aceptó. Se practicó una gastrectomía total por vía laparoscópica sin linfadenectomía utilizando cinco trocares; y reconstrucción mediante anastomosis gastroyeyunal en Y de Roux con CEEA n.o 25. Los márgenes de sección incluían tejido esofágico y duodenal necesarios para confirmar la extirpación completa de la mucosa gástrica. El procedimiento duró 190 minutos y no precisó transfusión de hemoderivados. Al quinto día del postoperatorio se realizó control radiológico con contraste oral que descartó la presencia de fugas y la paciente fue dada de alta a los siete días de la intervención con buen estado general y con dieta oral. La pieza de gastrectomía fue abierta a lo largo de la curvatura mayor (Fig. 2), fijada a una plancha de corcho y sumergida en formol 10% durante 48 horas. Se realizaron cortes seriados de la pieza (cada sección 2 cm x 0.3 cm de espesor), obteniendo un total de 140 bloques con tres fragmentos incluidos en cada bloque. Se identificó la mucosa esofágica, fúndica y del cuerpo, de la zona de transición cuerpo-antro, antral y de tipo duodenal. En una de las secciones de la cara posterior del fundus y próxima al cardias, se identificó en la porción superficial de la lámina propia un área de 250 micras de diámetro, que mostraba células epiteliales con el citoplasma ocupado por una vacuola basófila que desplazaba el núcleo hacia la periferia confiriéndole un aspecto de células en anillo de sello sin otras alteraciones, compatible con carcinoma difuso de células en anillo de sello (Fig. 3), estadio pT1a pNx pMx.
Discusión
Al igual que ocurre con el cáncer de colon, también se han descrito síndromes específicos de cáncer gástrico hereditario que condicionan un riesgo vital muy elevado para desarrollar este tipo de tumor. Debido a la creciente implantación de consultas de alto riesgo y unidades de prevención de tumores digestivos, resulta obligado conocer estos síndromes para identificar adecuadamente aquellos individuos que potencialmente pueden tener un mayor riesgo de desarrollar un tumor y poder realizar las estrategias de prevención disponibles para disminuir ese riesgo.
El cáncer gástrico es el cuarto tumor más frecuente globalmente. La mayoría de tumores gástricos son esporádicos, aunque está bien establecido que alrededor del 1-3% de los tumores aparecen en el contexto de síndromes hereditarios (5). Los tumores gástricos hereditarios son más frecuentemente del tipo difuso o linitis plástica y se conocen como cáncer gástrico hereditario difuso. Los criterios clínicos establecidos para sospecha de CGHD son los siguientes (6,7):
- Dos o más casos documentados de cáncer gástrico difuso en familiares de primer o segundo grado con al menos uno de los tumores diagnosticado antes de los 50 años, o
- Tres o más casos documentados de cáncer gástrico difuso en familiares de primer o segundo grado independientemente de la edad.
Estudios de ligamiento mostraron hace una década que este síndrome se debe a mutaciones germinales en el gen supresor cadherina-E (CDH1) (1). Se estima que aproximadamente el 25% de las familias que cumplen los criterios antes enunciados tendrán una mutación germinal que inactive CDH1 (6). Datos publicados de estas familias sugieren que la penetrancia de las mutaciones en CDH1 es alta (> 80%) (5), por lo que los individuos portadores de estas mutaciones tienen un riesgo muy elevado de desarrollar cáncer gástrico. Mutaciones germinales en cadherina-E también predisponen al desarrollo de otro tipo de tumores como cáncer lobular de mama y posiblemente cáncer de colon.
El manejo clínico del CGHD es complejo. Recientemente se han actualizado las guías clínicas para el manejo de estos pacientes fruto de una conferencia de consenso de expertos (5). En este documento se hace especial hincapié en la necesidad de que los pacientes con sospecha de CGHD sean vigilados por equipos multidisciplinares que incluyan endoscopistas, cirujanos y patólogos con experiencia en este síndrome.
El consejo genético es un componente esencial en la evaluación de CGHD. Incluye una evaluación genética precisa con un genograma abarcando un mínimo de tres generaciones, la confirmación histopatológica del diagnóstico de cáncer gástrico difuso, una discusión detallada del riesgo vital de desarrollar cáncer de estómago y las posibilidades de vigilancia disponibles en la actualidad. El estudio genético se debe iniciar en un familiar afecto. En nuestro caso, se indicó comenzar el estudio genético en la única hermana diagnosticada de cáncer gástrico que estaba viva en el momento de la consulta. La secuenciación de CDH1 encontró una mutación no descrita previamente que se consideró patológica por producir un codón de parada dando lugar a una proteína truncada. El hallazgo de una mutación de significado patológico en un probando afectado permite extender el análisis a los familiares de primer grado. Las dos hermanas a riesgo se realizaron el análisis mutacional dirigido, siendo positivo en una de ellas. El resultado negativo, no encontrar la mutación, se considera un verdadero negativo cuando hay una mutación conocida en la familia y por tanto ese individuo no presenta más riesgo que la población normal y no necesita someterse a un plan de vigilancia tumoral intensivo y/o cirugía profiláctica.
Una vez se ha identificado un individuo sano portador de una mutación patológica, lo aconsejado es considerar la realización de una gastrectomía total profiláctica independientemente de los hallazgos de la endoscopia (3). El momento de la gastrectomía puede variar en función de las preferencias del paciente, de la edad, del estado físico etc. En nuestro caso, se recomendó realizar la gastrectomía sin demora considerando la edad de la paciente y la edad al diagnóstico de los tumores en sus hermanos. Previo a la cirugía está indicado realizar una gastroscopia con el fin de detectar posibles lesiones macroscópicas. Se realizó una gastroscopia tomando múltiples biopsias aleatorias que fueron negativas para tumor. Se exploró más detenidamente la región subcardial por la tendencia a acumularse en esa zona muchos de los focos microscópicos de tumor (8), pero no se encontraron anomalías. Además de la gastroscopia, se realizó una ultrasonografía endoscópica alta buscando engrosamientos patológicos de la pared (linitis plástica), sin hallazgos relevantes.
El tipo de cirugía indicado es una gastrectomía total con reconstrucción en Y- de-Roux. El borde proximal de resección debe ser a través del esófago distal para garantizar la extirpación completa de la mucosa cardial. En el contexto de la cirugía profiláctica no parece necesario realizar linfadenectomía radical debido al mínimo riesgo de afectación ganglionar de los adenocarcinomas confinados a la mucosa y sin afectación de la submucosa (9). Con relación a si la vía de abordaje de la gastrectomía es abierta o laparoscópica, no hay estudios disponibles comparando ambas estrategias, si bien la recomendación de la guía de consenso (5) es que el abordaje laparoscópico debe hacerse en centros con experiencia en esta técnica sin riesgo añadido para el paciente. Se realizó la gastrectomía total por vía laparoscópica exclusivamente. Hasta la fecha hay descritos seis casos de gastrectomía profiláctica por vía laparoscópica, siendo uno de ellos por vía laparoscópica asistida (10,11).
Actualmente hay información disponible de 96 casos de gastrectomía total profiláctica en el contexto de CGHD. Setenta y tres casos corresponden, al igual que el caso que presentamos, con gastrectomías profilácticas reales, es decir, realizadas en individuos portadores de una mutación en CDH1 con biopsias negativas previas a la cirugía. Del total, 42 piezas quirúrgicas fueron estudiadas según un protocolo específico identificándose un carcinoma precoz de células en anillo de sello en 39 casos (93%). En las 31 piezas restantes estudiadas sin un protocolo específico, se identificaron en total 25 casos de cáncer gástrico precoz (81%) (5). El análisis realizado en nuestro caso fue siguiendo el protocolo aconsejado, lográndose identificar un foco microscópico de tumor de 250 micras de diámetro localizado en la cara posterior del fundus, próximo al cardias. El tratamiento aplicado se considera curativo en este estadio.
Para nuestro conocimiento, esta paciente representa el primer caso de CGHD en nuestro país detectado mediante una gastrectomía profiláctica. A pesar de su baja frecuencia, pone de manifiesto la complejidad en la atención de estos pacientes y sus familias y subraya la necesidad de contar con equipos multidisciplinares con experiencia en esta enfermedad.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Maite Herráiz
Unidad de Prevención y Consulta de Alto Riesgo
Departamento de Digestivo
Clínica Universidad de Navarra
Avda. Pío XII, 36
31009 Pamplona, Navarra
e-mail: mherraizb@unav.es
Recibido: 11-01-2012
Aceptado: 14-02-2012
Bibliografía
1. Guilford PJ, Hopkins JB, Grady WM, Markowitz SD, Willis J, Lynch H, et al. E-cadherin germline mutations define an inherited cancer syndrome dominated by diffuse gastric cancer. Hum Mutat 1999;14(3):249-55. [ Links ]
2. Pharoah PD, Guilford P, Caldas C, International Gastric Cancer Linkage Consortium. Incidence of gastric cancer and breast cancer in CDH1 (E-cadherin) mutation carriers from hereditary diffuse gastric cancer families. Gastroenterology 2001;121(6):1348-53. [ Links ]
3. Blair V, Martin I, Shaw D, Winship I, Kerr D, Arnold J, et al. Hereditary diffuse gastric cancer: diagnosis and management. Clin Gastroenterol Hepatol 2006;4(3):262-75. [ Links ]
4. Norton JA, Ham CM, Van Dam J, Jeffrey RB, Longacre TA, Huntsman DG, et al. CDH1 truncating mutations in the E-cadherin gene: an indication for total gastrectomy to treat hereditary diffuse gastric cancer. Ann Surg 2007;245(6):873-9. [ Links ]
5. Fitzgerald RC, Hardwick R, Huntsman D, Carneiro F, Guilford P, Blair V, et al. Hereditary diffuse gastric cancer: updated consensus guidelines for clinical management and directions for future research. J Med Genet 2010;47(7):436-44. [ Links ]
6. Caldas C, Carneiro F, Lynch HT, Yokota J, Wiesner GL, Powell SM, et al. Familial gastric cancer: overview and guidelines for management. J Med Genet 1999;36(12):873-80. [ Links ]
7. Oliveira C, Bordin MC, Grehan N, Huntsman D, Suriano G, Machado JC, et al. Screening E-cadherin in gastric cancer families reveals germline mutations only in hereditary diffuse gastric cancer kindred. Hum Mutat 2002;19(5):510-7. [ Links ]
8. Rogers WM, Dobo E, Norton JA, Van Dam J, Jeffrey RB, Huntsman DG, et al. Risk-reducing total gastrectomy for germline mutations in E-cadherin (CDH1): pathologic findings with clinical implications. Am J Surg Pathol 2008;32(6):799-809. [ Links ]
9. Sano T, Kobori O, Muto T. Lymph node metastasis from early gastric cancer: endoscopic resection of tumour. Br J Surg 1992;79(3):241-4. [ Links ]
10. Francis WP, Rodrigues DM, Perez NE, Lonardo F, Weaver D, Webber JD. Prophylactic laparoscopic-assisted total gastrectomy for hereditary diffuse gastric cancer. JSLS 2007;11(1):142-7. [ Links ]
11. Mayrbaeurl B, Keller G, Schauer W, Burgstaller S, Czompo M, Hoebling W, et al. Germline mutation of the E-cadherin gene in three sibling cases with advanced gastric cancer: clinical consequences for the other family members. Eur J Gastroenterol Hepatol 2010;22(3):306-10. [ Links ]











 texto en
texto en