Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.106 no.4 Madrid abr. 2014
Hepatotoxicidad asociada al consumo de estatinas: análisis de los casos incluidos en el Registro Español de Hepatotoxicidad
Hepatotoxicity associated with statin use: Analysis of the cases included in the Spanish Hepatotoxicity Registry
Emilia V. Perdices1, Inmaculada Medina-Cáliz1, Sofía Hernando1, Aida Ortega1, Francisca Martín-Ocaña1, José M. Navarro2, Gloria Peláez3, Agustín Castiella4, Hacibe Hallal5, Manuel Romero-Gómez6, Andrés González-Jiménez1, Mercedes Robles-Díaz1, M.a Isabel Lucena1 y Raúl J. Andrade1, en representación del Registro Español de Hepatotoxicidad
1Unidad de Gestión Clínica de Aparato Digestivo y Servicio de Farmacología Clínica. Instituto de Investigación Biomédica de Málaga (IBIMA). Hospital Universitario "Virgen de la Victoria". Facultad de Medicina. Universidad de Málaga. Centro de Investigación Biomédica en Red de enfermedades hepáticas y digestivas (CIBERehd). Barcelona
2Unidad de Aparato Digestivo. Agencia Sanitaria Costa del Sol. Marbella, Málaga.
3Servicio de Aparato Digestivo. Hospital Torrecárdenas. Almería
4Servicio de Aparato Digestivo. Hospital de Mendaro. Guipúzcoa
5Servicio de Aparato Digestivo. Hospital Morales Meseguer. Murcia
6Servicio de Aparato Digestivo. Hospital de Valme. Sevilla. CIBERehd
Dirección para correspondencia
RESUMEN
Objetivos: el potencial hepatotóxico de las estatinas es controvertido. Los objetivos de este estudio fueron describir la frecuencia relativa de hepatotoxicidad por estatinas y los fenotipos de presentación en España.
Pacientes y métodos: se analizaron las incidencias de hepatotoxicidad atribuidas a estatinas en el Registro Español de Hepatotoxicidad (REH) y se compararon con las atribuidas a otros fármacos.
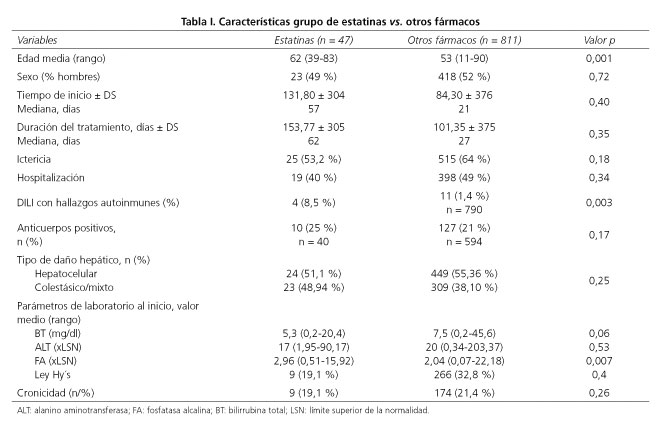
Resultados: entre abril de 1994 y agosto de 2012 se incluyeron en el REH un total 858 casos de los que 47 (5,5 %) se atribuyeron a estatinas. De ellos, 16 fueron por atorvastatina (34 %); 13 por simvastatina (27,7 %); 12 por fluvastatina (25,5 %); 4 por lovastatina (8,5 %) y 2 por pravastatina (4,3 %). Las estatinas representaban aproximadamente la mitad del grupo cardiovascular que ocupaba la 3.a posición (10 %), tras anti-infecciosos (37 %) y fármacos del sistema nervioso central (14 %). El patrón hepatocelular fue predominante, especialmente en el grupo de simvastatina (85 %), el colestático/mixto fue más frecuente con fluvastatina (66 %) y se distribuyó de manera similar con atorvastatina. Los pacientes con toxicidad por estatinas eran de edad más avanzada (62 años vs. 53 años, p < 0,001) y mostraban más frecuentemente un fenotipo de hepatitis autoinmune (8,5 % vs. 1,4 %, p < 0,003).
Conclusiones: las estatinas no son una causa frecuente de hepatotoxicidad en España. La atorvastatina es la estatina implicada en un mayor número de incidencias. El patrón de lesión hepática varía entre las distintas estatinas. El fenotipo de hepatitis con rasgos de autoinmunidad parece ser una firma característica de la hepatotoxicidad por estatinas.
Palabras clave: Hepatotoxicidad. Estatinas. Atorvastatina. Causalidad. Autoinmunidad.
ABSTRACT
Objectives: The hepatotoxic potential of statins is controversial. The objectives of this study were to describe the relative frequency of hepatotoxicity caused by statins and the phenotypes found in Spain.
Patients and methods: The incidence of hepatotoxicity attributed to statins in the Spanish Hepatotoxicity Registry (REH) were studied and compared with those attributed to other drugs.
Results: Between April 1994 and August 2012, the REH included a total of 858 cases of which 47 (5.5 %) were attributed to statins. Of these, 16 were due to atorvastatin (34 %); 13 to simvastatin (27.7 %); 12 to fluvastatin (25.5 %); 4 to lovastatin (8.5 %) and 2 to pravastatin (4.3 %). Statins represented approximately half of the cardiovascular group which occupied 3.er place (10 %), after anti-infectious agents (37 %) and central nervous system drugs (14 %). The hepatocellular pattern was predominant, especially in the simvastatin group (85%), the cholestatic/mixed pattern was more frequent with fluvastatin (66 %) and had a similar distribution to atorvastatin. Patients with statin-induced toxicity were older (62 years versus 53 years, p < 0.001) and more often demonstrated an autoimmune hepatitis phenotype (8.5 % versus 1.4 %, p < 0.003).
Conclusions: Statins are not a common cause of hepatotoxicity in Spain. Atorvastatin is the statin involved in the greatest number of incidents. The liver injury pattern varies among the different statins. The hepatitis phenotype with autoimmune features appears to be a characteristic signature of statin-induced hepatotoxicity.
Key words: Hepatotoxicity. Statins. Atorvastatin. Causality. Autoimmunity.
Introducción
El daño hepático producido por fármacos, productos de herboristería o suplementos dietéticos, también conocido como DILI (del acrónimo en inglés Drug Induced Liver Injury) es una reacción adversa en general impredecible y asociada con muchos fármacos de uso común que constituye una importante causa de daño hepático agudo y crónico potencialmente grave (1). El DILI es responsable de aproximadamente el 11 % de los casos de fallo hepático agudo en EE. UU. (2) y el 13 % en España (3). Las reacciones adversas hepáticas son además la principal causa de interrupciones de desarrollo, advertencias de uso y retirada de fármacos del mercado (4). Las estatinas son un grupo farmacológico de uso globalmente extendido como tratamiento de primera línea para la disminución de los niveles de LDL colesterol y para la prevención primaria y secundaria de eventos cardiovasculares.
El potencial hepatotóxico de las estatinas sigue siendo controvertido. Sólo una pequeña proporción de pacientes que participaron en ensayos clínicos con estatinas experimentaron elevaciones de transaminasas, que alcanzaron una magnitud de al menos 3 veces por encima del límite superior de la normalidad en el 0,1-2,7 % (5). El riesgo de alteraciones del perfil hepático asociado a estatinas observado en ensayos clínicos no es mayor que en el grupo con placebo cuando se usan dosis bajas o moderadas (< 40 mg/día), siendo menor del 1 %, y alcanza el 3 % con dosis altas (80 mg/día) (6). Dichas elevaciones, rara vez se asocian a DILI con expresividad clínica (7). A pesar de las diferencias farmacocinéticas, lipofílicas y metabólicas entre las estatinas, todas ellas parecen ser capaces de producir hepatotoxicidad (8).
Es bien conocido que la causa más frecuente de elevación leve moderada de alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST) en pacientes que consumen estatinas es el hígado graso no alcohólico (5). Una creencia generalizada era considerar que los pacientes con hígado graso no alcohólico u otras variedades de hepatopatía crónica tenían un riesgo incrementado de desarrollar DILI por estatinas. Sin embargo, las estatinas no sólo son seguras y efectivas en pacientes con hígado graso (9), sino que mejoran las alteraciones bioquímicas e histológicas de base (5). Además, entre otros efectos beneficiosos disminuyen la presión portal y el riesgo de carcinoma hepatocelular en pacientes con diabetes (10,11).
Desde su comercialización, los casos publicados de hepatotoxicidad por estatinas han sido escasos en relación con el gran número de consumidores, lo que hace que sigan siendo considerados como seguros y bien tolerados (7).
En el presente estudio hemos utilizado el Registro Español de Hepatotoxicidad para evaluar la importancia relativa de la hepatotoxicidad por estatinas en España en relación a otros fármacos, así como el potencial hepatotóxico de cada una de ellas, y describir los patrones de lesión y el pronóstico.
Material y métodos
Los datos utilizados han sido extraídos del Registro Español de Hepatotoxicidad fundado en 1994 y coordinado por 2 de los autores (RJA y MIL). El REH integra a más de 40 unidades clínicas de todo el territorio nacional (12), que utilizan una metodología uniforme para la identificación de casos y la recogida de información y su posterior inclusión en el Registro. Dicha metodología ha sido descrita con detalle previamente (12,13).
Los pacientes fueron identificados en dicho registro a través de una búsqueda por tipo de estatina. Para la recogida de datos se utilizó un protocolo estructurado que contiene los siguientes elementos (13): datos clínicos relevantes del paciente; factores de riesgo de hepatopatía; tratamiento habitual e inicio y duración del consumo de cada uno de los fármacos; relación temporal entre el comienzo del consumo del medicamento y el inicio de los síntomas y/o alteraciones analíticas; y relación temporal entre la suspensión del agente sospechoso y la recuperación de la disfunción hepática. Así mismo se descartaron otras causas de enfermedad hepática: hepatitis viral reciente por virus A (IgM anti-VHA), B (IgM anti-VHB), o C (anti-VHC y ARN por PCR); enfermedades autoinmunes [anticuerpos antinucleares (ANA), anticuerpos antimitocondriales y antimúsculo liso ASMA] y obstrucción biliar mediante prueba de imagen (ecografía abdominal o colangioRMN). De igual modo, si el contexto clínico lo sugería se descartó también CMV, VEB, infección por herpes virus o VHE.
La causalidad fue valorada mediante juicio clínico y posteriormente mediante la aplicación de la escala propuesta por el Council for International Organizations of Medical Sciences (CIOMS), también denominada Roussel-Uclaff Causality Assessment Method (RUCAM) (14). Únicamente los casos valorados por la escala de CIOMS como posible, probable o altamente probable se incluyeron en la base de datos.
Para establecer lesión hepática se utilizaron dos definiciones sucesivas. La definición estándar de lesión hepática formulada por el grupo internacional de consenso en 1989: incremento de dos veces sobre el límite superior a la normalidad (LSN) en ALT o bilirrubina conjugada; o a la combinación del incremento de aspartato aminotransferasa (AST), FA y bilirrubina total siendo uno de ellos 2 veces > LSN (15). En 2011, los criterios de daño hepático fueron redefinidos por un grupo de expertos, incrementando el umbral de corte de la ALT o AST cuando estas se elevan de forma aislada hasta ≥ 5 LSN. También serían considerados criterios de lesión hepática según este grupo de consenso una FA ≥ 2 x LSN o la combinación de un incremento de ALT > 3 x LSN y de bilirrubina total > 2 x LSN (16). Este último criterio cumple la ley de Hy que predice al menos un 10 % de evolución fulminante (4). El patrón de daño hepático se estableció en función de la ratio (ALT/LSN) /FA (LSN). De tal forma que si era superior a 5 era hepatocelular, inferior a 2 colestásico y entre 2 y 5 daño mixto. El término de DILI crónico se reservó para casos en el que el daño persistía más de un año (15).
Se definió DILI con fenotipo autoinmune cuando junto a la existencia de autoanticuerpos hubiese hallazgos histológicos sugestivos o compatibles con hepatitis autoinmune y/o serotipaje de HLA de riesgo.
Los datos obtenidos fueron analizados por el IBM SPSS Statistics Version 20. Se realizó un análisis descriptivo de los casos de hepatotoxicidad por estatinas presentes en el registro y se hizo un análisis comparativo con el resto de los casos de hepatotoxicidad. Para la comparación de las variables cualitativas entre ambos grupos se usó el test paramétrico Chi cuadrado. Se empleó los test de ANOVA o Kruskall-Wallis para la comparación de variables cualitativas con cuantitativas. Para la comparación de variables cuantitativas se utilizó el test t de Student, Las diferencias fueron consideradas estadísticamente significativas si el valor de p era inferior a 0,05.
Resultados
Entre 1994 y agosto de 2012 se han incluido en el Registro Español de Hepatotoxicidad 858 casos. Los agentes antiinfecciosos (36 %), los fármacos del SNC (14 %) y del aparato cardiovascular (10 %), entre los que se incluyen las estatinas, son los responsables de la mayoría de los casos de hepatotoxicidad del registro.
De los 858 casos, 47 casos fueron atribuidos a estatinas y 811 a un agente distinto a una estatina. Las características demográficas comparativas de la cohorte de pacientes se muestran en la tabla I. La edad media de presentación del grupo de estatinas fue superior al grupo global (62 vs. 53 años, p < 0,001). La latencia media, la tasa de hospitalización, la gravedad definida por el porcentaje de casos que cumplían la ley de Hy y el tiempo medio de resolución fue similar en ambos grupos de pacientes. Un 25 % del grupo global presentó fenómenos de hipersensibilidad es decir, fiebre, rash, eosinofilia, linfopenia, autoanticuerpos y/o artralgias, ocurriendo dichas manifestaciones en 17 casos (36 %) del grupo de estatinas. Aunque la distribución del patrón de lesión hepática en hepatocelular, colestásico y mixto fue similar en ambos grupos, los valores de FA expresados en veces > LSN fueron más elevados en el grupo de estatinas (2,96 vs. 2,04, p < 0,007) y los valores promedio de bilirrubina más bajos sin alcanzar significación estadística (5,3 mg/dl vs. 7,5 mg/dl, p < 0,06). La proporción de casos de DILI con fenotipo autoinmune fue significativamente mayor en el grupo de estatinas (8,5 % vs. 1,4 %, p < 0,003).
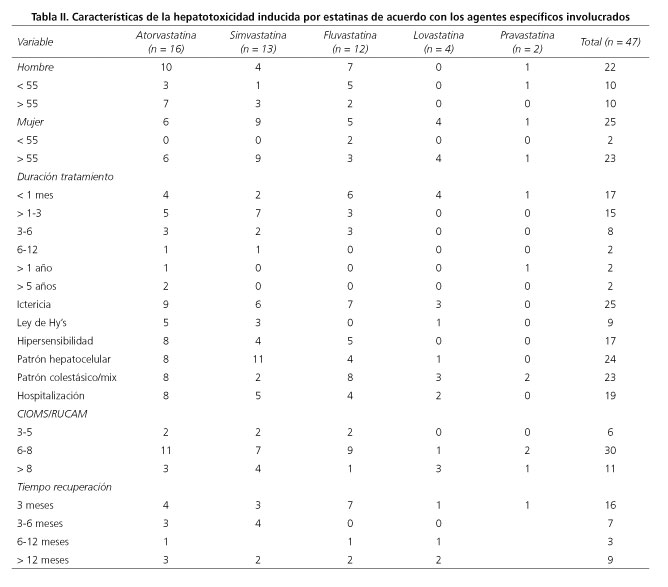
De los 47 casos de hepatotoxicidad por estatinas, 22 eran hombres (47 %). La mayoría, (72 %), tomaban otra medicación de forma concomitante pero 32 pacientes (68 %) llevaban únicamente 3 meses con tratamiento hipolipomiante. La ictericia se manifestó en 25 pacientes (53 %) presentándose en proporciones similares en ambos sexos. Un 19 % de los casos cumplió Ley de Hy. La hospitalización se produjo en 19 pacientes (40 %). El patrón de daño hepático predominante fue el hepatocelular, estando presente en 24 casos (51 %). Un 64 % de los pacientes presentaron una valoración en la escala de CIOMS/RUCAM comprendida entre 6 y 8. El tiempo de recuperación estuvo dentro de los tres primeros meses en un 34 % de los casos, con una media de recuperación de 153 días. Un 19 % de los pacientes (9 casos) presentaron daño crónico. En los 47 casos reportados hubo 2 fallecimientos, pero por causas ajenas al daño hepático producido por el agente sospechoso (Tabla II).
La distribución por tipo de estatina fue: 16 por atorvastatina (34 %); 13 por simvastatina (27,7 %); 12 por fluvastatina (25,5 %); 4 por lovastatina (8,5 %) y 2 por pravastatina (4,3 %). Seis de estos 47 casos cumplían los criterios de daño hepático establecidos por el Grupo Internacional de Consenso en 1989 (14), pero no alcanzaron niveles de transaminasas para ajustarse a la reciente definición de Aithal y cols. (15). De estos 6 casos, 3 eran por simvastatina, 2 por pravastatina y 1 por atorvastatina; 5 eran mujeres; los valores promedios de ALT y FA con respecto al LSN fueron de 2,25 y 1,25 UI/l respectivamente y todos presentaban una puntuación en la escala de CIOMS igual o superior a 6 (5 casos eran probables y 1 altamente probable). Hay que resaltar que 2 de estos episodios se dieron en una misma paciente. En ninguno de los dos episodios presentó ictericia ni fenómenos de hipersensibilidad y normalizó el perfil hepático a los pocos meses de la retirada del fármaco. El resto de los casos cumplían los criterios más exigentes de lesión hepática actualmente utilizados en la mayoría de los estudios (15).
Hepatotoxidad por atorvastatina
Se identificaron 16 casos de DILI atribuidos a este fármaco. De estos, 10 eran varones (63 %). En el 50 % de los casos aparecieron fenómenos de hipersensibilidad. Nueve pacientes (56 %) presentaron ictericia. El patrón hepatocelular estuvo presente en la mitad de los casos. La CIOMS/RUCAM tuvo una valoración de probable en el 69 % de los casos. De estos 16 pacientes, a 6 se les realizó biopsia hepática y en 4 de ellos se evidenciaron eosinófilos. Dos de los casos se catalogaron como hepatitis autoinmune inducida por fármacos. Uno de estos casos presentaba niveles de ANA + 1/640 y de IgG de 25,7 g/l. La biopsia hepática mostró zonas diferenciadas de cirrosis micronodular y signos de hepatitis subfulminante (sugestiva de toxicidad por fármacos vs. hepatitis autoinmune). Un año después del inicio, el perfil hepático continuaba alterado. En el otro caso no se realizó biopsia hepática pero los ANA eran positivos a título de 1/160 así como HLA DR-3 con un índice de HAI de 13. En este paciente, el tiempo de recuperación fue de 6 meses. Diez años antes se le había retirado pravastatina por elevación de transaminasas.
Hepatotoxicidad por simvastatina
Se encontraban recogidos en el registro 13 casos, 4 eran varones (31 %). La ictericia se manifestó en 6 pacientes (46 %). El patrón hepatocelular tuvo una clara predominancia en este grupo. Dos de los pacientes de este grupo fallecieron pero por causas ajenas al daño hepático. Un caso fue clasificado como hepatitis autoinmune desencadenada por fármacos. Presentaba ANA 1/1280 y la biopsia mostró hepatitis panlobular y portal periportal con intenso infiltrado linfoplasmocitario y necrosis picnócitica, balonización hepatocelular con formación de rosetas y depósitos de hemosiderina en células de Kupffer. En este paciente se instauró tratamiento con esteroides. El tiempo de recuperación fue de 2 meses.
Hepatotoxicidad por fluvastatina
Son 12 los casos de DILI asociado al consumo de fluvastatina que constaban en el registro en el momento del análisis. De ellos, 7 eran hombres (58 %). Siete pacientes (58 %) presentaron ictericia. El patrón hepatocelular se dio en el 33,3 % de los casos. En 4 de los casos se practicó biopsia hepática. Sólo en una de ellas existían eosinófilos. Un caso fue clasificado como de hepatitis autoinmune inducida por fármacos, con títulos de ANA de 1/640 y homozigoto para HLA DR 3. La biopsia mostró hepatitis periportal con discreta actividad inflamatoria y hemosiderosis leve. Se inició tratamiento con corticoides 4 meses después del inicio del episodio índice con disminución progresiva hasta la suspensión 16 meses después. Se añadió tratamiento con azatioprina a los 6 meses del episodio índice. La normalización del perfil hepático se produjo 8 meses después del episodio índice.
Hepatotoxicidad por lovastatina
Tan sólo había 4 casos recogidos en el registro. Los 4 pacientes eran mujeres. Tres de ellas presentaron ictericia. Ninguna tuvo fenómenos de hipersensibilidad. En tan sólo uno de los casos el patrón fue hepatocelular. En dos pacientes se realizó biopsia hepática y en ninguna se apreciaron eosinófilos.
Hepatotoxicidad por pravastatina
Únicamente había registrados 2 casos, de distintos sexos. No manifestaron ictericia. Los 2 casos tuvieron un patrón colestásico/mixto. Ambos se recuperaron de la lesión hepática.
Discusión
Las estatinas son fármacos empleados a nivel mundial para el control de las cifras del colesterol y, por tanto, para la prevención de eventos cardiovasculares.
El consumo de hipolipemiantes en España ha pasado de 18,9 DHD (dosis diaria por habitante y día) en el año 2000 a 102,6 DHD en el año 2012, lo que supone un incremento del 442 %. Las estatinas son los fármacos más utilizados, representando un 89,3 % del consumo de hipolipemiantes en 2012. El fármaco más utilizado durante todo el periodo de estudio fue atorvastatina, que ha pasado de 3,8 DHD en 2000 a 42,8 DHD en 2012 (incremento de 1,012 %). También hay que destacar la simvastatina como segunda estatina más consumida a lo largo de este periodo. La suma de atorvastatina y simvastatina representaron en 2012 el 78,2 % del consumo del total de estatinas (17).
La lesión hepática tóxica es un efecto adverso de numerosos medicamentos de uso común. Un elemento que caracteriza a la hepatitis tóxica es que puede presentarse con numerosos fenotipos capaces de simular otras enfermedades hepáticas, y debido a que aún no disponemos de marcadores específicos de hepatotoxicidad el diagnóstico es, en el mejor de los casos, de presunción basándose en la exclusión de causas alternativas (16). Los registros de hepatotoxicidad constituyen una herramienta útil para reforzar la detección de casos con información de calidad, incrementando las garantías de certeza y permitiendo analizar series amplias de casos bien fenotipados (12), así como recolectar muestras biológicas para realizar estudios genotípicos y mecanísticos (18). El presente estudio tuvo como objetivo establecer la frecuencia con la que las estatinas son involucradas en episodios de hepatotoxicidad comparadas con otros fármacos y describir sus fenotipos de presentación clínica y gravedad. Para ello, analizamos los casos de hepatotoxicidad atribuidos a estatinas en el REH un registro no restringido a fármacos o grupos de fármacos, en el que, por consiguiente, se incluye cualquier sospecha de hepatotoxicidad que los investigadores participantes detecten. Esta circunstancia, si bien no permite establecer figuras de incidencia -ya que no se dispone de datos de la población expuesta (denominador) y tampoco se captura muy probablemente el número total de casos que suceden (numerador) sino algunos de los más graves- sí posibilita dibujar la frecuencia relativa de inducción de daño hepático de fármacos y grupos farmacológicos.
En el presente análisis a las estatinas se imputó un 5,5 % de casos de hepatotoxicidad del REH, lo que supone aproximadamente la mitad del total de fármacos del grupo cardiovascular, que con un 10 % ocupan el tercer lugar. Estos datos demuestran que aunque las estatinas no son una causa frecuente de hepatotoxicidad en nuestro medio, su participación tampoco es excepcional. De hecho, hay un amplio debate en torno a si las estatinas son fármacos con potencial hepatotóxico significativo, y hay autores que sugieren que la toxicidad hepática de las estatinas es un mito y argumentan que el fallo hepático agudo por estatinas no es mayor que el idiopático (19,20). Sin embargo, en una serie de 133 incidencias de fallo hepático agudo por fármacos (excluyendo paracetamol) proveniente de distintos hospitales en EE. UU., 10 fueron atribuidas a estatinas ya fuese aisladamente o en combinación con otros fármacos (3). Es interesante señalar además, que en el recientemente publicado estudio poblacional de incidencia de DILI en Islandia, de 96 casos prospectivamente identificados a lo largo de 2 años, una estatina (atorvastatina) era responsable de 2 incidencias (2 %), situándose en el reducido grupo de fármacos con más de una incidencia. En este estudio se utilizaron los recursos del sistema nacional de salud islandés -que tiene una potente base de datos con información de número total de sujetos expuestos a cada fármaco- para calcular el riesgo de hepatotoxicidad con cada medicamento imputado, que en el caso de atorvastatina era de 1/3.693 pacientes tratados -más elevado que el de diclofenaco, un fármaco ampliamente conocido por su potencial hepatotóxico- (21).
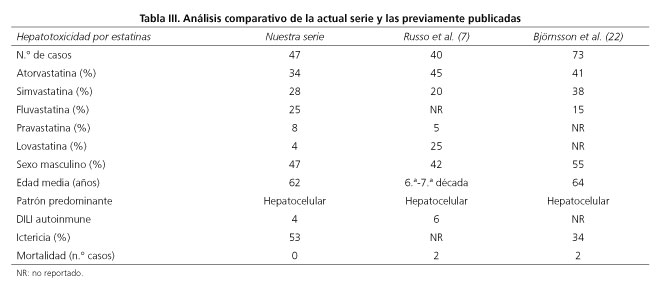
La mayor frecuencia de casos de atorvastatina es también consistente con los hallazgos de 2 series de casos recientemente publicadas (7,22). Russo y cols. (2007) revisaron todos los casos publicados hasta el momento de hepatotoxicidad por estatinas. Identificaron 40 casos repartidos en 26 publicaciones distintas. Por su parte, Björnsson y cols. hicieron una revisión de los casos sospechosos de reacciones adversas por estatinas reportados al Swedish Adverse Drug Reaction Advisory Committe (SADRAC) entre los años 1988 y 2010. La reacción adversa más frecuente fue DILI en un 57 % de los casos. Se incluyeron en el análisis únicamente los casos que superaran por 5 el LSN de aminotranferasas y/o 2 veces el límite superior de la normalidad de la fostatasa alcalina, resultando un total de 73 casos (22). Las características generales de ambas series de casos comparadas con la analizada en el presente estudio se muestran en la tabla III. Un hecho diferencial de la hepatotoxicidad por estatinas en nuestra serie es que ocurre a una edad más avanzada que para el conjunto del resto de los fármacos, y esta peculiaridad es compartida por las otras series. No obstante, es precipitado concluir que la edad avanzada incremente el riesgo de hepatotoxicidad por estos compuestos y no puede excluirse un sesgo de indicación, debido al contexto clínico en el que se utilizan habitualmente estos fármacos. El periodo de latencia también fue muy variable y ocasionalmente prolongado, tanto en nuestra serie (con periodos de latencia superiores a 1 año en varios casos y de hasta 5 años en una ocasión), como en el análisis de Russo et al (desde 5 días hasta 4 años). Estos periodos de latencia prolongados ocurrieron con atorvastatina en nuestra serie. En otra serie de casos recientemente publicada también se atribuyó a atorvastatina un caso de hepatotoxicidad tras 2,5 años de tratamiento (23). Un periodo de latencia muy prolongado constituye un argumento contra la imputabilidad de un fármaco determinado dificultando la adjudicación de la lesión hepática a hepatotoxicidad, además de suponer un desafío desde el punto de vista etiopatogénico.
La hepatotoxicidad idiosincrásica podría ser parcialmente dependiente de la dosis, a tenor de los resultados de un estudio que evaluó las incidencias de fallo hepático agudo, muerte y trasplante hepático registradas en 2 bases de datos farmacéuticas correspondientes a los 200 fármacos más frecuentemente prescritos en EE. UU., y encontró una relación lineal entre la dosis diaria y el riesgo de toxicidad hepática grave. El riesgo más elevado era con los que se usaban a una dosis mayor de 50 mg/día, en comparación con los prescritos a dosis inferiores (24). Las distintas estatinas se dosifican de manera muy variable. Doce casos (23 %) en nuestra serie se ingerían a dosis mayores de 50 mg/día (11 fluvastatina y 1 atorvastatina). Esta proporción es inferior a la que se observa con otros grupos terapéuticos como antibióticos y AINE y puede explicar, al menos en parte, el menor potencial hepatotóxico de las estatinas como grupo terapéutico. Es aventurado, no obstante, establecer una relación entre la dosis diaria total consumida y el mayor potencial relativo de toxicidad de fluvastatina y atorvastatina, porque para ello tendríamos que conocer la tasa de exposición relativa de ambas estatinas con respecto al total. Sin embargo, parece improbable que, al menos en el caso de atorvastatina, la dosis tenga una influencia relevante toda vez que sólo 1 de 16 casos ingerían dosis > 50 mg/día.
Por otra parte, aunque en nuestro análisis fallecieron 2 pacientes, ninguno de ellos lo hizo por complicaciones de la lesión hepática a diferencia de lo reportado en las series de Russo y cols. (7) y Björnsson y cols. (22) que incluían 2 casos de fallecimiento cada una de ellas, lo que supone una mortalidad del 5 % y del 2.7 %, respectivamente (7,22) subrayando la potencial gravedad de la hepatotoxicidad por estatinas.
Un hallazgo diferencial en la presente serie con respecto al conjunto del resto de los casos de hepatotoxicidad incluidos en el Registro fue la mayor frecuencia entre las estatinas de un fenotipo autoinmune con presencia de autoanticuerpos típicos de la hepatitis autoinmune tipo I (ANA y ASMA). La presentación ocasional de la toxicidad por estatinas con fenotipo autoinmune ha sido previamente descrita (7). De los 4 casos identificados como hepatitis autoinmune inducida por estatinas, 3 eran mujeres. La hepatitis autoinmune es una entidad de etiopatogenia desconocida, pero, en ciertas ocasiones se ha sugerido que un agente viral (virus A y especialmente el virus C), así como fármacos (25) actuarían como desenmascaradores, cuestionando para algún autor el origen espontáneo de la hepatitis autoinmune clásica (26).
No obstante, un estudio retrospectivo que analizó una amplia base de datos de la Mayo Clínic puso de manifiesto que la hepatitis toxica con fenotipo autoinmune característicamente mejora con la retirada del fármaco responsable y en caso de requerir tratamiento con esteroides es posible interrumpir de forma definitiva el tratamiento una vez adquirida la remisión sin recurrencia de la enfermedad (27), en tanto que en la HAI "idiopática" la recurrencia tras la retirada es la regla (28-30). Dos de los 4 casos de nuestra serie con fenotipo autoinmune requirieron tratamiento con esteroides con excelente respuesta siendo posible la retirada sin reactivación de la lesión hepática. Un asunto de interés emergente, que solo podrá abordarse de forma prospectiva en cohortes amplias de pacientes, es el papel de la lesión hepática tóxica -aislada o recurrente- (31) como predisponente a la hepatitis autoinmune en el medio y largo plazo.
En conclusión, este análisis confirma estudios previos que indican que la hepatotoxicidad por estatinas aunque no especialmente frecuente no es excepcional, y describe los fenotipos más frecuentes de presentación del DILI asociado al consumo de estos fármacos. La hepatitis autoinmune es una firma característica de la hepatotoxicidad por estatinas. Es, pues, obligada una encuesta rigurosa del consumo de estos fármacos en pacientes con alteraciones hepáticas y manifestaciones de autoinmunidad.
Registro español de hepatotoxicidad
Centros clínicos participantes:
Hospital Universitario Virgen de la Victoria, Málaga (centro coordinador): R.J. Andrade, M.I. Lucena, C. Stephens, M. García-Cortés, M. Robles-Díaz, I. Medina-Cáliz, A. Fernández-Castañer, E. Ulzurrun, A.F. González, I. Moreno, J. Ruiz, A. Papineau
Hospital Torrecárdenas, Almería: M.C. Fernández, G. Peláez, M. Casado, M. González-Sánchez.
Hospital Universitario Virgen de Valme, Sevilla: M. Romero-Gómez, R. Calle-Sanz, R. Millán-Domínguez, L. Grande, M. Jover, B. Prado.
Hospital de Mendaro, Guipúzcoa: A. Castiella, E.M. Zapata.
Hospital Central de Asturias, Oviedo: R. Pérez-Álvarez, L. Rodrigo-Sáez.
Hospital Costa del Sol, Marbella (Málaga): J.M. Navarro, I.M. Méndez Sánchez.
Hospital Sant Pau, Barcelona: C. Guarner, G. Soriano, E.M. Romá.
Hospital Morales Meseguer, Murcia: H. Hallal, E. García-Oltra, J.C. Titos-Arcos, A. Pérez- Martínez, C. Sánchez Cobarro, J.M. Egea-Caparrós.
Hospital de Donosti, San Sebastián: M. García-Bengoechea, J. Arenas, M.I. Gómez Osua.
Hospital de Basurto, Bilbao: S. Blanco, P. Martínez-Odriozola.
Hospital Alto Deba Mondragón, Guipúzcoa: P. Otazua.
Hospital Universitario San Cecilio, Granada: J. Salmerón, A. Gila.
Hospital Virgen de la Macarena, Sevilla: J.A. Durán, I. Carmona, A. Melcón de Dios, M. Jiménez, J. Alanís- López, M. Villar.
Hospital Clínico Valladolid: J.M. González, M.L. Ruiz-Rebollo.
Hospital Carlos Haya, Málaga: M. Jiménez, R. González-Grande, R. Manteca.
Hospital La Fe, Valencia: M. Prieto, M. García-Elix, M. Berenguer.
Hospital de Sagunto, Valencia: J. Primo, J.R. Molés.
Hospital de Laredo, Cantabria: M. Carrascosa.
Hospital 12 de Octubre, Madrid: T. Muñoz-Yagüe, J.A. Solís-Herruzo.
Hospital Germans Trias i Pujol, Badalona, Barcelona: J. Costa, A. Barriocanal, R. Planas.
Hospital Clínic, Barcelona: M. Bruguera, P. Gines, S. Lens.
Hospital Universitario de Canarias, La Laguna, Tenerife: A. Aldea, M. Hernández-Guerra.
Hospital de Alcorcón, Alcorcón, Madrid: C. Fernández, M. Fernández-Gil.
Hospital Reina Sofía, Córdoba: J.L. Montero, M. de la Mata.
Hospital Miguel Servet, Zaragoza: J. Fuentes-Olmo.
Hospital de Albacete, Albacete: J.M. Moreno.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Raúl J. Andrade
Unidad de Hepatología
Departamento de Medicina
Facultad de Medicina
Boulevard Louis Pasteur, n.o 32
29071 Málaga
e-mail: andrade@uma.es
Recibido: 03-09-2013
Aceptado 30-03-2014
Bibliografía
1. Fontana RJ, Seeff LB, Andrade RJ, Björnsson E, Day CP, Serrano J, et al. Standardization of nomenclature and causality assessment in drug-induced liver injury: Summary of a clinical research workshop. Hepatology 2010;52:730-42. [ Links ]
2. Reuben A, Koch DG, Lee WM. Drug-induced acute liver failure: Results of a U.S. multicenter, prospective study. Hepatology 2010;52:2065-76. [ Links ]
3. Escorsell A, Mas A, de la Mata M, and the Spanish Group for the Study of Acute Liver Failure. Acute liver failure in Spain: Analysis of 267 cases. Liver Transpl 2007;13:1389-95. [ Links ]
4. FDA Guidance for Industry, Drug-induced liver injury: Premarketing Clinical Evaluation (Issued July 2009) . Available at: http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM174090.pdf (Accessed 18 April 2013). [ Links ]
5. Chalasani N. Statins and hepatotoxicity: focus on patients with fatter liver. Hepatology 2005;41:690-5. [ Links ]
6. Cueto R, Valdivielso P, Lucena MI, García-Arias C, Andrade RJ, González-Santos P. Statins: Hepatic disease and hepatotoxicity risk. Open Gastroenterol J 2008;2:18-23. [ Links ]
7. Russo MW, Scobet M, Bonkovsky. Drug-induced liver injury associated with Statins. Semin Liver Dis 2009;29:412-22. [ Links ]
8. Argo CK, Loria P, Caldwell SH, Lonardo A. Statins in liver disease: A molehill, an icerberg, or neither? Hepatology 2008;48:662-9. [ Links ]
9. Chalasani N, Aljadhey H, Keserson J, Murray MD, Hall SD. Patients with elevated liver enzymes are not higher risk fos statin hepatotoxicity. Gastroenterology 2004;126:1287-92. [ Links ]
10. Abraldes JG, Albillos A, Bañares R, Turnes J, González R, García-Pagán JC, et al. Simvastatin lowers portal pressure in patients with cirrhosis and portal hypertension: a randomized controlled trial. Gastroenterology 2009;136:1651-8. [ Links ]
11. El-Serag HB, Johnson ML, Hachem C, Morgano RO. Statins are associated with a reduced risk of hepatocellular carcinoma in a large cohort of patients with diabetes. Gastroenterology 2009;136:1601-8. [ Links ]
12. Lucena MI, Andrade RJ, Kaplowitz N, García-Cortés M, Fernández MC, Romero-Gómez M, et al. Phenotypic characterization of idiosyncratic drug- induced liver Injury: The influence of age and sex. Hepatology 2009;49:2001-9. [ Links ]
13. Andrade RJ, Lucena MI, Fernández MC, Peláez G, Pachkoria K, García-Ruiz E, et al. Drug-induced liver injury: An analysis of 461 incidences submitted to the Spanish Registry over a 10-year period. Gastroenterology 2005;129:512-21. [ Links ]
14. Danan G, Bénichou C. Causality assessment of adverse reactions to drugs-I. A novel method based on the conclusions of international consensus meetings: Application to drug-induced liver injuries. J Clin Epidemiol 1993;46:323-30. [ Links ]
15. Bénichou, C. Criteria of drug-Induced liver disorders. Report of an international consensus meting. J Hepatol 1990;11:272-6. [ Links ]
16. Aithal GP, Watkins PB, Andrade RJ, Larrey D, Molokhia M, Takikawa H, et al. Case definition and phenotype standardization in drug-induced liver injury. Clin Pharmacol Ther 2011;55:683-91. [ Links ]
17. Use of lipid-lowering medications in Spain during the 2000-2012 period. Available at: http://www.aemps.gob.es/medicamentosUsoHumano/observatorio/docs/hipolipemiantes-2000-2012.pdf (Accessed 20 December 2013). [ Links ]
18. Andrade RJ, Robles M., Ulzurrun E., Lucena MI. Drug-Induced Liver Injury: Insights from genetic studies. Pharmacogenomics 2009;10:1467-87. [ Links ]
19. Bader T. The myth of statin-induced hepatotoxicity. Am J Gastroenterol 2010;105:978-80. [ Links ]
20. Bader T. Liver tests are irrelevant when prescribing statins. Lancet 2010;376:1882-3. [ Links ]
21. Björnsson ES, Bergmann OM, Björnsson HK, Kvaran RB, Olafsson S. Incidence, presentation, and outcomes in patients with drug-induced liver injury in the general population of Iceland. Gastroenterology 2013;144:1419-25. [ Links ]
22. Björnsson E, Jacobsen E, Kalaitzakis. Hepatotoxicity associated with statins: Reports or idiosyncratic liver injury post-marketing. J Hepatol 2012;56:374-80. [ Links ]
23. Bergmann OM, Kristjansson G, Jonasson JG, Björnsson E. Jaundice due to suspected statin hepatotoxicity: a case series. Dig Dis Sci 2012;57:1959-64. [ Links ]
24. Lammert C, Einarsson S, Saha C, Niklasson A, Björnsson E, Chalasani N. Relationship between daily dose of oral medications and idiosymcratic drug-Induced liver injury: Search for signals. Hepatology 2008;47:2003-9. [ Links ]
25. Lewis JH, Zimmerman HJ. Drug-induced autoimmune liver disease. In: Krawitt EL, Wiesner RH, Nishioka K, editors. Autoimmune Liver Diseases. 2nd ed. Amsterdam: Elservier; 1998. p. 627-49. [ Links ]
26. Czaja AJ. Drug-induced autoimmune -like hepatitis. Dig Dis Sci 2011;56:958-76. [ Links ]
27. Björnsson E, Talwalkar J, Treeprasersuk S, Kamath PS, Takahashi N, Sanderson S, et al. Drug-induced autoimmune hepatitis: Clinical characteristics and prognosis. Hepatology 2010;51:2040-8. [ Links ]
28. Hearty JE, Nouri Aria KT, Portmann B, Eddleston AL, Williams R. Relapse following treatment withdrawal in patients with autoimmune chronic active hepatitis. Hepatology 1983;3:685-9. [ Links ]
29. Czaja AJ, Ammon HV, Summerskill WH. Clinical features and prognosis of severe chronic active liver disease (CALD) after corticosteroid-induced remission. Gastroenterology 1980;78:518-23. [ Links ]
30. Manns MP, Czaja AJ, Gorham JD, Krawitt EL, Mieli-Vergani D, Vergani D, et al. Practice guidelines of the American Association for the Study of Liver Diseases. Diagnosis and management of autoimmune hepatitis. Hepatology 2010;51:2193-213. [ Links ]
31. Lucena MI, Kaplowitz N, Hallal H, Castiella A, Garcia-Bengoechea M, Otazua, P, et al. Recurrent drug-induced liver injury with different drugs. Analysis of nine cases in the Spanish DILI Registry. J. Hepatology 2011;55:820-7. [ Links ]











 texto en
texto en