Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.106 no.6 Madrid jun. 2014
REVISIÓN
Utilidad de la ecografía abdominal en el diagnóstico y seguimiento de la enfermedad inflamatoria intestinal
Utility of abdominal ultrasonography in the diagnosis and monitoring of inflammatory bowel disease
Joaquín Poza Cordón1 y Tomás Ripollés González2
1Servicio de Aparato Digestivo. Hospital Universitario La Paz. Madrid.
2Servicio de Radiología. Hospital Dr. Peset. Valencia
Dirección para correspondencia
RESUMEN
La ecografía abdominal ha sido una técnica infravalorada durante años para evaluar el tubo digestivo. Sin embargo, gracias al avance tecnológico que han experimentado los equipos ecográficos y al uso de sondas de alta frecuencia somos capaces de obtener imágenes de alta calidad de la pared intestinal. Por otra parte, debido al aumento de la sensibilidad del Doppler color podemos detectar la vascularización parietal. Finalmente, en los últimos años se están utilizando los contrastes ecográficos intravenosos que permiten no solo cuantificar la actividad inflamatoria, sino también detectar la presencia de complicaciones con una fiabilidad diagnóstica similar a la tomografía computarizada (TC) y la enterorresonancia magnética (entero-RM) sin riesgo de radiación y a un coste menor. En este artículo se hace una revisión de la utilidad de la ecografía abdominal en la enfermedad inflamatoria intestinal, especialmente en la enfermedad de Crohn, tanto en el diagnóstico inicial como durante el seguimiento de la enfermedad, así como de la capacidad de la técnica en la detección de complicaciones (estenosis, fístulas y abscesos).
Palabras clave: Ecografía. Enfermedad inflamatoria intestinal. Enfermedad de Crohn. Medios de contraste.
ABSTRACT
Abdominal ultrasonography has been undervalued for years as technique used in examining the gastrointestinal tract. However, thanks to the technological advances that have been seen in ultrasonography probes and the use of high frequency equipment, we are able to obtain high quality images of the intestinal wall. Moreover, due to the increased sensitivity of the colour Doppler, we can detect the parietal vascularization. Finally, in recent years, intravenous ultrasonography contrast agents have been used that allow not only the inflammatory activity to be quantified but also the presence of complications with a diagnostic accuracy similar to computed tomography (CT) and full magnetic resonance (full-RM), without the associated radiation risk and at a lower cost. This article reviews the utility of abdominal ultrasonography in inflammatory bowel disease, in particular Crohn's disease, both during initial diagnosis and follow-up of the disease; the article also reviews the ability of the technique to be used in the detection of complications (stenosis, fistulas and abscesses).
Key words: Ultrasonography. Inflammatory bowel diseases. Crohn's disease. Contrast agent BR1.
Introducción
La ecografía abdominal se utiliza habitualmente para el estudio de patología hepatobiliar, pancreática y urogenital. Sin embargo, su utilidad para evaluar el tubo digestivo ha sido menos establecida en el pasado por tres motivos principales: un mayor desarrollo tecnológico en otras técnicas diagnósticas, un rechazo de los gastroenterólogos en la validez de sus resultados y el propio contenido intestinal, que siempre se ha considerado una limitación para la exploración. A pesar de ello, en los últimos 20 años se ha utilizado con gran fiabilidad diagnóstica para evaluar procesos inflamatorios del tubo digestivo (1-3) como la enterocolitis infecciosa (4,5), la diverticulitis (6-8), la apendicitis (9) o la colitis isquémica (10). Solo en la última década ha sido aceptada como una técnica de primera línea en el diagnóstico y seguimiento de la enfermedad inflamatoria intestinal.
El diagnóstico y la valoración de un paciente con enfermedad inflamatoria intestinal se basan en la combinación de síntomas y signos clínicos, pruebas de laboratorio, endoscopia y técnicas de imagen. La ileocolonoscopia que ha sido considerada el "patrón de oro" para la evaluación de la enfermedad inflamatoria intestinal (EII); es una prueba invasiva para un uso regular y además solo nos proporciona información de la presencia de lesiones en la mucosa intestinal. Como sabemos, en la enfermedad de Crohn (EC) la afectación es transmural, por lo que es necesario utilizar pruebas de imagen que nos den información de toda la pared de los segmentos afectados y poder detectar complicaciones transmurales tales como las estenosis, las fístulas y los abscesos.
Las técnicas de imagen son necesarias en el diagnóstico inicial y durante el seguimiento de la enfermedad. Sin embargo muchas de ellas, como las radiografías de tórax y abdomen, el tránsito gastrointestinal o la TC, suponen someter a estos pacientes, generalmente jóvenes en edad fértil, a radiaciones ionizantes en repetidas ocasiones. Si además tenemos en cuenta que muchos de ellos reciben tratamientos inmunodepresores, los efectos deletéreos de las mismas pueden ser mayores. Se sabe que una dosis acumulada mayor o igual a 50 milisieverts (mSv) se relaciona con el desarrollo de tumores de colon y del tracto urogenital (11). En un metaanálisis publicado en el 2012 se estimó que aproximadamente un 11 % de las pacientes con EC reciben dosis iguales o superiores a 50 mSv de radiaciones ionizantes (12). Este porcentaje ascendía hasta un 20 % en una serie retrospectiva española publicada recientemente (13).
Por todo ello, la ecografía intestinal y la entero-RM, dadas su precisión diagnóstica e inocuidad, se han propuesto como las técnicas de elección para la evaluación y el seguimiento de la EC.
La principal ventaja que aporta la ecografía es que está disponible en todos los hospitales y es más barata en comparación con otras técnicas. Además, proporciona información en tiempo real difícil de obtener con otras pruebas de imagen. Sin embargo, tiene una serie de limitaciones, como son la obesidad (poco habitual en estos enfermos), la dificultad de valorar la afectación proximal y la anorrectal y, finalmente, es una técnica exploradora dependiente y que precisa cierta curva de aprendizaje.
Consideraciones generales: aspectos técnicos y contrastes ecográficos
La exploración del tubo digestivo requiere cierto grado de compresión abdominal por tres motivos principales (14):
- Desplaza el contenido intestinal (gas, heces).
- Disminuye la distancia entre el transductor y el asa. Esto es especialmente importante con el uso de sondas de alta frecuencia que tienen menor penetración, pero que proporcionan imágenes con mayor calidad.
- Evalúa la rigidez de un tejido y su reacción con la compresión abdominal.
Esta compresión debe ser gradual y comparable a la que se realiza durante una palpación abdominal. Debemos tener en cuenta que una compresión abdominal marcada puede condicionar un cambio en el grosor de la pared intestinal e influir en las mediciones que realicemos sobre las estructuras.
La exploración debe comenzar con una sonda abdominal estándar (3-5 MHz), que nos dará una información global de la distribución, localización y relación con estructuras vecinas de las asas de intestino delgado y colon. Posteriormente deberemos centrar el estudio con sondas de alta frecuencia (7-12 MHz), imprescindibles para realizar un examen detallado de los segmentos identificados previamente en los que sospechemos patología, ya que valoran con mayor resolución la pared intestinal. De hecho, durante el estudio es relativamente frecuente cambiar de una sonda a otra para obtener información complementaria de cada una de ellas.
No requiere preparación intestinal específica, salvo ayuno de 3-5 horas para disminuir la peristalsis posprandial y el aire luminal. Algunos autores proponen el uso de contrastes orales, técnica conocida con el acrónimo SICUS (small intestine contrast ultrasonography) (15) que requiere la administración de contraste oral, generalmente entre 200 y 2.000 ml de polietilenglicol (16).
En cuanto al uso de contrastes intravenosos en la ecografía, técnica conocida como CEUS (contrast-enhanced ultrasound), el único que se comercializa en España es el SonoVue® (Bracco, Italia). Es un contraste de segunda generación formado por microburbujas compuestas por hexafluoruro sulfúrico, molécula inerte y estable. Esta molécula se elimina por vía respiratoria sin participar el riñón ni el hígado en su excreción y no permanece en el organismo más allá de 15 minutos. Es un contraste exclusivamente intravascular, es decir, no difunde a los tejidos. Su detección requiere tener instalados en el ecógrafo programas de imagen específicos que permitan aumentar la diferencia entre la señal que llega de las microburbujas y la señal que procede de los tejidos. Otro aspecto importante para la valoración de la respuesta de las microburbujas es el índice mecánico (IM). El IM es la fuerza con que las ondas de ultrasonidos comprimen las microburbujas. La utilización de IM bajos (< 0,2) minimiza su destrucción y permite mantener un número suficiente de burbujas para la evaluación continua del realce en tiempo real durante varios minutos. La cantidad de bolo que se utiliza oscila entre 1,2 y 4,8 ml. La mayor parte de los estudios publicados utilizan un bolo de 1,2 ml con sondas de 3,5-5 MHz; sin embargo, las sondas de alta frecuencia tienen una mayor capacidad de destrucción de burbujas, por lo que se va a necesitar más cantidad de contraste.
Consideraciones generales: ecoestructura de la pared intestinal y anatomía
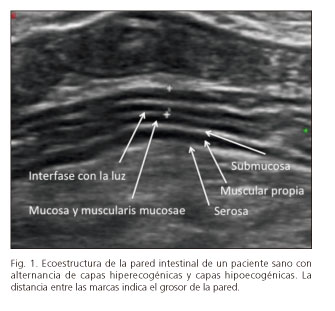
La correlación entre la anatomía y la apariencia ecográfica han sido consideradas adecuadas en la práctica clínica, aunque las diferentes interfases acústicas que producen el aspecto ecográfico de capas no se corresponden exactamente con las diferencias histológicas entre las capas, si bien está demostrado que la muscular propia y la submucosa corresponden a las capas identificadas en la ecografía (17,18). Ecográficamente podemos diferenciar hasta 5 capas ecogénicas (Fig. 1), alternando una capa hiperecogénica con otra hipoecogénica.
Se han publicado más de 30 estudios en las últimas dos décadas para establecer los rangos de normalidad del grosor de la pared intestinal y se han obtenido grandes diferencias de unos estudios a otros, desde 1 hasta 5 mm. Estas diferencias se deben a los equipos y frecuencias usadas, a las distintas técnicas de exploración y al grado de compresión abdominal durante la medición. Actualmente, con el uso de sondas de alta frecuencia, la mayor parte de los autores consideran una pared normal cuando está por debajo de 3 mm, y se emplea una compresión abdominal media (19).
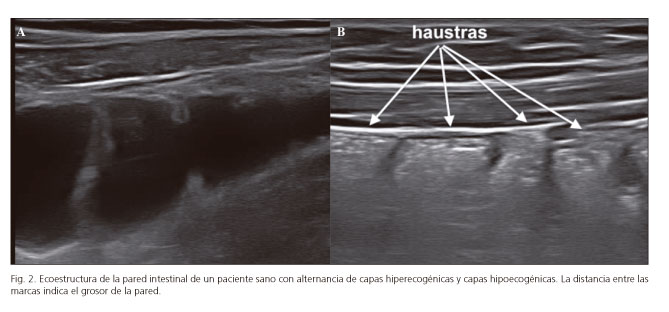
El intestino delgado (Fig. 2A) se diferencia del colon por su capacidad peristáltica, por su curso tortuoso y por la presencia de las válvulas conniventes siendo estas más expresivas cuando existe contenido líquido y en segmentos más proximales (yeyuno). Al igual que ocurre en otras técnicas de imagen, no se puede diferenciar entre asas de yeyuno e íleon. En la ecografía se utiliza un criterio topográfico para su identificación, de tal forma que generalmente las asas de delgado que se localizan en la región infraumbilical se consideran asas de íleon y las que se localizan en región supraumbilical se consideran asas de yeyuno. El aspecto ecográfico típico del colon es la haustración y se diferencia del intestino delgado por la disposición de ondas de gas y la ausencia de peristalsis (Fig. 2B).
El colon se localiza en la periferia del abdomen (20). La posición del colon ascendente y descendente, al ser vísceras retroperitoneales, es fija, en la porción laterodorsal del abdomen. El ciego se identifica fácilmente siguiendo el colon ascendente. El ángulo hepático lo podemos localizar justo por debajo de la porción más caudal del lóbulo hepático derecho y el ángulo esplénico entre bazo y riñón izquierdo. Ambos ángulos se pueden identificar generalmente por vía subcostal, ayudándose de una inspiración forzada del paciente, aunque en ocasiones podemos utilizar un abordaje intercostal. Sin embargo, la posición del colon transverso y el sigma puede variar significativamente en función de la longitud de su meso. Para explorar el colon transverso debemos comenzar el barrido ecográfico en el epigastrio desde la parte subxifoidea y dirigirse en sentido caudal hasta incluso la región infraumbilical. El sigma, a pesar de tener un meso móvil, podemos localizarlo la mayor parte de las veces por encima de los vasos iliacos y el músculo psoas de la región inguinal izquierda. La ecografía abdominal no es una prueba adecuada para valorar el recto por su localización pélvica.
Características ecográficas de la enfermedad de Crohn y la colitis ulcerosa
La diferenciación entre colitis ulcerosa (CU) y EC se basa más en la distribución de la enfermedad (continua versus discontinua) y/o en la afectación del íleon terminal que en la imagen ecográfica, ya que existe bastante solapamiento entre ambas enfermedades.
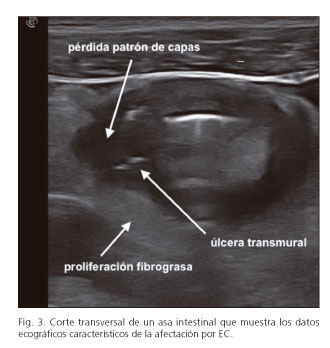
Como sabemos, en la EC el íleon terminal está afectado en aproximadamente un 70 % de los casos (21). Se caracteriza por un engrosamiento de la pared de forma discontinua y transmural, y es frecuente observar un engrosamiento de la submucosa sobre todo si la enfermedad tiene cierto tiempo de evolución (22). Además, con sondas de alta frecuencia es posible observar trayectos hiperecogénicos o hipoecoicos lineales (según contengan gas o no) que atraviesan las capas en profundidad, que corresponden a ulceraciones que van a condicionar mayor o menor desestructuración del patrón de capas (Fig. 3) (23). Otro dato que también permite diferenciar la EC de la CU y otros procesos que producen engrosamiento de la pared intestinal es la afectación de la grasa mesentérica adyacente a un asa engrosada, que se identifica generalmente por su aspecto homogéneo, casi isoecogénico a la submucosa. Finalmente, el dato que confiere mayor especificidad al diagnóstico de EC, aparte de la afectación discontinua, es la presencia de estenosis, fístulas y abscesos.
En la CU tan solo se encuentra afectada la capa mucosa, se preserva la ecoestructura del resto de las capas, salvo en brotes graves o megacolon, donde las úlceras son más profundas. A diferencia de la EC, la enfermedad se distribuye de forma continua y regular desde el recto en sentido proximal, pudiendo variar la extensión de la enfermedad sin afectar al íleon terminal. Hay que tener en cuenta la limitación de la ecografía abdominal para valorar el recto, por lo que la precisión diagnóstica en los casos de proctitis es muy baja.
Utilidad de la ecografía abdominal en la enfermedad de Crohn
Han sido muchos los trabajos publicados en cuanto a la utilidad de la ecografía en la EC y muy pocos los que hagan referencia a la CU. Esto se debe fundamentalmente a que en la CU los índices clínicos utilizados tienen muy buena correlación con la actividad inflamatoria de la enfermedad y se utilizan para decidir el inicio de un tratamiento y monitorizar su respuesta. Sin embargo, esto no ocurre en la EC, donde no existen buenos índices clínicos. El CDAI (Crohn Disease Activity Index), el único índice validado, utiliza principalmente criterios clínicos; es útil solo en el patrón inflamatorio de la enfermedad y por su complejidad se emplea únicamente en el contexto de ensayos clínicos. Por todo esto, para la toma de decisiones el clínico debería apoyarse no solo en la clínica, sino en pruebas analíticas y de imagen para demostrar la presencia o no de actividad inflamatoria y/o complicaciones.
A lo largo del artículo nos centraremos en la utilidad de la ecografía en distintos aspectos de la EC. De forma didáctica, los dividiremos en seis apartados:
- Evaluación inicial ante la sospecha de EC.
- Valoración de la extensión de la enfermedad.
- Diagnóstico de las complicaciones: abscesos, fístulas y estenosis.
- Determinar la actividad inflamatoria.
- Monitorización del tratamiento médico.
- Recurrencia posquirúrgica.
Evaluación inicial ante la sospecha de enfermedad de Crohn
Existen multitud de estudios prospectivos que comparan la ecografía abdominal con otras técnicas diagnósticas como la endoscopia, estudios baritados, TC, entero-RM o la cápsula endoscópica. La mayoría de ellos son estudios controlados con alta prevalencia en EII y combinan pacientes con enfermedad conocida y pacientes con sospecha clínica. Hay que tener en cuenta que las diferencias de sensibilidad y especificidad van a depender fundamentalmente del comparador empleado, del punto de corte utilizado del grosor de la pared intestinal y de la calidad del equipo ecográfico (24). Así, los estudios más clásicos tienen una sensibilidad del 53-81 % y una especificad del 80-87 % (25-28). Sin embargo, en estudios más recientes la sensibilidad está en torno al 86-95 % y la especificidad en el 93-97 % (29,30).
Fraquelli y cols. (19) publicaron un metaanálisis dirigido a la determinación de los valores de sensibilidad y especificidad de los distintos puntos de corte del grosor de la pared intestinal para el diagnóstico en la EC. Los autores concluyen que utilizando un punto de corte de más de 3 mm, la sensibilidad y especificidad era de un 88 % y 93 % respectivamente, mientras que cuando el punto de corte era de más de 4 mm la sensibilidad era del 75 % y la especificidad del 97 %. Esto hace que muchos autores utilicen 4 mm como punto de corte para el diagnóstico primario de la EC, para reducir el número de falsos positivos, y de 3 mm para el seguimiento de la enfermedad.
Se han publicado cuatro estudios que incluyen más de 1.000 pacientes en los que la sensibilidad y especificidad para el diagnóstico de la EC se realiza en pacientes sin diagnóstico previo de EII (31-34) (Tabla I). Hay que destacar el estudio de Parente y cols. (34), que incluye 487 pacientes con síntomas y signos que sugerían EII. La ecografía era el primer estudio que se realizaba en todos los pacientes y mostraban una sensibilidad del 85 %.
A pesar de estos datos, debemos tener en cuenta que, incluso en manos expertas, existen falsos positivos y falsos negativos, ya que el engrosamiento de la pared intestinal no es específico de EII y está presente en otras enfermedades inflamatorias, neoplásicas e infecciosas (35). La localización ileal y segmentaria, la afectación de la grasa mesentérica y la presencia de fístulas y abscesos son los datos más específicos. Sin embargo, el diagnóstico definitivo debería ir siempre que sea posible en el intestino delgado y siempre para el colon, acompañado del diagnóstico endoscópico e histológico (36).
Valoración de la extensión de la EC
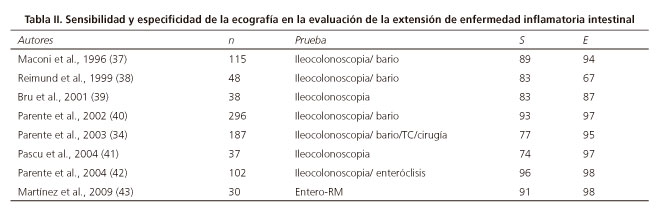
Hasta la fecha se han publicado ocho estudios que han comparado la ecografía con otras técnicas de imagen y/o endoscópicas para determinar la extensión de la EC (34,37-43) (Tabla II). Una revisión sistemática publicada recientemente (44) establece una sensibilidad global del 85 % (83-88 % IC 95%) y una especificidad del 94 % (93-95 % IC95 %).
La mayoría de estos estudios, aunque eran prospectivos, incluían series de escaso número de pacientes con EC localizada en el íleon, por lo que sus resultados deben ser interpretados con precaución. Además, debemos tener en cuenta el comparador empleado como prueba de referencia. Destaca de nuevo el estudio de Parente y cols. (34), quienes realizan un estudio comparativo con los hallazgos endoscópicos y radiológicos en 187 pacientes consecutivos con EC. El estudio reveló una sensibilidad para la enfermedad ileal del 95 %, más reducida para el colon izquierdo y transverso, con un 88 % y 82 % respectivamente. El yeyuno era la localización más difícil de diagnosticar con una sensibilidad del 72 %. En una serie reciente, Martínez y cols. (43) compararon la ecografía con la entero-RM en 30 pacientes con un total de 119 segmentos evaluados, obteniendo mayor sensibilidad diagnóstica la ecografía, aunque la diferencia no fue estadísticamente significativa.
Diagnóstico de las complicaciones: abscesos, fístulas y estenosis
Abscesos
La TC se ha considerado clásicamente como la prueba de imagen de elección, si bien, por su accesibilidad en todos los centros e inocuidad la ecografía, debería ser la primera prueba de imagen que se realizara ante un paciente con sospecha de absceso abdominal.
La utilidad de la ecografía en el diagnóstico de abscesos abdominales ha sido evaluada en tres estudios que utilizaron la cirugía como referencia e incluye un total de 41 lesiones en 242 pacientes (45-47). Agrupando los resultados de estos estudios (44) se establece una sensibilidad del 84 % (79-88 % IC95 %) y una especificidad del 93 % (89-95 % IC95 %).
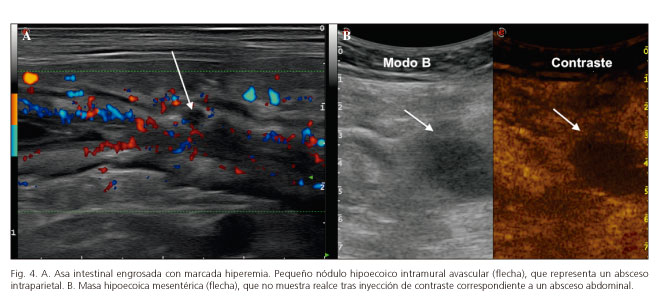
En la ecografía (Fig. 4) se suelen presentar como una imagen hipoanecoica, de bordes mal definidos, que puede contener o no contenido ecogénico (gas) en su interior (Fig. 4B). Con el uso de sondas de alta frecuencia es posible identificar la presencia de abscesos intraparietales como imágenes hipoecogénicas generalmente bien delimitadas (Fig. 4A). Según su localización en la cavidad abdominal se pueden clasificar en intraperitoneales (superficiales o profundas) o retroperitoneales (47).
En ocasiones es difícil establecer la diferencia entre absceso y flemón. Para ello, el uso del Doppler color puede ayudar a diferenciarlas entre sí. En el absceso se suele detectar señal Doppler en la vecindad de la lesión pero no dentro de la misma, mientras que en el flemón generalmente se identifica aumento de la señal Doppler en el interior. La introducción de los contrastes ecográficos intravenosos ha permitido no solo diferenciar claramente estas lesiones entre sí, sino que también podemos delimitar con nitidez los límites del absceso y por tanto definir mejor el tamaño, valorar su multilocularidad y la comunicación con otros órganos intraabdominales (48) (Fig. 4B). Tras inyección de contraste ecográfico hay realce de la masa inflamatoria correspondiente al flemón; por el contrario, en los abscesos hay ausencia de señal en la colección, con realce del tejido adyacente periférico. Asimismo, permiten detectar lesiones de hasta 1 cm con mayor resolución que la TC que, por su pequeño tamaño, no puede distinguir fístulas o adenopatías.
Fístulas
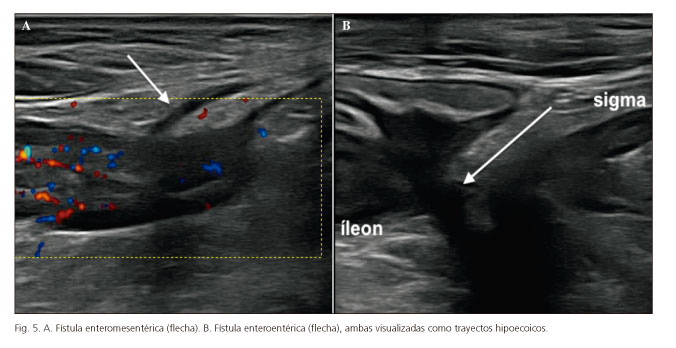
Las fístulas se visualizan como tractos o áreas hipoecogénicas procedentes de un asa intestinal engrosada, que pueden tener contenido ecogénico en su interior (si contienen gas) y que pueden comunicar con otras estructuras (fístulas enteroentéricas, enterovesicales, etc.) (Fig. 5) o terminar en la grasa mesentérica de forma ciega (fístulas enteromesentéricas) (45,46).
Actualmente no existe ninguna técnica fiable para el diagnóstico de esta complicación y los hallazgos intraoperatorios deberían ser considerados referencia a la hora de valorar la utilidad de una técnica para el diagnóstico de esta complicación (49). Los estudios baritados, que han sido considerados como "patrón de oro" durante años, podrían perder más del 40 % de las fístulas encontradas durante la cirugía (36). Tan solo dos estudios prospectivos han evaluado el papel de la ecografía en determinar la presencia de fístulas internas utilizando la cirugía como referencia (46,47), donde la sensibilidad puede alcanzar hasta el 87 % con una especificidad del 90-96 % según las series. Destaca el estudio de Martínez y cols. (43), quienes compararon de forma prospectiva los hallazgos obtenidos en la ecografía y la entero-RM sin obtener diferencias significativas entre ambas técnicas en la detección de fístulas, con una sensibilidad del 82 % para la ecografía y del 70 % para la entero-RM.
Estenosis
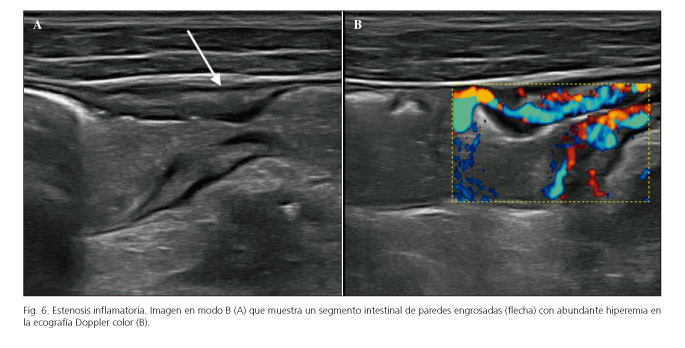
Las estenosis se identifican como segmentos de paredes engrosadas, aperistálticas, con estrechamiento de la luz. Existe dilatación preestenótica identificada por la distensión líquida o contenido ecogénico en el asa previa (Fig. 6A).
Hasta la fecha se han publicado cuatro estudios prospectivos que han evaluado la utilidad de la ecografía en el diagnóstico de las estenosis (40,45,46,50). La sensibilidad y especificidad de la ecografía van a depender de la prueba utilizada como "patrón de oro", de tal forma que cuando se compara con la cirugía las estenosis son de mayor grado, ecográficamente más expresivas y por lo tanto más fáciles de detectar.
En algunos estudios emplean contraste oral para aumentar la tasa de detección de las estenosis, especialmente las de bajo grado. Parente y cols., en su serie, revelan que podría aumentar la sensibilidad diagnóstica un 10 % para una estenosis única y un 20 % para dos o más estenosis (42).
La ecoestructura de la pared intestinal, así como la densidad de la vascularización del segmento estenótico, pueden darnos una aproximación de los cambios histológicos y la posibilidad de discriminar entre estenosis fibróticas o inflamatorias (51,52). Así, tanto la pérdida de estratificación como el aumento de la vascularización intraparietal están presentes en las estenosis de carácter inflamatorio (Fig. 6B), mientras que en las estenosis donde está presente la estratificación (sobre todo a expensas de la submucosa) con pobreza vascular son más características de las estenosis predominantemente fibróticas. Los contrastes ecográficos intravenosos podrían ayudar a diferenciar el grado de inflamación o fibrosis de estos segmentos. El trabajo con mayor número de pacientes publicado es de Ripollés y cols. (53), quienes correlacionan los hallazgos ecográficos con los hallazgos histopatológicos en una serie de 25 pacientes intervenidos y obtienen que las complicaciones transmurales, el grado de Doppler color y el porcentaje de incremento de contraste son significativamente mayores en las estenosis inflamatorias.
Determinar la actividad inflamatoria
Los principales criterios para determinar la actividad inflamatoria en la ecografía son el engrosamiento parietal y el grado de vascularización parietal detectado con Doppler color. Aunque existen otros datos que se relacionan con la actividad de la enfermedad, como son la pérdida de la ecoestructura de la pared (54), la proliferación fibrograsa y la presencia de adenopatías (55); también son criterios de actividad inflamatoria la existencia de complicaciones transmurales, tales como úlceras profundas, fístulas, flemones o abscesos.
Múltiples estudios se han centrado en determinar la utilidad del Doppler para demostrar la actividad inflamatoria. Así, en la década de los 90 del siglo pasado se publicaron trabajos acerca de la utilidad del Doppler pulsado sobre la arteria mesentérica superior (56-60). Los resultados que obtuvieron eran contradictorios sin obtener diferencias significativas entre los grupos (sanos, EC en remisión y EC en brote) en todos los estudios y su validez no se ha confirmado en series más amplias. Además, su medición está influenciada por múltiples factores técnicos y otros como la edad, la ateroesclerosis, el ayuno o el territorio de segmento afectado, que influyen de forma directa en los resultados obtenidos (61). Los estudios publicados posteriormente se han centrado en la vascularización sobre el segmento intestinal afectado. El índice más empleado es semicuantitativo y gradúa de 0 a 3 la densidad de la vascularización parietal utilizando el Doppler color, siendo 0 ausente, 1 apenas visible, 2 moderado y 3 intenso (62) (Fig. 7). En este sentido, los autores han correlacionado la actividad Doppler con la actividad clínica (63,64), endoscópica (62) e histológica (65). Otros trabajos han evaluado la utilidad del índice de resistencia obtenido en los vasos de la pared intestinal (66,67) (Tabla III).
En los últimos años se están publicando estudios acerca de la utilidad de los contrastes ecográficos intravenosos para valorar la actividad inflamatoria de la enfermedad con resultados prometedores.
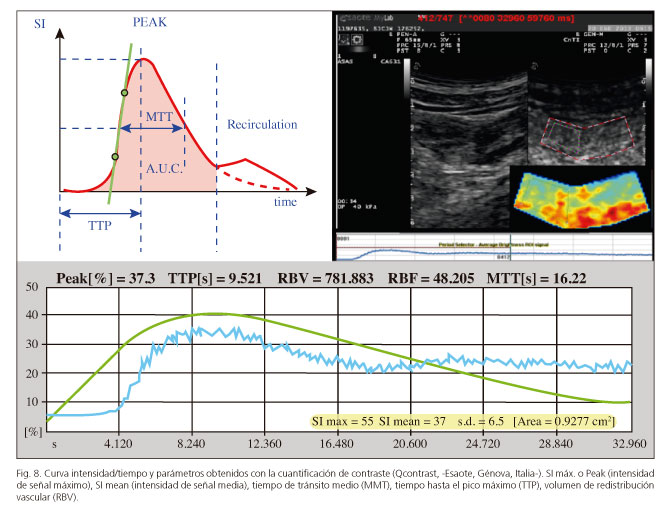
Aunque se han publicado algunos estudios que valoran de forma cualitativa el realce parietal (68), la mayor parte de los autores realizan análisis cuantitativos del realce parietal con programas específicos, que permiten realizar curvas de intensidad/tiempo de una región de interés (ROI). Es decir, analizan en una zona seleccionada manualmente la intensidad de brillo durante un tiempo definido (generalmente 60 segundos) tras la administración de contraste. A través de estas curvas, dependiendo del software utilizado, se han analizado distintas variables como: SI máx. o Peak (intensidad de señal máximo), SI mean (intensidad de señal media), porcentaje de realce ((SI máx.-SI min) x 100/ SI min), el MMT (tiempo de tránsito medio), el TTP (tiempo hasta el pico máximo), el coeficiente β (pendiente de la curva), el área bajo la curva y el RBV (volumen de redistribución vascular) (Fig. 8).
En un estudio, Girlich y cols. (69) encontraron en una serie de 20 pacientes con EC que se iban a someter a cirugía una correlación fuertemente negativa entre el TTP y los hallazgos histopatológicos (r = -0,68, p < 0,01), de tal forma que el tiempo desde la introducción de contraste hasta el pico máximo descendía cuanto mayor era la actividad inflamatoria en el análisis de la pieza quirúrgica (70). De Franco y cols. (71) analizaron, en una serie de 54 pacientes con EC ileal, dos parámetros obtenidos en la cuantificación de contraste (Peak y el coeficiente β) y obtuvieron una sensibilidad para demostrar actividad ileal del 97 % para el Peak y del 86 % para el coeficiente β, con una especificidad del 83 % para ambos. Finalmente, Ripollés y cols. (72) obtuvieron una correlación entre el porcentaje de realce y la severidad endoscópica en una serie de 61 pacientes con EC. Los pacientes con actividad endoscópica moderada o grave, medida por SES-CD o por Índice de Rutgeerts, presentaban un incremento de realce significativamente mayor que los pacientes con enfermedad inactiva (p < 0,001). Tomando como punto de corte el 46 % de incremento de realce tras la administración de contraste, la sensibilidad era del 96 % con una especificidad, del 73 % para detectar actividad endoscópica moderada o grave.
A pesar de ello, la cuantificación de contraste tiene una serie de limitaciones porque los resultados son equipodependientes, ya que cada ecógrafo trabaja con programas distintos. Además, en ocasiones no es posible analizar con claridad la pared intestinal, incluso con equipos modernos, si la pared es demasiado delgada.
Monitorización del tratamiento médico
Para evaluar la respuesta al tratamiento médico el mismo paciente debe ser monitorizado frecuentemente, por lo que la técnica de seguimiento debería ser no invasiva, no utilizar radiación ionizante y sobre todo ser bien tolerada por el paciente. La ecografía cumple todos estos requisitos, pudiendo disminuir el empleo de otras técnicas invasivas o que utilizan radiación ionizante.
La bibliografía médica ha demostrado que existen pacientes sin sintomatología que tienen actividad inflamatoria confirmada en la endoscopia. En el estudio de Hirche y cols. (73) se realizó una ecografía de forma rutinaria a 255 pacientes con EC, la cual reveló complicaciones transmurales en el 18 % de los pacientes, el 37 % de ellos asintomáticos, con CDAI < 150. Todos estos datos resaltan la importancia de monitorizar con técnicas de imagen la efectividad del tratamiento.
El objetivo de los tratamientos médicos clásicos ha sido el control de la sintomatología de los pacientes. Las recaídas y los cambios de tratamiento han sido evaluados con signos clínicos. Varios estudios han analizado mediante ecografía la respuesta al tratamiento médico, detectando en pacientes con buena respuesta reducción tanto del grosor como del flujo Doppler de la pared intestinal (74,75). Sin embargo, en la mayoría de estos estudios no hubo correlación entre la respuesta médica evaluada con el CDAI o la PCR y los cambios ecográficos. Las recaídas en los casos con respuesta clínica favorable han sido atribuidas a la persistencia de actividad inflamatoria, a pesar de buena evolución con alivio de los síntomas. Se ha demostrado que la hiperemia residual evaluada con Doppler color o con contraste puede identificar pacientes con remisión incompleta histológica reflejando inflamación subclínica, con mayor predisposición a recaídas (75,76).
La introducción de los anti-TNF en el tratamiento de la EC está cambiando el curso natural de la enfermedad; estas terapias no solo reducen la actividad de la enfermedad, también la tasa de complicaciones a largo plazo. En un estudio reciente realizado en pacientes tratados con anti-TNF se observó disminución del grosor de pared, del grado de vascularización y de las complicaciones transmurales, y existía correlación significativa entre estos cambios y la respuesta clínica (77). Solo los pacientes con respuesta parcial o remisión mostraron mejoría ecográfica. La evolución (cirugía, aumento de dosis o cambio de anti-TNF) durante el año siguiente mostró diferencias significativas entre los pacientes con mejoría ecográfica y los que no mejoraron.
Castiglione y cols. (78), en un estudio realizado en 133 pacientes a los 2 años de tratamiento, 66 tratados con anti-TNF y 67 con inmunosupresores, observaron curación mucosa en 42 pacientes y curación transmural valorada con ecografía en 20 pacientes. En el estudio se encontró buena correlación entre curación mucosa y transmural (k = 0,63) y existió curación mucosa en 18 de los 20 pacientes con curación transmural. En este estudio hubo poca correlación entre remisión clínica y curación mucosa o curación transmural.
Las técnicas cuantitativas en la ecografía con contraste pueden medir cambios en el realce mural y reflejar la respuesta a la terapia en el seguimiento de la enfermedad inflamatoria. Se ha demostrado que existe una reducción significativa del realce en los pacientes con respuesta clínica a tratamientos biológicos (79). Sin embargo, hasta el momento no existen estudios que demuestren que esta valoración añada información adicional a la aportada por la ecografía Doppler color.
Utilidad en la recurrencia posquirúrgica
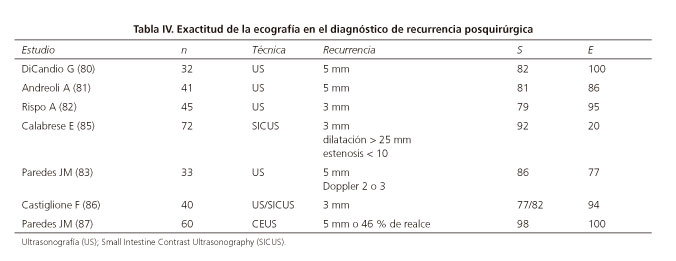
Hasta la fecha se han publicado ocho estudios que evalúan la utilidad de la ecografía abdominal en la recurrencia posquirúrgica (80-84), dos de ellos con contraste oral (85, 86) y solo uno con contraste intravenoso (87), utilizando la endoscopia como prueba de referencia (Tabla IV). Todos los estudios muestran una gran precisión diagnóstica en la detección de recurrencia posquirúrgica y detectan casi todos los casos de recurrencia grave, así como una alta sensibilidad y especificidad en diferenciar recurrencia leve de grave. El empleo de contraste oral puede aumentar la sensibilidad diagnóstica de la prueba, como se refleja en el estudio de Castiglione y cols. (86). El uso de contraste intravenoso presenta resultados esperanzadores, alcanza en el estudio de Paredes y cols. (87) una sensibilidad y especificidad del 98 % y 100 % respectivamente, incluyendo el criterio de grosor > 5 mm o realce > 46 %.
Utilidad de la ecografía abdominal en la colitis ulcerosa
Como sabemos, la CU afecta exclusivamente al colon y se extiende desde el recto de forma variable en sentido proximal. A diferencia de la EC, el patrón de capas se encuentra respetado salvo en los brotes graves de la enfermedad, donde puede existir una desestructuración de su pared. De forma característica, la muscular y la grasa pericólica no suelen estar afectadas. Finalmente, el engrosamiento parietal depende de la primera capa aunque, en ocasiones, puede estar aumentada la submucosa por edema o por fibrosis.
La utilidad clínica de la ecografía abdominal en la CU está menos establecida que en la EC, ya que la resolución de las imágenes ecográficas no permite demostrar la presencia de lesiones en la capa mucosa. Además, como ya hemos comentado previamente, con la ecografía abdominal el recto no puede valorarse adecuadamente.
En este sentido, algunos trabajos no han conseguido encontrar correlación entre el engrosamiento parietal y la actividad clínica (88,89). Sin embargo, otros autores encuentran una mayor correlación entre los hallazgos ecográficos y endoscópicos en la CU que en la EC (41). En otro trabajo publicado más recientemente no solo encuentran una buena correlación entre la actividad endoscópica y la actividad ecográfica, sino que consiguen establecer un factor pronóstico de mala evolución si persisten datos de actividad a los 3 meses de inicio de corticoides (90).
En nuestra opinión, la utilidad de la ecografía abdominal en la colitis ulcerosa puede tener interés en tres situaciones clínicas: valorar la extensión de la enfermedad en casos de colonoscopia incompleta, como en un debut grave de la enfermedad, ayudar en el diagnóstico diferencial en casos de colitis indeterminada con el fin de descartar afectación de intestino delgado, y finalmente puede ser una alternativa a la colonoscopia en los brotes de la enfermedad para valorar actividad o extensión de la enfermedad. En cambio, la ecografía no es útil para evaluar el colon cuando hay sospecha de megacolon tóxico o sus complicaciones.
Conclusiones
La ecografía intestinal es una prueba con gran fiabilidad diagnóstica en la evaluación de pacientes con EII, tanto en el diagnóstico inicial como en el seguimiento, lo que permite demostrar la presencia de complicaciones. Por la accesibilidad en todos los centros, por su escaso coste y porque no supone irradiar a estos pacientes debería convertirse en una técnica de primera línea. Sin embargo, es una técnica explorador dependiente que precisa cierta curva de aprendizaje y requiere conocimientos no solo de la técnica ecográfica, sino también de la EII. En el futuro, el uso de contrastes ecográficos y otras técnicas en desarrollo como la elastografía podrían ayudar a diferenciar entre estenosis fibrosas e inflamatorias, lo que ayudaría a la toma de decisiones médicas o quirúrgicas, que a su vez supondría un mejor manejo del paciente y un importante ahorro en el gasto farmacéutico.
Agradecimientos
A todo el Servicio de Aparato Digestivo del Hospital Universitario la Paz, por su apoyo incondicional y respaldo en el desarrollo de esta técnica; a AbbVie Laboratorios S. A. por su colaboración en la formación e impulso de esta técnica.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Joaquín Poza Cordón.
Servicio de Aparato Digestivo.
Hospital Universitario La Paz.
Paseo de la Castellana, 261.
28046 Madrid
e-mail: pozacordon@gmail.com
Recibido: 18-02-2014
Aceptado: 30-04-2014
Bibliografía
1. Cuenca B, García M, Garre MC, Gil LA, Gómez RA, López A, et al., editores. Tratado de Ultrasonografía Abdominal: Ediciones Díaz Santos, S. A.; 2011. [ Links ]
2. Segura Cabral JM, editor. Ecografía digestiva. 2a ed. Universidad Autónoma de Madrid: UAM Ediciones; 2011. [ Links ]
3. Puylaert JB. Ultrasound of acute GI tract conditions. Eur Radiol 2001;11:1867-77. [ Links ]
4. Teefey SA, Roarke MC, Brink JA, Middleton WD, Balfe DM, Thyssen EP, et al. Bowel wall thickening: differentiation of inflammation from ischemia with color Doppler and duplex US. Radiology 1996;198:547-51. [ Links ]
5. Kawamoto S, Horton KM, Fishman EK. Pseudomembranous colitis: spectrum of imaging findings with clinical and pathologic correlation. Radiographics 1999;19:887-97. [ Links ]
6. Ripollés T, Agramunt M, Martínez MJ, Costa S, Gómez-Abril SA, Richart J. The role of ultrasound in the diagnosis, management and evolutive prognosis of acute left-sided colonic diverticulitis: a review of 208 patients. Eur Radiol 2003;13:2587-95. [ Links ]
7. Pradel JA, Adell JF, Taourel P, Djafari M, Monnin-Delhom E, Bruel JM. Acute colonic diverticulitis: prospective comparative evaluation with US and CT. Radiology 1997;205:503-12. [ Links ]
8. Hollerweger A, Macheiner P, Rettenbacher T, Brunner W, Gritzmann N. Colonic diverticulitis: diagnostic value and appearance of inflamed diverticula-sonographic evaluation. Eur Radiol 2001;11:1956-63. [ Links ]
9. Lee JH. Sonography of acute appendicitis. Semin Ultrasound CT MR 2003;24:83-90. [ Links ]
10. Ripollés T, Simó L, Martínez-Pérez MJ, Pastor MR, Igual A, López A. Sonographic findings in ischemic colitis in 58 patients. AJR Am J Roentgenol 2005;184:777-85. [ Links ]
11. Brenner DJ, Doll R, Goodhead DT, Hall EJ, Land CE, Little JB, et al. Cancer risks attributable to low doses of ionizing radiation: assessing what we really know. Proc Natl Acad Sci USA 2003;100:13761-6. [ Links ]
12. Chatu S, Subramanian V, Pollok RC. Meta-analysis: diagnostic medical radiation exposure in inflammatory bowel disease. Aliment Pharmacol Ther 2012;35:529-39. [ Links ]
13. Ciáurriz-Munuce A, Fraile-González M, León-Brito H, Vicuña-Arregui M, Miquélez S, Uriz-Otano J, et al. Ionizing radiation in patients with Crohn's disease. Estimation and associated factors. Rev Esp Enferm Dig 2012;104:452-7. [ Links ]
14. Puylaert JB, van der Zant FM, Rijke AM. Sonography and the acute abdomen: practical considerations. AJR Am J Roentgenol 1997;168:179-86. [ Links ]
15. Pallotta N, Baccini F, Corazziari E. Contrast ultrasonography of the normal small bowel. Ultrasound Med Biol 1999;25:1335-40. [ Links ]
16. Nylund K, Ødegaard S, Hausken T, Folvik G, Lied GA, Viola I, et al. Sonography of the small intestine. World J Gastroenterol 2009;15:1319-30. [ Links ]
17. Kimmey MB, Martin RW, Haggitt RC, Wang KY, Franklin DW, Silverstein FE. Histologic correlates of gastrointestinal ultrasound images. Gastroenterology 1989;96(2 Pt 1):433-41. [ Links ]
18. Wiersema MJ, Wiersema LM. High-resolution 25-megahertz ultrasonography of the gastrointestinal wall: Histologic correlates. Gastrointest Endosc 1993;39:499-504. [ Links ]
19. Fraquelli M, Colli A, Casazza G, Paggi S, Colucci A, Massironi S, et al. Role of US in detection of Crohn disease: Meta-analysis. Radiology 2005;236(1):95-101. [ Links ]
20. Hollerweger A. Colonic diseases: the value of US examination. Eur J Radiol 2007;64:239-49. [ Links ]
21. Veloso FT, Ferreira JT, Barros L, Almeida S. Clinical outcome of Crohn's disease: Analysis according to the vienna classification and clinical activity. Inflamm Bowel Dis. 2001;7:306-13. [ Links ]
22. Di Mizio R, Maconi G, Romano S, D'Amario F, Bianchi Porro G, Grassi R. Small bowel Crohn disease: sonographic features. Abdom Imaging 2004;29:23-35. [ Links ]
23. Kunihiro K, Hata J, Haruma K, Manabe N, Tanaka S, Chayama K. Sonographic detection of longitudinal ulcers in Crohn disease. Scand J Gastroenterol 2004;39:322-6. [ Links ]
24. Nylund K, Hausken T, Gilja OH. Ultrasound and inflammatory bowel disease. Ultrasound Q 2010;26:3-15. [ Links ]
25. Pera A, Cammarota T, Comino E, Caldera D, Ponti V, Astegiano M, et al. Ultrasonography in the detection of Crohn's disease and in the differential diagnosis of inflammatory bowel disease. Digestion 1988;41:180-4. [ Links ]
26. Sonnenberg A, Erckenbrecht J, Peter P, Niederau C. Detection of Crohn's disease by ultrasound. Gastroenterology 1982;83:430-4. [ Links ]
27. Pedersen BH, Grønvall S, Dorph S, Fahrenkrug L, Holm HH, Binder V. The value of dynamic ultrasound scanning in Crohn's disease. Scand J Gastroenterol 1986;21:969-72. [ Links ]
28. Worlicek H, Lutz H, Heyder N, Matek W. Ultrasound findings in Crohn's disease and ulcerative colitis: A prospective study. J Clin Ultrasound 1987;15:153-63. [ Links ]
29. Solvig J, Ekberg O, Lindgren S, Florén CH, Nilsson P. Ultrasound examination of the small bowel: comparison with enteroclysis in patients with Crohn disease. Abdom Imaging 1995;20:323-6. [ Links ]
30. Faure C, Belarbi N, Mougenot JF, Besnard M, Hugot JP, Cézard JP, et al. Ultrasonographic assessment of inflammatory bowel disease in children: Comparison with ileocolonoscopy. J Pediatr 1997;130:147-51. [ Links ]
31. Bozkurt T, Richter F, Lux G. Ultrasonography as a primary diagnostic tool in patients with inflammatory disease and tumors of the small intestine and large bowel. J Clin Ultrasound 1994;22:85-91. [ Links ]
32. Hollerbach S, Geissler A, Schiegl H, Kullmann F, Lock G, Schmidt J, et al. The accuracy of abdominal ultrasound in the assessment of bowel disorders. Scand J Gastroenterol 1998;33:1201-8. [ Links ]
33. Astegiano M, Bresso F, Cammarota T, Sarno A, Robotti D, Demarchi B, et al. Abdominal pain and bowel dysfunction: diagnostic role of intestinal ultrasound. Eur J Gastroenterol Hepatol 2001;13:927-31. [ Links ]
34. Parente F, Greco S, Molteni M, Cucino C, Maconi G, Sampietro GM, et al. Role of early ultrasound in detecting inflammatory intestinal disorders and identifying their anatomical location within the bowel. Aliment Pharmacol Ther 2003;18:1009-16. [ Links ]
35. Truong M, Atri M, Bret PM, Reinhold C, Kintzen G, Thibodeau M, et al. Sonographic appearance of benign and malignant conditions of the colon. AJR Am J Roentgenol 1998;170:1451-5. [ Links ]
36. Maconi G, Radice E, Greco S, Bianchi Porro G. Bowel ultrasound in Crohn's disease. Best Pract Res Clin Gastroenterol 2006;20:93-112. [ Links ]
37. Maconi G, Parente F, Bollani S, Cesana B, Bianchi Porro G. Abdominal ultrasound in the assessment of extent and activity of Crohn's disease: Clinical significance and implication of bowel wall thickening. Am J Gastroenterol 1996;91:1604-9. [ Links ]
38. Reimund JM, Jung-Chaigneau E, Chamouard P, Wittersheim C, Duclos B, Baumann R. Diagnostic value of high resolution sonography in Crohn's disease and ulcerative colitis. Gastroenterol Clin Biol 1999;23:740-6. [ Links ]
39. Bru C, Sans M, Defelitto MM, Gilabert R, Fuster D, Llach J, et al. Hydrocolonic sonography for evaluating inflammatory bowel disease. AJR Am J Roentgenol 2001;177:99-105. [ Links ]
40. Parente F, Maconi G, Bollani S, Anderloni A, Sampietro G, Cristaldi M, et al. Bowel ultrasound in assessment of Crohn's disease and detection of related small bowel strictures: a prospective comparative study versus x ray and intraoperative findings. Gut 2002;50:490-5. [ Links ]
41. Pascu M, Roznowski AB, Müller HP, Adler A, Wiedenmann B, Dignass AU. Clinical relevance of transabdominal ultrasonography and magnetic resonance imaging in patients with inflammatory bowel disease of the terminal ileum and large bowel. Inflamm Bowel Dis 2004;10:373-82. [ Links ]
42. Parente F, Greco S, Molteni M, Anderloni A, Sampietro GM, Danelli PG, et al. Oral contrast enhanced bowel ultrasonography in the assessment of small intestine Crohn's disease. A prospective comparison with conventional ultrasound, x ray studies, and ileocolonoscopy. Gut 2004;53:1652-7. [ Links ]
43. Martínez MJ, Ripollés T, Paredes JM, Blanc E, Martí-Bonmatí L. Assessment of the extension and the inflammatory activity in Crohn's disease: Comparison of ultrasound and MRI. Abdom Imaging 2009;34:141-8. [ Links ]
44. Panés J, Bouzas R, Chaparro M, García-Sánchez V, Gisbert JP, Martínez de Guereñu B, et al. Systematic review: the use of ultrasonography, computed tomography and magnetic resonance imaging for the diagnosis, assessment of activity and abdominal complications of Crohn's disease. Aliment Pharmacol Ther 2011;34:125-45. [ Links ]
45. Maconi G, Bollani S, Bianchi Porro G. Ultrasonographic detection of intestinal complications in Crohn's disease. Dig Dis Sci 1996;41:1643-8. [ Links ]
46. Gasche C, Moser G, Turetschek K, Schober E, Moeschl P, Oberhuber G. Transabdominal bowel sonography for the detection of intestinal complications in Crohn's disease. Gut 1999;44:112-7. [ Links ]
47. Maconi G, Sampietro GM, Parente F, Pompili G, Russo A, Cristaldi M, et al. Contrast radiology, computed tomography and ultrasonography in detecting internal fistulas and intra-abdominal abscesses in Crohn's disease: A prospective comparative study. Am J Gastroenterol 2003;98:1545-55. [ Links ]
48. Ripollés T, Martínez-Pérez MJ, Paredes JM, Vizuete J, García-Martínez E, Jiménez-Restrepo DH. Contrast-enhanced ultrasound in the differentiation between phlegmon and abscess in Crohn's disease and other abdominal conditions. Eur J Radiol 2013;82:e525-31. [ Links ]
49. Michelassi F, Stella M, Balestracci T, Giuliante F, Marogna P, Block GE. Incidence, diagnosis, and treatment of enteric and colorectal fistulae in patients with Crohn's disease. Ann Surg 1993;218:660-6. [ Links ]
50. Kohn A, Cerro P, Milite G, De Angelis E, Prantera C. Prospective evaluation of transabdominal bowel sonography in the diagnosis of intestinal obstruction in Crohn's disease: comparison with plain abdominal film and small bowel enteroclysis. Inflamm Bowel Dis 1999;5:153-7. [ Links ]
51. Maconi G, Carsana L, Fociani P, Sampietro GM, Ardizzone S, Cristaldi M, et al. Small bowel stenosis in Crohn's disease: clinical, biochemical and ultrasonographic evaluation of histological features. Aliment Pharmacol Ther 2003;18:749-56. [ Links ]
52. Di Sabatino A, Ciccocioppo R, Armellini E, Morera R, Ricevuti L, Cazzola P, et al. Serum bFGF and VEGF correlate respectively with bowel wall thickness and intramural blood flow in Crohn's disease. Inflamm Bowel Dis 2004;10:573-7. [ Links ]
53. Ripollés T, Rausell N, Paredes JM, Grau E, Martínez MJ, Vizuete J. Effectiveness of contrast-enhanced ultrasound for characterisation of intestinal inflammation in Crohn's disease: a comparison with surgical histopathology analysis. J Crohns Colitis 2013;7:120-8. [ Links ]
54. Hata J, Haruma K, Yamanaka H, Fujimura J, Yoshihara M, Shimamoto T, et al. Ultrasonographic evaluation of the bowel wall in inflammatory bowel disease: comparison of in vivo and in vitro studies. Abdom Imaging 1994;19:395-9. [ Links ]
55. Maconi G, Di Sabatino A, Ardizzone S, Greco S, Colombo E, Russo A, et al. Prevalence and clinical significance of sonographic detection of enlarged regional lymph nodes in Crohn's disease. Scand J Gastroenterol 2005;40:1328-33. [ Links ]
56. van Oostayen JA, Wasser MN, Griffioen G, van Hogezand RA, Lamers CB, de Roos A. Activity of Crohn's disease assessed by measurement of superior mesenteric artery flow with Doppler ultrasound. Neth J Med 1998;53:S3-8. [ Links ]
57. Maconi G, Parente F, Bollani S, Imbesi V, Ardizzone S, Russo A, et al. Factors affecting splanchnic haemodynamics in Crohn's disease: a prospective controlled study using Doppler ultrasound. Gut 1998;43:645-50. [ Links ]
58. Giovagnorio F, Diacinti D, Vernia P. Doppler sonography of the superior mesenteric artery in Crohn's disease. AJR Am J Roentgenol 1998;170:123-6. [ Links ]
59. Ludwig D, Wiener S, Brüning A, Schwarting K, Jantschek G, Stange EF. Mesenteric blood flow is related to disease activity and risk of relapse in Crohn's disease: A prospective follow-up study. Am J Gastroenterol 1999;94:2942-50. [ Links ]
60. Yekeler E, Danalioglu A, Movasseghi B, Yilmaz S, Karaca C, Kaymakoglu S, et al. Crohn disease activity evaluated by Doppler ultrasonography of the superior mesenteric artery and the affected small-bowel segments. J Ultrasound Med 2005;24:59-65. [ Links ]
61. Ludwig D. Doppler sonography in inflammatory bowel disease. Z Gastroenterol 2004;42:1059-65. [ Links ]
62. Neye H, Voderholzer W, Rickes S, Weber J, Wermke W, Lochs H. Evaluation of criteria for the activity of Crohn's disease by power Doppler sonography. Dig Dis 2004;22:67-72. [ Links ]
63. Heyne R, Rickes S, Bock P, Schreiber S, Wermke W, Lochs H. Non-invasive evaluation of activity in inflammatory bowel disease by power Doppler sonography. Z Gastroenterol 2002;40:171-5. [ Links ]
64. Spalinger J, Patriquin H, Miron MC, Marx G, Herzog D, Dubois J, et al. Doppler US in patients with crohn disease: vessel density in the diseased bowel reflects disease activity. Radiology 2000;217:787-91. [ Links ]
65. Drews BH, Barth TF, Hänle MM, Akinli AS, Mason RA, Muche R, et al. Comparison of sonographically measured bowel wall vascularity, histology, and disease activity in Crohn's disease. Eur Radiol 2009;19:1379-86. [ Links ]
66. Esteban JM, Maldonado L, Sanchiz V, Minguez M, Benages A. Activity of Crohn's disease assessed by colour Doppler ultrasound analysis of the affected loops. Eur Radiol 2001;11:1423-8. [ Links ]
67. Sjekavica I, Barbaric-Babic V, Krznaric Z, Molnar M, Cukovic-Cavka S, Stern-Padovan R. Assessment of Crohn's disease activity by doppler ultrasound of superior mesenteric artery and mural arteries in thickened bowel wall: cross-sectional study. Croat Med J 2007;48:822-30. [ Links ]
68. Migaleddu V, Scanu AM, Quaia E, Rocca PC, Dore MP, Scanu D, et al. Contrast-enhanced ultrasonographic evaluation of inflammatory activity in Crohn's disease. Gastroenterology 2009;137:43-52. [ Links ]
69. Girlich C, Jung EM, Iesalnieks I, Schreyer AG, Zorger N, Strauch U, et al. Quantitative assessment of bowel wall vascularisation in Crohn's disease with contrast-enhanced ultrasound and perfusion analysis. Clin Hemorheol Microcirc 2009;43:141-8. [ Links ]
70. Girlich C, Jung EM, Huber E, Ott C, Iesalnieks I, Schreyer A, et al. Comparison between preoperative quantitative assessment of bowel wall vascularization by contrast-enhanced ultrasound and operative macroscopic findings and results of histopathological scoring in Crohn's disease. Ultraschall Med 2011;32:154-9. [ Links ]
71. De Franco A, Di Veronica A, Armuzzi A, Roberto I, Marzo M, De Pascalis B, et al. Ileal Crohn disease: Mural microvascularity quantified with contrast-enhanced US correlates with disease activity. Radiology 2012;262:680-8. [ Links ]
72. Ripollés T, Martínez MJ, Paredes JM, Blanc E, Flors L, Delgado F. Crohn disease: correlation of findings at contrast-enhanced US with severity at endoscopy. Radiology 2009;253:241-8. [ Links ]
73. Hirche TO, Russler J, Schröder O, Schuessler G, Kappeser P, Caspary WF, et al. The value of routinely performed ultrasonography in patients with Crohn disease. Scand J Gastroenterol 2002;37:1178-83. [ Links ]
74. Ruess L, Blask AR, Bulas DI, Mohan P, Bader A, Latimer JS, et al. Inflammatory bowel disease in children and young adults: Correlation of sonographic and clinical parameters during treatment. AJR Am J Roentgenol 2000;175:79-84. [ Links ]
75. Ripollés T, Martínez MJ, Barrachina MM. Crohn's disease and color Doppler sonography: response to treatment and its relationship with long-term prognosis. J Clin Ultrasound 2008;36:267-72. [ Links ]
76. Robotti D, Cammarota T, Debani P, Sarno A, Astegiano M. Activity of Crohn disease: Value of Color-Power-Doppler and contrast-enhanced ultrasonography. Abdom Imaging 2004;29:648-52. [ Links ]
77. Paredes JM, Ripollés T, Cortés X, Martínez MJ, Barrachina M, Gómez F, et al. Abdominal sonographic changes after antibody to tumor necrosis factor (anti-TNF) alpha therapy in Crohn's Disease. Dig Dis Sci 2010;55:404-10. [ Links ]
78. Castiglione F, Testa A, Rea M, De Palma GD, Diaferia M, Musto D, et al. Transmural healing evaluated by bowel sonography in patients with Crohn's disease on maintenance treatment with biologics. Inflamm Bowel Dis 2013;19:1928-34. [ Links ]
79. Quaia E, Migaleddu V, Baratella E, Pizzolato R, Rossi A, Grotto M, et al. The diagnostic value of small bowel wall vascularity after sulfur hexafluoride-filled microbubble injection in patients with Crohn's disease. Correlation with the therapeutic effectiveness of specific anti-inflammatory treatment. Eur J Radiol 2009;69:438-44. [ Links ]
80. DiCandio G, Mosca F, Campatelli A, Bianchini M, D'Elia F, Dellagiovampaola C. Sonographic detection of postsurgical recurrence of Crohn disease. AJR Am J Roentgenol 1986;146:523-6. [ Links ]
81. Andreoli A, Cerro P, Falasco G, Giglio LA, Prantera C. Role of ultrasonography in the diagnosis of postsurgical recurrence of Crohn's disease. Am J Gastroenterol. 1998;93:1117-21. [ Links ]
82. Rispo A, Bucci L, Pesce G, Sabbatini F, de Palma GD, Grassia R, et al. Bowel sonography for the diagnosis and grading of postsurgical recurrence of Crohn's disease. Inflamm Bowel Dis 2006;12: 486-90. [ Links ]
83. Paredes JM, Ripollés T, Cortés X, Reyes MD, López A, Martínez MJ, et al. Non-invasive diagnosis and grading of postsurgical endoscopic recurrence in Crohn's disease: Usefulness of abdominal ultrasonography and (99m)Tc-hexamethylpropylene amineoxime-labelled leucocyte scintigraphy. J Crohns Colitis 2010;4:537-45. [ Links ]
84. Pallotta N, Giovannone M, Pezzotti P, Gigliozzi A, Barberani F, Piacentino D, et al. Ultrasonographic detection and assessment of the severity of Crohn's disease recurrence after ileal resection. BMC Gastroenterol 2010;10:69. [ Links ]
85. Calabrese E, Petruzziello C, Onali S, Condino G, Zorzi F, Pallone F, et al. Severity of postoperative recurrence in Crohn's disease: Correlation between endoscopic and sonographic findings. Inflamm Bowel Dis 2009;15:1635-42. [ Links ]
86. Castiglione F, Bucci L, Pesce G, De Palma GD, Camera L, Cipolletta F, et al. Oral contrast-enhanced sonography for the diagnosis and grading of postsurgical recurrence of Crohn's disease. Inflamm Bowel Dis 2008;14:1240-5. [ Links ]
87. Paredes JM, Ripollés T, Cortés X, Moreno N, Martínez MJ, Bustamante-Balén M, et al. Contrast-enhanced ultrasonography: Usefulness in the assessment of postoperative recurrence of Crohn's disease. J Crohns Colitis 2013;7:192-201. [ Links ]
88. Stiatti A, Martinuzzi A, Bartolini M, Lascialfari L, Trallori G, Morettini A. Ultrasonography in the diagnosis of chronic inflammatory intestinal disease. Radiol Med. 1990;80:301-3. [ Links ]
89. Dietrich CF. Significance of abdominal ultrasound in inflammatory bowel disease. Dig Dis 2009;27:482-93. [ Links ]
90. Parente F, Molteni M, Marino B, Colli A, Ardizzone S, Greco S, et al. Are colonoscopy and bowel ultrasound useful for assessing response to short-term therapy and predicting disease outcome of moderate-to-severe forms of ulcerative colitis?: A prospective study. Am J Gastroenterol 2010;105:1150-7. [ Links ]











 texto en
texto en