Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.107 no.5 Madrid may. 2015
REVISIÓN
Pancreatitis del surco
Groove pancreatitis
Anna Pallisera Lloveras1, José Manuel Ramia Ángel2, Carles Vicens Arbona1 y Andrés Cifuentes Rodenas1
1Hospital Son Llàtzer. Palma de Mallorca.
2Hospital Universitario de Guadalajara. Guadalajara
Dirección para correspondencia
RESUMEN
La pancreatitis del surco o groove pancreatitis es un subtipo muy infrecuente de pancreatitis crónica de etiología incierta que ocurre en el surco pancreático duodenal, y suele afectar a varones alcohólicos de mediana edad. Debido a su baja incidencia probablemente haya sido en el pasado infradiagnosticada. El diagnóstico diferencial con otras entidades duodenales y pancreáticas primordialmente el cáncer de páncreas, pese a los avances diagnósticos es aún muy difícil. No existen guías terapéuticas definidas que nos permiten el tratamiento más óptimo.
Hemos efectuado una revisión exhaustiva de la literatura de la clínica, patogenia, histología,métodos diagnósticos, diagnóstico diferencial y maniobras terapéuticas de la pancreatitis del surco que permiten un mejor conocimiento de esta entidad.
Palabras clave: Pancreatitis. Tomografía computarizada. Imagen por resonancia magnética. Cirugía. Revisión.
ABSTRACT
Groove pancreatitis is a type of chronic pancreatitis that affects the area between the pancreatic head, the duodenum and the common bile duct and can simulate, mask or coexist with pancreatic carcinoma. It should be considered in the differential diagnosis of pancreatic masses or duodenal stenosis. It is a rare disease but is probably underdiagnosed. Several names are used to refer to it in the literature, a fact that makes it difficult to extract precise information. Here we present an exhaustive review of the relevant literature on the entity and discuss its clinical features, diagnosis and therapy.
Key words: Groove pancreatitis. Computed tomography. MRI. Surgery. Revision.
Introducción
El surco pancreático duodenal es una pequeña área confinada entre la cabeza pancreática, el duodeno y el colédoco (1). El término pancreatitis del surco (PS) ("groove pancreatitis"), es un tipo de pancreatitis crónica que afecta principalmente a esta zona pancreática, mientras el resto del páncreas permanece prácticamente intacto (2-5). Fue descrita por primera vez en 1973 por Becker, usando el término alemán "Rinnenpankreatitis" (6) que en 1982 Solte y cols. (2) tradujeron como "groove pancreatitis". Es una enfermedad infrecuente pero probablemente también infradiagnosticada (7).
En 1991, Becker y Mischke (3) describieron dos formas de PS: pura y segmentaria. En la forma pura, el tejido cicatricial afecta sólo al surco pancreático, preservando el parénquima y conducto pancreático principal (CPP) (2-5,8,9). En la forma segmentaria, el tejido cicatricial se extiende a la porción dorso-craneal de la cabeza pancreática, próximo a la pared duodenal, con estenosis del CPP (2-5,8,9). No obstante, a veces la demarcación de estas dos formas no está siempre clara (10).
La PS ha recibido diferente terminología en la literatura: distrofia quística de páncreas heterotópico o distrofia duodenal, cuadro descrito por primera vez en 1970 por los autores franceses Potet y Duclert (11). Otros nombres como quiste de pared duodenal/paraduodenal, hamartoma pancreático de la pared duodenal, miodenomatosis, hamartoma de las glándulas de Brunner y pancreatitis paraduodenal han sido utilizados también para describir esta entidad lo que ha dificultado extraer información concisa sobre la misma (4,9,12-17).
La PS es más frecuente en hombres, en la 4.a-5.a década de la vida, con historia de alcoholismo crónico severo, y en algunas series refieren asociación a tabaquismo severo (9,15,16,18-20). También ha sido descrita en mujeres (9,21,22) y en pacientes sin historia de alcoholismo (9,17,21,22) y más jóvenes, pero con una incidencia considerablemente menor (10,21).
La importancia de la PS radica en que puede simular un carcinoma pancreático (CP) (9,18,23-28), puede coexistir con él o incluso enmascararlo (29). La PS se debe tener en cuenta en el diagnóstico diferencial de masas pancreáticas o estenosis duodenales (30-32).
Por todo lo expuesto hemos creído interesante realizar una revisión exhaustiva de la literatura más relevante sobre PS a nivel clínico, diagnóstico y terapéutico.
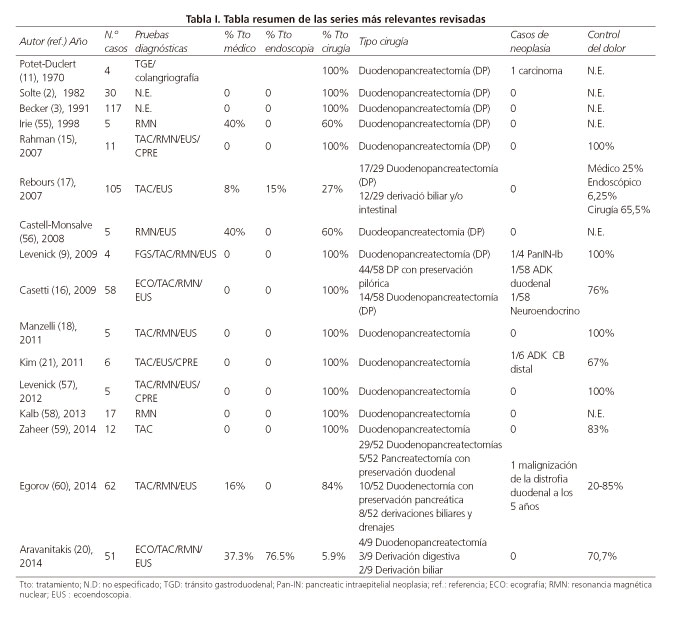
Para ello hemos realizado una búsqueda en MEDLINE (1966-2014) de los términos "groove pancreatitis", "paraduodenal pancreatitis", "paraduodenal wall cysts" y "duodenal cystic dystrophy". Sólo los artículos en español, inglés o francés han sido utilizados. En total 68 artículos han sido leídos y revisados para la realización de esta revisión. De estos, la mayoría son casos clínicos con menos de 4 casos cada uno (5-7,19,22,23,25,28-54). Hemos confeccionado una tabla resumen con las series descritas más relevantes (2,3,9,11,15-18,20,21,55-60).
Clínica
El cuadro clínico más habitual de la PS es dolor en hemiabdomen superior, asociado a vómitos recurrentes postprandiales y pérdida de peso, debido primordialmente a la obstrucción duodenal (15-17,20). A veces puede asociarse a diarrea (17,40), diabetes mellitus (17) y de forma infrecuente a ictericia, que cuando se presenta, normalmente es fluctuante, si la comparamos con la ictericia progresiva secundaria al CP (14,17,21,61). Su curso suele ser crónico con una duración de la clínica que oscila entre semanas hasta más de un año de evolución (42). Se han descrito ciertas complicaciones de la PS, como la perforación y el sangrado gastrointestinal y, excepcionalmente, la degeneración maligna del páncreas heterotópico (15,21,48).
Patogenia
La verdadera patogenia de la PS no está claramente identificada (8,30,42,43). Casi todos los autores coinciden en que el alcohol es un factor predisponente y desencadenante fundamental, independientemente de las diferentes causas etiológicas postuladas (2,4,8,9,12,14,40-42).
Uno de los mecanismos propuestos es la alteración de la secreción pancreática a través del conducto de Santorini (CS) relacionada con la agresión causada por el alcohol (2,4,8,12,14,18,43,62). Cuando esta está perturbada, la secreción pancreática del CS es dirigida hacia el cuerpo del páncreas, hacia la rodilla del Wirsung, que forma un ángulo agudo, causando una interferencia con el flujo y un acúmulo de secreción temporal en la parte superior de la cabeza pancreática (30). El aumento de presión intraductal del CS facilita la formación de pseudoquistes y la fuga de jugo pancreático en el área del surco (29,34).
Esta alteración puede estar producida por causas anatómicas de la papila menor (4,5,14,21,29,43) o por una incorrecta función papilar (4,5,21,33,34).
1. Causas anatómicas: tumores que ocluyen la papila menor y el CS (30,40), un CS cerrado (12), el páncreas divisum (4,5,12,14) y páncreas heterotópico en la pared duodenal que puede reflejar una incompleta involución del páncreas dorsal en esta zona y contribuir a una obstrucción del flujo en esta área (4,14,18,35). Este tejido pancreático heterotópico, bajo la estimulación del tabaco y alcohol, puede causar episodios recidivantes de pancreatitis "isquémica" dolorosa (29).
2. Causas funcionales: la hiperplasia de las glándulas de Brunner (5,8,18,21,29,40) y el consumo crónico excesivo de alcohol y/o tabaco pueden causar disfunción o oclusión de la papila menor (5,29). El consumo crónico de alcohol aumenta la concentración intraductal de proteínas que a su vez conduce a un incremento de la viscosidad del jugo pancreático, que exacerba el proceso inflamatorio y la obstrucción ductal (5,8,18,30,41,42).
También se han postulado como posibles factores desencadenantes de la PS las úlceras pépticas (2,4,5,18,40,42,43,62), tanto gástricas como duodenales, asociándose a la forma segmentaria en un 41% de los casos, en la serie de Solte y cols. (2). Otros factores son: hipersecreción gástrica (4,40), resecciones gástricas (2,4,5,18,37,40,42,43,62), quistes verdaderos de la pared duodenal (2,4,18,42,43,62), quistes de la cabeza pancreática (36,42) y enfermedades previas del sistema biliar (2,5,40,42).
Recientemente se ha descrito un caso de PS causada por isoniazida, posiblemente por vía tóxica o por mediadores autoinmunes (53).
Histología
Los diferentes aspectos macroscópicos y microscópicos de esta entidad son los que han hecho que reciba diferentes nombres en la literatura, como ya se ha mencionado.
Aspecto macroscópico
El examen macroscópico de la pared duodenal, sobre todo en la vecindad de la papila menor, es muy importante para el diagnóstico de PS (12). En la mayoría de casos se objetiva cierto grado de engrosamiento y cicatrización de la pared duodenal con trabeculaciones que suelen ir asociadas a cambios quísticos (5,9,12,14,15,18,26,39,63). Estos quistes, localizados en la submucosa, pueden contener líquido claro, material granular blanco o litiasis y pueden extenderse a la zona del surco comprimiendo el colédoco (5,12,14,26).
A nivel macroscópico existen dos subtipos de PS: a) el tipo "quístico", caracterizado por múltiples quistes que sobresalen de la mucosa del duodeno supraampular y que pueden ser de tamaños comprendidos entre 1 y 10 cm (26), formando un "quiste de pared paraduodenal" o simulando una duplicación intestinal (12); b) el tipo "sólido" que presenta quistes menores de 1 cm de diámetro pero se caracteriza por un marcado engrosamiento de la pared duodenal (26).
El proceso cicatricial también puede afectar al colédoco presentando este una superficie lisa, edematosa y con hialinización homogénea (12,26). Otros hallazgos posibles son: pliegues engrosados con ulceraciones y retracciones en la mucosa duodenal y el engrosamiento de los ganglios linfáticos de la cabeza pancreática (5,12,26).
En estadios tempranos de la PS, la cabeza pancreática suele ser normal o presentar edema, leve fibrosis en la porción dorsocraneal con obstrucción y dilatación del CS (26,43,46). A medida que la enfermedad progresa, la fibrosis es más acentuada y puede afectar a toda la cabeza pancreática (26).
Aspecto microscópico
El examen microscópico de la pared duodenal en la vecindad de la papila menor muestra una proliferación de células mioides envolviendo lóbulos de acinos (14,39,63), más prominente en la musculatura de la submucosa de la papila menor y menos en la zona del surco, creando una imagen que recuerda a la "miodenomatosis" (4,5,12,16,47) o a un hamartoma pancreático (7,39). Es frecuente la existencia de tejido pancreático heterotópico en la submucosa o en la muscular propia de la pared duodenal (4,15,18,30,43,62).
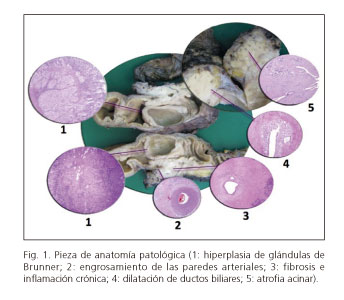
Entre la proliferación mioide se objetivan conductos dilatados, revestidos de epitelio columnar (5,7,12,14-16,47), que puede erosionarse y transformarse en un proceso fibroblástico hipercelular, dando una apariencia de pseudoquiste (4,16) y formando la variedad "quística" anteriormente mencionada (16). Puede haber una reacción de cuerpo extraño con células gigantes y acúmulos de eosinófilos, por la extravasación de material mucoproteinoide al romperse estos conductos (7,12,14,16,47,63). Un hallazgo frecuente de esta entidad es la hiperplasia de glándulas de Brunner (4,5,12,14-16,26,39,63) que contribuye al engrosamiento de la pared duodenal (12,14,16). Otro hallazgo común es la proliferación neural, con nervios "hiperplásicos" íntimamente mezclados con islotes proliferantes, creando una imagen de pseudoinfiltración (12,16) (Fig. 1).
Diagnóstico
El diagnóstico preoperatorio de la PS suele ser difícil y depende del conocimiento y familiaridad de la patología, la revisión de las imágenes por radiólogos expertos y la comunicación entre los diferentes especialistas (22).
Análisis de sangre
Los enzimas pancreáticos y hepáticos pueden estar levemente elevados (4,10,18). Los marcadores tumorales suelen ser normales (4,10).
Ecografía abdominal (ECO)
Normalmente se evidencia una masa hipoecoica con engrosamiento de la pared duodenal que ocasiona estrechamiento de la segunda porción duodenal, y obstrucción del colédoco (18,43,64).
Wronski y cols. (39) han postulado que los hallazgos de la ecografía dependen del estadio de la enfermedad, reflejando los diferentes procesos patológicos que ocurren durante el proceso evolutivo de la PS (39). Así, en el estadio temprano, cuando la inflamación predomina sobre la fibrosis, se evidencia una banda hipoecoica en el surco pancreatodudodenal que corresponde a la infiltración inflamatoria, y además se puede evidenciar una zona heterogénea en la cabeza del páncreas y un moderado engrosamiento de la pared duodenal (39). En la fase más tardía, cuando la fibrosis se ha establecido, se evidencia un engrosamiento hiperecogénico de la pared duodenal, resultante de la hipertrofia de la submucosa por hiperplasia de las glándulas de Brunner (39). En este estadio se puede objetivar un hallazgo patognomónico: una parte de la cabeza pancreática hiperecoica con estructuras ductales anecoicas, que corresponde a la proliferación miomatosa y a la fibrosis del páncreas adyacente (39).
Tomografía abdominal computerizada (TAC)
El TAC refleja las características histológicas de esta entidad de una forma concisa (64).
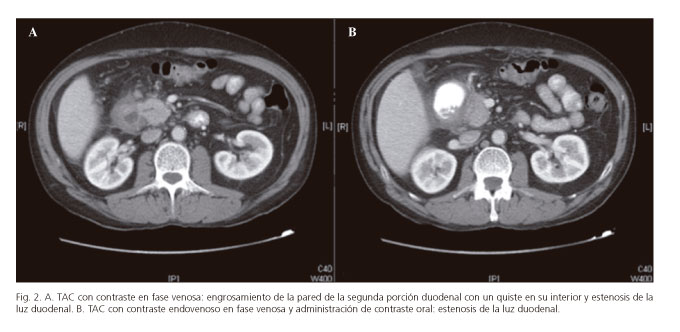
En la forma pura se puede objetivar una masa laminar hipodensa entre la cabeza pancreática y el duodeno, cerca de la papila menor (4,8,10,39,52,59,61,62,65), que representa tejido cicatricial (64). El retraso en la captación de contraste objetivado en algunos pacientes es debido al retraso de la circulación sanguínea por la proliferación de tejido fibrótico y a una constricción de las arterias secundarias (4). Son frecuentes los quistes, de diferente tamaño, en la pared duodenal o en el surco (4,8,10,52,59,62,65) (Fig. 2A), o incluso una masa quística multilocular (4). El hallazgo de múltiples quistes en una pared duodenal engrosada que captan contraste es muy sugestivo de distrofia quística del páncreas heterotópico (4,15), así como la estenosis duodenal por engrosamiento de la pared duodenal (4,8,59,61) (Fig. 2B). El CPP suele ser normal (1,4).
En la forma segmentaria se puede ver una lesión hipodensa en la cabeza pancreática, próxima a la pared duodenal (4,52). El CPP puede estar levemente dilatado hacia el cuerpo y cola del páncreas (4,59). El colédoco puede estar estrecho en la parte distal, con leve dilatación del árbol biliar intra y extrahepático (4). Los vasos peripancreáticos suelen estar preservados, sin signos de trombosis ni infiltración, incluso en los casos de enfermedad extensa (1,4,27).
Fibrogastroscopia (FGS)
Puede mostrar una mucosa duodenal poliploide e inflamada con estenosis de la luz duodenal (7,21,29,31,36,42).
Colangiopancreatografía retrógrada endoscópica (CPRE)
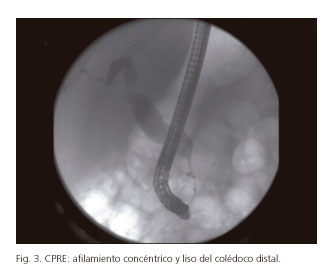
Normalmente es difícil de realizar, sobre todo en fases avanzadas, por la estenosis duodenal presente (4,29,41), pero cuando es posible, puede evidenciar una estenosis distal lisa del colédoco sin anomalías en el CPP o con una leve dilatación (4,7,18,36) (Fig. 3). Otro hallazgo posible es la obstrucción o estenosis irregular del CS y sus ramas, que pueden contener litiasis o tapones de moco (4,7,36).
ECO-endoscopia (USE)
Según algunos autores proporciona una exacta localización y extensión de la enfermedad, aunque es difícil la diferenciación entre infiltración e inflamación (4,17,29). Suele objetivarse engrosamiento y estenosis de la segunda porción duodenal con quistes intramurales (15,17,20,52), así como una estenosis lisa del colédoco (21,31,64). En la forma segmentaria, se puede observar un engrosamiento de la cabeza pancreática o una masa hipoecoica heterogénea que puede infiltrar la pared duodenal (20,41,52,64), con calcificaciones o pseudoquistes y dilatación del CPP (41,42,64).
Biopsia endoscópica o PAAF guiada por ECO-endoscopia
Hay poca información en la literatura sobre las características citológicas en la PAAF de la PS (44,50), con gran variabilidad entre ellas, según la zona puncionada (4,44,50). Si se punciona un área con abundantes células fusiformes (44), con gran número de células gigantes multinucleadas (50) o con hiperplasia de glándulas de Brunner puede simular una neoplasia (44,47,50). Esta situación es particularmente traicionera ya que la presencia de células gigantes y de hiperplasia de glándulas de Brunner son algunos de los elementos de esta entidad (66). Así mismo, una zona con cambios fibróticos no descarta una neoplasia, ya que es común encontrar una reacción desmoplásica asociada al adenocarcinoma imitando cambios inflamatorios anormales (4).
Resonancia magnética nuclear (RMN)
Para algunos autores es el mejor método diagnóstico de PS, por presentar un rendimiento superior y por permitir evaluar los diferentes aspectos patológicos de la enfermedad (43,56,58,62,67).
En la RMN, la PS se evidencia como una masa laminar entre la cabeza del páncreas y el duodeno, que en la secuencia T1 es hipointensa en comparación con el parénquima pancreático (43,55,56,62,64,65). En la secuencia T2 puede ser hipo-, iso- o ligeramente hiperintensa, según el tiempo de evolución de la enfermedad. En estadios precoces subagudos es más hiperintensa por el edema, mientras que en los estadios crónico es hipointensa por la fibrosis (43,55,56,62,64,65,67). En las imágenes post-gadolinio se puede observar un realce irregular de la masa en la fase portal, pero con una captación de contraste progresiva y centrípeta en fases más retardadas, que refleja el elevado componente fibrótico (43,55,56,64,67).
Se pueden objetivar lesiones quísticas en el surco o en la pared duodenal, más evidentes e hiperintensas en la secuencia T2 (20,43,55,56,65,67) y es frecuente evidenciar un aumento del grosor o estenosis de la pared duodenal (4,8,20,43,56,62,65,67). Algunos autores refieren que siempre hay un cierto grado de estenosis virtual del colédoco, otros que se objetiva sólo en el 50% de los pacientes (63,67). Cuando tiene lugar es una estenosis tubular lisa o en forma de estrechamiento regular (8,55,57,65,67). En la forma segmentaria, la cabeza pancreática o el páncreas entero puede visualizarse hipointenso en la secuencia T1, asociado con atrofia del parénquima y dilatación ductal, reflejando la pérdida progresiva de células glandulares que son reemplazadas por tejido fibroso (65,67). También se puede evidenciar un engrosamiento de la cabeza del páncreas con un estrechamiento progresivo del CPP (8,43,67). En la forma pura el páncreas suele objetivarse hiperintenso en la secuencia T1 (67).
Colangiopancreatografía por resonancia magnética (MRCP)
Actualmente es la prueba de imagen principal para la visualización del CPP y el colédoco (4). Informa de la relación entre el sistema ductal y los cambios quísticos (55,67). Permite evidenciar una estenosis lisa de la porción distal intrapancreática del colédoco (4,31,62,64). En la forma pura, el CPP es normal, pero en la forma segmentaria normalmente se evidencia una estenosis del CPP en la cabeza pancreática asociada a una dilatación proximal poco marcada (4).
En la mayoría de casos de pancreatitis del surco se evidencia un ensanchamiento del espacio entre los conductos pancreáticos, colédoco distal y la luz duodenal, debido a una lesión ocupante de espacio en el surco, así como un marcado engrosamiento de la pared duodenal (64,67). No es infrecuente la imagen de "vesícula biliar en forma de banana" ("Banana-shaped"), a menudo encontrada en las pancreatitis crónicas (67).
Diagnóstico diferencial
El surco pancreático duodenal es una zona anatómica pequeña donde convergen los procesos patológicos que afectan la cabeza pancreática, el duodeno, la papila duodenal, el colédoco distal y el retroperitoneo, por lo que el diagnóstico diferencial de la PS incluye un espectro de entidades que va desde variantes anatómicas hasta entidades malignas (1).
El diagnóstico diferencial más importante de la PS (principalmente de la forma segmentaria) es con el carcinoma de cabeza de páncreas, que en la mayoría de los casos es extremadamente complicado preoperatoriamente (6,10,13,21,23-25,43,61,64,65,67). Ete es difícil de realizar de manera fiable mediante TAC y RMN, sobre todo cuando la tumoración es escirra y con gran componente fibrótico (32,61). Existen además CP que tienen su origen en la zona del surco, lo que dificulta su distinción de la forma pura de la PS (21,23,29,43,62,63). En 2010, Ishigami y cols. (68) describieron la utilidad de la fase venosa portal en el TAC y en la RMN para diferenciar la PS y el carcinoma del surco pancreático, presentando la PS más frecuentemente un realce focal irregular en dicha fase (68). Recientemente Kalb y cols. (58) han presentado un estudio en el que consiguen una precisión diagnóstica del 87,2% de la PS utilizando tres criterios estrictos en la RMN: engrosamiento focal de la segunda porción duodenal, un realce anormalmente aumentado de la segunda porción duodenal y cambios quísticos en la región del conducto pancreático accesorio. Según los autores, si se cumplen los tres criterios se puede excluir el carcinoma ductal de cabeza de páncreas con un valor predictivo negativo del 92,9% (58).
La existencia de dilatación ductal del CPP no sirve para diferenciar entre PS y carcinoma de cabeza de páncreas, dado que si este último afecta al CPP puede presentar una dilatación de su porción distal y en el CP con origen en el surco, el CPP suele estar respetado (23). La invasión vascular es un signo importante para la diferenciación de las dos entidades (4,5,13,27,62,65), especialmente de la arteria gastroduodenal que aparece infiltrada en el caso de tumor y desplazada a la izquierda en el caso de PS (1,4,43,61). El hallazgo de lesiones quísticas en la masa del surco o pared duodenal, normalmente ausentes en el CP (1,2,4,59,61,62,64), el engrosamiento inflamatorio de la pared duodenal (1,2,6,23,30,50,61,62) y la estenosis por cicatrización de la luz duodenal apuntan a la PS (1,2,23,61). La biopsia endoscópica puede ser de ayuda, aunque poco si el carcinoma es pequeño y no invade la mucosa duodenal (4). La presencia de hiperplasia de glándulas de Brunner es más característico de la PS y normalmente ausente en el CP (2,6,30).
La CPRE y la ecoendoscopia pueden servir también para diferenciar estas dos entidades, presentando la PS una estenosis del colédoco regular y lisa, mientras que en el CP es irregular y abrupta (1,5,6,13,30,42,62,65,67).
La PAAF guiada por ecoendoscopia es de gran importancia en el estudio de lesiones pancreáticas dada su alta sensibilidad y especificidad para el diagnóstico del CP (44,50). Aún así su valor está limitado dependiendo de la zona de punción (4,44) y su interpretación tiene que apoyarse y correlacionarse con el resto de exploraciones complementarias (44,50).
Otras entidades con las que realizar el diagnóstico diferencial, sobre todo en la forma pura, son: las enfermedades de la vía biliar común, como el quiste de colédoco (21,32) y el colangiocarcinoma distal (4,21,32,42,67), las enfermedades periampulares, como el ampuloma (10), carcinoma duodenal (4,10,15,42,43,62,65), divertículo periampular (32), metástasis ampulares (49), hamartoma duodenal (21,24), tumores neuroendocrinos del surco (21,32,43,62,65), pancreatitis autoinmune (21,43,62,65) y pancreatitis agudas con necrosis o pseudoquistes en la zona del surco (4,32,42,43).
Los carcinomas periampulares, incluyendo el ampuloma y el colangiocarcinoma distal, suelen presentar una masa hipointensa en las secuencias T1 y T2 de la RMN (43) y en la MRCP se evidencia una estenosis abrupta del colédoco, en vez de la estenosis segmentaria, larga y lisa de la PS (4,43). El tumor neuroendocrino que tiene lugar más frecuentemente en la zona del surco es el gastrinoma y se distingue de la PS en que presenta una imagen hiperintensa en la secuencia T2 de la RMN e hipervascular después de la administración del contraste, con una captación periférica en anillo postgadolinum (43). Los GIST que se presentan como lesiones hipodensas en la capa submucosa duodenal pueden simular la PS, aunque la mayoría de estos y los tumores neuroendocrinos se presentan como lesiones hipervasculares (10).
Una entidad que merece una mención a parte, por ser casi imposible de diferenciar preoperatoriamente de la PS, es la degeneración maligna del páncreas heterotópico, que aunque poco frecuente, ha sido descrita en algunas series de especímenes quirúrgicos de PS (48). En casos de enfermedad muy avanzada se podría evidenciar la diseminación del tumor por la cara posterior de la segunda porción duodenal, respetando la cabeza pancreática (48).
Tratamiento
En un estudio reciente Arvanitakis y cols. (20) demuestran que el tratamiento escalonado de la PS es factible, efectivo y asociado a una tasa de complicaciones aceptables.
El tratamiento de los síntomas iniciales agudos con las medidas conservadoras: analgésicos, reposo pancreático y abstinencia de alcohol y tabaco, pueden ser útiles temporalmente (4,7,13,18,21,2,31,36,37,57,63). A veces la nutrición enteral no es posible en los pacientes por la estenosis duodenal y requieren nutrición parenteral (17,20,63).
La somatostatina o sus análogos de acción prolongada han demostrado mejorar los resultados en los pacientes con un enfoque no-quirúrgico (20). Esta puede ser una alternativa al tratamiento endoscópico, cuando no se puede acceder a la papila por compresión o por el gran número de quistes (66), y a la cirugía, en pacientes con un consumo crónico de alcohol y un diagnóstico establecido de PS asociada a pancreatitis crónica (16,48). Entre los inconvenientes destaca el elevado riesgo de reaparición de los síntomas al cese de su administración (20,48).
El tratamiento endoscópico, que incluye el drenaje del conducto pancreático, la dilatación de la estenosis y el drenaje de quistes, es el pilar del tratamiento no quirúrgico y puede adaptarse en función de la respuesta clínica (20). El drenaje endoscópico del CS a través de la papila menor (5,18,34,39,63), parece factible sólo en el estadio temprano de la enfermedad, antes del desarrollo de la cicatrización severa y la estenosis duodenal, que impide el paso del endoscopio (34,39). Algunos autores refieren que la colocación de una prótesis en la papila menor disminuye el dolor temporalmente (57) y puede ser una alternativa a la cirugía para aquellos pacientes con una alteración de la secreción del flujo pancreático por la papila menor (4). La fenestración endoscópica mediante una cistoduodenostomía para el drenaje de los quistes parece efectiva en pacientes con pocos quistes y grandes (13,48). El inconveniente de estas dos técnicas endoscópicas es la tasa de recidiva de los síntomas y las posibles complicaciones derivadas de la movilización u obstrucción de la prótesis (16). El tratamiento médico y/o endoscópico pueden utilizarse como primera opción en casos no muy severos o como tratamientos "puente" a la cirugía (16). Sus resultados son variables, mientras que en la serie de Rebours y cols. (17) sólo un 37,5% de los pacientes tratados endoscópicamente presentaron respuestas clínicas completas, en series más recientes (20) estas han sido de casi el 80%, asociando el tratamiento médico con el tratamiento endoscópico (20).
Algunos autores abogan que gracias a las mejoras en las técnicas de imagen que permiten descartar malignidad en algunos casos de PS, se puede optar, con más tranquilidad, por la realización de procedimientos no quirúrgicos en el tratamiento de esta entidad (20,66). Contrariamente, según Patriti y cols. (48), la cirugía parece ser el tratamiento más seguro incluso cuando no hay sospecha de malignidad asociada al cuadro, mientras no haya un sistema de detección de la degeneración a adenocarcinoma en el páncreas heterotópico.
La cirugía se considera el tratamiento de elección en la PS si los síntomas no mejoran, cuando hay complicaciones o hay dudas diagnósticas que sugieran malignidad (5,7,16,18,21,25,31,32,35,42,51). Para algunos autores, la técnica de elección es la duodenopancreatectomía cefálica o técnica de Whipple (13,16,42,51,60), sobre todo cuando el síntoma principal es el dolor, asociado o no a la obstrucción duodenal (17). La pancreatectomía con preservación duodenal también se ha realizado en algunos casos con una correcta resolución de los síntomas (5,42,60), aunque no siempre es posible dado el importante componente fibrótico de la zona antral y periduodenal (10,16). Otras técnicas realizadas por algunos autores con buenos resultados, en caso de afectación principalmente duodenal, son las resecciones duodenales con preservación pancreática (60). Una gastroenteroanastomosis puede ser una solución para los pacientes con marcada estenosis duodenal sin dolor intratable (17) y/o no aptos para una pancreatectomía.
Se ha demostrado que la duodenopancreatectomía es un tratamiento efectivo y definitivo para el manejo de la PS, controlando los dos principales síntomas de esta entidad, el dolor y la pérdida de peso (4,15,18,39,47,48,57,60), permitiendo un examen patológico completo de la pieza quirúrgica para confirmar el diagnóstico y descartar malignidad (31,39,48). Se ha postulado que la patogénesis del dolor en esta entidad está relacionada con los mediadores inflamatorios más que con la hiperpresión del conducto pancreático principal, por lo que las técnicas de derivación pancreatoyeyunales, asociadas o no con un derivación gástrica y/o biliar, ofrecerían un tratamiento temporal con recidiva de los síntomas (16,60). Es importante la abstinencia de alcohol y tabaco, asociado a la cirugía, para obtener buenos resultados a largo plazo (16,60).
En un estudio reciente Egorov y cols. (60) han presentado una serie de 62 pacientes, de los cuales 52 fueron tratados quirúrgicamente: 29 mediante duodenopancreatectomías; 5 con pancreatectomía con preservación duodenal, 10 mediante resección duodenal con preservación pancreática y 8 mediante cirugías de drenaje, obteniendo un control de los síntomas del 85%, 18%, 83% y 18%, respectivamente (60).
Los pacientes con PS del surco sometidos a tratamiento sintomático o con técnicas quirúrgicas de preservación duodenal requieren un seguimiento estricto por el riesgo de presentar un carcinoma coexistente (7,42), sobre todo en el conducto de Santorini (7,30).
Conclusión
La PS es un tipo de pancreatitis crónica que afecta el área entre la cabeza pancreática, el duodeno y el colédoco que puede simular, enmascarar o coexistir con un carcinoma pancreático y que tiene que tenerse en cuenta el diagnóstico diferencial de masas pancreáticas o estenosis duodenales. En el TAC y en la RMN se evidencia como una masa laminar entre la cabeza pancreática y el duodeno, o en la cabeza pancreática, con o sin dilatación del CPP. Es característico de esta entidad el engrosamiento inflamatorio de la pared y la estenosis de la luz duodenal, y las lesiones quísticas en la masa o la pared duodenal. Una estenosis del colédoco lisa y regular y el desplazamiento o falta de infiltración vascular también pueden ayudar al diagnóstico diferencial de esta entidad con el carcinoma pancreático. El tratamiento médico y endoscópico puede ser útil inicialmente o en pacientes no susceptibles de cirugía, pero ya sea por duda diagnóstica o por la necesidad de solventar la sintomatología refractaria al tratamiento médico-endoscópico, en ciertas ocasiones la resección pancreática puede ser necesaria.
Agradecimientos
Al Dr. Mario Serradilla por la imagen de anatomía patológica de pancreatitis del surco.
![]() Dirección para correspondencia:
Dirección para correspondencia:
José Manuel Ramia Ángel.
Hospital Universitario de Guadalajara.
c/ Donantes de Sangre, s/n.
19002 Guadalajara
e-mail:
jose_ramia@hotmail.com
Recibido: 01-04-2014
Aceptado: 22-02-2015
Bibliografía
1. Hernández-Jover D, Pernas JC, González-Ceballos S, et al. Pancreatoduodenal junction: Review of anatomy and pathologic conditions. J Gastrointest Surg 2011;15:1269-81. [ Links ]
2. Solte M, Weib W, Volkholz H, et al. A special form of segmental pancreatitis: "groove pancreatitis". Hepatogastroenterology 1982;29: 198-208. [ Links ]
3. Becker V, Mischke U. Groove pancreatitis. Int J Pancreatol 1991; 10:173-82. [ Links ]
4. Triantopoulou C, Dervenis C, Giannakou N, et al. Groove pancreatitis: A diagnostic Challenge. Eur Radiol 2009;19:1736-43. [ Links ]
5. Tezuka K, Makino T, Hirai I, et al. Groove pancreatitis. Dig Surg 2010;27:149-52. [ Links ]
6. Mohl W, Hero-Gross R, Feifel G, et al. Groove pancreatitis: An important differential diagnosis to malignant stenosis of the duodenum. Dig Dis Sci 2001;46:1034-8. [ Links ]
7. Meesiri S. Groove pancreatitis: Report of one case in Thailand. J Med Assoc Thai 2009;92:1554-9. [ Links ]
8. Kwak SW, Kim S, Lee JW, et al. Evaluation of unusual causes of pancreatitis: role of cross-sectional Imaging. Eur J Radiol 2009;71:296-312. [ Links ]
9. Levenick JM, Gordon SR, Sutton JE, et al. A comprehensive, case-based review of groove pancreatitis. Pancreas 2009;38:e169-75. [ Links ]
10. Raman SP, Salaria SN, Hruban RH, et al. Groove pancreatitis: Spectrum of imaging findings and radiology-pathology correlation. AJR Am J Roentgenol 2013;2013;201:W29-39. [ Links ]
11. Potet N, Duclert N. Cystic dystrophy on aberrant pancreas of the duodenal wall. Arch Fr Mal App Dig 1970;59:223-38. [ Links ]
12. Adsay NV, Zamboni G. Paraduodenal pancreatitis: A clinico-pathologically distinct entity unifying "cystic dystrophy of heterotopic pancreas", "para-duodenal wall cyst" and "groove pancreatitis". Semin Diagn Pathol 2004;21:247-54. [ Links ]
13. Sunnapwar A, Prasad SR, Menias CO, et al. Nonalcoholic, nonbiliary pancreatitis: Cross-sectional Imaging spectrum. AJR Am J Roentgenol 2010;195:67-75. [ Links ]
14. Klöppel G. Chronic pancreatitis, pseudotumors and other tumor-like lesions. Mod Pathol 2007;20 (Supl. 1):S113-31. [ Links ]
15. Rahman SH, Verbeke CS, Gomez D, et al. Pancreatico-duodenectomy for complicated groove pancreatitis. HPB 2007;9:229-34. [ Links ]
16. Casetti L, Bassi C, Salvia R, et al. "Paraduodenal" pancreatitis: Results of surgery on 58 consecutive patients from a single institution. World J Surg 2009;33:2664-9. [ Links ]
17. Rebours V, Lévy P, Vullierme MP, et al. Clinical and morphological features of duodenal cystic dystrophy in heterotopic pancreas. Am J Gastroenterol 2007;102:871-9. [ Links ]
18. Manzelli A, Petrou A, Lazzaro A, et al. Groove pancreatitis. A mini-series report and review of literature. JOP 2011;12:230-3. [ Links ]
19. Latham J, Sanjay P, Watt DG, et al. Groove pancreatitis: A case series and review of the literature. Scott Med J. 2013;58:e28-31. [ Links ]
20. Arvanitakis M, Rigaux J, Toussaint E, et al. Endotherapy for paraduodenal pancreatitis: A large retrospective case series. Endoscopy 2014;46:580-7. [ Links ]
21. Kim JD, Han YS, Choi DL. Characteristic clinical and pathologic features for preoperative diagnosed groove pancreatitis. J Korean Surg Soc 2011;80:342-7. [ Links ]
22. Gupta R, Williams GS, Keough V. Groove pancreatitis: A common condition that is uncommonly diagnosed preoperatively. Can J Gastoenterol Hepatol 2014;28:181-2. [ Links ]
23. Tan CH, Chow PK, Thng CH, et al. Pancreatic adenocarcinoma that mimics groove pancreatitis: Case report of a diagnostic dilemma. Dig Dis Sci 2006;51:1294-6. [ Links ]
24. Adsay NV, Basturk O, Klimstra DS, et al. Pancreatic pseudotumors: Non-neoplastic solid lesions of the pancreas that clinically mimic pancreas cancer. Semin Diagn Pathol 2004;21:260-7. [ Links ]
25. Varma V, Gandhi V, Bheerappa N, et al. Groove pancreatitis mimicking pancreatic malignancy. Indian J Gastroenterol 2008;27:86. [ Links ]
26. Zamboni G, Capelli P, Scarpa A, et al. Nonneoplastic mimickers of pancreatic neoplasms. Arch Pathol Lab Med 2009;133:439-53. [ Links ]
27. Coakley FV, Hanley-Knutson K, Mongan J, et al. Pancreatic Imaging mimics: Part 1, Imaging mimics of pancreatic adenocarcinoma. AJR Am Roentgenol 2012;199:301-8. [ Links ]
28. Palomeque Jimenez A, Pérez Cabrera B, Navarro Freire F, et al. Groove pancreatitis in the differential diagnosis of pancreatic adenocarcinoma. Cir Esp 2014;92:127-9. [ Links ]
29. Malde DJ, Oliveira-Cunha M, Smith AM. Pancreatic carcinoma masquerading as groove pancreatitis: Case report and review of the literature. JOP 2011;12:598-602. [ Links ]
30. Shudo R, Yazaki Y, Sakurai S, et al. Groove pancreatitis: Report of a case and review of the clinical and radiologic features of groove pancreatitis reported in Japan. Intern Med 2002;41:537-42. [ Links ]
31. Balakrishnan V, Chatni S, Radhakrishnan L, et al. Groove pancreatitis: A case report and review of literature. JOP 2007;8:592-7. [ Links ]
32. Viñolo-Ubiña C, Morales Ruiz J, Heredia Carrasco C, et al. Groove pancreatitis with duodenal stenosis. Rev Esp Enferm Dig 2010; 102:59-60. [ Links ]
33. Shudo R, Obara T, Tanno S, et al. Segmental groove pancreatitis accompanied by protein plugs in Santorini's duct. J Gastroenterol 1998;33:289-94. [ Links ]
34. Isayama H, Kawabe T, Komatsu Y, et al. Successful treatment of groove pancreatitis by endoscopic drainage via the minor papilla. Gastrointest Endosc 2005;61:175-8. [ Links ]
35. Chatelain D, Vibert E, Yzet T, et al. Groove pancreatitis and pancreatic heterotopia in the minor duodenal papilla. Pancreas 2005;30:e92-5. [ Links ]
36. Sanada Y, Yoshida K, Itoh H, et al. Groove pancreatitis associated with true pancreatic cyst. J Hepatobiliary Pancreat Surg 2007;14:401-9. [ Links ]
37. Ito R, Shiba H, Okamoto T, et al. Groove pancreatitis with several cystic lesions around pancreatic head treated conservatively: Report of a case. Case Rep Gastroenterol 2008;2:405-9. [ Links ]
38. Lee TH, Park SH, Lee CK, et al. Ectopic opening of the common bile duct accompanied by groove pancreatitis: Diagnosis with magnetic resonance cholangiopancreatography. Gastrointest Endosc 2010;71:1301-2. [ Links ]
39. Wronski M, Karkocha D, Slodkowski M, et al. Sonographic findings in groove pancreatitis. J Ultrasound Med 2011;30:111-5. [ Links ]
40. Fiscaletti M, Fornelli A, Zanini N, et al. Segmental groove pancreatitis and duodenal gangliocytic paraganglioma with lymph node metastasis: A newly described association. Pancreas 2011;40:1145-7. [ Links ]
41. De Tejada AH, Chennat J, Miller F, et al. Endoscopic and EUS features of groove pancreatitis masquerading as a pancreatic neoplasm. Gastrointest Endosc 2008;68:796-8. [ Links ]
42. German V, Ekmektozoglou KA, Kyriakos N, et al. Pancreatitis of the gastroduodenal groove: A case report. Case Report Med 2010;2010:329587. doi:10.1155/2010/329587. [ Links ]
43. Ferreira A, Remalho M, Herédia V, et al. Groove pancreatitis: A case report and review of the literature. J Radiol Case Rep 2010;4:9-17. [ Links ]
44. Chute DJ, Stelow EB. Fine-Needle aspiration features of paraduodenal pancreatitis (groove pancreatitis): A report of three cases. Diagn Cytophathol 2011;40:1116-21. [ Links ]
45. Tyagi P, Thaper S, Bhatia V, et al. Often a missed type of pancreatitis: Groove pancreatitis. Indian J Gastroenterol 2012;31:215-6. [ Links ]
46. Goldaracena N, McCormack L. A typical feature of groove pancreatitis. HPB 2012;14:487-8. [ Links ]
47. Nankoe SR, Wilcox R, Roggin KK. Paraduodenal pancreatitis (groove pancreatitis) mimicking pancreatic adenocarcinoma. Clin Gastroenterol Hepatol 2012;10:A31-2. [ Links ]
48. Patriti A, Castellani D, Partenzi A, et al. Pancreatic adenocarcinoma in paraduodenal pancreatitis: A note of caution for conservative tretaments. Updates Surg 2012;64:307-9. [ Links ]
49. Lee TH, Park SH, Lee CK, et al. Ampulla of Vater metastasis from recurrent uterine cervix carcinoma presenting as groove pancreatitis. Gastrointest Endosc 2011;73:362-3. [ Links ]
50. Brosens LAA, Leguit RJ, Vleggaar FP, et al. EUS-guided FNA cytology diagnosis of paraduodenal pancreatitis (Groove pancreatitis) with numerous giant cells: Conservative management by cytological and radiological correlation. Cytopathology 2014. doi: 10.1111/cyt.12140 (Epub ahead of print). [ Links ]
51. Jiménez Fuertes M, Costa Navarro D. Distrofia quística de pared duodenal. De la incertidumbre diagnóstica a la confirmación anatomopatológica. Cir Esp 2014;92:498-9. [ Links ]
52. Dekeyzer S, Traen S, Smeets P. CT features of Groove pancreatitis subtypes. JBR-BTR 2013;96:365-8. [ Links ]
53. Yi PH, Veltre DR, Kuttab JS, et al. Acute Groove pancreatitis due to isoniazid. Neth J Med 2013;71:104. [ Links ]
54. Ciçek B, Ergüner I, Kara F, et al. Groove (paraduodenal) pancreatitis: Report of two cases. Turk J Gastroenterol 2013;24:173-7. [ Links ]
55. Irie H, Honda H, Kuroiwa T, et al. MRI of groove pancreatitis. J Comput Assist Tomogr 1998;22:651-5. [ Links ]
56. Castell-Monsalve FJ, Sousa-Martin JM, Carranza-Carranza A. Groove pancreatitis: MRI and pathologic findings. Abdom Imaging 2008; 33:342-8. [ Links ]
57. Levenick JM, Sutton JE, Smith KD, et al. Pancreaticoduodenectomy for the treatment of groove pancreatitis. Dig Dis Sci 2012;57:1954-8. [ Links ]
58. Kalb B, Martin DR, Sarmiento JM, et al. Paraduodenal pancreatitis: Clinical performance of MR imaging in distinguishing from carcinoma. Radiology 2013;269:475-81. [ Links ]
59. Zaheer A, Haider M, Kawamoto S, et al. Dual-phase CT finding of groove pancreatitis. Eur J Radiol 2014;83:1337-43. [ Links ]
60. Egorov VI, Vankovich AN, Petrov RV, et al. Pancreas-preserving approach to "paraduodenal pancreatitis" treatment: Why, when, and how? Experience of treatment of 62 patients with duodenal dystrophy. Biomed Res Int 2014;2014:185265. doi:10.1155/2014/185265. [ Links ]
61. Gabata T, Kadoya M, Terayama N, et al. Groove pancreatic carcinomas: Radiological and pathological findings. Eur Radiol 2003; 13:1679-84. [ Links ]
62. Shanbhogue AK, Fasih N, Surabhi VR, et al. A clinical and radiologic review of uncommon types and causes of pancreatitis. Radiographics 2009;29:1003-26. [ Links ]
63. Pezzilli R, Santini D, Calculli L, et al. Cystic dystrophy of the duodenal wall is not always associated with chronic pancreatitis. World J Gastroenterol 2011;17:4349-64. [ Links ]
64. Arora A, Dev A, Mukund A, et al. Paraduodenal pancreatitis. Clin Radiol 2014;69:299-306. [ Links ]
65. Perez-Johnston R, Sainani NI, Sahani DV. Imaging of chronic pancreatitis (including groove and autoimmune pancreatitis). Radiol Clin N Am 2012;50:447-66. [ Links ]
66. Laugier R, Grandval P. Does paraduodenal pancreatitis systematically need surgery? Endoscopy 2014;46:588-90. [ Links ]
67. Blasbalg R, Baroni RH, Costa DN, et al. MRI features of groove pancreatitis. AJR Am J Roentgenol 2007;189:73-80. [ Links ]
68. Ishigami K, Tajima T, Nishie A, et al. Differential diagnosis of Groove pancreatic carcinomas vs groove pancreatitis: Usefulness of the portal venous phase. Eur J Radiol 2010;74:e95-100. [ Links ]











 texto en
texto en