Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Española de Enfermedades Digestivas
versão impressa ISSN 1130-0108
Rev. esp. enferm. dig. vol.108 no.11 Madrid Nov. 2016
https://dx.doi.org/10.17235/reed.2016.4058/2016
REVISIÓN
Mecanismos responsables de la relajación neuromuscular en el tracto gastrointestinal
Mechanisms responsible for neuromuscular relaxation in the gastrointestinal tract
Diana Gallego1,2, Noemí Mañé1, Víctor Gil1, Miriam Martínez-Cutillas1 y Marcel Jiménez1,2
1Departamento de Biología Celular, Fisiología e Inmunología e Instituto de Neurociencias. Universitat Autònoma de Barcelona. Barcelona.
2Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBERehd). Instituto de Salud Carlos III. Barcelona
La investigación llevada a cabo por Diana Gallego está financiada por el CIBERehd (Instituto de Salud Carlos III).
Dirección para correspondencia
RESUMEN
El sistema nervioso entérico (SNE) es responsable de la génesis de los patrones motores que aseguran un correcto tránsito intestinal. Las neuronas entéricas se clasifican en aferentes, interneuronas y motoneuronas, que pueden a su vez ser excitatorias, causando contracción, o inhibitorias, provocando la relajación de la musculatura lisa. Los mecanismos de relajación muscular son claves para entender procesos fisiológicos como la relajación de los esfínteres, la acomodación gástrica o la fase descendente del reflejo peristáltico. El óxido nítrico (NO) y el ATP o una purina relacionada son los principales neurotransmisores inhibitorios. Las neuronas nitrérgicas sintetizan NO a partir del enzima nNOS. El NO difunde a través de la membrana celular uniéndose a su receptor, la guanilil ciclasa, y activando posteriormente una serie de mecanismos intracelulares que provocan finalmente una relajación muscular. El ATP actúa como neurotransmisor inhibitorio junto con el NO y el receptor de membrana purinérgico P2Y1 ha sido identificado como elemento clave para entender cómo el ATP relaja la musculatura intestinal. Aunque probablemente ningún clínico duda de la importancia del NO en la fisiopatología motora digestiva, la relevancia de la neurotransmisión purinérgica es aparentemente mucho menor puesto que el ATP no ha sido todavía asociado a una disfunción motora concreta. El objetivo de esta revisión es mostrar el funcionamiento de ambos mecanismos de relajación para poder establecer las bases fisiológicas de posibles disfunciones motoras asociadas a la alteración de la relajación intestinal.
Palabras clave: Sistema nervioso entérico. Neurotransmisión inhibitoria. Óxido nítrico. ATP. Receptores P2Y1.
ABSTRACT
The enteric nervous system (ENS) is responsible for the genesis of motor patterns ensuring an appropriate intestinal transit. Enteric motor neurons are classified into afferent neurons, interneurons and motorneurons. Motorneurons are excitatory or inhibitory causing smooth muscle contraction and relaxation respectively. Muscle relaxation mechanisms are key for the understanding of physiological processes such as sphincter relaxation, gastric accommodation, or the descending phase of the peristaltic reflex. Nitric oxide (NO) and ATP or a related purine are the primary inhibitory neurotransmitters. Nitrergic neurons synthesize NO through nNOS enzyme activity. NO diffuses across the cell membrane to bind guanylyl cyclase, and then activates a number of intracellular mechanisms that ultimately result in muscle relaxation. ATP is an inhibitory neurotransmitter together with NO. The P2Y1 receptor has been identified as a the purine receptor responsible for smooth muscle relaxation. Although, probably, no clinician doubts about the significance of NO in the pathophysiology of gastrointestinal motility, the relevance of purinergic neurotransmission is apparently much lower, as ATP has not been associated with any specific motor dysfunction yet. The goal of this review is to discuss the function of both relaxation mechanisms in order to establish the physiological grounds of potential motor dysfunctions arising from impaired intestinal relaxation.
Key words: Enteric nervous system. Inhibitory neurotransmission. Nitric oxide. ATP. P2Y1 receptors.
Introduccón
El tracto digestivo alberga 100 millones de neuronas que constituyen el sistema nervioso entérico (SNE); estas neuronas se distribuyen por todo el tubo digestivo y están agrupadas en dos plexos, el plexo submucoso o de Meissner y el mientérico o de Auerbach. El plexo mientérico está situado entre las capas musculares circular y longitudinal desde el esófago hasta el canal anal. Su principal papel es la regulación de la actividad motora, pero tiene también terminaciones que alcanzan la mucosa y, por tanto, implicación en funciones secretoras. El plexo submucoso se encuentra bajo la muscularis mucosae y una de sus principales funciones es el control de la secreción. El SNE junto con las células intersticiales de Cajal (ICCs) son los responsables de regular los movimientos de mezcla y propulsión del tubo digestivo, que tienen como efector final el músculo liso. El SNE posee una importante independencia pese a recibir influencias del sistema nervioso central a través de las vías aferentes y eferentes del autónomo.
Las neuronas del SNE pueden clasificarse según su función como neuronas aferentes, interneuronas y motoneuronas (1-4). Las neuronas aferentes denominadas IPANs (del inglés intrinsic primary afferent neurons) tienen sus cuerpos celulares tanto en los ganglios del plexo mientérico como en los del plexo submucoso y recogen la información "sensitiva" gracias a las fibras nerviosas cuyos terminales están localizados en la mucosa intestinal. Las IPANs responden a estímulos químicos de deformación mecánica de la mucosa y a otros estímulos como el estiramiento radial y la tensión muscular. En la mucosa se encuentran, además, las células enterocromafines, que liberan mediadores como la serotonina y el ATP (5) y responden a estímulos luminales que, a su vez, activan los terminales de las IPANs (3,6). La activación de estas células es el primer paso para poner en marcha los reflejos motores, ya que transforman los estímulos procedentes de la luz intestinal en un impulso nervioso que se transmite a las interneuronas y motoneuronas.
Las interneuronas forman cadenas en dirección oral y aboral formando circuitos localizados en el plexo mientérico. Se pueden diferenciar, por tanto, interneuronas ascendentes (que proyectan en sentido oral) y descendentes (que proyectan en sentido anal). Un ejemplo de la integración de la información por parte de estas neuronas lo encontramos en el reflejo peristáltico. La estimulación en la mucosa libera mediadores (serotonina y ATP) que activan IPANs, los cuales, a su vez, activan las interneuronas. Estas interneuronas se encargarán de activar oralmente motoneuronas excitatorias provocando la contracción del musculo liso y, aboralmente, motoneuronas inhibitorias, relajando el músculo y permitiendo la propulsión del bolo en sentido peristáltico (1,7,8).
Las motoneuronas representan la conexión final con las células musculares lisas de las capas circular y longitudinal. Se pueden subclasificar en motoneuronas excitatorias e inhibitorias, según los neurotransmisores que codifican (2). Las motoneuronas excitatorias liberan mayoritariamente acetilcolina (ACh) y taquiquininas (principalmente la NKA y la substancia P). En cambio, las motoneuronas inhibitorias liberan principalmente óxido nítrico (NO) y ATP, aunque también podrían liberar otros neuromoduladores como el VIP, el PACAP, el monóxido de carbono (CO) y sulfhídrico (H2S) (9,10), pero las evidencias experimentales no son tan claras.
Esta revisión se centra en la relajación neuromuscular, en los neurotransmisores, receptores y vías de señalización implicados en esta. Además, pretende poner de manifiesto su importancia para el óptimo funcionamiento del aparato digestivo, la correcta propulsión del bolo y su implicación en patologías que cursan con trastornos motores digestivos.
MÉTODOS DE ESTUDIO IN VITRO
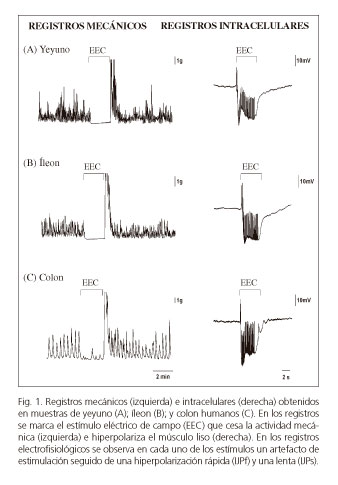
Dos de las técnicas más utilizadas para estudiar funcionalmente los mecanismos neurales de relajación intestinal in vitro son el baño de órganos y la técnica electrofisiológica de microelectrodos (Fig. 1). Con ambas técnicas se pueden estudiar biopsias transmurales procedentes de cirugía. Factores como el tiempo post-quirúrgico, la medicación, los anestésicos y las patologías de base deben ser siempre tenidos en cuenta para interpretar correctamente los resultados (11). Otra aproximación es el uso de tejido de animales de experimentación. Los ratones modificados genéticamente han sido una herramienta crucial para entender los receptores y las vías de señalización celular implicados en la relajación gastrointestinal (12,13). Los animales de experimentación permiten, además, trabajar con modelos de disfunciones motoras que pretenden imitar las enfermedades humanas.
Estas técnicas posibilitan evaluar funcionalmente los diferentes elementos implicados en la regulación de la motilidad (neuronas entéricas, ICCs y músculo liso). Los registros mecánicos de la figura 1 muestran la contractilidad espontánea de preparaciones transmurales de intestino delgado (yeyuno e íleon) y colon. Si se estimula eléctricamente la preparación, se genera un impulso nervioso en las motoneuronas que provoca la liberación de neurotransmisores inhibitorios que cesan la motilidad. Esta inhibición mecánica se correlaciona con la hiperpolarización observada en los registros intracelulares obtenidos mediante la técnica de microelectrodos. Estas hiperpolarizaciones se denominan potenciales postunión inhibitorios o IJPs (del inglés inhibitory junction potentials). La hiperpolarización es un incremento de la diferencia de potencial en sentido negativo que aleja las células musculares del voltaje de apertura de los canales de calcio voltaje dependientes (Cav), lo que se traduce en una relajación mecánica. En la mayoría de especies, este IJP en el tracto gastrointestinal se compone de una primera fase rápida conocida como IJPf (del inglés IJP fast), seguida por una hiperpolarización más sostenida denominada IJPs (del inglés IJP slow).
Principales neurotransmisores inhibitorios del SNE
Óxido nítrico (NO)
El NO fue descrito en los 90 como uno de los neurotransmisores inhibitorios fundamentales en el tracto gastrointestinal (14). El NO media la relajación en diversas áreas del tracto gastrointestinal como el esfínter esofágico (15), en el estómago, donde promueve la acomodación y el vaciado gástrico (16), en el intestino delgado y colon (17-20) y en el esfínter anal interno (21). Actualmente es el neurotransmisor inhibitorio más conocido por su implicación en diversas patologías (22).
El NO es una molécula generada por una familia de enzimas denominadas NO sintasas (NOS), que producen NO a partir de L-arginina. Hay tres genes independientes que codifican para las tres isoformas de la NOS (NOS-1, NOS-2 y NOS-3); estos genes codifican para la isoforma neuronal (nNOS), inducible (iNOS) y endotelial (eNOS) respectivamente. Todas ellas producen NO a través de mecanismos independientes y con diferentes mecanismos de regulación. La principal fuente de NO en las neuronas del tracto gastrointestinal es debida a la nNOS. Se ha descrito una sobreproducción de NO como resultado de la inducción de la iNOS en distintas estructuras celulares durante los procesos inflamatorios. La inhibición de nNOS con L-NNA bloquea el componente lento de la hiperpolarización o IJPs, revelando su origen nitrérgico. La sobreproducción de NO puede tener consecuencias como la excesiva relajación intestinal observada en algunas disfunciones motoras (22).
Receptor y vía intracelular
El NO es lipofílico, con lo cual, difunde muy bien a través de la membrana plasmática. La vía intracelular más caracterizada para el NO es la mediada por la guanilil ciclasa soluble (sGC) citoplasmática, que produce GMP cíclico (23). Este activa una proteína kinasa G (PKG) generando una cascada de fosforilaciones que acaba resultando en una activación de la fosfatasa de la cadena ligera de la miosina y, por lo tanto, relajando la célula muscular lisa. La PKG también activa canales de potasio. La apertura de estos provoca una hiperpolarización de la estructura causada por la salida de potasio de la célula muscular lisa. El cierre de canales de cloro ha sido también descrito como causante de esta hiperpolarización (13). Como consecuencia del aumento de negatividad en el interior de la célula muscular lisa, esta se relaja como respuesta al NO (13,23). La fosfodiesterasa 5 (PDE5) participa en la degradación del GMPc. Fármacos que inhiben la degradación de la PDE5 como el sildenafil han sido propuestos para el tratamiento de algunas enfermedades digestivas en las que la vía nitrérgica está alterada. Desde un punto de vista experimental, el bloqueo de la sGC con ODQ, al igual que el inhibidor de la síntesis de NO (L-NNA), inhibe el IJPs. Esta hiperpolarización es responsable de una relajación mecánica sostenida. Además, el NO se libera de forma tónica y es responsable de lo que se ha denominado tono inhibitorio basal (24-26).
ATP o un nucleótido relacionado
Estudios iniciales
En 1970, el ATP (o un nucleótido relacionado) fue propuesto por Burnstock y colaboradores como neurotransmisor inhibitorio en el tracto gastrointestinal de diversas especies de mamíferos. En aquella época el resultado fue muy controvertido puesto que no fue fácil aceptar que la principal molécula energética producida en las mitocondrias fuese además un neurotransmisor químico. Actualmente sabemos que el ATP es liberado por parte de las neuronas inhibitorias, que relaja el músculo liso y se han identificado neuronas "purinérgicas" mediante la técnica de la quinacrina (27,28). Esta técnica marca vesículas con alto contenido de ATP aunque probablemente no garantice que sean exclusivamente purinérgicas. Los datos obtenidos en el colon e intestino humano, así como en diversos animales de experimentación, muestran que el ATP sería responsable de la hiperpolarización rápida inicial o IJPf (17,19,29,30). Este IJPf se correlaciona con una relajación mecánica no sostenida o fásica. Este IJPf, o hiperpolarización transitoria, sufre un fenómeno de atenuación o "rundown", es decir, estímulos sucesivos producen respuestas inferiores a la primera respuesta (24,26).
Identificación del receptor P2Y1 como receptor responsable de la relajación intestinal
La identificación del receptor purinérgico implicado en la hiperpolarización y relajación intestinal es imprescindible para poner de manifiesto mecanismos fisiopatológicos asociados a esta vía. Sin embargo, diversos factores han dificultado el esclarecimiento de los receptores y vías de acción del ATP y análogos en el tracto digestivo. Quizás el más importante ha sido durante mucho tiempo la falta de antagonistas selectivos para cada subtipo de receptor. Existen dos familias de receptores purinérgicos (Tabla I). Los receptores P1 son receptores para adenosina y se han descrito cuatro subtipos: los A1, A2A, A2B y A3. Todos ellos están acoplados a proteína G, dando lugar a la activación de segundos mensajeros. Actúan mediante la inhibición (A1 y A3) o la estimulación (A2A y A2B) de la adenilato ciclasa. Los receptores P2 reconocen principalmente ATP, ADP, UDP y UTP. Dentro de esta familia encontramos dos subclases de receptores. Los P2X son ionotrópicos, es decir, canales iónicos que cuando se activan median la entrada de cationes. Se han descrito siete subtipos de receptores P2X (P2X1-P2X7). Los receptores P2Y son metabotrópicos, y se han identificado ocho subtipos: P2Y1, P2Y2, P2Y3, P2Y6, P2Y11, P2Y12, P2Y13 y P2Y14, aunque actualmente se han propuesto nuevos subtipos como los P2Y15. La mayoría de ellos están acoplados a una proteína G, que activa la fosfolipasa C dando lugar a diacilglicerol (DAG) y fosfoinositoltrifosfato (IP3), que produce liberación de calcio de los depósitos intracelulares. Algunos receptores pueden estar unidos a proteínas G, las cuales, a su vez, activan la adenilato ciclasa dando lugar a un incremento de AMP cíclico (31,32) (Tabla I). Los receptores purinérgicos están presentes en numerosos tipos celulares puesto que las purinas participan en muchos procesos de comunicación celular, incluyendo procesos de transducción de señales a nivel epitelial, comunicación interneuronal, activación aferente, comunicación neuroglia, etc. (33). La pregunta que nos hemos hecho durante estos últimos años es ¿cuál de estos es el receptor responsable de la relajación intestinal?
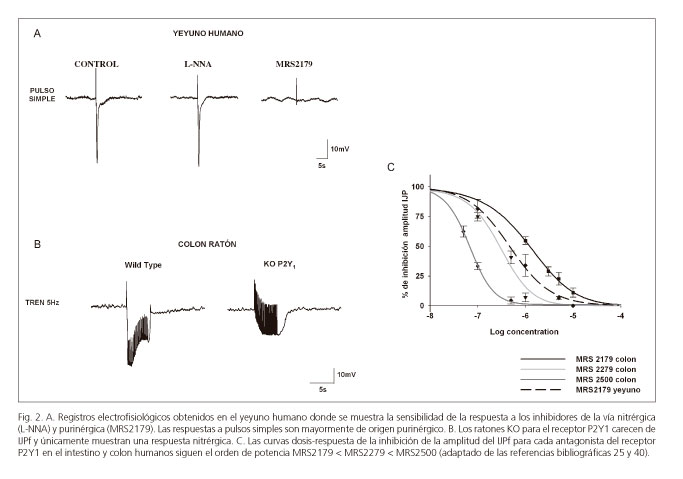
La suramina y el PPADs son antagonistas purinérgicos poco selectivos que no permiten diferenciar entre distintos receptores P2. El desarrollo de fármacos específicos, como por ejemplo el MRS2179, que bloquea los receptores P2Y1 (34,35), nos permitió demostrar farmacológicamente que el ATP, o una purina relacionada, actúa a través de P2Y1 postsinápticamente relajando diversas áreas del tracto gastrointestinal (12,24,25,36,37). Posteriormente, dos nuevos antagonistas con mayor afinidad por el receptor P2Y1, el MRS2279 y el MRS2500 (35,38,39), respaldaron el papel de este receptor en la neurotransmisión purinérgica con el orden de potencia MRS2179 < MRS2279 < MRS2500 (40) (Fig. 2). Estos resultados han sido confirmados recientemente utilizando animales genéticamente modificados (ratones knockout) para el receptor P2Y1 (41-43). Estos knockout no presentan ni el IJP purinérgico ni el componente purinérgico de la relajación (Fig. 2).
El receptor P2Y1 es el responsable de mediar la relajación en las diversas áreas del tracto gastrointestinal (12). Se ha descrito que, igual que la mayoría de los receptores P2Y, este receptor está unido a una proteína G (Gq) que activa la fosfolipasa C. Esta hidroliza un lípido de membrana dando lugar a dos segundos mensajeros, el DAG y el IP3, que activa la salida de calcio del retículo sarcoplasmático (44,45). El calcio activa los canales de potasio sK(Ca) (los canales de potasio de baja conductancia activados por calcio). La activación de estos canales y la subsiguiente salida de potasio hiperpolariza la célula muscular lisa responsable de la relajación mecánica observada.
La figura 2 muestra la respuesta electrofisiológica a un pulso simple en el yeyuno humano que es similar a otras áreas del tracto digestivo (íleon y colon). A excepción del esfínter esofágico, donde estas respuestas son puramente nitrérgicas, la hiperpolarización observada tanto en el intestino delgado como en el colon es principalmente purinérgica.
¿ATP y quizás otros neurotransmisores?
Actualmente está en discusión si el neurotransmisor purinérgico es el ATP o un nucleótido relacionado. El ATP sería liberado en la unión neuromuscular y por efecto de ectonucleotidasas (enzimas de degradación) se producirían los diferentes metabolitos (ADP, AMP y adenosina). Cada uno de ellos tiene mayor o menor afinidad sobre los diferentes receptores purinérgicos (31). Recientemente se ha propuesto que el neurotransmisor purinérgico en el tracto digestivo podría ser el β-NAD (β-nicotinamida adenina dinucleótido), la ADPR (ADP ribosa) o la Up4A (uridina adenosina tetrafosfato) (46-49). Sin embargo, algunos datos experimentales han matizado estos resultados (43,50-52).
Otros neurotransmisores/neuromoduladores
Otros neurotransmisores han sido propuestos como neurotransmisores inhibitorios en el tracto gastrointestinal humano. Entre ellos, los péptidos como el VIP y el PACAP (53) que participarían en la relajación de algunas zonas como el fundus gástrico o el colon (54,55). También gases como el CO (56,57) o el H2S (58,59) han sido propuestos como posibles neurotransmisores/neuromoduladores. Sin embargo, los datos de tipo funcional que demuestran que estos neurotransmisores participan en la relajación muscular todavía no son consistentes.
En la tabla II se resumen los principales estudios in vitro y áreas del tracto gastrointestinal humano donde se han descrito estos neurotransmisores inhibitorios.
Co-transmisión funcional no Y ATP
La aparición de antagonistas específicos y cada vez con más potencia farmacológica para el receptor P2Y1 (35,40) ha permitido aislar tanto el componente purinérgico como el nitrérgico de la neurotransmisión inhibitoria (24,26). Actualmente no existen técnicas de marcaje para el ATP que aseguren con un 100% de fiabilidad la identificación de neuronas purinérgicas. Por tanto, el fenómeno de co-transmisión, i.e. ambos neurotransmisores deben ser liberados por la misma neurona, no ha sido aún demostrado. Sin embargo, la mayoría de la comunidad científica asume la co-transmisión puesto que nadie ha demostrado una doble inervación inhibitoria. Es importante determinar qué parámetros diferenciales potencian la liberación de uno u otro neurotransmisor y qué efecto tiene cada uno en la célula postunión. Basándonos en los hallazgos experimentales podemos decir que estos dos neurotransmisores tendrían funciones complementarias a la hora de relajar el tubo digestivo. El NO, como se ha comentado, sería necesario para relajaciones tónicas como la acomodación gástrica o la relajación de esfínteres, donde se ha descrito que su presencia es predominante (54,60-62), mientras que el ATP podría tener un papel determinante para llevar a cabo relajaciones transitorias como la que tiene lugar en la fase descendente del reflejo peristáltico (24,26) y, por tanto, predominante en áreas donde la peristalsis tiene una mayor relevancia, como es el caso del intestino y el colon (17,19,24,25,30,36,37).
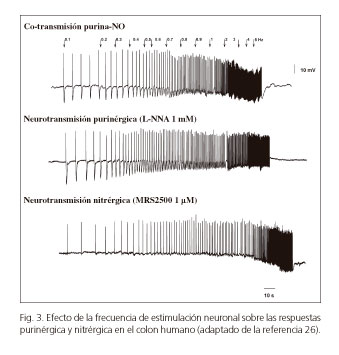
Estudios recientes realizados en nuestro laboratorio demuestran que el efecto de ambos neurotransmisores depende de la frecuencia a la que se estimula la preparación (24-26). A baja frecuencia (inferior a 1 Hz) la respuesta purinérgica sería dominante, mientras que a frecuencias más elevadas se atenuaría la respuesta purinérgica e incrementaría la nitrérgica NO (26) (Fig. 3). Esto nos ha permitido elaborar una serie de modelos matemáticos que relacionan la respuesta obtenida con la frecuencia de estimulación, probablemente asociada a la frecuencia de impulsos de las motoneuronas. Según los datos experimentales y el modelo desarrollado, la mayor frecuencia de disparo de las neuronas provocaría una relajación sostenida (liberando NO), mientras que la menor frecuencia de disparo está asociada a una drástica pero transitoria relajación (liberando ATP) (26,63,64). Si nuestra hipótesis es cierta, una misma neurona podría desempeñar funciones diferentes en función de su frecuencia de disparo. En algunos modelos animales estímulos más prolongados y de mayor frecuencia pueden producir la liberación de otros neurotransmisores como el VIP (65). Sin embargo, esto no ha sido confirmado en la especie humana. En la tabla III se detallan las características de las dos principales vías inhibitorias en el tracto gastrointestinal (la vía nitrérgica y la purinérgica).
Vía de acción directa vs. indirecta
Un tema candente que está en discusión es si estos neurotransmisores inhibitorios (NO y ATP) actúan de forma directa, vía unión neuromuscular, o bien a través de células intermediarias situadas entre las motoneuronas y el músculo liso. Se ha propuesto que estas células serían las ICCs para la vía nitrérgica (66,67) mientras que en la vía purinérgica serían células PDGFRα (platelet-derived growth factor receptor α) positivas las que harían de intermediarias (68-70). Los estudios que defienden la hipótesis de la vía de acción directa se basan en el hecho de que animales genéticamente modificados, sin ICCs, presentan neurotransmisión inhibitoria nitrérgica (71,72). Estudios recientes han demostrado que tanto las ICCs como el músculo podrían mediar los efectos del NO que liberan las neuronas nitrérgicas (73). El papel de las células PDGRFα positivas en la mediación de la relajación purinérgica todavía está en duda ya que no hay estudios con animales deficientes para este subtipo celular. Los estudios que defienden la hipótesis alternativa, la indirecta, se basan en argumentos morfológicos. Las células intersticiales están muy inervadas y se encuentran intercaladas entre los terminales nerviosos y las células musculares lisas (74). Además, las células intersticiales disponen de los receptores/mediadores para estos neurotransmisores (75) que hacen que la respuesta a la adición exógena de agonistas a estas células aisladas sea mayor que la del músculo liso (70). En modelos experimentales carentes de ICCs se ha visto que la neurotransmisión nitrérgica está ausente (76-78). En la figura 4 aparecen representadas ambas hipótesis de neurotransmisión en el tracto gastrointestinal.
El desarrollo de knockouts condicionales, carentes de receptores/vías en algunos subtipos celulares, abre ampliamente las posibilidades de estudio en este campo. Un ejemplo es el estudio citado anteriormente, de Lies y cols. (73), llevado a cabo con un modelo de ratones deficientes para la sGC (el enzima que media el efecto del NO a nivel intracelular) sólo en ICCs o solo en músculo. Los hallazgos de este estudio mostraron que la pérdida de este enzima en las ICCs causa una enorme disminución en la neurotransmisión (hiperpolarización o IJPs), pero que queda una parte funcional, lo que sugiere que ambas hipótesis podrían no ser compatibles (en parte, un efecto directo y otro indirecto).
Patologías digestivas asociadas a la neurotransmisión inhibitoria
Alteraciones en las vías que producen una relajación del tubo digestivo han sido relacionadas con un número importante de trastornos motores digestivos. Sin embargo, los datos clínicos disponibles acerca de la relevancia de estos neurotransmisores sobre la relajación no es la misma en todas las alteraciones motoras que se citan a continuación.
Se ha descrito ausencia de producción de NO y de nNOS en neuronas del esfínter esofágico inferior en pacientes con achalasia (79). Un estudio reciente realizado en niños de una misma familia demuestra que alteraciones en el gen que codifica para la nNOS (NOS-1) producen una achalasia infantil impidiendo la correcta relajación del esfínter esofágico inferior (80). El uso de inhibidores de la degradación de NO como el sildenafilo (inhibidor de la PDE5) es una estrategia farmacológica que puede ser útil en algunos de estos pacientes (80-82). En el esfínter anal, el NO provoca relajación, tal y como lo avala, por ejemplo, la eficacia del tratamiento de la fisura anal crónica con nitritos tópicos, que actúan aquí como donantes de NO, favoreciendo la cicatrización al disminuir el tono esfinteriano. En estas dos entidades el NO juega un papel muy relevante.
El vaciamiento gástrico requiere una correcta acomodación del fundus y la propulsión rítmica del antro para vaciar tanto líquidos como sólidos. La acomodación gástrica se basa en la relajación del fundus y estudios con humanos han demostrado que depende de NO (83,84). La gastroparesia se define como un enlentecimiento del vaciamiento gástrico sin una obstrucción aparente y suele estar asociada a la diabetes o su origen es idiopático. En animales de experimentación se ha relacionado la pérdida de nNOS con la gastroenteropatía diabética (85,86). Recientemente se han descrito alteraciones de las ICCs y de neuronas nitrérgicas en pacientes con gastroparesis idiopática (40%) y diabética (20%) (87). De nuevo, el sildenafilo ha sido propuesto como herramienta farmacológica para relajar la porción proximal del estómago (88). La deficiencia de nNO, junto con una pérdida de ICCs, ha sido asociada a la inercia colónica y al estreñimiento generado por la enteropatía diabética (89,90). Muestras de pacientes en fases asintomáticas de enfermedad diverticular (diverticulosis) presentan incremento de la expresión de nNOS y de la producción de NO (91). Hallazgos similares han sido descritos en un modelo experimental de síndrome del intestino irritable (SII) (92). Hay que tener en cuenta que en algunas de estas entidades, como por ejemplo en la neuropatía diabética o el SII, también puede verse afectada la inervación autonómica extrínseca, que incluye tanto vías aferentes como eferentes del autónomo. En los estados inflamatorios, la tremenda sobreproducción de NO por inducción de la forma inducible de la iNOS podría ser responsable de una excesiva relajación de la musculatura lisa (93,94). Son, sin embargo, necesarios más estudios para poder discernir si el NO es responsable directo de las alteraciones motoras (tal y como avala, por ejemplo, la eficacia del tratamiento de la fisura anal crónica con nitritos tópicos, que actúan aquí como donantes del óxido nítrico, favoreciendo la cicatrización al disminuir el tono esfinteriano) o bien un epifenómeno y las alteraciones motoras son debidas a otros mediadores inflamatorios con capacidad de relajación muscular (95).
¿Qué papel juega el ATP en patologías motoras del tracto gastrointestinal? La pregunta es mucho más difícil de contestar puesto que, a pesar de que hemos identificado el papel fisiológico, el papel del ATP en las alteraciones motoras ha sido mucho menos investigado. Sin embargo, tenemos algunos indicios que sugieren que el ATP, al igual que el NO, podría participar en la disfunción motora gastrointestinal.
Una de las principales limitaciones para poder responder a esta pregunta es la falta de marcadores para neuronas purinérgicas. Dicho de una manera simple, el clínico no puede encargar al patólogo que le identifique si hay o no neuronas purinérgicas en una biopsia transmural. De hecho, a pesar de que todo el mundo asume un fenómeno de co-transmisión, es decir, la misma neurona es a la vez nitérgica y purinérgica, nadie ha podido demostrar una co-localización de ambos neurotransmisores. Actualmente ha habido algunos avances en este campo y se han propuesto algunos marcadores para vesículas neurales que contienen ATP (96), aunque su especificidad no ha podido ser demostrada puesto que muchas vesículas pueden acumular ATP en su interior.
En el proceso inflamatorio, múltiples células inflamatorias, así como las células necróticas, liberan nucleótidos al espacio extracelular (97). Esta liberación de nucleótidos podría tener efectos tanto a nivel presináptico como postsináptico. Se ha descrito que algunas purinas podrían actuar a nivel presináptico para inhibir la liberación de ATP en el yeyuno humano (52). Estos nucleótidos podrían tener también un efecto a nivel postsináptico desensibilizando el receptor P2Y1, como se ha observado en el intestino y colon humano (24-26,30,36). Modelos experimentales de colitis en los que se observa una disminución del componente purinérgico del IJP, el IJPf, confirman esta hipótesis. Esta desensibilización, o disminución del IJPf, podría tener un gran impacto sobre la motilidad intestinal, ya que se ha observado que la carencia de los receptores que median la relajación purinérgica (los P2Y1) en ratones knockout para dicho receptor, la ausencia de IJPf, se traduce en un gran enlentecimiento del tránsito colónico. Es muy posible que el ATP también participe en muchas de las alteraciones motoras descritas para el NO donde se ve afectado el SNE. Es importante a nuestro entender revisar el papel del ATP/P2Y1 como neurotransmisor inhibitorio en enfermedades como la achalasia, la gastroparesia, la pseudo-obstrucción intestinal o la inercia colonica. Datos preliminares obtenidos en nuestro laboratorio muestran, por ejemplo, la falta de neurotransmisión purinérgica en muestras de la zona de transición en la enfermedad de Hirschsprung (98).
Esperamos haber convencido al lector de que el ATP es fundamental para entender la relajación intestinal. Parte de nuestro trabajo ha sido la identificación del receptor P2Y1 como elemento clave en la transducción purinérgica. Hemos, por tanto, identificado una nueva diana farmacológica con posibles aplicaciones en el tratamiento de la disfunción motora gastrointestinal. Posibles líneas de futuro incluyen la identificación de alteraciones genéticas que puedan comprometer la neurotransmisión purinérgica o la identificación de células intersticiales PDGFRα+ en muestras de patologías motoras digestivas. También es esencial continuar el trabajo en el diseño de modelos animales con deleción condicionales de un receptor en una célula y no en otra. Todos estos estudios deben hacerse para conocer mejor la vía de señalización y expandir dicho conocimiento a la fisiopatología motora digestiva.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Marcel Jiménez.
Departamento de Biología Celular, Fisiología e Inmunología.
Edificio V. Universitat Autònoma de Barcelona.
08193 Bellaterra, Cerdanyola del Vallès. Barcelona
e-mail: marcel.jimenez@uab.es
Recibido: 20-10-2015
Aceptado: 09-01-2016
Bibliografía
1. Kunze WA, Furness JB. The enteric nervous system and regulation of intestinal motility. Annu Rev Physiol 1999;61:117-42. DOI: 10.1146/annurev.physiol.61.1.117. [ Links ]
2. Furness JB. Types of neurons in the enteric nervous system. J Auton Nerv Syst 2000;81:87-96. DOI: 10.1016/S0165-1838(00)00127-2. [ Links ]
3. Costa M, Brookes SJ, Hennig GW. Anatomy and physiology of the enteric nervous system. Gut 2000;47(Suppl. 4):iv15-iv19. DOI: 10.1136/gut.47.suppl_4.iv15. [ Links ]
4. Brookes SJ. Classes of enteric nerve cells in the guinea-pig small intestine. Anat Rec 2001;262:58-70. DOI: 10.1002/1097-0185(20010101) 262:1<58::AID-AR1011>3.0.CO;2-V. [ Links ]
5. Bertrand PP, Bornstein JC. ATP as a putative sensory mediator: Activation of intrinsic sensory neurons of the myenteric plexus via P2X receptors. J Neurosci 2002;22:4767-75. [ Links ]
6. Furness JB, Jones C, Nurgali K, et al. Intrinsic primary afferent neurons and nerve circuits within the intestine. Prog Neurobiol 2004;72:143-64. DOI: 10.1016/j.pneurobio.2003.12.004. [ Links ]
7. Bornstein JC, Costa M, Grider JR. Enteric motor and interneuronal circuits controlling motility. Neurogastroenterol Motil 2004;16(Suppl. 1):34-8. DOI: 10.1111/j.1743-3150.2004.00472.x. [ Links ]
8. Hansen MB. The enteric nervous system I: Organisation and classification. Pharmacol Toxicol 2003;92:105-13. DOI: 10.1034/j.1600-0773.2003.t01-1-920301.x. [ Links ]
9. Lecci A, Santicioli P, Maggi CA. Pharmacology of transmission to gastrointestinal muscle. Curr Opin Pharmacol 2002;2:630-41. DOI: 10.1016/S1471-4892(02)00225-4. [ Links ]
10. Linden DR, Levitt MD, Farrugia G, et al. Endogenous production of H2S in the gastrointestinal tract: Still in search of a physiologic function. Antioxid Redox Signal 2010;12:1135-46. DOI: 10.1089/ars.2009.2885. [ Links ]
11. Sanger GJ, Broad J, Kung V, et al. Translational neuropharmacology: The use of human isolated gastrointestinal tissues. Br J Pharmacol 2013;168:28-43. DOI: 10.1111/j.1476-5381.2012.02198.x. [ Links ]
12. Jiménez M, Clave P, Accarino A, et al. Purinergic neuromuscular transmission in the gastrointestinal tract; functional basis for future clinical and pharmacological studies. Br J Pharmacol 2014;171:4360-75. DOI: 10.1111/bph.12802. [ Links ]
13. Sanders KM, Koh SD, Ro S, et al. Regulation of gastrointestinal motility - Insights from smooth muscle biology. Nat Rev Gastroenterol Hepatol 2012;9:633-45. DOI: 10.1038/nrgastro.2012.168. [ Links ]
14. Bult H, Boeckxstaens GE, Pelckmans PA, et al. Nitric oxide as an inhibitory non-adrenergic non-cholinergic neurotransmitter. Nature 1990;345:346-7. DOI: 10.1038/345346a0. [ Links ]
15. González AA, Farre R, Clave P. Different responsiveness of excitatory and inhibitory enteric motor neurons in the human esophagus to electrical field stimulation and to nicotine. Am J Physiol Gastrointest Liver Physiol 2004;287:G299-306. DOI: 10.1152/ajpgi.00534.2003. [ Links ]
16. Andrews CN, Bharucha AE, Camilleri M, et al. Nitrergic contribution to gastric relaxation induced by glucagon-like peptide-1 (GLP-1) in healthy adults. Am J Physiol Gastrointest Liver Physiol 2007;292:G1359-65. [ Links ]
17. Keef KD, Du C, Ward SM, et al. Enteric inhibitory neural regulation of human colonic circular muscle: Role of nitric oxide. Gastroenterology 1993;105:1009-16. [ Links ]
18. Stark ME, Bauer AJ, Sarr MG, et al. Nitric oxide mediates inhibitory nerve input in human and canine jejunum. Gastroenterology 1993;104:398-409. [ Links ]
19. Boeckxstaens GE, Pelckmans PA, Herman AG, et al. Involvement of nitric oxide in the inhibitory innervation of the human isolated colon. Gastroenterology 1993;104:690-7. [ Links ]
20. Tam FS, Hillier K. The role of nitric oxide in mediating non-adrenergic non-cholinergic relaxation in longitudinal muscle of human taenia coli. Life Sci 1992;51:1277-84. DOI: 10.1016/0024-3205(92)90017-J. [ Links ]
21. O'Kelly T, Brading A, Mortensen N. Nerve mediated relaxation of the human internal anal sphincter: The role of nitric oxide. Gut 1993;34:689-93. DOI: 10.1136/gut.34.5.689. [ Links ]
22. Shah V, Lyford G, Gores G, et al. Nitric oxide in gastrointestinal health and disease. Gastroenterology 2004;126:903-13. DOI: 10.1053/j.gastro.2003.11.046. [ Links ]
23. De Man JG, De Winter BY, Herman AG, et al. Study on the cyclic GMP-dependency of relaxations to endogenous and exogenous nitric oxide in the mouse gastrointestinal tract. Br J Pharmacol 2007;150:88-96. DOI: 10.1038/sj.bjp.0706964. [ Links ]
24. Gallego D, Gil V, Aleu J, et al. Purinergic and nitrergic junction potential in the human colon. Am J Physiol Gastrointest Liver Physiol 2008;295:G522-33. DOI: 10.1152/ajpgi.00510.2007. [ Links ]
25. Gallego D, Malagelada C, Accarino A, et al. Nitrergic and purinergic mechanisms evoke inhibitory neuromuscular transmission in the human small intestine. Neurogastroenterol Motil 2014;26:419-29. DOI: 10.1111/nmo.12293. [ Links ]
26. Mane N, Gil V, Martínez-Cutillas M, et al. Differential functional role of purinergic and nitrergic inhibitory cotransmitters in human colonic relaxation. Acta Physiol (Oxf) 2014;212:293-305. DOI: 10.1111/apha.12408. [ Links ]
27. Burnstock G, Campbell G, Satchell D, et al. Evidence that adenosine triphosphate or a related nucleotide is the transmitter substance released by non-adrenergic inhibitory nerves in the gut. Br J Pharmacol 1970;40:668-88. DOI: 10.1111/j.1476-5381.1970.tb10646.x. [ Links ]
28. Burnstock G. Historical review: ATP as a neurotransmitter. Trends Pharmacol Sci 2006;27:166-76. DOI: 10.1016/j.tips.2006.01.005. [ Links ]
29. Zagorodnyuk VP, Vladimirova IA, Vovk EV, et al. Studies of the inhibitory non-adrenergic neuromuscular transmission in the smooth muscle of the normal human intestine and from a case of Hirschsprung's disease. J Auton Nerv Syst 1989;26:51-60. DOI: 10.1016/0165-1838(89)90107-0. [ Links ]
30. Xue L, Farrugia G, Sarr MG, et al. ATP is a mediator of the fast inhibitory junction potential in human jejunal circular smooth muscle. Am J Physiol 1999;276:G1373-9. [ Links ]
31. Ralevic V, Burnstock G. Receptors for purines and pyrimidines. Pharmacol Rev 1998;50:413-92. [ Links ]
32. Burnstock G, Knight GE. Cellular distribution and functions of P2 receptor subtypes in different systems. Int Rev Cytol 2004;240:31-304. [ Links ]
33. Burnstock G. Purinergic signalling in the gastrointestinal tract and related organs in health and disease. Purinergic Signal 2014;10:3-50. DOI: 10.1007/s11302-013-9397-9. [ Links ]
34. Camaioni E, Boyer JL, Mohanram A, et al. Deoxyadenosine bisphosphate derivatives as potent antagonists at P2Y1 receptors. J Med Chem 1998;41:183-90. DOI: 10.1021/jm970433l. [ Links ]
35. Cattaneo M, Lecchi A, Ohno M, et al. Antiaggregatory activity in human platelets of potent antagonists of the P2Y1 receptor. Biochem Pharmacol 2004;68:1995-2002. DOI: 10.1016/j.bcp.2004.06.026. [ Links ]
36. Gallego D, Hernández P, Clave P, et al. P2Y1 receptors mediate inhibitory purinergic neuromuscular transmission in the human colon. Am J Physiol Gastrointest Liver Physiol 2006;291:G584-94. DOI: 10.1152/ajpgi.00474.2005. [ Links ]
37. Auli M, Martínez E, Gallego D, et al. Effects of excitatory and inhibitory neurotransmission on motor patterns of human sigmoid colon in vitro. Br J Pharmacol 2008;155:1043-55. DOI: 10.1038/bjp.2008.332. [ Links ]
38. Kim HS, Barak D, Harden TK, et al. Acyclic and cyclopropyl analogues of adenosine bisphosphate antagonists of the P2Y1 receptor: Structure-activity relationships and receptor docking. J Med Chem 2001;44:3092-108. DOI: 10.1021/jm010082h. [ Links ]
39. Boyer JL, Adams M, Ravi RG, et al. 2-Chloro N(6)-methyl-(N)-methanocarba-2'-deoxyadenosine-3',5'-bisphosphate is a selective high affinity P2Y(1) receptor antagonist. Br J Pharmacol 2002;135:2004-10. DOI: 10.1038/sj.bjp.0704673. [ Links ]
40. Gallego D, Gil V, Aleu J, et al. Pharmacological characterization of purinergic inhibitory neuromuscular transmission in the human colon. Neurogastroenterol Motil 2011;23:792-e338. DOI: 10.1111/j.1365-2982.2011.01725.x. [ Links ]
41. Gallego D, Gil V, Martínez-Cutillas M, et al. Purinergic neuromuscular transmission is absent in the colon of P2Y(1) knocked out mice. J Physiol 2012;590:1943-56. DOI: 10.1113/jphysiol.2011.224345. [ Links ]
42. Hwang SJ, Blair PJ, Durnin L, et al. P2Y1 purinoreceptors are fundamental to inhibitory motor control of murine colonic excitability and transit. J Physiol 2012;590:1957-72. DOI: 10.1113/jphysiol.2011.224634. [ Links ]
43. Gil V, Martínez-Cutillas M, Mane N, et al. P2Y(1) knockout mice lack purinergic neuromuscular transmission in the antrum and cecum. Neurogastroenterol Motil 2013;25:e170-82. DOI: 10.1111/nmo.12060. [ Links ]
44. Hu HZ, Gao N, Zhu MX, et al. Slow excitatory synaptic transmission mediated by P2Y1 receptors in the guinea-pig enteric nervous system. J Physiol 2003;550:493-504. DOI: 10.1113/jphysiol.2003.041731. [ Links ]
45. Wood JD. The enteric purinergic P2Y1 receptor. Curr Opin Pharmacol 2006;6:564-70. DOI: 10.1016/j.coph.2006.06.006. [ Links ]
46. Mutafova-Yambolieva VN, Hwang SJ, Hao X, et al. Beta-nicotinamide adenine dinucleotide is an inhibitory neurotransmitter in visceral smooth muscle. Proc Natl Acad Sci U S A 2007;104:16359-64. DOI: 10.1073/pnas.0705510104. [ Links ]
47. Hwang SJ, Durnin L, Dwyer L, et al. Beta-nicotinamide adenine dinucleotide is an enteric inhibitory neurotransmitter in human and nonhuman primate colons. Gastroenterology 2011;140:608-17. DOI: 10.1053/j.gastro.2010.09.039. [ Links ]
48. Durnin L, Hwang SJ, Ward SM, et al. Adenosine 5-diphosphate-ribose is a neural regulator in primate and murine large intestine along with beta-NAD(+). J Physiol 2012;590:1921-41. DOI: 10.1113/jphysiol.2011.222414. [ Links ]
49. Durnin L, Hwang SJ, Kurahashi M, et al. Uridine adenosine tetraphosphate is a novel neurogenic P2Y1 receptor activator in the gut. Proc Natl Acad Sci USA 2014;111:15821-6. DOI: 10.1073/pnas.1409078111. [ Links ]
50. Goyal RK. Evidence for beta-nicotinamide adenine dinucleotide as a purinergic, inhibitory neurotransmitter in doubt. Gastroenterology 2011;141:e27-8. DOI: 10.1053/j.gastro.2011.07.047. [ Links ]
51. Goyal RK, Sullivan MP, Chaudhury A. Progress in understanding of inhibitory purinergic neuromuscular transmission in the gut. Neurogastroenterol Motil 2013;25:203-7. DOI: 10.1111/nmo.12090. [ Links ]
52. Wang GD, Wang XY, Liu S, et al. Beta-nicotinamide adenine dinucleotide acts at prejunctional adenosine A1 receptors to suppress inhibitory musculomotor neurotransmission in guinea pig colon and human jejunum. Am J Physiol Gastrointest Liver Physiol 2015;308:G955-63. DOI: 10.1152/ajpgi.00430.2014. [ Links ]
53. Bitar KN, Makhlouf GM. Relaxation of isolated gastric smooth muscle cells by vasoactive intestinal peptide. Science 1982;216:531-3. DOI: 10.1126/science.6176025. [ Links ]
54. Tonini M, De Giorgio R, De Ponti F, et al. Role of nitric oxide- and vasoactive intestinal polypeptide-containing neurones in human gastric fundus strip relaxations. Br J Pharmacol 2000;129:12-20. DOI: 10.1038/sj.bjp.0702977. [ Links ]
55. Schworer H, Clemens A, Katsoulis S, et al. Pituitary adenylate cyclase-activating peptide is a potent modulator of human colonic motility. Scand J Gastroenterol 1993;28:625-32. DOI: 10.3109/ 003655293090 96101. [ Links ]
56. Farrugia G, Miller SM, Rich A, et al. Distribution of heme oxygenase and effects of exogenous carbon monoxide in canine jejunum. Am J Physiol 1998;274:G350-8. [ Links ]
57. Gibbons SJ, Farrugia G. The role of carbon monoxide in the gastrointestinal tract. J Physiol 2004;556:325-36. DOI: 10.1113/jphysiol.2003.056556. [ Links ]
58. Gallego D, Clave P, Donovan J, et al. The gaseous mediator, hydrogen sulphide, inhibits in vitro motor patterns in the human, rat and mouse colon and jejunum. Neurogastroenterol Motil 2008;20:1306-16. DOI: 10.1111/j.1365-2982.2008.01201.x. [ Links ]
59. Martínez-Cutillas M, Gil V, Mane N, et al. Potential role of the gaseous mediator hydrogen sulphide (H2S) in inhibition of human colonic contractility. Pharmacol Res 2015;93:52-63. DOI: 10.1016/j.phrs.2015.01.002. [ Links ]
60. Lecea B, Gallego D, Farre R, et al. Regional functional specialization and inhibitory nitrergic and nonnitrergic coneurotransmission in the human esophagus. Am J Physiol Gastrointest Liver Physiol 2011;300:G782-94. DOI: 10.1152/ajpgi.00514.2009. [ Links ]
61. Broad J, Hughes F, Chin-Aleong J, et al. Regionally dependent neuromuscular functions of motilin and 5-HT(4) receptors in human isolated esophageal body and gastric fundus. Neurogastroenterol Motil 2014;26:1311-22. DOI: 10.1111/nmo.12394. [ Links ]
62. Broad J, Goralczyk A, Mannur K, et al. Drugs acting at 5-HT4, D2, motilin, and ghrelin receptors differ markedly in how they affect neuromuscular functions in human isolated stomach. Neurogastroenterol Motil 2014;26:851-61. DOI: 10.1111/nmo.12338. [ Links ]
63. Mane N, Gil V, Martínez-Cutillas M, et al. Dynamics of inhibitory co-transmission, membrane potential and pacemaker activity determine neuromyogenic function in the rat colon. Pflugers Arch 2014;466:2305-21. DOI: 10.1007/s00424-014-1500-8. [ Links ]
64. Mane N, Viais R, Martínez-Cutillas M, et al. Inverse gradient of nitrergic and purinergic inhibitory cotransmission in the mouse colon. Acta Physiol (Oxf). 2016;216:120-31. DOI: 10.1111/apha.12599. [ Links ]
65. Keef KD, Saxton SN, McDowall RA, et al. Functional role of vasoactive intestinal polypeptide in inhibitory motor innervation in the mouse internal anal sphincter. J Physiol 2013;591:1489-1506. DOI: 10.1113/jphysiol.2012.247684. [ Links ]
66. Ward SM, Sanders KM. Interstitial cells of Cajal: Primary targets of enteric motor innervation. Anat Rec 2001;262:125-35. DOI: 10.1002/1097-0185(20010101)262:1<125::AID-AR1017>3.0.CO;2-I. [ Links ]
67. Sanders KM. A case for interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract. Gastroenterology 1996;111:492-515. DOI: 10.1053/gast.1996.v111.pm8690216. [ Links ]
68. Kurahashi M, Nakano Y, Hennig GW, et al. Platelet-derived growth factor receptor alpha-positive cells in the tunica muscularis of human colon. J Cell Mol Med 2012;16:1397-404. DOI: 10.1111/j.1582-4934.2011.01510.x. [ Links ]
69. Kurahashi M, Zheng H, Dwyer L, et al. A functional role for the 'fibroblast-like cells' in gastrointestinal smooth muscles. J Physiol 2011;589:697-710. DOI: 10.1113/jphysiol.2010.201129. [ Links ]
70. Kurahashi M, Mutafova-Yambolieva V, Koh SD, et al. Platelet-derived growth factor receptor-alpha-positive cells and not smooth muscle cells mediate purinergic hyperpolarization in murine colonic muscles. Am J Physiol Cell Physiol 2014;307:C561-70. DOI: 10.1152/ajpcell.00080.2014. [ Links ]
71. De Lorijn F, De Jonge WJ, Wedel T, et al. Interstitial cells of Cajal are involved in the afferent limb of the rectoanal inhibitory reflex. Gut 2005;54:1107-13. DOI: 10.1136/gut.2004.051045. [ Links ]
72. Terauchi A, Kobayashi D, Mashimo H. Distinct roles of nitric oxide synthases and interstitial cells of Cajal in rectoanal relaxation. Am J Physiol Gastrointest Liver Physiol 2005;289:G291-9. DOI: 10.1152/ajpgi.00005.2005. [ Links ]
73. Lies B, Gil V, Groneberg D, et al. Interstitial cells of Cajal mediate nitrergic inhibitory neurotransmission in the murine gastrointestinal tract. Am J Physiol Gastrointest Liver Physiol 2014;307:G98-106. DOI: 10.1152/ajpgi.00082.2014. [ Links ]
74. Ward SM, Sanders KM. Interstitial cells of Cajal: Primary targets of enteric motor innervation. Anat Rec 2001;262:125-35. DOI: 10.1002/1097-0185(20010101)262:1<125::AID-AR1017>3.0.CO;2-I. [ Links ]
75. Peri LE, Sanders KM, Mutafova-Yambolieva VN. Differential expression of genes related to purinergic signaling in smooth muscle cells, PDGFRalpha-positive cells, and interstitial cells of Cajal in the murine colon. Neurogastroenterol Motil 2013;25:e609-20. DOI: 10.1111/nmo.12174. [ Links ]
76. Burns AJ, Lomax AE, Torihashi S, et al. Interstitial cells of Cajal mediate inhibitory neurotransmission in the stomach. Proc Natl Acad Sci USA 1996;93:12008-13. DOI: 10.1073/pnas.93.21.12008. [ Links ]
77. Ward SM, Morris G, Reese L, et al. Interstitial cells of Cajal mediate enteric inhibitory neurotransmission in the lower esophageal and pyloric sphincters. Gastroenterology 1998;115:314-29. DOI: 10.1016/S0016-5085(98)70198-2. [ Links ]
78. Suzuki H, Ward SM, Bayguinov YR, et al. Involvement of intramuscular interstitial cells in nitrergic inhibition in the mouse gastric antrum. J Physiol 2003;546:751-63. DOI: 10.1113/jphysiol.2002.033365. [ Links ]
79. Mearin F, Papo M, Malagelada JR. Impaired gastric relaxation in patients with achalasia. Gut 1995;36:363-8. DOI: 10.1136/gut.36.3.363. [ Links ]
80. Shteyer E, Edvardson S, Wynia-Smith SL, et al. Truncating mutation in the nitric oxide synthase 1 gene is associated with infantile achalasia. Gastroenterology 2015;148:533-6. DOI: 10.1053/j.gastro.2014.11.044. [ Links ]
81. Bortolotti M, Mari C, Lopilato C, et al. Sildenafil inhibits gastroduodenal motility. Aliment Pharmacol Ther 2001;15:157-61. DOI: 10.1046/j.1365-2036.2001.00917.x. [ Links ]
82. Eherer AJ, Schwetz I, Hammer HF, et al. Effect of sildenafil on oesophageal motor function in healthy subjects and patients with oesophageal motor disorders. Gut 2002;50:758-64. DOI: 10.1136/gut.50.6.758. [ Links ]
83. Kuiken SD, Vergeer M, Heisterkamp SH, et al. Role of nitric oxide in gastric motor and sensory functions in healthy subjects. Gut 2002;51:212-8. DOI: 10.1136/gut.51.2.212. [ Links ]
84. Kuiken SD, Tytgat GN, Boeckxstaens GE. Role of endogenous nitric oxide in regulating antropyloroduodenal motility in humans. Am J Gastroenterol 2002;97:1661-7. DOI: 10.1016/S0002-9270(02)04180-1. [ Links ]
85. Watkins CC, Sawa A, Jaffrey S, et al. Insulin restores neuronal nitric oxide synthase expression and function that is lost in diabetic gastropathy. J Clin Invest 2000;106:803. DOI: 10.1172/JCI8273C1. [ Links ]
86. Vanormelingen C, Vanuytsel T, Masaoka T, et al. The normoglycaemic biobreeding rat: A spontaneous model for impaired gastric accommodation. Gut 2016;65:73-81. DOI: 10.1136/gutjnl-2014-308154. [ Links ]
87. Grover M, Farrugia G, Lurken MS, et al. Cellular changes in diabetic and idiopathic gastroparesis. Gastroenterology 2011;140:1575-85. DOI: 10.1053/j.gastro.2011.01.046. [ Links ]
88. Sarnelli G, Sifrim D, Janssens J, et al. Influence of sildenafil on gastric sensorimotor function in humans. Am J Physiol Gastrointest Liver Physiol 2004;287:G988-92. DOI: 10.1152/ajpgi.00419.2003. [ Links ]
89. He CL, Burgart L, Wang L, et al. Decreased interstitial cell of Cajal volume in patients with slow-transit constipation. Gastroenterology 2000;118:14-21. DOI: 10.1016/S0016-5085(00)70409-4. [ Links ]
90. He CL, Soffer EE, Ferris CD, et al. Loss of interstitial cells of Cajal and inhibitory innervation in insulin-dependent diabetes. Gastroenterology 2001;121:427-34. DOI: 10.1053/gast.2001.26264. [ Links ]
91. Espin F, Rofes L, Ortega O, et al. Nitrergic neuro-muscular transmission is up-regulated in patients with diverticulosis. Neurogastroenterol Motil 2014;26:1458-68. DOI: 10.1111/nmo.12407. [ Links ]
92. Tjong YW, Ip SP, Lao L, et al. Role of neuronal nitric oxide synthase in colonic distension-induced hyperalgesia in distal colon of neonatal maternal separated male rats. Neurogastroenterol Motil 2011;23:666-e278. DOI: 10.1111/j.1365-2982.2011.01697.x. [ Links ]
93. García-González MA, Peña AS. Nitric oxide and inflammatory bowel disease. Rev Esp Enferm Dig 1998;90:870-6. [ Links ]
94. Perner A, Rask-Madsen J. Review article: The potential role of nitric oxide in chronic inflammatory bowel disorders. Aliment Pharmacol Ther 1999;13:135-44. DOI: 10.1046/j.1365-2036.1999.00453.x. [ Links ]
95. Martínez-Cutillas M, Mañé N, Gallego D, et al. EP2 and EP4 receptors mediate PGE2 induced relaxation in murine colonic circular muscle: Pharmacological characterization. Pharmacol Res 2014;90:76-86. DOI: 10.1016/j.phrs.2014.10.001. [ Links ]
96. Chaudhury A, He XD, Goyal RK. Role of myosin Va in purinergic vesicular neurotransmission in the gut. Am J Physiol Gastrointest Liver Physiol 2012;302:G598-607. DOI: 10.1152/ajpgi.00330.2011. [ Links ]
97. Idzko M, Ferrari D, Eltzschig HK. Nucleotide signalling during inflammation. Nature 2014;509:310-7. DOI: 10.1038/nature13085. [ Links ]
98. Jiménez M, De Diego M, Martínez-Cutillas M, et al. Purinergic and nitrergic inhibitory neuromuscular transmission in ganglionic, transitional and aganglionic segments from Hirschsprung's disease patients. Neurogastroenterol Motil 2015;27(S2):71Abs. [ Links ]











 texto em
texto em