INTRODUCCIÓN
La colangitis biliar primaria (CBP) es una enfermedad hepática autoinmune, rara, grave y progresiva que eventualmente deriva en cirrosis hepática, fallo hepático y muerte 1,2. La CBP se caracteriza por la presencia de anticuerpos antimitocondriales (AMA) en suero y por la destrucción gradual de origen autoinmune de los pequeños conductos biliares en el hígado, presentando colestasis y pudiendo producir daño en el tejido hepático 1. Además, también se caracteriza por alteraciones en la analítica sanguínea (p. ej., elevación de los niveles de fosfatasa alcalina [FA]), alteraciones en otros marcadores de daño hepático (p.ej., gamma glutamil transpeptidasa [GGT], aspartato aminotransferasa [AST] y alanina aminotransferasa [ALT]) 1,2,3, así como de niveles elevados de bilirrubina tras daño hepático significativo 4.
La epidemiología de la CBP es difícil de establecer con precisión. En el informe de mayo de 2015 de Orphanet, se indicaba que la incidencia y la prevalencia estimada de la CBP en Europa era de 30 casos/millón y 210,5 casos/millón habitantes, respectivamente 5, siendo esta diez veces más frecuente en mujeres que en hombres 4. Cada año se diagnostica un número creciente de nuevos casos 4,5 debido, probablemente, a la mayor detección de casos silentes y asintomáticos como consecuencia del mayor conocimiento de la patología y de la mejora de las técnicas diagnósticas. Los factores que desencadenan el inicio de la enfermedad no se conocen del todo y se cree que la influencia ambiental juega un papel importante en su inicio 6.
La CBP generalmente progresa de manera lenta en sus fases más tempranas; sin embargo, el curso clínico presenta gran variabilidad entre pacientes 7. Hasta un 30% de los pacientes pueden presentar una forma grave y progresiva de CBP con un desarrollo temprano de fibrosis y fallo hepático 4. Algunos pacientes experimentan una rápida progresión de la enfermedad en un periodo de tan solo dos años. Aproximadamente entre el 60-80% de los pacientes con CBP son asintomáticos en el momento del diagnóstico 8. Una vez que se presentan síntomas, la progresión de la enfermedad es muy rápida, con una media de supervivencia de entre cuatro y ocho años en pacientes sintomáticos 9.
Sin tratamiento, la enfermedad progresa hasta cirrosis, con la mayoría de pacientes pasando al siguiente estadio histológico en el plazo de dos años 7,10. Sin tratamiento, la supervivencia media estimada desde la primera aparición de AMA en suero hasta la muerte es de, aproximadamente, 20-22 años 11,12.
La historia natural de la CBP es desde hace unos años menos grave debido en gran parte al diagnóstico y tratamiento tempranos tras el diagnóstico 1.
La introducción del ácido ursodesoxicólico (AUDC) para su tratamiento ha modificado considerablemente la historia natural de la enfermedad previniendo la progresión a cirrosis, el desarrollo de hipertensión portal y prolongando el tiempo hasta el trasplante hepático 13,14,15,16. Sin embargo, los pacientes que presentan una respuesta inadecuada al tratamiento actual tienen un riesgo mayor de sufrir la progresión de la enfermedad y sus consecuencias.
En España, se ha determinado que alrededor del 35-40% de los pacientes presentan una respuesta insuficiente a AUDC y el 5% de los pacientes son intolerantes 2. Los pacientes con respuesta insuficiente al tratamiento con AUDC presentan un mayor riesgo de progresión de la enfermedad, de desarrollar eventos de enfermedad avanzada y una menor probabilidad de supervivencia libre de trasplante 13,17,18,19,20,21, ya que el trasplante hepático es el único tratamiento disponible para las formas más avanzadas de la enfermedad 22,23, con una tasa de supervivencia a cinco y diez años del 80% y 70%, respectivamente 24,25,26,27. Por ello, se espera la próxima comercialización de nuevas alternativas para los pacientes no respondedores a AUDC, como, por ejemplo, el ácido obeticólico 24,28.
A pesar de los avances experimentados en los últimos años, la CBP sigue siendo una enfermedad con muchos interrogantes, ya que en España, como ocurre con diversas enfermedades raras 29, la información que existe sobre el tamaño de la población de pacientes con diagnóstico de CBP así como sobre la trayectoria que siguen en el sistema de salud desde la detección y durante el seguimiento de la enfermedad es limitada. Concretamente, los estudios epidemiológicos hasta la fecha se llevaron a cabo hace más de diez años y estaban focalizados en áreas geográficas determinadas 30,31,32,33,34,35,36, sin que existan datos a nivel nacional.
El objetivo de este estudio es responder a los interrogantes asociados a la CBP en España y avanzar en la estimación de la epidemiología, identificar el flujo del paciente en el sistema público de salud, elucidar la forma de presentación y de diagnóstico y determinar el tratamiento actual de los pacientes con CBP en España.
MÉTODOS
El estudio se realizó mediante la técnica Delphi (semiestructurada, de dos rondas de consulta por vía telemática y un taller presencial de validación de resultados tras las dos rondas de consulta) 37. Para ello, se llevó a cabo una revisión de la literatura que produjo un primer cuestionario, el cual fue validado por cuatro expertos clínicos. El cuestionario resultante se distribuyó a un grupo más amplio de expertos clínicos (primera ronda), se analizaron sus respuestas y, considerando las cuestiones en las que no se alcanzó consenso durante la primera ronda, se realizó un segundo cuestionario que fue distribuido al mismo grupo de expertos clínicos (segunda ronda). Los resultados de las dos rondas se validaron de manera presencial en una reunión física con los principales expertos en el manejo de la CBP en España.
Revisión de la literatura
Se realizó una revisión de la literatura para identificar publicaciones relativas a la epidemiología, diagnóstico y tratamiento de la CBP, así como guías, recomendaciones y consensos de la práctica clínica habitual. La búsqueda se realizó en las bases de datos Medline, ISI-WOK, Scopus, Cochrane Library, MEDES, ReDIris y fuentes de literatura gris (Google, página web de Albi España [38], Asociación Española para el Estudio del Hígado [39] y Orphanet [40]). Las publicaciones seleccionadas fueron aquellas publicadas antes del 31 de julio de 2016.
Elaboración de los cuestionarios
Los datos de las dos rondas de cuestionarios se recogieron en formato online. Con la información obtenida de la revisión de la literatura, se elaboró un primer cuestionario sobre cuatro aspectos de la CBP: epidemiología, diagnóstico, seguimiento y tratamiento actual. El cuestionario utilizado en la segunda ronda fue elaborado para obtener una respuesta consensuada en aquellas preguntas en las que no se consiguió en la primera ronda o para precisar los resultados obtenidos durante la misma.
Taller de validación
Una vez finalizadas las dos rondas de consulta mediante cuestionarios online, se llevó a cabo un taller presencial para validar los resultados obtenidos con un grupo reducido de participantes expertos en la enfermedad.
Panel de expertos
Se invitó a participar a una muestra de expertos que fuese representativa tanto geográficamente como del perfil de especialistas de los centros de excelencia en el tratamiento de la CBP en España.
Análisis estadístico
El análisis estadístico para determinar el grado de consenso entre las respuestas se definió antes de la realización del estudio y se basó en medidas de tendencia central (mediana = Q2) y grado de dispersión (rango intercuartílico Q1-Q3, donde se sitúan el 25-75% de los valores). Se determinó que existía consenso sobre las respuestas del cuestionario cuando:
La información estaba relacionada con la práctica clínica habitual o la experiencia individual (por ejemplo, el número de pacientes visitados al año).
Las respuestas de ≥ 90% de los participantes se encontraban en el rango intercuartílico Q1-Q3.
El valor de la diferencia entre Q2 y Q1 y entre Q3 y Q2 era < 10%.
El valor de la diferencia entre Q2 y Q1 y entre Q3 y Q2 no se consideró relevante.
La epidemiología fue calculada a partir de los datos proporcionados por los expertos, extrapolando el número de pacientes con CBP para el área de influencia de cada hospital a la población total de la comunidad autónoma de dichos hospitales. Una vez obtenidos los datos extrapolados para las comunidades autónomas con representación en el estudio, estos se extrapolaron a toda la población española usando datos del Instituto Nacional de Estadística (INE) 41.
RESULTADOS
Revisión de la literatura
De la revisión de la literatura se seleccionaron 51 publicaciones. Los principales estudios referentes a la epidemiología de la enfermedad en España se muestran en la Tabla 1. La incidencia y prevalencia extraída de estas publicaciones presenta una gran variabilidad, dependiendo de la zona geográfica considerada y del año de publicación.
Elaboración de los cuestionarios
El cuestionario elaborado para la primera ronda constó de 59 preguntas: diez referentes a la epidemiología, 27 al flujo del paciente y proceso diagnóstico, 12 al diagnóstico y seguimiento y 10 al tratamiento.
A partir de los resultados de la primera ronda, se elaboró un segundo cuestionario en el que se reformularon aquellas preguntas en las que no se había alcanzado un consenso.
El segundo cuestionario constó de 11 preguntas: 3 referentes a la epidemiología, 3 al flujo del paciente y proceso diagnóstico, 4 al diagnóstico y seguimiento y 1 al tratamiento.
Taller de validación
Los resultados de las dos rondas de cuestionarios Delphi se presentaron y validaron de forma presencial con un grupo reducido de especialistas de los centros más relevantes en el manejo de la CBP en España. Los resultados se discutieron hasta obtener un consenso final.
Panel de expertos
Tanto en la primera como en la segunda ronda participaron 28 expertos de diferentes especialidades (57% hepatólogos, 39% gastroenterólogos y 4% internistas), procedentes de 13 comunidades autónomas distintas (Fig. 1).

Fig. 1 Localización de los hospitales representados por los participantes en el estudio Delphi. Madrid: 1. H. Ramón y Cajal; 2. H. Puerta del Hierro; 3. H. Clínico San Carlos; 4. H. General Universitario Gregorio Marañón; 5. H. Universitario Fundación Alcorcón; 6. H. de La Princesa; 7. H. del 12 de Octubre; 8. H. Universitario La Paz; Andalucía: 9. H. Universitario Virgen de la Victoria; 10. H. Universitario Virgen del Rocío; Extremadura: 11. H. Universitario San Pedro de Alcántara; Cantabria: 12. H. Marqués de Valdecilla; Comunidad Valenciana: 13. H. La Fe; 14. H. General Universitari de València; Aragón: 15. H. Clínico Universitario Lozano Blesa; Cataluña: 16. H. Parc Taulí; 17. H. Clinic; 18. H. Universitario Vall de Hebrón; Islas Baleares: 19. H. Universitario Son Espases; Islas Canarias: 20. H. Universitario Nuestra Señora La Candelaria 21. H. Universitario De Gran Canaria Dr. Negrín; Asturias: 22. H. Universitario Central de Asturias; Castilla-La Mancha: 23. H. Universitario de Albacete; Castilla-León: 24. H. Universitario de León; Galicia: 25. H. Clínico Universitario de Santiago de Compostela.
En el taller presencial participaron siete hepatólogos procedentes de los principales centros de excelencia en el manejo de la CBP de cinco comunidades autónomas.
Resultados del Delphi
Epidemiología
Los datos epidemiológicos proporcionados por los expertos se muestran en la Tabla 2. Teniendo en cuenta los datos proporcionados, se estimó que existen aproximadamente 9.400 pacientes diagnosticados con CBP en España, lo que equivale a una tasa de prevalencia de 20,2/100.000 habitantes sobre la población total española. El número estimado de nuevos pacientes diagnosticados anualmente con CBP en España es de 1.027, que equivale a una tasa de incidencia estimada de 2,2/100.000 habitantes sobre la población total, existiendo variabilidad de resultados entre regiones. La incidencia habría variado en los últimos años, según el 68% de los clínicos entrevistados, principalmente debido al aumento en el número de diagnósticos precoces, así como de pacientes con síndrome de superposición (que se presentarían en un 5-15% de los pacientes, según el 89% de los clínicos) y a la aparición de técnicas de diagnóstico más sensibles. Los expertos coinciden en que alrededor del 84% de los nuevos casos corresponden a mujeres, de las cuales un 20% son menores de 40 años en el momento del diagnóstico.
Flujo del paciente
Los médicos de Atención Primaria son, habitualmente, los especialistas involucrados en la sospecha inicial de CBP, encargados de realizar la derivación del paciente al especialista para la confirmación del diagnóstico, que es llevada a cabo por un hepatólogo o gastroenterólogo (en aproximadamente un 90% de los casos). En el 28% de los casos, aproximadamente, son otros especialistas (internistas, hepatólogos, gastroenterólogos, ginecólogos, dermatólogos y reumatólogos) los que detectan la CBP debido a la diversa sintomatología y morbilidad asociada que pueden presentar los pacientes al comienzo de la enfermedad.
El tiempo medio en que un paciente es remitido al especialista es de aproximadamente nueve meses, durante los cuales se lleva a cabo un promedio de cuatro visitas antes de la derivación al especialista. Este periodo depende de la formación, región y otros factores médicos. Este tiempo se reduce a cinco meses en pacientes sintomáticos. Para realizar el diagnóstico de CBP, tanto los gastroenterólogos como los hepatólogos requieren un promedio de tres visitas médicas por paciente a lo largo de una media de dos meses (intervalo 1,5-12 meses, dependiendo de la experiencia individual de cada centro). Se estima que entre el 15% y el 20% de los individuos con CBP en España no han sido diagnosticados.
Una vez confirmado el diagnóstico, se inicia el tratamiento farmacológico, así como el seguimiento del paciente.
Diagnóstico
Según la opinión de los expertos, aproximadamente un 65% de los pacientes con CBP están asintomáticos en el momento del diagnóstico, detectable por una alteración en los parámetros bioquímicos en un análisis rutinario. En torno a un 15% de los individuos presenta sintomatología, frecuentemente prurito, mientras que entre un 5% y un 15% manifiesta una sintomatología más compleja, que suele corresponder a un síndrome de superposición.
La sospecha de CBP se inicia tras la detección de una elevación sostenida (al menos seis meses) de la FA, por encima de 1,5 veces el límite superior de la normalidad (LSN), después de descartar otras posibles causas de colestasis y daño hepático. Además, los pacientes sintomáticos suelen presentar prurito y melanodermia. Las alteraciones analíticas más frecuentes son presencia de AMA (96%), incremento de FA (96%) y GGT (93%), así como de otros marcadores bioquímicos de función hepática. Sin embargo, no es frecuente que los pacientes presenten un tiempo de protrombina (TP) prolongado al inicio de la enfermedad. En pacientes asintomáticos, las alteraciones analíticas más frecuentes al inicio de la CBP son presencia de AMA (100%) y niveles de FA (89%) y colesterol (75%) elevados. La fase asintomática de la enfermedad puede prolongarse más de diez años. La confirmación del diagnóstico requiere la realización de estudios de imagen, generalmente una ecografía abdominal y, en algunos casos, biopsia hepática. El tiempo necesario para la realización de estos exámenes es de dos a cinco meses.
La ecografía abdominal se realiza ante la presencia de indicadores de colestasis con valores de FA y GGT elevados para establecer el grado de compromiso del hígado y descartar colestasis extrahepática u otras causas de daño hepático. La mayoría de los especialistas consultados (76%) utiliza la elastografía hepática tanto para la determinación del grado de fibrosis del hígado (93%) como para conocer el curso y, en consecuencia, estimar el pronóstico de la CBP.
La biopsia hepática es utilizada para realizar el diagnóstico de un 10% de los pacientes con CBP. Esta técnica se aplica principalmente en casos de pacientes AMA negativo que presentan niveles alterados de marcadores bioquímicos, los cuales representan un 8,34% del total de pacientes con CBP. Un 14% de los expertos consultados no utiliza la biopsia hepática para el diagnóstico de CBP, mientras que un 79% solo la utiliza en determinados tipos de pacientes.
Seguimiento
El objetivo del seguimiento de los pacientes es valorar la actividad y progresión de la enfermedad, así como detectar la aparición de comorbilidades, y requiere de una visita y un análisis del perfil hepático cada seis meses al especialista (gastroenterólogo o hepatólogo), cuya finalidad es monitorizar la función hepática y la respuesta al tratamiento durante la fase asintomática de la enfermedad y 5-6 visitas en la fase sintomática, incrementándose con la progresión de la patología. Este seguimiento puede extenderse entre 5 y 40 años si la respuesta terapéutica es positiva. Cuando aparecen signos y síntomas de progresión de la enfermedad a un estadio avanzado, debe plantearse la conveniencia de un trasplante hepático, teniendo en cuenta el alto riesgo tanto de fallecimiento por la enfermedad en esta fase como de recurrencia tras el trasplante (Fig. 2).
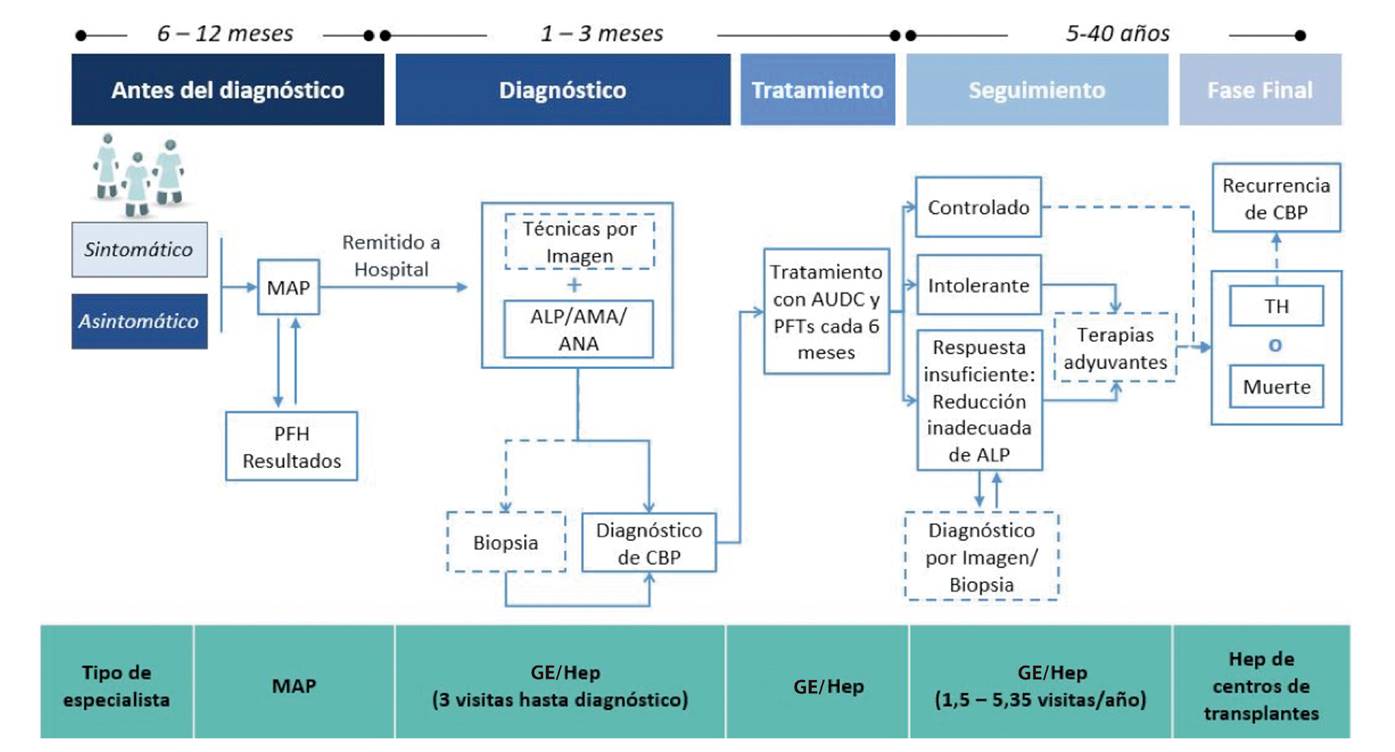
Fig. 2 Flujo del paciente con CBP en el sistema público de salud español (consenso experto) (CBP: colangitis biliar primaria; FA: fosfatasa alcalina; PFH: pruebas de función hepática; AMA: anticuerpos antimitocondriales; ANA: anticuerpos antinucleares; MAP: médico de Atención Primaria; GE: gastroenterólogo; Hep: hepatólogo; AUDC: ácido ursodeoxicólico; TH: trasplante hepático. La línea discontinua significa posibilidad del evento).
Diversos factores de riesgo pueden comprometer el pronóstico a largo plazo: estadio de la enfermedad, edad del paciente en el momento del diagnóstico, velocidad de progresión, tratamientos previos recibidos, respuesta al tratamiento y presencia del síndrome de superposición. Los niveles de FA, GGT, aminotransferasas (alanina transaminasa y aspartato transaminasa) y bilirrubina total son los marcadores bioquímicos con valor predictivo del pronóstico más utilizados en la práctica médica y se miden con regularidad durante el seguimiento de los pacientes, siendo necesarias entre una y dos determinaciones por paciente/año en la fase asintomática y entre tres y cuatro en la fase sintomática. La elastografía hepática y la ecografía abdominal son las técnicas de imagen más empleadas en el seguimiento de los pacientes. La frecuencia de utilización aumenta con la progresión de la enfermedad, especialmente en la ecografía abdominal, con una media de 0,8 ecografías abdominales por paciente/año en la fase asintomática y 2,4 ecografías en la fase sintomática.
Los síntomas más frecuentes que presentan los pacientes con CBP son prurito, presente, de media, en el 27% de los pacientes (intervalo del 10% al 60%), y astenia, en una media del 47% de los pacientes (intervalo del 15% al 70%). Los pacientes suelen desarrollar comorbilidades debidas a la progresión de la CBP o de enfermedades asociadas después de cinco años del diagnóstico. Las más comunes, por orden de frecuencia, son síndrome de Sjögren (63% de los pacientes con CBP), alteración tiroidea autoinmune (15%), osteoporosis/osteopenia (10%), enfermedad de Raynaud (9%) y/o escleroderma (8%). La presencia de comorbilidades incrementa las visitas al especialista en un promedio de tres visitas por paciente y año. Además, un 2% de los pacientes con CBP requiere trasplante hepático en España. El tiempo medio de supervivencia libre de trasplante es de 28 años tras el diagnóstico, produciéndose alrededor de dos fallecimientos al año por esta enfermedad en cada centro.
El 29% de los especialistas utiliza herramientas validadas para la valoración de la calidad de vida relacionada con la salud (CVRS) de los pacientes. Los cuestionarios más empleados son los genéricos Short Form 36 (SF-36) (utilizado por el 14% de los especialistas), Fatigue Impact Scale (FIS) (utilizado por un 11% de los especialistas) y el cuestionario específico para la CBP Primary Biliary Cholangitis-40 (PBC-40), utilizado por un 11-14% de los especialistas.
Tratamiento de la CBP
Aproximadamente, un 95% de los pacientes diagnosticados de CBP reciben tratamiento con AUDC. El 5% restante no recibe AUDC, el 3% de estos por intolerancia (principalmente síntomas gastrointestinales) y el 2% por falta de adherencia. El criterio de Barcelona 21 es el aplicado con más frecuencia en la práctica habitual para establecer la respuesta a AUDC. Los especialistas consideran que un 17% (intervalo del 5% al 70%) de los pacientes tratados responden de forma incompleta al AUDC. Considerando la prevalencia calculada de CBP en España, en la actualidad existirían aproximadamente 3.476 pacientes que no responden al tratamiento con AUDC (en torno al 39% de los pacientes tratados) y 469 que son intolerantes al mismo (Fig. 3). No existen recomendaciones establecidas en guías nacionales de práctica clínica para tratar a los pacientes no respondedores o intolerantes a AUDC, por lo que la segunda línea de tratamiento está aún por definir. Sin embargo, y en ausencia de un tratamiento autorizado para dicha indicación en el momento del estudio -el ácido obeticólico recibió la aprobación regulatoria por la Agencia Europea del Medicamento el 12 de diciembre de 2016 indicado para el tratamiento de la colangitis biliar primaria (también conocida como cirrosis biliar primaria) en combinación con ácido ursodesoxicólico (AUDC) en adultos con una respuesta inadecuada a AUDC o como monoterapia en adultos que no pueden tolerar el AUDC 28-, en la práctica clínica habitual los especialistas tratan a los pacientes con fibratos (se administran al 57% de los pacientes no respondedores y al 32% de pacientes intolerantes a AUDC) y tratamiento con glucocorticoides o corticosteroides como la budesonida o la prednisolona (se administran al 11% de los pacientes no respondedores y al 18% de pacientes intolerantes a AUDC). Ninguno de estos tratamientos tiene la indicación autorizada en ficha técnica.
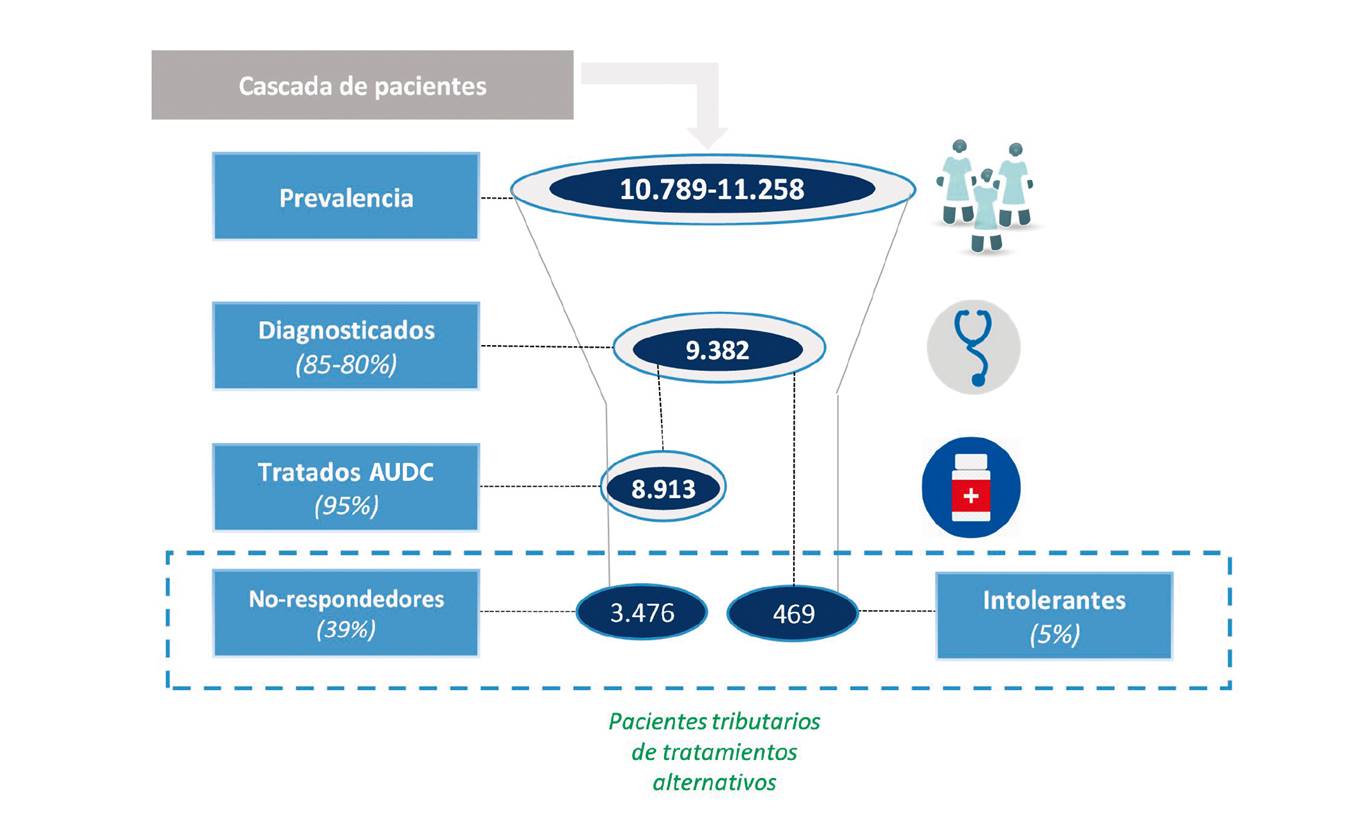
Fig. 3 Estimación del número potencial de pacientes con CBP que en España serían tributarios de tratamientos de segunda línea o alternativos a AUDC (consenso experto) (CBP: colangitis biliar primaria; AUDC: ácido ursodeoxicólico. Población (2016): 46,4 millones de habitantes).
Los fármacos más utilizados para manejar el prurito son antihistamínicos, resinas de intercambio aniónico (como colestiramina), antidepresivos, rifampicina y antagonistas opioides. Por otra parte, los fármacos administrados comúnmente para el tratamiento de las comorbilidades son: diuréticos (furosemida y espironolactona) para disminuir la ascitis, beta-bloqueantes en el caso de aparición de varices esofágicas para prevenir hemorragias y la somatostatina o vasopresina para el tratamiento en caso de hemorragia digestiva por hipertensión portal, así como lactulosa y rifamixina para tratar los casos de encefalopatía hepática.
Los expertos consideran que faltan pautas estandarizadas de actuación en España, por lo que existe una variabilidad importante de criterios y de práctica, condicionada a su vez por la disparidad en experiencia y en recursos humanos y técnicos disponibles entre centros hospitalarios.
DISCUSIÓN
Este estudio presenta una síntesis de la perspectiva de expertos sobre la epidemiología, el flujo del paciente, el diagnóstico y el seguimiento de la enfermedad y el tratamiento de la CBP en España. Los expertos que participaron en este estudio ofrecieron una estimación de la incidencia y la prevalencia de la CBP muy dispar (prevalencia entre 11,79 y 37,99 casos/100.000 habitantes e incidencia entre 0,51 y 3,86 casos/100.000 habitantes), aunque similar a las cifras presentes en la literatura de estudios realizados en otros países y para Europa 5,42,43. La dispersión de estas cifras puede explicarse, o bien por una amplia variabilidad en el número de pacientes diagnosticados de CBP en cada región, factores epidemiológicos como la edad de los grupos poblacionales, raza o inmigración (datos no analizados), diferencias en niveles de formación en la patología y/o por la falta de un registro sistemático de los casos de CBP en los hospitales.
Los expertos coincidieron en que existe una tendencia creciente a diagnosticar de forma más precoz la enfermedad, lo cual contribuye a mejorar el pronóstico de los pacientes en la medida en que se inicia antes el tratamiento. El papel del médico de Atención Primaria es fundamental en este proceso ya que son los profesionales que, con más frecuencia, ante una sospecha clínica, realizan la derivación del paciente al especialista para confirmar el diagnóstico e iniciar el tratamiento 44,45,46.
Con el fin de estimar el estadio y el curso de la enfermedad, la valoración rutinaria del grado de fibrosis del hígado en el ámbito hospitalario suele hacerse mediante técnicas no invasivas como la elastografía hepática. No obstante, limitaciones en el acceso y disponibilidad de estas técnicas, así como la ausencia de guías de práctica clínica, se presentan como barreras para un empleo más extendido de las mismas 47.
En el momento de realizar el estudio, el AUDC era la única alternativa disponible con indicación autorizada comercializada en España para el tratamiento de CBP, de forma que el pronóstico de los pacientes está ligado a la respuesta al tratamiento de este fármaco 32. Aunque la terapia con AUDC parece estar establecida, sería oportuno estudiar la variabilidad en su utilización en la práctica clínica, ya que se ha demostrado que dicha variación influye en la historia natural de la enfermedad 33. En los pacientes intolerantes o que responden de manera insuficiente a AUDC, se utilizan otras opciones terapéuticas fuera de ficha técnica con criterios muy heterogéneos, que dependen del profesional sanitario y del centro hospitalario considerado. Los tratamientos usados como segunda línea por los expertos en España coinciden con los tratamientos sin indicación aprobada para el tratamiento de la CBP incluidos en las últimas guías europeas EASL para el diagnóstico y el manejo de la CBP, aunque estas no los recomiendan ya que no se dispone de evidencia que respalde su efectividad 48. Así, resultaría necesaria la disponibilidad de segundas opciones que tengan como indicación aprobada el tratamiento de la CBP y de las que se conozcan los beneficios de su uso en términos de mejora de las variables clínicas y bioquímicas, supervivencia libre de trasplante, reducción de la mortalidad por enfermedad hepática y mejora de la calidad de vida relacionada con la salud de los pacientes 30.
Las limitaciones del presente estudio son las derivadas de la metodología utilizada para la obtención de la información, pues se carece de datos publicados. La técnica Delphi permite obtener información en base a la opinión de expertos que conocen la enfermedad y tratan a los pacientes con CBP, por lo que deben corroborarse con estudios epidemiológicos diseñados para tal fin. Los datos del registro ColHai (Registro Nacional de Enfermedades Colestásicas y Autoinmunes Hepáticas, puesto en marcha en el año 2016) 31 pueden proporcionar evidencia adicional a la actual, cuyo nivel se considera bajo.
Una limitación que podría estar asociada a la metodología Delphi es una posible pobre variabilidad entre las opciones de respuesta, cosa que impediría considerar correctamente puntos de vista alternos entre los participantes. Para evitar este problema, todas las preguntas de los cuestionarios usados en el presente estudio contenían un campo abierto para que los expertos añadiesen sus propios datos, incluso en las preguntas donde se mostraban rangos o listas.
Por último, intervenciones dirigidas a formar a los equipos asistenciales en las características y necesidades de los pacientes con CBP pueden incrementar la tasa de diagnóstico y reducir el tiempo para alcanzarlo. Además del nuevo registro ColHai, que permitirá obtener datos y realizar un seguimiento de la enfermedad en España, serían necesarias guías de práctica clínica españolas sobre el manejo de CBP que definan criterios diagnósticos, de tratamiento y seguimiento de los pacientes, que informen, faciliten y homogenicen la toma de decisiones clínicas y permitan conocer los resultados en salud obtenidos con las intervenciones citadas.











 texto en
texto en 




