INTRODUCCIÓN
El resultado del injerto es uno de los factores que más condicionan la evolución posterior del paciente sometido a un trasplante hepático. Este riesgo es valorado minuciosamente por los equipos de trasplante y depende: a) de variables relacionadas con el donante, aún más cuando el uso de órganos se ha ampliado a donantes con criterios expandidos; b) de variables relacionadas con el proceso donación-trasplante, que pueden ser diferentes de unos programas a otros; y c) de variables relacionadas con el receptor, aún más cuando se han ampliado las fronteras previamente definidas de las indicaciones de trasplante a nuevos receptores.
Por ello, se han descrito indicadores para la valoración de la supervivencia postrasplante hepático, tanto del injerto como del receptor: MELD y CTP 1, NDDF 2, SOLD 3, DRI 4, SOFT 5, D-MELD 6, BAR 7, ET-DRI 8, NN-CCR y NN-MS 9, NNtop15 10 y DLI 11 (Tabla 1 Suplementaria).
Tabla Suplementaria 1 Indicadores de supervivencia en trasplante hepático
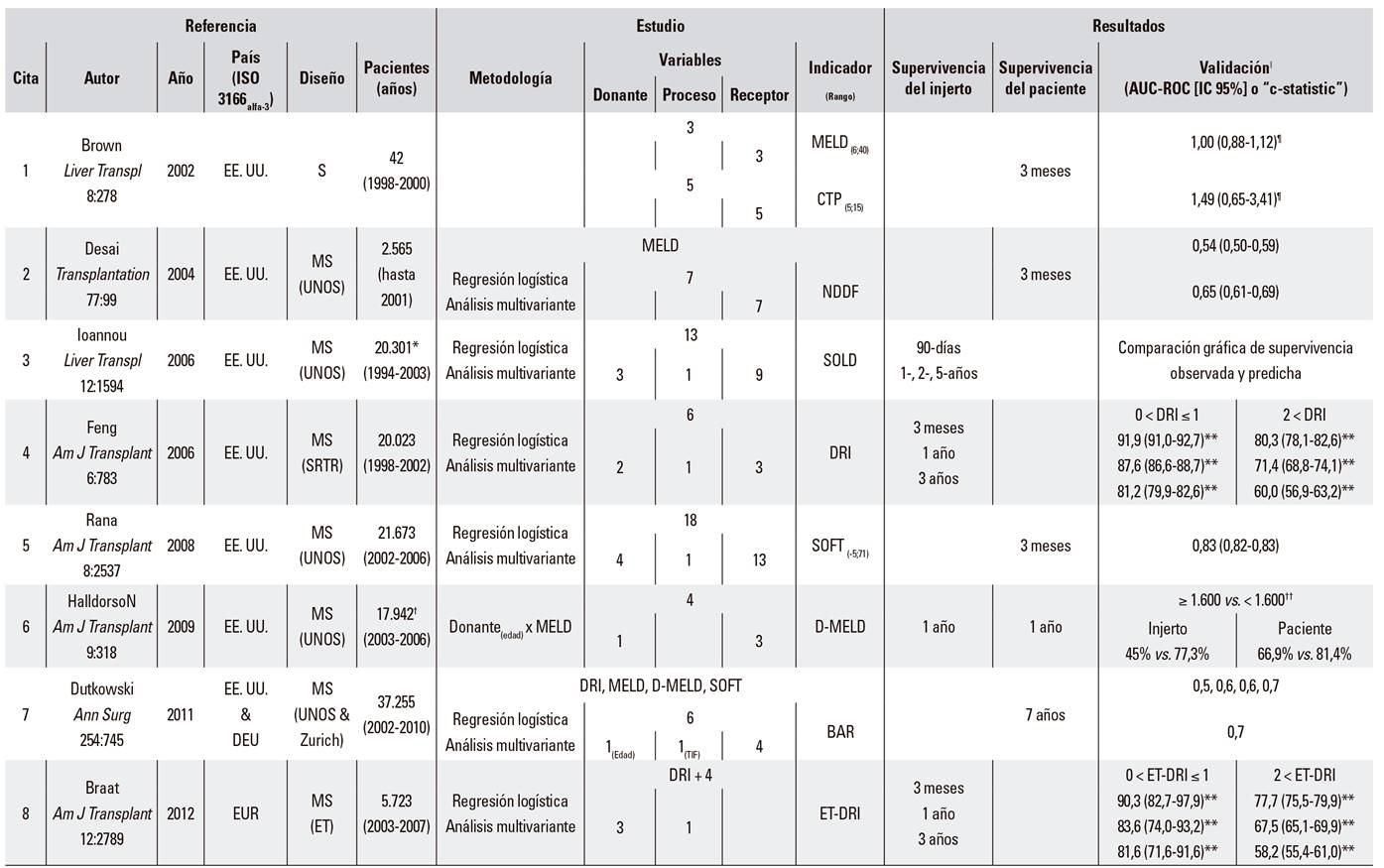

Referencia: S: estudio unicéntrico; MS: estudio multicéntrico; UNOS: United Network for Organ Sharing; SRTR Scientific Registry of Transplants Recipients; ET: Eurotransplant; UKTR: United Kingdom Transplant Registry. *Transplantes combinados y retrasplantes excluidos. †Retrasplantes, insuficiencia hepática aguda y donación tras muerte cardiaca excluidos. ‡Split, donante vivo y trasplantes combinados excluidos. §Receptores < 16 años, hígado heterotópico o auxiliar e incompatibilidad sanguínea excluidos.
Estudio: MELD: model for end-stage liver disease; CTP: Child-Turcotte-Pugh score; NNDF: newly derived discrimination function; SOLD: score of liver donor; DRI: donor risk index; SOFT: survival outcome following liver transplantation; D-MELD: donor-MELD; BAR: balance of risk score; ET-DRI: Eurotransplant donor risk index; NN-CCR: neural network-correct classification rate; NN-MS: neural network-minimum sensitivity; DLI: donor liver index.
Resultados: ǁSalvo indicación AUC-ROC (95% IC): área bajo la curva ROC (95% intervalo de confianza); ¶Regresión Lineal OR (95% IC); **Supervivencia Ajustada; ††Kaplan-Meier.
Sin embargo, existen diferencias importantes entre los programas de donación-trasplante de los diferentes países y organizaciones, tanto en lo que se refiere a las características de los donantes como a los resultados del trasplante (Tabla 2 Suplementaria). Estas diferencias resultan más llamativas en cuanto a la edad y etnia de los donantes, el número de donantes en muerte encefálica (DBD) vs. donantes en muerte cardiaca (DCD), las causas de la DBD y las ofertas de bipartición hepática, entre otras. Todo lo anterior demuestra que los donantes y los receptores pueden ser bastante distintos entre los países y/o regiones y, por tanto, sería más apropiado disponer de un sistema de puntuación cercano y que pueda ser utilizado para la aceptación y asignación de un hígado.
Tabla Suplementaria 2 Actividad 2016 en las organizaciones: OPTN, ET, y ONT*
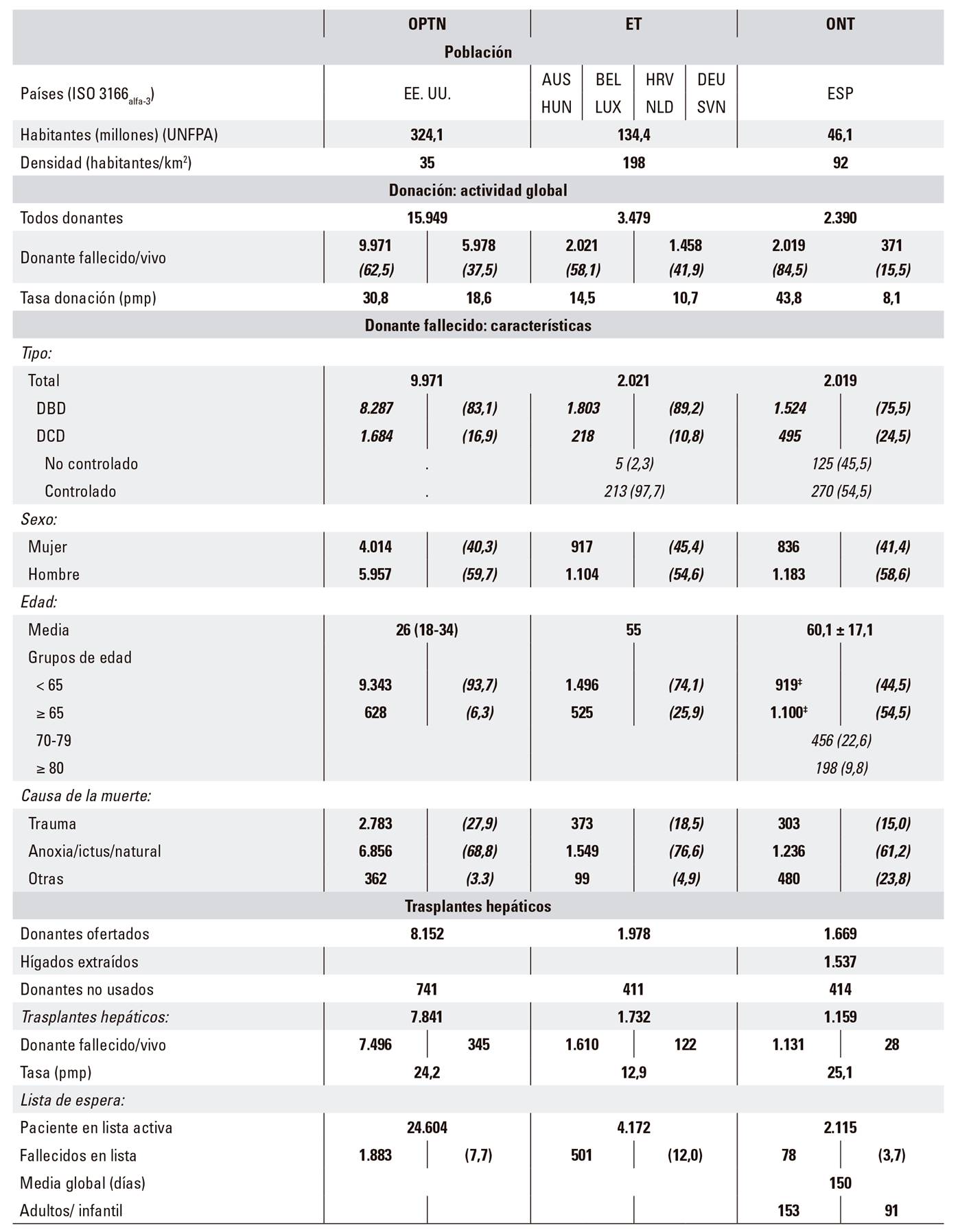

DBD: donor brain dead; DCD: donor cardiac dead. Datos en valor absoluto (%). *Basado en: OPTN: Organ Procurement and Transplantation Network. Disponible en https://optn.transplant.hrsa.gov/data/. ET: Eurotransplant. Disponible en http://statistics.eurotransplant.org/. ONT: Organización Nacional de Trasplantes. Disponible en http://www.ont.es/infesp/Paginas/Memorias.aspx. Newsletter Transplant 2017. Disponible en http://www.ont.es/publicaciones/Documents/. †OPTN2011-2014: media y 95% intervalo de confianza; ONT2016: mediana y rango intercuartílico. ‡Datos < o ≥ 60 años.
El Registro Español de Trasplante Hepático (RETH) recoge la experiencia del trasplante hepático en España y contiene la información sistematizada de todos los trasplantes hepáticos realizados en nuestro país. Es por esto que constituye una herramienta de conocimiento de nuestra propia experiencia.
El objetivo de este estudio es describir un nuevo indicador de riesgo del injerto hepático a partir de los resultados del RETH, que sea una combinación de los factores relacionados con el donante, con el proceso y con el receptor, y que facilite la toma de decisiones de la aceptación de un órgano y su asignación a un paciente concreto. También se pretende validar y comparar este indicador con el DRI americano (DRI) y el ET-DRI europeo (ET-DRI) en nuestra casuística.
MATERIAL Y MÉTODO
Fuentes de datos
La descripción del nuevo indicador se basó en la información recogida en la memoria anual del RETH 12. En ella se describen las características de los donantes y los resultados de los trasplantes hepáticos realizados en España; en concreto, están sistematizados los datos de 22.846 trasplantes hepáticos realizados por 24 centros de trasplante desde 1984 hasta 2016. Dicha memoria es pública y está disponible en línea.
Para la validación de los indicadores descritos se utilizaron los 600 trasplantes hepáticos adultos (mayores de 15 años) realizados consecutivamente en nuestro centro, cuyos datos son recogidos de forma prospectiva y cuyas características se describen posteriormente.
El estudio fue acorde con la Ley Orgánica 15/1999 de Protección de Datos de carácter personal. El trabajo fue aprobado por el Comité Ético de Investigación Clínica de Aragón, CódigoCEICA PI18/0097, con fecha 24 de abril de 2018.
Descripción del GRI
La metodología del estudio para el diseño y validación del GRI esta resumida en la Tabla 1:
La memoria del RETH incluye un análisis de riesgos proporcionales de regresión de Cox de los factores relacionados con la supervivencia global del injerto. En ella, los resultados se expresan como valores de CoxPH (RR) con un intervalo de confianza del 95% (95%IC) (Tabla 1A).
A partir de la propia ecuación de la regresión de Cox [ln (λt) = a + b1x1 + b2x2 + ... + bnxn], se puede definir un indicador como el exponencial (logaritmo inverso) de una puntuación de riesgo lineal. Agrupando las variables con diferencias estadísticamente significativas (DES) en dicho análisis multivariante, se pudieron definir tres indicadores: índice de riesgo del donante (dRI), índice de riesgo del receptor (rRI) e índice de riesgo del injerto o graft risk index (GRI), siendo GRI = dRI x rRI) (Tabla 1B).
El nuevo indicador (GRI) será validado y comparado con el DRI americano (DRI) y el ET-DRI europeo (ET-DRI) en nuestra serie (Tabla 1C).
Para la evaluación de los indicadores se consideraron dos eventos:
Evento 1: supervivencia del injerto (SI), definida como el periodo desde la fecha del trasplante hasta la fecha del retrasplante o la muerte del receptor por cualquier causa, lo que ocurriera primero.
Evento 2: supervivencia del injerto sin fallo (SIsf), definida como el periodo desde la fecha del trasplante hasta la fecha del retrasplante o la muerte del receptor con disfunción crónica del injerto, lo que ocurriera primero.
Tabla 1 Descripción del GRI. Variables incluidas (1A), fórmula (1B) y ejemplos comparados con DRI y ET-DRI (1C)
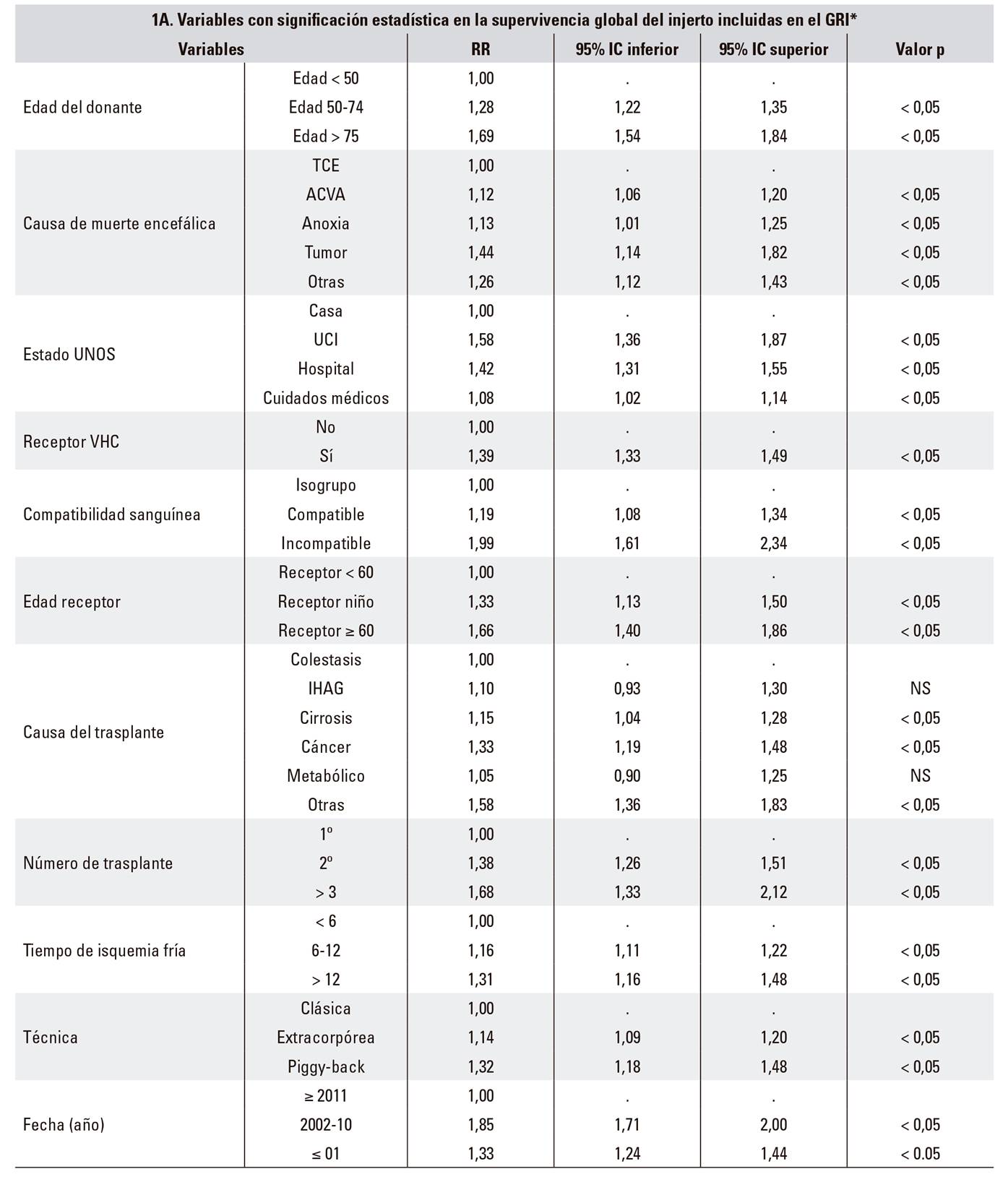

*Memoria de resultados del RETH. Disponible en: http://www.sethepatico.org. RR: risk ratio; IC: intervalo de confianza; NS: no significativa; ACVA: accidente cerebrovascular agudo; IHAG: insuficiencia hepática aguda grave; TCE: traumatismo craneoencefálico; UCI: Unidad de Cuidados Intensivos; UNOS: United Network for Organ Sharing; VHC: virus hepatitis C.
En negrita, ejemplo de referencia (riesgo 1); en cursiva, variables modificadas respecto a referencia. Para el cálculo del DRI y ET-DRI las variables no contempladas en el GRI se han considerado de valor 0 (riesgo 1).
Función logística del GRI
Se usó el test de bondad de ajuste de Hosmer-Lemeshow (p > 0,05) para evaluar el ajuste al modelo. Después, se obtuvieron los valores para dibujar la curva de la regresión logística: coeficientes de regresión (β0 y β1) con sus correspondientes errores estándar, el valor del estadístico de Wald y el valor de la "odd ratio" OR = e(β1), con su intervalo de confianza.
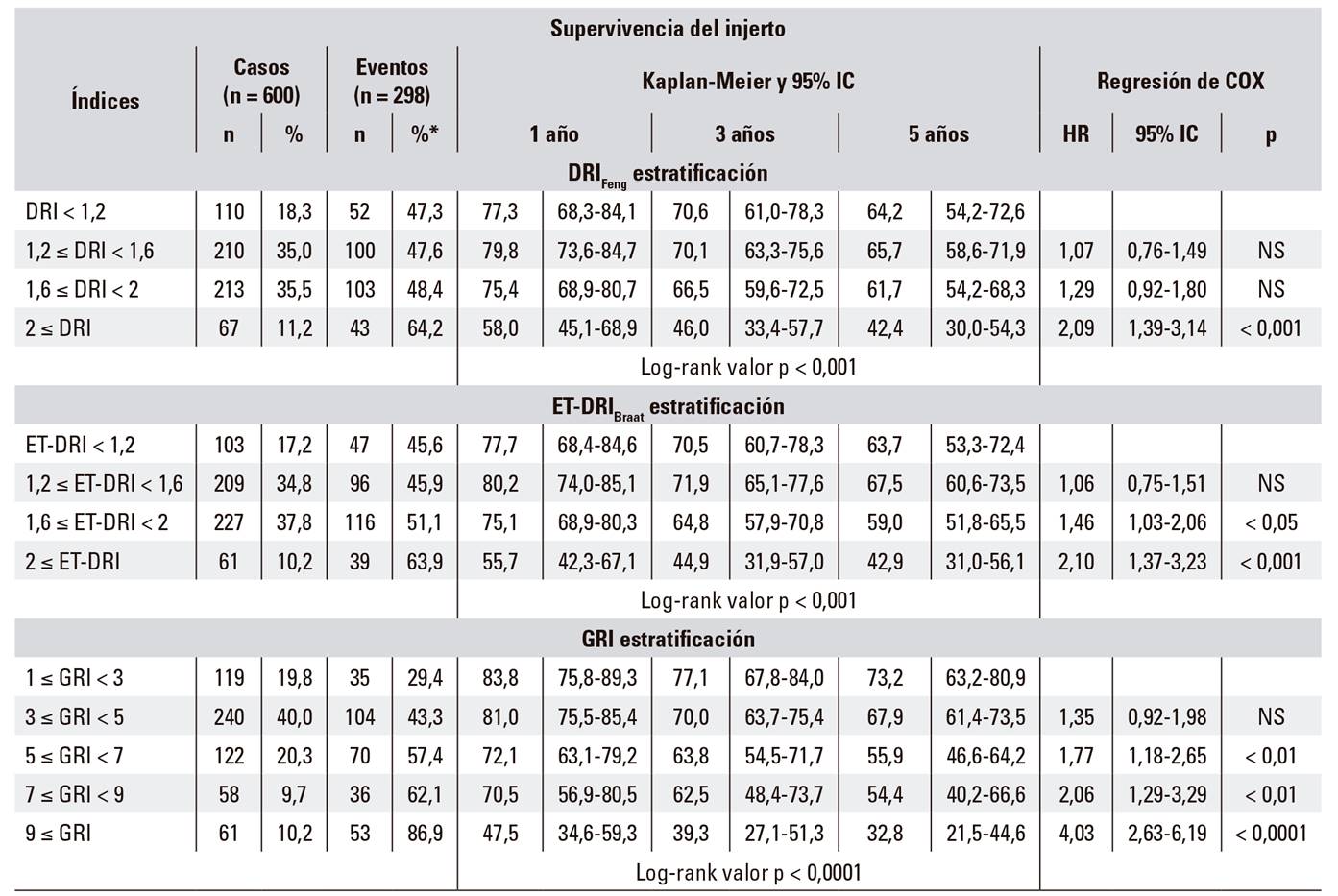
Comparación de indicadores: valores, supervivencia del injerto y hazard ratio (HR) según estratificación
Se calcularon las curvas de supervivencia del injerto por grupos de riesgo de los indicadores usando las estimaciones de Kaplan-Meier. Se estimó la HR de cada grupo de riesgo respecto del grupo estándar mediante una regresión de Cox.
Curvas ROC
La precisión del DRI, del ET-DRI y del GRI para predecir la supervivencia del injerto se evaluó mediante el cálculo del área bajo la curva en un análisis de ROC, en el que un valor de 1 representa una discriminación perfecta, mientras que un valor de 0,5 representa una discriminación no superior al azar.
Un valor de p Wald < 0,05 se consideró significativo. Todos los análisis se realizaron con IBM(r) SPSS(r) Statistics versión 22.0 ((c)Copyright IBM Corporation1989-2013, Chicago, IL, USA).
RESULTADOS
Descripción y cálculo del DRI, RRI y GRI
A partir de los datos del análisis de regresión logística de COX de supervivencia global del injerto del RETH se obtuvieron los indicadores dRI, rRI y GRI (Tabla 1). En ella, puede apreciarse un ejemplo de GRI con riesgo 1 y un ejemplo de riesgo máximo (GRI: 81.045); los ejemplos descritos se acompañan de los valores del DRI y del ET-DRI.
Serie de validación
Para la validación de los nuevos indicadores y del DRI y ET-DRI, se han utilizado los datos de 600 trasplantes hepáticos de adultos de nuestro centro. Los datos de la serie de validación se describen en la Tabla 2.
Tabla 2 Principales características de la cohorte





HCV: hepatitis C virus; HIV: hepatitis immunodeficiency virus; MELD: model for end-stage liver disease; UNOS: United Network for Organ Sharing; HCC: hepatocellular carcinoma; HBV: hepatitis B virus. *Variables cuantitativas se presentan como: media ± desviación estándar, mediana (rango intercuartílico) y rango. Variables cualitativas se presentan como n (%).
AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; GGT: gamma glutamil transpeptidasa; HBcAb: antígeno central de la hepatitis B; CMV: citomegalovirus; UW: Universidad de Wisconsin. Localización: local, en la ciudad; regional, < 200 km; nacional, > 200 km. *Variables cuantitativas se presentan como: media ± desviación estándar, mediana (rango intercuartílico) y rango. Variables cualitativas se presentan como n (%).
Variables de evolución clínica categorizadas como en el RETH. DDG: muerto con disfunción del injerto; DFG: muerto con injerto funcionante. *Variables cuantitativas se presentan como: media ± desviación estándar, mediana (rango intercuartílico) y rango. Variables cualitativas se presentan como n (%). Kaplan-Meier: media (95% intervalo de confianza). †Veintiún pacientes fallecieron en lista de espera de retrasplante.
Función logística del GRI
El test de Hosmer-Lemeshow reveló que las probabilidades observadas eran similares a las esperadas para los tres indicadores: DRI (p = 0,883), ET-DRI (p = 0,317) y GRI (p = 0,210). En la Figura 1 se observa la curva de la ecuación logística junto con los valores observados por intervalos de GRI. Un valor del GRI de 1 se corresponde con una probabilidad de pérdida del injerto del 23,25%; cada punto de aumento del GRI supone que la probabilidad de sufrir una pérdida del injerto se multiplica por 1,33 (IC 95%: 1,24-1,44).
Comparación de indicadores: valores, supervivencia del injerto y HR según estratificación
La media del DRI no muestra diferencias estadísticamente significativas entre los grupos con y sin supervivencia del injerto: 1,54 (IC 95%: 1,50-1,58) vs. 1,60 (IC 95% 1,55-1,65), respectivamente. El ET-DRI muestra ligeras diferencias con significación estadística: 1,51 (IC 95%: 1,47-1,55) vs. 1,60 (IC 95%: 1,56-1,63), p < 0,05, respectivamente. Finalmente, el GRI presenta diferencias estadísticamente muy significativas entre ambos grupos: 4,27 (IC 95%: 4,06-4,49) vs. 6,46 (IC 95%: 5,98-6,93), p < 0,0001.
Las diferencias de supervivencia del injerto entre los índices más altos y los más bajos son evidentes para los tres indicadores. Sin embargo, de los tres indicadores, el GRI es el que mostró una mejor discriminación de supervivencia en los grupos intermedios, pudiendo observarse cómo esta disminuye de forma progresiva hasta que un valor de GRI ≥ 9 supone una supervivencia del injerto al año del 47,5% (IC 95%: 34,6-59,3), con diferencias muy significativas respecto del grupo estándar (HR 4,03, IC 95%: 2,63-6,19; p < 0,0001) (Tabla 3).
Curvas ROC
El área bajo la curva en el análisis ROC del DRI fue igual a 0,54 (IC 95%: 0,50-0,59) y del ET-DRI, igual a 0,56 (IC 95%: 0,51-0,61), lo que significa que su capacidad de predicción de supervivencia del injerto no es superior al azar. El área del GRI fue igual a 0,70 (IC 95%: 0,65-0,73), con diferencias muy significativas respecto de las otras dos (test de DeLong, p < 0,0001) (Fig. 2).
Analizando la capacidad predictiva del GRI en términos de posible futilidad del trasplante, merece destacar que un GRI ≥ 10 supuso una pérdida del injerto siempre: especificidad 100%, sensibilidad 14,4%, valor predictivo positivo 100% y valor predictivo negativo 54,2%.
Todos los resultados respecto del evento 2 (SIsf) son superponibles a los descritos para el evento 1 (SI) (datos no publicados).
DISCUSIÓN
Los indicadores clásicos para valorar el pronóstico de la cirrosis (Child-Pugh) o la mortalidad en lista de espera de trasplante (MELD) no son válidos para predecir la supervivencia del paciente postrasplante 1,2. Los últimos indicadores creados a partir de redes neurales son complejos, basados en experiencias limitadas, con baja capacidad de generalización y difícilmente extrapolables a la práctica clínica diaria 9,10. Finalmente, las validaciones externas de algunos indicadores (DRI, MELD, D-MELD y SOFT [7]; DRI y ET-DRI 13 y DRI y SOFT [10]) no parecen confirmar su validez cuando se aplican en escenarios distintos de aquellos en los que fueron descritos, al igual que ocurre en nuestro estudio. Esto último seguramente es debido a las grandes diferencias entre países y programas respecto de las características de su población donante y del proceso de donación-trasplante, y menos a las características de los receptores.
Las variables relacionadas con el donante pueden estar vinculadas con las características particulares del injerto y con las características generales del donante per se. La mayoría de los indicadores descritos comparten una serie de variables comunes: edad, causa de la DBD, etc. Por otro lado, algunos incluyen variables cuya justificación o relación con la supervivencia del injerto o del paciente no parecen tener una clara relación científica: tabaquismo, talla, etc.
Sin embargo, siendo la esteatosis uno de los determinantes principales de la función hepática postrasplante 14 (especialmente en el primer año), ninguno de los indicadores descritos incluye este dato ni directa ni indirectamente. Kulik y cols. 15, en un estudio reciente, destacan que los aloinjertos con un hígado graso son una causa importante de fallo primario del injerto y de una mortalidad excesiva después del trasplante.
Clásicamente, las altas concentraciones de sodio del donante se han relacionado con el fallo y la disfunción primaria del injerto (PNF) 16. En un estudio llevado a cabo por Sirivatanauksorn y cols. 17, el alto nivel de sodio del donante se asoció con hígados marginales, pero solo los niveles de ALT > 65 IU/l se asociaron con mayor incidencia de PNF. Más recientemente, Al-Freah y cols. 18 no encuentran ningún factor del donante relacionado con PNF, a excepción de la incompatibilidad ABO donante-receptor.
Finalmente deberían contemplarse en estos indicadores las variables relacionadas con el donante per se. Algunas de ellas son variables englobadas internacionalmente bajo el concepto de donantes con criterios expandidos, y en España también bajo el término donantes de riesgo no estándar (DRNE), y son múltiples: abuso de drogas, intoxicaciones, tumores, infecciones, hepatitis B o C, edad mayor de 65 años, etc.
Respecto de las variables relacionadas con el receptor, la asignación de un determinado órgano al receptor más adecuado es una de las decisiones más delicadas, sobre todo en determinadas situaciones. Estamos de acuerdo con Feng y cols. 4 en que los injertos ideales son un grupo muy homogéneo y así, un órgano óptimo puede asignarse a cualquiera, mientras que los injertos no ideales son un grupo muy heterogéneo que abarca un amplio espectro de riesgo. En estos casos, la asignación de un órgano subóptimo a un receptor con un MELD alto 19,20, con patologías concretas 21 o con patologías que tienen una mayor mortalidad en lista de espera 22, juega con el riesgo de supervivencia del paciente postrasplante frente a la mortalidad en lista de espera.
Por último, en cuanto a las variables relacionadas con el proceso donación-trasplante, la mayoría de los indicadores descritos incluyen el tiempo de isquemia fría (TIF) en su diseño. El TIF puede depender a su vez de la localización del donante, de los medios de transporte disponibles, de la habilidad del cirujano y de eventos imprevisibles relacionados con la técnica quirúrgica, etc. Un buen indicador debería conocerse en el momento de la oferta del órgano y no debería incluir variables que puedan medir más o menos lo mismo (por ejemplo, localización del donante o TIF).
Quizás, en un futuro, la toma de decisiones en la medicina en general, y en los trasplantes en particular, se basará en complejas redes neuronales artificiales 23 que, analizando incontables variables más o menos evidentes (big data) y numerosas redes interdependientes, serán capaces de aprender, decidir y puede que incluso acertar o equivocarse. Sin embargo, a la espera de ello, seguiremos creyendo que la solución al problema de la asignación donante-receptor podrá verse facilitada por este tipo de herramientas, pero en ningún caso supondrá la eliminación del componente humano, que es la única herramienta con conciencia, consciencia y sensibilidad.
El presente estudio tiene una serie de limitaciones: el indicador descrito está basado en un análisis no predictivo de un registro nacional de más de 22.000 trasplantes; su validación se ha hecho con una serie limitada de un único centro; será necesario perfilar y actualizar el peso real de determinadas variables en la supervivencia del injerto (el ejemplo más significativo es el virus C); y, por último, hay que considerar que con estos índices se pretende simplificar situaciones complejas que dependen de muchos factores, en muchos casos reduciendo variables cuantitativas a categóricas.
En conclusión, nuestro estudio señala que ni el DRI ni el ET-DRI parecen predecir adecuadamente el riesgo del injerto en nuestro medio. Un GRI nacional podría ser una herramienta muy útil para categorizar la asignación del injerto-receptor, por lo que es necesario un estudio nacional que perfile y actualice periódicamente este indicador y realice una validación más amplia.











 texto en
texto en