Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Española de Cirugía Oral y Maxilofacial
versión On-line ISSN 2173-9161versión impresa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.27 no.2 Madrid mar./abr. 2005
Caso Clínico
Linfoma nasal de células T/NK
Nasal T/NK cell lymphoma
A. Torre Iturraspe1, S. Llorente Pendás2, J.C. de Vicente Rodríguez3, L.M. Junquera Gutiérrez2,
J.S. López-Arranz Arranz3
| Resumen: El linfoma nasal de células T/ natural killer (NK) (LNT/NK), tras haber recibido múltiples denominaciones, ha sido definido y caracterizado en el año 2001 por la Organización Mundial de la Salud (OMS), basándose en una clasificación previa de la Revised European-American Lymphoma Classification (REAL), de la manera en que se le conoce actualmente. Su incidencia en el mundo occidental es baja, mientras que en Asia supone el segundo grupo de linfomas más frecuente, tras los gastrointestinales. Se localiza preferentemente en las fosas nasales y senos maxilares, mostrando un curso clínico agresivo, definido por una destrucción de los tejidos circundantes. Su diagnóstico definitivo se realiza por medio de técnicas de hibridación in situ, llegando a la determinación de su inmunofenotipo. Se ha observado una frecuente asociación con el virus de Epstein-Barr (VEB). El pronóstico de esta enfermedad viene definido por el índice pronóstico internacional (IPI) y por el volumen alcanzado por el tumor. A pesar de ser radiosensible, su pronóstico es infausto, aconteciendo la muerte del paciente poco tiempo después del diagnóstico, generalmente como consecuencia de las complicaciones del tratamiento. Palabras clave: Linfoma nasal de células T/NK; Virus de Epstein-Barr; Hibridación in situ; Clasificación; Linfoma sinonasal. | Abstract: Nasal T-cell and Natural Killer cell lymphoma (NT/NKL), having been given many names, was defined and described in the year 2001 by the World Health Organization (WHO), on the basis of a previous classification by the Revised European-American Lymphoma Classification (REAL) as it is known today. Its incidence in the western world is low, while in Asia it represents the second most frequent group of lymphomas, followed by the gastrointestinal [lymphoma]. It is typically located in the nasal cavity and maxillary sinuses. It is associated with an aggressive clinical course, characterized by the destruction of surrounding tissue. The definitive diagnosis is made by means of in situ hybridization techniques, in order to determine the immunophenotype. Its association with the Epstein-Barr virus (EBV) has frequently been observed. The prognosis of this disease is determined by the International Prognosis Index (IPI) and by the size of the tumor. In spite of being responsive to irradiation therapy, its prognosis is gloomy, and the death of the patient occurs shortly after the diagnosis, generally as a result of treatment complications. Key words: Nasal T/NK cell lymphoma; Epstein-Barr virus; In situ hybridization; Classification; Sinonasal lymphoma. |
Recibido: 26-04-2004
Aceptado: 18-11-2004
1 Médico Residente.
2 Médico Adjunto.
3 Jefe de Sección.
Servicio de Cirugía Oral y Maxilofacial.
Hospital Universitario Central de Asturias. Oviedo, España.
Correspondencia:
Aintzane Torre Iturraspe.
Fuente del Prado, 11- 2ºA
33009. Oviedo. España
Teléfono: 655 70 75 63
e-mail: aintza_torre@eresmas.com
Introducción
El linfoma nasal de células T/NK (LNT/NK) fue descrito por Mc Bride en 1897, si bien hasta 1994 no se llegó a la identificación certera de la lesión ni a su clasificación como entidad independiente dentro del grupo de los linfomas no Hodgkin (LNH) con la denominación de LNT/NK. Durante este tiempo ha recibido múltiples denominaciones (Tablas 1 y 2).1-3 La introducción de la clasificación de la OMS,4,5 ha generado unas condiciones que han favorecido la cooperación internacional de oncólogos y patólogos. Esta clasificación se basa, principalmente, en el comportamiento inmunohistoquímico de las células tumorales, y realiza una división morfológica según las distintas líneas celulares. Dentro de cada categoría se agrupan las distintas entidades nosológicas según su presentación clínica ofreciendo así una clasificación de «enfermedades reales» (Tabla 3).3,6-11
Presentamos un caso de linfoma nasal de células T/NK, enfatizando en los problemas diagnósticos que habitualmente plantea esta rara entidad.
Caso clínico
Una mujer de 72 años, que acudió a consultar en Septiembre de 2000, por presentar una lesión ulcerada en la mucosa palatina de la región maxilar superior derecha, de una semana de evolución, asociada a molestias faciales homolaterales. Entre sus antecedentes destacaba una sinusitis maxilar derecha recidivante desde el año 1995, que había requerido legrado endoscópico en tres ocasiones, siendo las biopsias negativas para malignidad en todos los casos.
En la exploración se apreció la existencia de una lesión palatina ulceronecrotizante, de aproximadamente 2 x 2 cm. de diámetro, con bordes imprecisos, fondo necrótico y acompañada de una erosión ósea superficial (Fig. 1). El resto de la exploración oral, facial y cervical resultó normal. No existía afectación del estado general ni fiebre. En la exploración radiológica efectuada en ese momento ortopantomografía y tomografía computarizada (TC), solamente se apreció una opacificación del seno maxilar derecho, sin destrucción ósea, que dados los antecedentes de la paciente no resultó llamativo. En los análisis practicados, destacó una elevación significativa de la velocidad de sedimentación globular VSG, de 62 mm en la 1ª hora, así como una elevación de la proteína C reactiva (PCR). La biopsia realizada no aportó hallazgos específicos que permitieran clasificar la lesión, ni descartar malnignidad.
Con los resultados disponibles en aquel momento, se planteó un diagnóstico diferencial con todas las lesiones ulceroproliferativas de asiento en la extremidad cefálica.
A pesar de ello, y dado que la clínica de dolor iba en aumento, se instauró un tratamiento empírico con corticoides, lográndose una leve mejoría del cuadro, que no se mantuvo en el tiempo. A los dos meses se produjo un empeoramiento, tanto del dolor como de la ulceración, que se extendió a todo el hemimaxilar derecho, incluyendo el proceso alveolar y el fondo de vestíbulo homolateral.
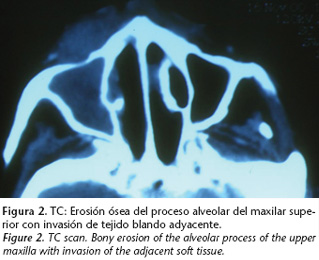
La TC realizada en ese momento reveló la existencia de adenopatías laterocervicales yugulares menores de 1 cm, ocupación del seno maxilar derecho, ahora con destrucción de la pared anterior y afectación de los tejidos blandos adyacentes (Fig. 2). Se realizó entonces, una nueva biopsia en el fondo del vestíbulo derecho, siendo el resultado de síndrome linfoproliferativo tipo linfoma no-Hodgkin extralinfático T/NK. No se llegó a confirmar la presencia de VEB mediante técnicas clásicas. Tres años después, en que tras realizar una revisión de las muestras anatomopatológicas disponibles del caso, se confirmó su presencia mediante la utilización de técnicas de hibridación in situ que no habían sido utilizadas en el momento del diagnóstico. En el rastreo sistémico realizado no se apreciaron otros focos de neoplasia en el organismo. Se instauró un tratamiento multidisciplinario con quimioterapia (QTP) de inducción y radioterapia (RTP). Se inició la QTP, a base de ciclofosfamida, doxorrubicina, vincristina y prednisona (CHOP), pero fue suspendida al segundo ciclo al constatarse una nula respuesta, con aumento de la masa tumoral. Se realizó entonces radioterapia radical, con técnica de campos opuestos laterales para llegar a dosis de 45- 50 Gy con Co60. La respuesta al tratamiento fue mala, produciéndose el fallecimiento de la paciente, en enero de 2001, como consecuencia de una sepsis por Pseudomona aeruginosa secundaria a la pancitopenia desencadenada por el tratamiento.
Discusión
La prevalencia del LNT/NK en Occidente es baja y representa el 1,5% de todos los LNH. Sin embargo, en Asia, supone el segundo grupo más frecuente de linfomas periféricos, inmediatamente después de los gastrointestinales, con una proporción del 2,6% al 7% del total. Estas cifras se observan también en algunos países americanos, como México, Guatemala y Perú reforzando, según algunos autores,12 las teorías existentes sobre un posible origen común de los habitantes de estos países y los asiáticos. En los EE.UU., se ha observado un incremento de su incidencia desde 1970, en relación con el SIDA.13 Las localizaciones más frecuentes del LNT/NK son las fosas nasales y los senos paranasales, de los cuales el maxilar es el más y el frontal el menos frecuentemente afectado.
En prácticamente todas las series revisadas se observa una mayor prevalencia en varones que en mujeres, si bien no se aprecia una uniformidad en las proporciones publicadas, debido probablemente al escaso tamaño de las muestras, oscilando desde 4/1 (hombre / mujer) en Europa o 3/1 en Asia,7,12,14,15 y hasta 1,7/1 en México.24 La edad de presentación más frecuentemente observada es la sexta década de la vida, con un rango extendido entre la primera y la octava décadas.
En Occidente existe un claro predominio de los linfomas de células B sobre los de células T en el territorio cérvico-facial, constituyendo aquellos entre un 55% y un 85% de los linfomas nasosinusales. El origen de esta diferencia geográfica no ha sido aclarado aún, si bien en algunas áreas geográficas como el sur de China, la incidencia relativamente elevada de los LNT/NK coincide con áreas endémicas de infección del VEB, el cual también se asocia con una elevada incidencia de carcinomas nasofaríngeos. En los pacientes aquejados de estos últimos, se observan elevaciones de IgA contra la cápside viral del VEB que no se observa en los pacientes con LNT/NK. En esta región también los linfomas B están asociados al VEB, lo que parece sugerir que existen factores relacionados con la localización geográfica, de mayor relevancia que la asociación a las distintas líneas celulares.
El diagnóstico de las lesiones destructivas centrofaciales se basa en la clínica y sobre todo en los hallazgos histopatológicos, si bien, dada su dificultad, es necesario un promedio de dos biopsias.16 La resonancia magnética (RM) y la TC son las técnicas de imagen más utilizadas para delimitar el estadiaje local. Las imágenes más frecuentemente observadas con estas técnicas son inespecíficas: ocupación de la cavidad nasal por grandes masas de tejido blando y erosión ósea de las paredes de los senos maxilares. La invasión del tejido blando centrofacial, orofaríngeo, infratemporal y orbitario indican un estadio avanzado (T3, T4). La erosión ósea implica un comportamiento más agresivo que el observado en el carcinoma escamoso naso-sinusal.17 La forma de presentación clínica más típica se caracteriza por obstrucción nasal y tumefacción facial (Tabla 4). Las lesiones tumorales son destructivas y pueden estar restringidas a cavidad nasal o afectar a estructuras adyacentes (nasofaringe, senos paranasales, cavidad oral). Habitualmente, la afectación de ganglios linfáticos y la sintomatología sistémica son poco frecuentes. En el caso que presentamos, existía una lesión destructiva mediofacial, pero sin afectación sistémica y con hallazgos en los estudios de imagen e histopatológicos inespecíficos. Existe, no obstante, un pequeño número de pacientes que pueden presentar manifestaciones en otras localizaciones distintas de la facial como la piel de otras partes del cuerpo, los pulmones y el tracto gastrointestinal. Este hecho sugiere, para algunos investigadores,18 que el LNT/NK pertenece en realidad a un grupo de linfomas con idéntico cuadro histológico y clínico, siendo sus diversas localizaciones (pulmonar, intestinal, dermatológica) manifestaciones diferentes de una misma enfermedad.
El diagnóstico definitivo de esta entidad es histopatológico. Es característico que las biopsias realizadas no presenten, en una valoración inicial, indicios de malignidad, lo que podría deberse al escaso tamaño de las muestras obtenidas en las biopsias. Pero el hecho es que la biopsia se positiviza cuando es repetida en fases avanzadas de la enfermedad, cuando esta presenta signos destructivos clínicos y radiológicos. En definitiva, los LNT/NK muestran un curso clínico agresivo y un modelo de progresión extralinfático. En los niños la afectación sistémica y respiratoria es más frecuente pudiendo presentar incluso úlceras faríngeas.1 La imagen histológica de los LNT/NK se caracteriza por presentar invasión vascular, necrosis y presencia de células inflamatorias. Si bien la invasión vascular es un hallazgo inconstante, la necrosis no lo es, y probablemente se debe a la propia angioinvasión o a la expresión de un factor de necrosis tumoral (TNF) inducido por el VEB.5 Este es un dato común a otras afecciones relacionadas con este virus como la mononucleosis infecciosa, la enfermedad linfoproliferativa post-transplante y la granulomatosis linfomatoide, si bien es éstas, el VEB se expresa en linfocitos B y no en células T. El diagnóstico se dificulta por la presencia constante de un infiltrado polimorfo de células inflamatorias benignas de cualquier tamaño, que incluyen neutrófilos, histiocitos y linfocitos atípicos de pequeño y mediano tamaño. En la Tabla 5 se recoge el inmunofenotipo más frecuente.
Para su determinación se utilizan técnicas de hibridación in situ, ya que las técnicas clásicamente empleadas con anticuerpos monoclonales, presentan un elevado porcentaje de falsos negativos (Fig. 3).4,11,19 Mediante esta técnica se demuestra la presencia del VEB, incluso en casos en los que la muestra tisular posea un escaso número de células neoplásicas. Este hecho sugiere su posible futura utilización como técnica de diagnóstico aproximativo inicial.20 Algunos investigadores,10, 23 han sugerido un origen monoclonal para las células NK, basándose en análisis inmunohistoquímicos, con expresión de marcadores de las células NK, como el CD 56 y, en un elevado número de casos, ausencia de las cadenas α/ß y γ/δ de los receptores de células T y del complejo CD3. Recordemos que las células NK son células linfoides que carecen de receptores de antígenos tradicionales como «receptores para células T» (TCR) o CD3, presentan marcadores CD16 y CD56 y una actividad citolítica innata que no precisa una sensibilización previa ni la presencia de moléculas de histocompatibilidad tipo I para que se lleva a cabo. Seki y cols.19 concluyen, tras estudiar muestras analizadas en el sur de Japón, que el LNT/NK está constituido por una mezcla heterogénea de distintos tipos celulares pero corresponde inmunofenotípica e inmunohistoquímicamente a líneas celulares NK y no de células T, lo que apoya el origen monocelular de esta entidad linfoproliferativa en las células NK.
Los LNT/NK son tumores radiosensibles en los que es posible lograr un control local de la enfermedad, aunque la recidiva es la norma en la mayoría de las series publicadas.21 Existe un consenso unánime sobre la utilización conjunta de radio (RTP) y quimioterapia (QTP) en estadios avanzados,15,22,23 si bien en fases iniciales, la quimioterapia no parece aportar una mejoría adicional de la supervivencia respecto a la utilización de la RTP aislada. Este comportamiento difiere del de los LNH «no centrofaciales» en los que la terapia conjunta aumenta la supervivencia.19 Algunos autores,16, 24 han observado en estudios prospectivos, que la QTP usada como tratamiento primario ocasiona un elevado riesgo de hemorragia y complicaciones sépticas, por lo que proponen su uso tan solo como tratamiento coadyuvante. El protocolo de QTP más utilizado es el CHOP. Las combinaciones de segunda (5-fluoruracilo, metotrexate, arabinósido de citosina, ciclofosfamida, vincristina y prednisona o F-MACHOP; ciclofosfamida, doxorrubicina, etopóxido, mecloretamina, vincristina, prednisona, procarbacina, metotrexate y leucovorina o PROMACE-MOPP) o tercera generación (metotrexate, doxorrubicina, ciclofosfamida, vincristina, prednisona y bleomicina o MACOP-B) no han demostrado ser mejores que las iniciales en cuanto a la tasas de remisiones completas y supervivencia. La dosis de RTP que proporciona un mejor control local es superior a 45- 50 Gy, independientemente del volumen tumoral.23 Otra posibilidad terapéutica es la utilización de un transplante de médula ósea asociado a QTP ablativa, lo que parece mejorar el control de la recidiva local tras el fracaso del tratamiento convencional con QTP. Los clásicos factores pronósticos son las características histológicas y el estadiaje en el momento del diagnóstico. Sin embargo, el factor predictivo de progresión más ampliamente aceptado hoy es el IPI,18,25 obtenido como resultado de un proyecto para el desarrollo de sistemas de clasificación para los LNH agresivos y que utiliza criterios clínicos que reflejan el potencial invasivo del tumor (Tabla 6). Existe un modelo simplificado para los menores de 60 años puesto que la edad es un factor pronóstico. El sexo, sin embargo, parece no estar asociado con la supervivencia. El volumen tumoral (que, sin embargo, no se contempla en el IPI) es considerado por algunos autores,23 como factor pronóstico independiente para el linfoma agresivo localizado.
La mayoría de los pacientes mueren pocos meses después del diagnóstico como consecuencia de las complicaciones del tratamiento (RTP y QTP), habitualmente por cuadros sépticos debido a la inmunosupresión.26, 27
Bibliografía
1. Vidal RW, Devaney K, Ferlito A, Rinaldo A, Carbone A. Sinonasal malignant lymphomas: a distinct clinicopathological category. Ann Otol Rhinol Laryngol 1999;108:411-9. [ Links ]
2. Borges A, Fink J, Villablanca P, Eversole R, Lufkin R. Midline destructive lesions of the sinonasal tract: simplified terminology based on histopathologic criteria. Am J Neuroradiol 2000;21:331-6. [ Links ]
3. Jakic-Razumovic J Aurer I. The World Health Organization classification of lymphomas. Croat Med J 2002;43:527-34. [ Links ]
4. Arrowsmith ER, Macon WR, Kinney MC, Stein RS, Goodman SA, Morgan DS y cols. Peripheral T-cell lymphomas: clinical features and prognostic factors of 92 cases defined by the revised European American lymphoma classification. Leuk Lymphoma 2003;44:241-9. [ Links ]
5. Vidal RW, Devaney K, Ferlito A, Rinaldo A, Carbone A. Sinonasal malignant lymphomas: a distinct clinicopathological category. Ann Otol Rhinol Laryngol 1999; 108:411-9. [ Links ]
6. Jaffe S E, Chan JKC, Ih-Jen Su, Frizzera G, Mori S, Feller AC y cols. Report of the workshop on nasal and related extranodal angiocentric T/Natural Killer ell lymphomas. Am J Surg Pathol 1996;20:103-11. [ Links ]
7. Hatta C, Ogasawara H, Okita J, Kubota A, Ishida M, Sakagami M. Non-Hodgkins malignant lymphoma of the sinonasal tract-treatment outcome for 53 patients according to REAL classification. Auris Nasus Larynx 2001;28:55-60. [ Links ]
8. Harris NL, Jaffe ES, Diebold J, Flandrin G, Muller-Hermelink H, Vardiman J. Lymphoma classification-from controversy to consensus: the R.E.A.L. and WHO Classification of lymphoid neoplasms. Ann Oncol 2000;11:3-10. [ Links ]
9. Harris NL, Jaffe ES, Diebold J, Flandrin G, Muller-Hermelink HK, Vardiman J, y cols. The World Health Organization classification of neoplasms of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee meeting- Airlie House, Virginia, November, 1997. Hematol J 2000;1:53-66. [ Links ]
10. Noorduyn LA, Torenbeek R, van der Valk P, Snow GB, Balm AJH, Ossenkoppele GJ y cols. Sinonasal non-Hodgkin´s lymphoma and Wegener´s granulomatosis: a clinicopathological study. Vircows Archiv A Pathol Ana 1991;418:235-40. [ Links ]
11. Jaffe ES. Classification of natural killer (NK) cell and NK-Like T-cell malignancies. Blood 1996;87:1207-10. [ Links ]
12. Gaal K, Sun NC, Hernandez AM, Arber DA. Sinonasal NK/T-cell lymphomas in the United States. Am J Surg Patho 2000;24:1511-17. [ Links ]
13. Hanna E, Wanamaker J, Adelstein D, Tubbs R, Lavertu P. Extranodal lymphomas of the head and neck. A 20-year experience. Arch Otolaryngol Head Neck Surg 1997;123:1318-23. [ Links ]
14. Cleary KR, Batsakis JG. Sinonasal Lymphomas. Ann Otol Rhinol Laryngol 1994; 103:911-14. [ Links ]
15. Cuadra-Garcia I, Proulx GM, Wu CL, Wang CC, Pilch BZ, Harris NL, y cols. Sinonasal lymphoma: a clinicopathologic analysis of 58 cases from the Massachusetts General Hospital. Am J Surg Pathol 1999;23:1356-69. [ Links ]
16. Sobrevilla-Calvo P, Meneses A, Alfaro P, Bares JP, Amador J, Reynoso EE. Radiotherapy compared to chemoterapy as initial treatment of angiocentric centrofacial lymphoma (polymorphic reticulosis). Acta Oncológica 1993;32:69-72. [ Links ]
17. Ooi GC, Chim CS, Liang R, Tsang KWT, Kwong YL. Nasal T-cell/Natural Killer cell lymphoma: CT and MR imaging features of a new clinicopathologic entity. Am J Radiol 2000;174:1141-5. [ Links ]
18. Yang Y, Gau JP, Chang SM, Lin TH, Ho KC, Young JH. Malignant lymphomas of sinonasal region, including cases of polymorphic reticulosis: a retrospective clinicopathologic analysis of 34 cases. Cin Med J (Taipei) 1997;60:236-44. [ Links ]
19. Seki D, Ueno K, Kurono Y, Eizuru Y. Clinicopathological features of Epstein-Barr virus associated nasal T/NK cell lymphomas in southern Japan. Auris Nasus Larynx 2001;28:61-70. [ Links ]
20. Jaffe S E. Nasal and nasal-type T/NK cell lymphoma: a unique form of lymphoma associated with the Epstein-Barr virus. Histopathology 1995;27:581-83. [ Links ]
21. Van Gorp J, de Bruin PC, Sie-Go DMDS, van Heerde P, Ossenkoppele GJ, Rademakers LHP, y cols. Nasal T-cell lymphoma: a clinicopathological and inmunophenotypic analysis of 13 cases. Histopathology 1995;27:139-48. [ Links ]
22. Donato V, Iacari V, Zurlo A, Nappa M, Martelli M, Banelli E, y cols. Radiation therapy and chemotherapy in the treatment of head and neck extranodal non-Hodgkins lymphoma in early stage with a high grade of malignancy. Anticancer Research 1998;18:547-54. [ Links ]
23. Shikama N, Ikeda H, Nakamura S, Oguchi M, Isobe K, Hirota S, y cols. Localized aggressive non-Hodgkins lymphoma of the nasal cavity: a survey by the Japan Lymphoma Radiation Therapy Group. Int J Radiat Oncol Biol Phys 2001;51:1228-33. [ Links ]
24. Meneses García A, Súchil Bernal L, de la Garza Slazar J, Gómez González E. Linfomas angiocéntricos centrofaciales de células T/NK. Aspectos histopatológicos y algunas consideraciones clínicas de 30 pacientes del Instituto Nacional de Cancerología, México. Cir Ciruj 2002;70: 410-16. [ Links ]
25. The International Non-Hodgkin´s Lymphoma Prognostic Factors Project. A predictive model for agressive Non-Hodgkin´s lymphoma. N Engl J Med 1993; 329:987-94. [ Links ]
26. Proulx GM, Cuadra-Garcia I, Ferry J, Harris NL, Greco WR, Kaya U, y cols. Lymphoma of the nasal cavity and paranasal sinuses. Treatment and outcome of early-stage disease. Am J Clin Oncol 2003;26:6-11. [ Links ]
27. Prellat J, Sweetenham J, Pickering RM, Brown L, Wilkins B. A singlecentre study of treatment outcomes and survival in 120 patients with peripheral T-cell non-Hodgkin´s lymphoma. Ann Hematol 2002;81:267- 72. [ Links ]











 texto en
texto en