My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.37 n.2 Toledo Mar./Apr. 2013
https://dx.doi.org/10.7399/FH.2013.37.2.87
ORIGINALES
Estudio de utilización, efectividad y toxicidad asociada al tratamiento con sorafenib
Study on the usage, effectiveness, and toxicity associated to treatment with sorafenib
C. Camañas-Troyano, Ma Moriel-Sánchez, R. Ma Catalá-Pizarro
Servicio de Farmacia, Hospital Universitario de Móstoles, Móstoles, Madrid, España.
Dirección para correspondencia
RESUMEN
Objetivo: Conocer la utilización, efectividad y toxicidad asociada al tratamiento con sorafenib en los pacientes oncológicos de un hospital general.
Métodos: Estudio observacional, retrospectivo y longitudinal de utilización, efectividad y toxicidad asociada a sorafenib. Se incluyeron los pacientes oncológicos de un hospital general universitario, que iniciaron tratamiento con sorafenib entre Enero 2007 y Diciembre 2010, ampliando el periodo de seguimiento hasta junio de 2012.
Resultados: Iniciaron tratamiento 31 pacientes (edad media 61,6 años, 67,7% varones). En todos se utilizó un régimen de monoterapia, empleándose dosis fijas de 400 mg cada 12 horas en el 83,87%, mientras que 5 pacientes precisaron ajuste de dosis por mala tolerancia gastrointestinal y toxicidad cutánea. Al finalizar el estudio, 3 pacientes continuaban vivos y mantuvieron el tratamiento, 27 pacientes lo suspendieron y en 1 paciente se perdió el seguimiento. Las patologías tratadas con sorafenib fueron hepatocarcinoma (38,7%), cáncer renal avanzado (35,5%), melanoma (9,7%), cáncer de tiroides (12,9%) y tumor del estroma gastrointestinal (3,2%). La mediana de supervivencia global fue de 524 días para hepatocarcinoma y de 217 días para cáncer renal. Se observaron reacciones adversas a sorafenib en el 41,9% de los pacientes.
Conclusiones: Este estudio revela que sorafenib es eficaz en los pacientes con hepatocarcinoma y cáncer renal, dependiendo fundamentalmente de la situación clínica inicial de los pacientes. Sorafenib es responsable de la aparición de efectos secundarios, fundamentalmente de tipo gastrointestinal y cutáneo, que requirieron ajuste de dosis y suspensión del tratamiento en algunos casos.
Palabras clave: Sorafenib; utilización de fármacos; eficacia; toxicidad farmacológica.
ABSTRACT
Objective: To know the usage, effectiveness, and toxicity associated to Sorafenib treatment in cancer patients at a general hospital.
Methods: Observational, retrospective, and longitudinal study on the usage, effectiveness and toxicity associated to Sorafenib. Cancer patients at a general university hospital initiating treatment with Sorafenib were included between January of 2007 and December of 2010, with an extended follow-up period up to June of 2012.
Results: 31 patients started the treatment (mean age 61.6 years; 67.7% males). 83.87% received a monotherapy regimen with fixed doses of 400 mg b.i.d., whereas 5 patients required dose adjustment due to poor gastrointestinal tolerance and skin toxicity. At the end of the study, 3 patients were still alive and kept on receiving the treatment, 27 withdrew from the therapy, and 1 patient was lost to follow-up. The pathologies treated with Sorafenib were hepatocarcinoma (38.7%), advanced renal cancer (35.5%), melanoma (9.7%), thyroid cancer (12.9%), and gastrointestinal stromal tumor (3.2%). The median overall survival was 524 days for hepatocarcinoma and 217 days for renal cancer. Adverse reactions with Sorafenib were observed in 41.9% of the patients.
Conclusions: This study reveals that Sorafenib is effective in patients with hepatocarcinoma and renal cancer, essentially depending on the baseline clinical status of the patients. Sorafenib may be associated with the occurrence of adverse events, mainly gastrointestinal and cutaneous, requiring dose adjustment and treatment withdrawal in some cases.
Key words: Sorafenib; Drug utilization; Effectiveness; Drug toxicity.
Introducción
El progreso en la Oncología en los últimos años se debe al avance en el conocimiento de la biología molecular del cáncer1. Una de las vías de señalización más estudiadas es la de Raf/MEK (mitogen extracellular kinase) /ERK (extracellular signal-regulated protein kinase), sobreactivada en un 30% de los cánceres humanos y cuyos componentes representan excelentes dianas terapéuticas para el desarrollo de nuevos fármacos2-4.
La unión de factores de crecimiento como EGF, VEGF o PDGF-β a sus receptores de membrana promueve la activación de los oncogenes Ras, que estimulan a las proteínas Raf y desencadenan procesos celulares que pueden inducir el fenotipo maligno y promover la angiogénesis, siendo responsables de la aparición de tumores como el cáncer renal, el carcinoma hepatocelular, el melanoma o el carcinoma papilar de tiroides.
Sorafenib inhibe la actividad tirosina quinasa de varias isoformas de Raf y de otras tirosina quinasas5 y está aprobado para el tratamiento del carcinoma hepatocelular (HCC) y del carcinoma avanzado de células renales (CCR) en los que ha fracasado la terapia previa con interferón-α o interleukina-2 (IL-2) o que se consideran inapropiados para dicha terapia6, aunque también ha sido utilizado en el angiosarcoma, tumores del estroma gastrointestinal (GIST) o cáncer de tiroides7.
Los hepatocarcinomas son tumores altamente vascularizados en los que se ha observado un papel destacado de la vía VEGF en su desarrollo y progresión8,9. La eficacia de sorafenib en HCC se demostró en el ensayo clínico fase III SHARP10, que incluyó a 602 pacientes con HCC avanzado que no habían recibido terapia previa, demostrando una mediana de supervivencia global (SG) superior de sorafenib frente a placebo (10,7 meses frente a 7,9 meses; p = 0,001).
Asimismo Cheng y colaboradores demostraron que en 271 pacientes asiáticos con HCC avanzado que no habían recibido terapia anteriormente, la SG obtenida fue de 6,5 meses con sorafenib frente a 4,2 meses con placebo (p = 0,014)11.
Según la Guía de Práctica Clínica ESMO para el HCC12, las opciones terapéuticas están determinadas por la extensión de la enfermedad, el patrón de crecimiento del tumor, la función hepática de reserva y el estado basal del paciente. En el caso de tumores resecables, en pacientes sin cirrosis hepática, la opción terapéutica óptima es la resección quirúrgica sin necesidad de tratamiento adyuvante; mientras que en pacientes cirróticos, la resección quirúrgica y el trasplante hepático son opciones a considerar según la función hepática de reserva, aunque sólo un 5% de los HCC son susceptibles de trasplante. En el caso de tumores no resecables, se considerará la hepatectomía total con trasplante hepático y/o técnicas de ablación local entre las que se incluyen la radiofrecuencia (RFA), la quimioembolización transarterial (TACE) y la inyección percutánea de etanol (PEI). La quimioterapia intravenosa no ha demostrado eficacia y sólo sorafenib se considera el tratamiento de elección en el HCC avanzado13.
Los ensayos citados anteriormente también evaluaron la seguridad de sorafenib. En el ensayo SHARP se observó una incidencia global de efectos adversos relacionados con sorafenib del 80% frente al 52% del grupo placebo, fundamentalmente síndrome constitucional (31%), reacciones gastrointestinales (69%) y cutáneas (72%)10, que se clasificaron en función de la gravedad según los criterios CTCAE (Common Terminology Criteria for Adverse Events) del National Cancer Institute (NCI)14. Aunque la mayoría de las reacciones adversas (RAM) fueron de carácter leve, otras alcanzaron mayor gravedad (grado 3) como por ejemplo diarrea (8%), síndrome mano-pie (8%), hipertensión (2%) y dolor abdominal (2%). En cuanto a las alteraciones en las pruebas de laboratorio cabe destacar la presencia de hipofosfatemia de grado 3 (11%) y trombocitopenia de grado 3-4 (4%)10.
La reducción de dosis como consecuencia de la aparición de RAM fue del 26% con sorafenib frente al 7% con placebo, siendo las más comunes diarrea (8%), síndrome mano-pie (5%) y rash cutáneo o descamación (3%). La suspensión del tratamiento como consecuencia de RAM fue necesaria en el 11% de los pacientes que recibieron sorafenib frente al 5% del grupo placebo, principalmente por eventos gastrointestinales (6%), fatiga (5%) y disfunción hepática (5%)10.
En el ensayo que realizó Cheng, las RAM de grados 3 y 4 más frecuentes fueron síndrome mano-pie (10,7%), diarrea (6%) y fatiga (3,4%), que dieron lugar a reducción de dosis por síndrome mano-pie en el 11,4% y por diarrea en el 7,4%. No se documentó la interrupción del tratamiento con sorafenib como consecuencia de estos efectos adversos11.
En el estudio realizado por Wörns, se suspendió el tratamiento en el 61,8% de los pacientes por diversas causas: progresión tumoral (32,3%), éxitus (17,6%), efectos adversos (8,8%) o incumplimiento terapéutico (2,9%)15.
En el cáncer renal avanzado la señalización alterada a través del receptor del EGF origina un incremento en la síntesis de VEGF y PDGF-β y promueve la angiogénesis tumoral16,17.
La eficacia de sorafenib en el CCR avanzado se demostró en el ensayo fase III TARGET, que comparó sorafenib 400 mg cada 12 horas con placebo en 451 pacientes con CCR resistente a terapia estándar, demostrando mayor SG de sorafenib (19,3 meses frente a 15,9 meses). Como tratamiento previo en el grupo de sorafenib, se documentó nefrectomía en el 94%, IL-2 en el 42%, IFN-α en el 68% y la combinación de IL-2 e IFN-α en el 27% de los pacientes18.
Según las guías de práctica clínica publicadas19,20, el tratamiento de elección en el CCR localizado es la nefrectomía total o parcial, mientras que en la enfermedad avanzada, además de la nefrectomía, se emplean en primera línea sunitinib, temsirolimus, pazopanib o una combinación de bevacizumab e IFN-α, y en segunda línea, se recomienda sorafenib o pazopanib en pacientes no respondedores a citoquinas, o bien everolimus en pacientes refractarios a inhibidores de tirosina quinasa.
La seguridad de sorafenib se evaluó en el ensayo fase II realizado por Ratain, destacando como RAM más frecuentes fatiga (73%), rash cutáneo o descamación (66%), síndrome mano-pie (62%) y diarrea (58%)21.
En el ensayo TARGET también se demostró la seguridad de sorafenib; las RAM más comunes fueron diarrea (43%), rash (40%), fatiga (37%), reacciones cutáneas mano-pie (30%) y náuseas (23%). La toxicidad hizo necesaria la reducción de dosis (13%) o bien, dio lugar interrupción del tratamiento (10%)18. Otros estudios también describen alteraciones en la función tiroidea, como hipotiroidismo (18%) e hipertiroidismo (3%)22 .
Para observar la influencia de la edad, Eisen estratificó la población de estudio en dos grupos (<70 años y > 70años) y demostró que los efectos de sorafenib en cuanto a eficacia y frecuencia o gravedad de RAM eran similares con independencia de la edad23.
Por último, debido a que se trata de pacientes pluripatológicos con una terapia compleja, que son seguidos por diferentes especialistas, el tratamiento debe enfocarse desde un punto de vista multidisciplinar9. Esto es una oportunidad para el farmacéutico de hospital que, formando parte del equipo multidisciplinar, puede hacer recomendaciones al paciente, alertar al oncólogo de estos efectos, implicarse en el seguimiento de la terapia y mejorar la calidad de vida de los pacientes.
El objetivo general del presente estudio es conocer la utilización, efectividad y toxicidad asociada al tratamiento con sorafenib en los pacientes oncológicos de un hospital general.
Como objetivos específicos se definen los siguientes:
• Analizar las características generales de los pacientes sometidos a tratamiento con sorafenib, desde un punto de vista demográfico y clínico.
• Evaluar la efectividad del tratamiento en función del diagnóstico.
• Analizar la toxicidad asociada al tratamiento y clasificarla en función de su gravedad.
• Analizar la frecuencia y las causas de suspensión de tratamiento y de ajuste de dosis.
Métodos
Se diseñó un estudio observacional de tipo retrospectivo y longitudinal de utilización, efectividad y toxicidad asociada al uso de sorafenib. Se incluyeron todos los pacientes valorados en la consulta de Oncología de un Hospital General Universitario, que iniciaron tratamiento con sorafenib en el periodo comprendido entre Enero de 2007 y Diciembre de 2010. El periodo de seguimiento de seguimiento de los pacientes se prolongó hasta junio de 2012.
Se recopilaron, para cada paciente, las siguientes variables de estudio:
• Variables demográficas y clínicas: sexo, edad, antecedentes personales, diagnóstico, escala ECOG, metástasis, tratamientos oncológicos previos.
• Variables de tratamiento: pauta posológica de sorafenib, duración y causa de suspensión de tratamiento o ajuste de dosis.
• Variables de efectividad: supervivencia global.
• Variables de toxicidad: RAM observadas durante el periodo de estudio y determinaciones analíticas: niveles de albúmina, fosfato, linfocitos, plaquetas y electrolitos (sodio, potasio y calcio) antes y durante el tratamiento (al inicio y en los meses 1, 3, 6 y 12).
La gravedad de la toxicidad se evaluó siguiendo los criterios CTCAE del NCI14.
Los datos se obtuvieron del módulo de Pacientes Externos del programa informático Farmatools® del Servicio de Farmacia, de la aplicación informática Weblab® del Servicio de Análisis Clínicos y de la revisión de informes e historias clínicas de los pacientes seleccionados para el estudio. Los datos analíticos se recopilaron antes y durante el tratamiento con sorafenib.
A través del procesador de datos estadísticos SPSS 18.0 para Windows se realizó un análisis estadístico descriptivo, utilizando medias o medianas (con desviación estándar y rango) para las variables cuantitativas y porcentajes para las cualitativas. Los datos obtenidos de las diferentes variables de estudio definidas fueron sometidos a la prueba de normalidad Shapiro-Wilk, dado el tamaño de la muestra. También se realizó un análisis estadístico bivariable con la técnica Chi-cuadrado para determinar la asociación entre variables cualitativas y se emplearon las pruebas t de Student y Wilcoxon para analizar las variables analíticas antes y durante el tratamiento con sorafenib en función del grado de normalidad de las variables. Para la determinación de la supervivencia global se estimaron las respectivas curvas de supervivencia de Kaplan-Meier.
Resultados
Durante el periodo comprendido entre Enero de 2007 y Diciembre de 2010 iniciaron tratamiento con sorafenib 31 pacientes. En la tabla 1 se describen las características generales de la muestra estudiada. El 77,4% de los pacientes presentaba comorbilidades, principalmente hipertensión arterial (41,9%), diabetes mellitus tipo 2 (19,3%), hiperplasia benigna de próstata (16,1%) e insuficiencia cardiaca congestiva (12,9%) y tomaba un promedio de 6,6 fármacos diarios. El tratamiento farmacológico completo de los pacientes se muestra en la figura 1, con un elevado consumo de analgésicos, neurolépticos/psicótropos y protectores gástricos.
En la tabla 2 se detallan las características clínicas basales de los pacientes en función del diagnóstico. Destaca la utilización de sorafenib en el 74,2% para las dos indicaciones recogidas en ficha técnica (HCC en el 38,7% y CCR en el 35,5%). El tiempo transcurrido desde el diagnóstico hasta el comienzo del tratamiento con sorafenib fue de 5,17 años.
El 60,9% de los pacientes recibió otros tratamientos antineoplásicos previos, siendo sorafenib la primera opción terapéutica para 9 de los 12 pacientes diagnosticados de HCC, dos pacientes recibieron TACE y otro fue sometido a hepatectomía parcial como terapia previa. En cuanto al CCR, un paciente fue tratado con IL-2 y bevacizumab y 10 pacientes recibieron sunitinib como terapia previa a sorafenib (2 de ellos recibieron también radioterapia local, uno IL-2 y otro IL-2 e IFN).
Se utilizó un régimen de monoterapia en la totalidad de los casos, empleándose dosis fijas de 400 mg dos veces al día en el 83,87% de los pacientes, mientras que los 5 pacientes restantes fueron tratados con 400 mg al día o 200 mg dos veces al día. El motivo de ajuste de dosis fue la mala tolerancia gastrointestinal en tres pacientes y toxicidad cutánea en dos de ellos (grado 2-3).
Se estudió la presencia de enfermedad hepática o hábitos tóxicos en los 12 pacientes afectados de HCC, encontrándose que el 58,3% presentaban además VHC/VHB o cirrosis (p = 0,026) y el 33,3% tenía hábitos tóxicos, mientras que el 16,7% eran ex fumadores o ex bebedores. El 16,7% de los pacientes con HCC presentaban metástasis.
También se analizó la relación del sexo y el tipo de cáncer, resultando que HCC, CCR y GIST son más frecuentes en hombres, mientras que el melanoma y el cáncer de tiroides se diagnosticaron más en mujeres (p = 0,003).
En la tabla 3 se describen las características del tratamiento con sorafenib en función de las dos indicaciones recogidas en ficha técnica. La mediana de duración de tratamiento fue de 109 días (rango: 14-1350). Al finalizar el periodo de seguimiento, 3 pacientes continuaban vivos y mantenían el tratamiento, 27 pacientes lo suspendieron (29,6% por RAM, 29,6% por progresión tumoral y el 40,7% por éxitus) y en 1 paciente se perdió el seguimiento. De los que sobrevivieron, 2 presentaban HCC y se trataron durante 1.339 y 1.350 días, respectivamente; mientras que el que presentaba carcinoma de tiroides tuvo un tiempo de exposición al fármaco de estudio de 1.006 días.
Los datos de SG para el análisis de efectividad del tratamiento en función de las indicaciones recogidas en ficha técnica se encuentran recogidos en la tabla 4. En la figura 2 se muestran las curvas de supervivencia global para HCC y CCR, respectivamente.
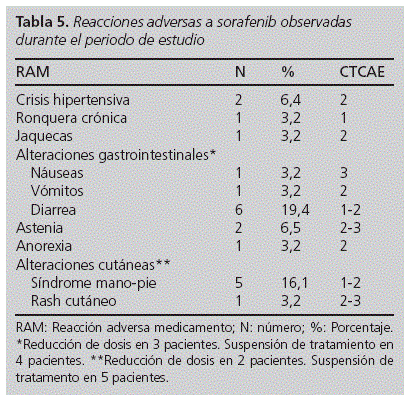
Durante la revisión de las historias clínicas de los pacientes, se pudieron recoger diferentes variables de toxicidad asociadas al tratamiento. Se detectaron RAM en el 41,9% de los pacientes. En la tabla 5 se detallan las más frecuentas así como el grado de toxicidad. Una vez estratificada la población de estudio en dos grupos etáreos se observó que el 74,2% de los pacientes tenía menos de 70 años y de ellos, el 30,4% presentaba RAM, a diferencia del 75% de pacientes mayores de 70 años con RAM (p = 0,028).
Con respecto a los datos obtenidos sobre la posible toxicidad analítica del fármaco, se obtuvieron descensos de los niveles de albúmina (p = 0,916) y fosfato (p = 0,08) pero dentro de los límites de normalidad (albúmina 3,55 g/dL, fosfato 2,6-4,8 mg/dL). Los niveles de linfocitos disminuyeron (p = 0,91) durante el primer mes de tratamiento y posteriormente alcanzaron un valor incluso superior al obtenido antes de iniciar el tratamiento (p = 0,60), manteniéndose dentro del rango de normalidad (1-4 x 109/L). El recuento plaquetario siguió un camino paralelo al anterior y las cifras se incrementaron durante todo el periodo de estudio (p = 0,50) a excepción de un descenso correspondiente al sexto mes de tratamiento (p = 0,41), con valores dentro de los márgenes de normalidad establecidos (150-450 x 109/L). Las determinaciones de electrolitos (sodio, potasio y calcio) no sufrieron apenas alteraciones.
Discusión
El HCC es la sexta neoplasia más frecuente a nivel mundial y la tercera en cuanto a muertes relacionadas con el cáncer10,13. Suele diagnosticarse entre los 50-60 años, con mayor frecuencia en hombres y siendo la causa más habitual la infección crónica por el VHB, si bien en los países occidentales predomina la infección por el virus de la hepatitis VHC y el consumo de alcohol10. Los datos obtenidos en nuestro estudio están en consonancia con los descritos en la bibliografía12,13 en relación a la edad media de diagnóstico, a la asociación con el daño hepático crónico (VHB/VHC y hábitos tóxicos) (p < 0,05) y a la incidencia superior en varones, que resultó estadísticamente significativa (p = 0,003).
Según Jelic12 la opción curativa quirúrgica está limitada a pacientes muy seleccionados, ya que sólo uno fue sometido a hepatectomía parcial, al igual que la utilización de TACE, que tan sólo se empleó en 2 pacientes. En cambio, el tratamiento farmacológico de elección en HCC avanzado fue sorafenib en el 75% de los pacientes.
El CCR avanzado representa el 2% de las neoplasias diagnosticadas en adultos, siendo más frecuente en hombres con una incidencia superior entre los 50-70 años18. Estos datos coinciden con los obtenidos en nuestro estudio, en el que la frecuencia de aparición de CCR es superior en hombres y la media de edad se sitúa en los 66,6 años. Un aspecto a tener en cuenta es que, en nuestra población de estudio, todos los pacientes con CCR presentaban el subtipo de células claras. En consonancia con la guía ESMO20, la terapia inicial en el 90,9% de los pacientes incluyó el fármaco sunitinib y en el 9,1% con IL-2, mientras que sorafenib fue prescrito como segunda opción terapéutica.
Después de estratificar la población de estudio en dos grupos etáreos, resultó que los pacientes mayores de 70 años toleraban peor el tratamiento (p = 0,028) a diferencia del estudio de Eisen et al23, que concluye que no hay diferencia en la frecuencia y gravedad de RAM en función de la edad, hecho que el autor relaciona con las medidas profilácticas y de mantenimiento encaminadas a controlar los síntomas gastrointestinales y dermatológicos.
Casi el 80% de la población de estudio tomaba otros fármacos para las patologías concomitantes, lo que corrobora el enfoque multidisciplinar del tratamiento9. Destaca el elevado consumo de protectores gástricos tipo inhibidores de la bomba de protones como el omeprazol, del que cabe mencionar la posible interacción farmacocinética existente con sorafenib que fue objeto de intervenciones desde el Servicio de Farmacia encaminadas a la prescripción de otro tipo de antiulcerosos.
Con respecto a la efectividad del tratamiento, la mediana de SG obtenida en los pacientes diagnosticados de HCC fue de 524 días, cifra superior a los 321 días del estudio SHARP10 y a los 195 días obtenidos por Cheng et al11. Esto podría relacionarse con el hecho de que sólo el 16,7% de nuestros pacientes presentaba diseminación extrahepática al inicio del tratamiento, un factor pronóstico de mortalidad del carcinoma hepatocelular11, frente al 53% de los pacientes del ensayo SHARP y el 68,7% de Cheng et al, que fueron tratados con Sorafenib. Esto sugiere que los pacientes de nuestro estudio se encontraban en un estadio menos avanzado de la enfermedad.
La mediana de supervivencia global alcanzada para los pacientes diagnosticados de CCR (217 días) contrasta con la del estudio TARGET (579 días), dato que se puede explicar por las diferencias en la calidad de vida de los pacientes al inicio del tratamiento, ya que en nuestro estudio el 45,5% de los pacientes presentaba un ECOG 2-3, que podría empeorar la tolerancia al tratamiento, frente al 2% del estudio TARGET18.
La pauta posológica empleada con el fármaco de estudio se ajustó a la ficha técnica en la mayoría de los casos, estableciéndose reducciones de dosis por mala tolerancia y/o toxicidad cutánea moderada-grave (grado 2-3) en el 16,13% de pacientes. Este dato resultó similar al publicado por Escudier en el ensayo TARGET (13%) pero inferior al obtenido en el ensayo SHARP (26%). La gravedad de las reacciones adversas que fueron motivo de reducción de dosis está en consonancia con la publicada en la bibliografía10,11,18.
Durante el periodo de estudio se suspendió el tratamiento al 87,09% de los pacientes; la causa de interrupción fue la presencia de RAM en el 20% de los pacientes con HCC, superior al 8,8% publicado por Wörns15 o al 11% obtenido por Llovet10, mientras que en CCR la suspensión por RAM fue del 36,3%, también superior al 10% recogido en la bibliografía18,19, probablemente relacionado con el ECOG inicial del paciente. En cuanto a la suspensión del tratamiento por progresión tumoral, se obtuvo un porcentaje similar para HCC (40%) y CCR (36,3%); este dato estaba en consonancia con el publicadopara HCC (32,3%)10 sin poder establecer comparación para el caso de CCR debido a la ausencia de datos en la bibliografía.
Durante el periodo de estudio no se notificó ningún caso de suspensión de tratamiento por incumplimiento terapéutico a diferencia de lo recogido por Wórns15, lo que demuestra el elevado grado de adherencia de nuestros pacientes.
Los porcentajes de reacciones adversas obtenidos en nuestra población, tales como alteraciones cutáneas (19,4%) incluidos síndrome mano-pie (16,1%) o rash (3,2%) o alteraciones de tipo gastrointestinal (25,8%) como diarrea (19,4%), náuseas (3,2%) o vómitos (3,2%) resultaron inferiores a los publicados10,11,18.
La presencia de alteraciones gastrointestinales fue el efecto adverso más común encontrado en nuestro estudio, coincidiendo con los resultados obtenidos por Llovet10 y Escudier18 y a diferencia de lo publicado por Ratain et al21, donde la aparición de fatiga (73%) supuso el efecto adverso más frecuente. En contraste con lo recogido en la bibliografía10,18, en nuestra población no se notificó ningún caso de dolor abdominal.
La gravedad de las reacciones gastrointestinales o cutáneas, incluyendo síndrome mano-pie (grado1-2), coincidió con la de referencia10,21, aunque otras como la aparición de rash, náuseas o astenia alcanzaron un grado 3.
En general, la incidencia global de efectos adversos que se obtuvo en el estudio (41,9%) resultó inferior al 80% publicado en la bibliografía10. Las diferencias en cuanto al porcentaje de aparición de RAM podrían estar relacionadas con el diseño del estudio, ya que para evaluar la toxicidad sería más recomendable un diseño prospectivo, así como un registro de efectos adversos más exhaustivo y detallado en la historia clínica. Además, el seguimiento de estos pacientes fue complejo al tratarse de pacientes ambulantes, por lo que el establecimiento de un programa de Farmacovigilancia desde el Servicio de Farmacia podría paliar esta limitación.
Después de revisar las analíticas realizadas se puede concluir que, en nuestra población de estudio no hubo variaciones estadísticamente significativas ni clínicamente relevantes en ninguno de los parámetros de laboratorio estudiados a pesar de lo encontrado en la bibliografía referente a hipofosfatemia grado 3, trombocitopenia grado 4, hipoalbuminemia o linfopenia.
En conclusión, nuestro estudio revela que sorafenib es eficaz en los pacientes con hepatocarcinoma y cáncer renal, siendo determinante la situación clínica inicial en los resultados obtenidos. Sorafenib es responsable de la aparición de efectos secundarios, fundamentalmente de tipo gastrointestinal y cutáneo, que requirieron ajuste de dosis y suspensión del tratamiento en algunos casos.
Bibliografía
1. Cortes-Funes H, Colomer R, editores. Tratado de Oncología. Tomo I. Ediciones Permanyer. Barcelona; 2009. [ Links ]
2. Gollob JA, Wilhelm S, Carter C, Kelley SL. Role of Raf Kinase in cancer: therapeutic potential of targeting the Raf/MEK/ERK signal transduction pathway. Semin Oncol. 2006;33:392-406. [ Links ]
3. Faivre S, Djelloul S, Raymond E. New paradigms in anticancer therapy: targeting multiple signaling pathways with kinase inhibitors. Semin Oncol. 2006;33:407-20. [ Links ]
4. Sridhar S, Hedley D, Siu L. Raf kinase as a target for anticancer therapeutics. Mol Cancer Ther. 2005;4(4):677-85. [ Links ]
5. Wilhelm S, Adnane L, Newell P, Villanueva A, Llovet JM, Lynch M. Preclinical overview of sorafenib, a multikinase inhibitor that targets both Raf and VEGF and PDGF receptor tyrosine kinase signaling. Mol Cancer Ther. 2008;7(10):3129-40. [ Links ]
6. Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica Sorafenib (Nexavar®). Disponible en: www.agemed.es [ Links ]
7. Sorafenib Drug Information. UptoDate 2012, (citado 2-junio-2012). Disponible en: http://www.uptodate.com/contents/sorafenib-druginformation [ Links ]
8. Peck-Radosavljevic M. Hepatocellular carcinoma: the place of new medical therapies. Ther Adv Gastroenterol. 2010;3(4):259-67. [ Links ]
9. Gish R, Marrero JA, Benson AB. A multidisciplinary approach to the management of hepatocellular carcinoma. Systemic therapy for advances stage hepatocellular carcinoma. Gastroenterol Hepatol. 2010;6(3 Suppl 7):1-16. [ Links ]
10. Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, for the SHARP Study Group. Sorafenib in advanced hepatocellular carcinoma. N England J Med. 2008;359:378-90. [ Links ]
11. Cheng A, Kang YK, Chen Z, Tsao CJ, Qin S, Kim JS, et al. Efficacy and safety of sorafenib in patients in the Asian-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol. 2009;10(1):25-34. [ Links ]
12. Jelic S, Sotiropoulos GC. Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2010;21(Supl 5):59-64. [ Links ]
13. Keating GM, Santoro A. Sorafenib: a review of its use in advanced hepatocellular carcinoma. Drugs. 2009;69(2):223-40. [ Links ]
14. Common Terminology Criteria for Adverse Events (CTCAE). Versión 4.0. Publicado el 29 de mayo de 2009 (v4.03: 14 de junio de 2010). US Department of Health Human Services. National Cancer Institute (NCI). Disponible en: http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf [ Links ]
15. Wörns MA, Weinnmann A, Pfingst K, Schulte-Sasse C, Messow CM, Schulze-Bergkamen, et al. Safety and efficacy of sorafenib in patients with advanced hepatocellular carcinoma in consideration of concomitant stage of liver cirrhosis. J Clin Gastroenterol. 2009; 43(5):489-95. [ Links ]
16. Schoffski P, Dumez H, Clement P, Hoeben A, Prenen H, Wolter P, et al. Emerging role of tyrosine kinase inhibitors in the treatment of advanced renal cell cancer: a review. Ann Oncol 2006;17:1185-96. [ Links ]
17. Atkins MB. Molecularly targeted therapy for advanced renal carcinoma. UpToDate 2011, (citado el 24-enero-2011). Disponible en: http://www.uptodate.com/online [ Links ]
18. Escudier B, Eisen T, Stadler W, Szczylik C, Oudard S, Siebels M, for the TARGET Study Group. Sorafenib in advanced clear-cell renal-cell carcinoma. N Eng J Med. 2007;356:125-34. [ Links ]
19. Oudar S, George D, Medioni J, Motzer R. Treatment options in renal cell carcinoma: past, present and future. Ann Oncol. 2007;18 (Supl 10):25-31. [ Links ]
20. Escudier B, Kataja V. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow up. Ann Oncol. 2010;21(Supl 5):137-9. [ Links ]
21. Ratain MJ, Eisen T, Stadler W, Flaherty KT, Kaye SB, Rosner GL, et al. Phase II placebo-controlled randomized discontinuation trial of sorafenib in patients with metastatic renal cell carcinoma. J Clin Oncol. 2006;24:2505-12. [ Links ]
22. Tamaskar I, Bukowski R, Wood L. Thyroid function test abnormalities in patients with metastatic renal cell cancer treated with sorafenib. Ann Oncol. 2008;19:265-8. [ Links ]
23. Eisen T, Oudard S, Szczylik, Gravis G, Heinzer H, Middleton R. Sorafenib for older patients with renal cell carcinoma: Subset analysis from a randomized trial. J Natl Cancer Inst. 2008;100:1454-63. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: cristina.camanas@gmail.com
(C. Camañas-Troyano)
Recibido: 29 de septiembre de 2012.
Aceptado: 19 de enero de 2013.