Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.38 no.5 Toledo Set./Out. 2014
https://dx.doi.org/10.7399/FH.2014.38.5.7957
Revisión Sistemática de la evidencia de efectos proarrítmicos de domperidona en infantes
Proarrhythmic effects of domperidone in infants: a systematic review
Lucía Caraballo, Gabriel Molina, Darío Weitz, Laura Piskulic, Aylén Avila y Marta Marzi
Departamento de Matemática y Estadística, Facultad de Ciencias Bioquímicas y Farmacéuticas. Universidad Nacional de Rosario. Argentina.
Dirección para correspondencia
RESUMEN
Objetivo: Determinar si existe evidencia de prolongación del intervalo QTc y efectos proarrítmicos asociados al uso de domperidona oral en infantes.
Método: Se realizó una revisión sistemática de la literatura científica consultando la base de datos electrónica MEDLINE y las fuentes LILACS, ScIELO y Biblioteca Cochrane a través de la Biblioteca Virtual de Salud, sin límite de fecha ni de idioma.
Resultados: De los estudios identificados se excluyeron ocho por no cumplir con los criterios de inclusión, quedando seleccionados un reporte de caso y tres estudios pilotos. Rocha et al (2005) reportan el caso de un niño de 3 meses con intervalo QTc=463 mseg tras un mes de tratamiento con 1,8 mg/kg/día de domperidona oral. Djeddi et al (2008) administraron una dosis promedio de 1,3 mg/kg/día a 31 neonatos, observando prolongación del intervalo QTc>30 mseg en nueve. Hegar et al (2009) estudiaron a 10 niños con edad media de 5,6 meses tratados con 0,8 mg/kg/día y no observaron prolongación del intervalo QTc. Gunlemez et al (2010) incluyeron en su estudio a 40 infantes prematuros a quienes administraron 1 mg/kg/día de domperidona oral, en dos de ellos el intervalo QTc aumentó por encima de 450 mseg.
Conclusiones: Aunque se encontró evidencia de prolongación del intervalo QTc en infantes tratados con domperidona oral, se necesitan más estudios para cuantificar el riesgo asociado a la droga en esta población. Se sugiere a los profesionales de la salud realizar un monitoreo electrocardiográfico de los infantes tratados con domperidona e informar al sistema de farmacovigilancia los casos de ocurrencia de eventos adversos.
Palabras clave: Domperidona; Síndrome de QT prolongado; Infante.
ABSTRACT
Aims: To assess the association of the use of domperidone in infants with QTc interval prolongation and proarrhythmic events.
Methods: A systematic search of the scientific literature was conducted without any date or language restriction. The electronic database MEDLINE and the sources LILACS, ScIELO and Cochrane library were consulted.
Results: From the twelve identified studies, eight were excluded because they did not meet the inclusion criteria. One case report and three pilot studies were selected. Rocha et al (2005) reported the case of an infant (age 3 months) with QTc interval = 463 ms after being treated during one month with 1.8 mg/kg/day of oral domperidone. Djeddi et al (2008) administered an average dose of 1.3 mg/kg/day to 31 neonates; QTc interval prolongation > 30 ms was observed in nine neonates. Hegar et al (2009) studied 10 infants (mean age 5.6 months) who received 0.8 mg/ kg/day of oral domperidone; QTc interval prolongation was not observed. Günlemez et al (2010) enrolled 40 premature infants who were administered 1 mg/kg/day of oral domperidone; the QTc interval increased to above 450 ms in two infants.
Conclusions: Although evidence that orally administrated domperidone in infants produces prolongation of QTc interval was found, further studies are needed in order to quantify the risk associated with the drug in that population. We suggest that heath professionals should conduct ECGs to infants treated with domperidone and inform the pharmacovigilance system the occurrence of any case of adverse event.
Key words: Domperidone; Long QT syndrome; Infants.
Introducción
El reflujo gastroesofágico (RGE) es un desorden gastrointestinal frecuente en la población infantil. La mayor incidencia se da a partir de los cuatro meses de edad y generalmente se resuelve espontáneamente entre el primer y segundo año de vida en la mayoría de los infantes1. De ser necesaria una intervención, el tratamiento de elección consiste en medidas dietéticas, medidas posturales y/o utilización de alimentos espesados o alginatos2. En caso de persistencia de los síntomas o de presentarse complicaciones, suelen administrarse agentes procinéticos tales como domperidona, un derivado benzoimidazólico antagonista periférico de los receptores dopaminérgicos D2.
Domperidona, a diferencia de metoclopramida, no atraviesa fácilmente la barrera hematoencefálica como para producir efectos secundarios extrapiramidales. Cisaprida, otro fármaco procinético, de acceso restringido en muchos países, dejó de utilizarse en los Estados Unidos debido a su potencial de provocar arritmias cardíacas graves, a veces mortales, tales como taquicardia ventricular, fibrilación ventricular y torsade de pointes (TdP). Estas arritmias se deben a una prolongación del intervalo QT a través de la interacción con subunidades formadoras de poro del conducto K+HERG. Los conductos K+HERG conducen la corriente de K+ rectificadora tardía rápida, importante para la repolarización normal del ventrículo. Las arritmias ventriculares provocadas por cisaprida ocurren frecuentemente cuando se combina con otros fármacos que inhiben la enzima CYP3A4; tales combinaciones inhiben el metabolismo de cisaprida y dan por resultado altas concentraciones plasmáticas del fármaco3.
Domperidona se encuentra en el mercado farmacéutico desde 1978, pero su uso se incrementó desde que se limitó el de cisaprida. Aunque aparenta ser una alternativa terapéutica segura, se han reportado casos de prolongación del intervalo QT y arritmia ventricular tras la administración oral de domperidona4,5,6. En 1986 la forma inyectable fue retirada del mercado farmacéutico de muchos países a partir de diversos informes sobre efectos adversos cardíacos en pacientes con cáncer tratados con altas dosis para la prevención de náuseas y vómitos provocados por la quimioterapia7,8,9. Recientemente, las agencias reguladoras de España, Canadá, Inglaterra y Sudáfrica, entre otras, han emitido alertas acerca del riesgo de arritmias cardíacas y muerte súbita asociadas al uso de domperidona10,11,12,13,14,15. En los Estados Unidos está prohibida su administración en todas las presentaciones y la Food and Drug Administration (FDA) enfatiza que domperidona no es una droga aprobada y que su comercialización es ilegal16.
Domperidona está incluida en el Formulario Terapéutico de Argentina por ser considerada medicamento esencial en el tratamiento de nauseas y vómitos. En niños, la dosis indicada es de 0,2 a 0,4 mg/kg de peso corporal cada 4 a 8 hs y se recomienda limitar su uso al tratamiento de nauseas y vómitos inducidos por citóxicos o radioterapia17,18.
El objetivo de la presente revisión sistemática fue determinar si existe evidencia de prolongación del intervalo QT y efectos proarrítmicos asociados al uso de domperidona oral para el tratamiento del RGE en infantes.
Métodos
Criterios de elegibilidad: Estudios primarios que evaluaran prolongación del intervalo QT, arritmia ventricular, fibrilación ventricular, TdP y/o muerte súbita asociada al uso de domperidona oral en infantes con RGE. No hubo restricción respecto al diseño, siendo elegibles reporte de casos, ensayos clínicos y estudios observacionales del tipo caso-control y de cohortes.
Estrategia de búsqueda para la identificación de los estudios: Se consultaron las fuentes de información LILACS, SclELO y la Biblioteca Cochrane a través de la Biblioteca Virtual de Salud (BVS), la base de datos electrónica MEDLINE y los alertas y boletines de seguridad de los entes regulatorios nacionales e internacionales disponibles en línea, sin límite de fecha ni de idioma. La estrategia de búsqueda consistió en la combinación de términos indexados (términos MeSH: domperidone, arrhythmia, death, torsades de pointes) y de términos libres (QT, fibrillation) mediante la utilización de operadores booleanos, adaptada a cada una de las fuentes consultadas. [Por ejemplo en MEDLINE se ingresó la siguiente ecuación: Domperidone AND (arrhythmia OR QT OR death OR fibrillation OR torsades de pointes)]. Se especificó que la información requerida estuviera en el título y/o resumen. Algunos de los filtros activados, según cuál fuera la fuente de información consultada, fueron: humans, child: birth -18 years. La búsqueda se complementó con la revisión de citas incluidas en los artículos completos recuperados por cumplir los criterios de elegibilidad y Identificación y selección de los estudios: Los artículos fueron identificados por tres autores según la estrategia descripta. La selección fue realizada por dos revisores de manera independiente y consensuada por un tercero. En primer lugar se evaluó el título y el resumen de los artículos, en segundo lugar se recuperó el texto completo de los estudios potencialmente relevantes para ser sometidos nuevamente a evaluación para su elegibilidad.
Extracción de los datos: Se diseñó un formulario de extracción de datos donde se registró el diseño del estudio, la duración del mismo, el lugar de realización, los métodos utilizados para la evaluación cardiológica, las características de los pacientes, la intervención/exposición y los resultados. Se incluyó cualquier dato que pudiera aportar información acerca de la calidad de los estudios incluidos y de potenciales conflicto de intereses de los autores.
Resultados
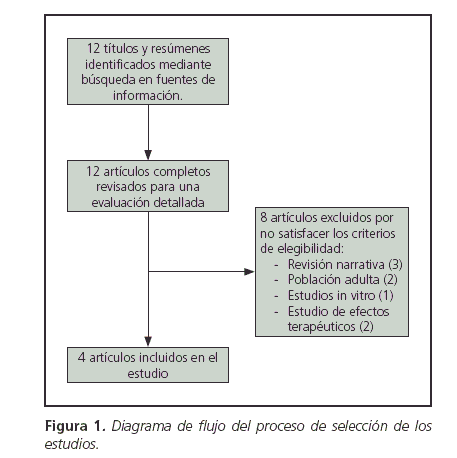
Selección de los estudios: La búsqueda en las bases de datos se realizó durante los meses de Octubre y Noviembre de 2013. Se obtuvieron doce títulos y resúmenes en MEDLINE y se recuperaron los textos completos para una evaluación detallada. En las restantes fuentes de información no se obtuvieron resultados. A partir de la lectura de los mismos se excluyeron ocho por tratarse de: artículos de revisión narrativa, informes de estudios de efectos terapéuticos que sólo hacían referencia al potencial proarrítmico de domperidona, estudios en infantes con RGE que evaluaron otros fármacos y/o parámetros fisicoquímicos, estudios in vitro o en población adulta. Con acuerdo de los revisores, 4 artículos resultaron incluidos en el presente estudio (Fig. 1).
Características de los estudios incluidos: De los cuatro estudios identificados y seleccionados por cumplir los criterios de elegibilidad, uno fue un reporte de caso y los tres restantes respondieron a un diseño del tipo estudio piloto4,19,20,21. Todos satisfacían los requisitos metodológicos propios del diseño utilizado. Hegar et al realizaron un ensayo sobre veinte infantes con regurgitación frecuente y con signos y síntomas de RGE que no respondían a la terapia no farmacológica. Conformaron dos grupos de igual tamaño y con características homogéneas, asignando en forma aleatorizada el tratamiento, con domperidona uno y con cisaprida el otro. Los estudios de Djeddi et al y de Günlemez et al fueron realizados en neonatos que tenían indicación de domperidona oral (Tabla 1).
Resultados de los estudios individuales: Los estudios fueron heterogéneos no solo en el diseño utilizado sino también en la edad de los infantes incluidos, en las dosis administradas, en la duración del tratamiento y en la información incluida en el artículo publicado. Los resultados se muestran en la Tabla 1.
Rocha et al reportaron el caso de un infante de 3 meses de edad con intervalo QT corregido en función de la frecuencia cardíaca (QTc) de 463 milisegundos (mseg) después de un mes de tratamiento con tres dosis diarias de 0,6 mg/kg cada vez.
Hegar et al compararon el efecto terapéutico de domperidona y cisaprida en niños de 2 a 9 meses de edad en dosis de 0,8 mg/kg/día, igual para ambos fármacos, en tres tomas. Un mismo co-autor realizó un electrocardiograma (ECG) antes de iniciar el tratamiento y otro entre los 3 y 5 días después de iniciado. Por cada ECG, se obtuvieron tres mediciones del intervalo QTc y se promediaron. El valor medio del intervalo QTc del grupo tratado con domperidona fue 404 mseg y 402 mseg antes y durante el tratamiento respectivamente. Para cisaprida los valores fueron 430 mseg y 404 mseg, encontrándose un infante con intervalo QTc que superó el rango normal, considerado inferior a 450 mseg.
En los estudios Djeddi et al y Günlemez et al se evaluó el efecto de domperidona sobre el intervalo QT según la edad gestacional (EG) de los neonatos. El primero consideró tres rangos diferentes de EG mientras que el segundo sólo uno. Los resultados se muestran en la Tabla 2.
Discusión
Se encontraron pocos estudios que evaluaran, directa o indirectamente, el riesgo de ocurrencia de efectos adversos cardíacos asociados al uso de domperidona en la población infantil. Los tres estudios clínicos de intervención incluidos en la presente revisión, fueron los únicos identificados tras una exhaustiva revisión de la literatura científica y el contacto con centro y redes de investigación farmacológica. Dichos estudios tienen importantes limitaciones, algunas inherentes al diseño y otras debido a las características del grupo poblacional de interés. Ninguno de los estudios incluyó un grupo control formado por niños sanos, para contrastar los valores de los parámetros electrocardiográficos evaluados.
Del total de 81 infantes incluidos en los tres estudios piloto, en 11 (13,6%) se observó prolongación del intervalo QTc y dicho intervalo superó el rango normal en 3 infantes (3,7%). Todos los casos se observaron en neonatos, quienes fueron evaluados en dos de los estudios, reuniendo un total de 71 infantes20,21. Referidos al grupo de neonatos, los porcentajes calculados son 15,5% y 4,2% respectivamente.
En relación a la edad gestacional de los neonatos, Djeddi et al observaron prolongación del intervalo QTc en los grupos B y C (EG > 32 semanas) y no en el grupo A con EG < 32 semanas que incluía a 11 infantes. Günlemez et al, en cambio, sólo estudiaron niños prematuros nacidos entre las semanas 24 y 33 de gestación, observando 2 casos en 40 (5%) con intervalo QTc superior al rango normal. Si este valor fuera realmente la incidencia en neonatos expuestos a domperidona oral, no extrañaría que en el estudio de Djeddi et al no se hubieran encontrado casos, dado el pequeño tamaño muestral del grupo A.
La asociación entre uso de domperidona oral en la población infantil y riesgo de eventos proarrítmicos no puede ser concluyente debido a la escasa cantidad de estudios realizados y a las limitaciones de los mismos antes mencionadas. Sin embargo, cabe destacar que tanto en los estudios piloto como en el reporte de caso la longitud del intervalo QTc regresó al rango normal con la interrupción del tratamiento farmacológico.
La principal ruta metabólica de domperidona es la que involucra a la isoforma CYP3A4 del citocromo P45 022,23. Esta vía metabólica es utilizada por muchos fármacos, entre ellos cisaprida, que alargó el segmento QTc en uno de los diez infantes del estudio de Hegar et al incluido en este trabajo de revisión. Cabe señalar que la actividad de CYP3A4 presente en el hígado de un infante de un mes representa un 30% de la actividad del adulto, alcanzando los niveles de éste entre el año y los cuatro años de edad24.
Estudios en adultos probaron que la administración conjunta de domperidona y drogas que inhiben el CYP3A4 incrementa el riesgo de arritmia ventricular y muerte súbita cardíaca debido a una mayor biodisponibilidad del agente procinético25,26. Resultados similares se observaron con cisaprida, de la que se han reportado 341 casos de arritmia ventricular, incluyendo 80 muertes27.
Estudios in vitro han demostrado que domperidona, al igual que cisaprida, puede inhibir la corriente rectificadora retardada de potasio demorando la repolarización cardíaca, mecanismo que conduce a eventos proarrítmicos28,29.
Considerando los mecanismos farmacocinéticos y farmacodinámicos expuestos, los resultados de los estudios realizados en adultos y los analizados en la presente revisión, sería prudente reconsiderar la hipótesis de que domperidona es una alternativa más segura que cisaprida para el tratamiento de desórdenes gastrointestinales.
Se necesitan más estudios que involucren a infantes. Sería apropiado que los organismos reguladores de la calidad y seguridad de los medicamentos organicen estudios multicéntricos que evalúen el riesgo de prolongación del intervalo QTc en infantes que necesitan ser tratados con domperidona. Deberá coordinarse las dosis a utilizar, la vía de administración y los controles electrocardiográficos con la metodología correspondiente. Los informes de los estudios deberán incluir información precisa y completa acerca de la edad de los pacientes, sexo, peso, duración del tratamiento, criterios de inclusión y exclusión.
Se sugiere a los pediatras y profesionales de otras especialidades médicas, agotar todos los recursos terapéuticos no farmacológicos disponibles antes de utilizar domperidona en infantes con reflujo gastroesofágico. Si su administración no puede evitarse, se recomienda acompañarla con mediciones periódicas del intervalo QTc. Los casos de ocurrencia de eventos proarrítmicos asociados al uso de domperidona deberán informarse a la brevedad al sistema de farmacovigilancia.
Agradecimientos
Los autores de la presente revisión agradecen la desinteresada colaboración de la Dra. Nora Beatriz Quaglia. En calidad de Médica y Doctora en Ciencias Biomédicas brindó asesoramiento en temas específicos y realizó una minuciosa lectura del informe final devolviendo enriquecedores comentarios.
Bibliografía
1. Nelson SP, Chen EH, Syniar GM, Christoffel KK. Prevalence of symptoms of gastroesophageal reflux during infancy: a pediatric practice-based survey. Pediatric Practice Research Group. Arch Pediatr Adolesc Med. 1997; 151(6): 569-72. [ Links ]
2. Caffaratti M. Eficacia y seguridad de domperidona en el reflujo gastroesofágico en niños. Boletín Cime (Centro de información de medicamentos). Córdoba (Argentina). 2012; Vol 13 (2). (acceso 7 de agosto de 2014). Disponible en: http://cime.fcq.unc.edu.ar/boletin domperidona 19-06-12.pdf. [ Links ]
3. Sharkey K, Wallace J. Tratamiento de los trastornos de la motilidad intestinal y del flujo de agua; antieméticos; fármacos utilizados en las enfermedades biliares y pancreáticas. En: Goodman y Gillman. Las Bases Farmacológicas de la Terapéutica. 12o Edición. México, D.F: Editorial Mc Graw Hill 2012. p 1323-1349. [ Links ]
4. Rocha CM, Barbosa MM. QT interval prolongation associated with the oral use of domperidone in an infant. Pediatr Cardiol. 2005; 26(5): 720-3. [ Links ]
5. Strauss SM, Sturkenboom MC, Bleumink GS, Dieleman JP, van der Lei J, de Graeff PA, et al. Non-cardiac QTc-prolonging drugs and risk of sudden cardiac death. Eur Heart J. 2005; 26(19): 2007-12. [ Links ]
6. Deepak P, Ehrenpreis ED, Sadozai Y, Sifuentes H. Tu1470 Co-Prescription of Interacting Medications, Arrhythmias and Treatment With Domperidone. Gastroenterology 2012; 142 (5) suppl 1: S-841-2. [ Links ]
7. Joss RA, Goldhirsch A, Brunner KW, Galeazzi RL. Sudden death in cancer patient on high-dose domperidone. Lancet 1982; 1(8279): 1019. [ Links ]
8. Roussak JB, Carey P, Parry H. Cardiac arrest after treatment with intravenous domperidone. Br Med J. (Clin Res Ed) 1984; 289(6458): 1579. [ Links ]
9. Bruera E, Villamayor R, Roca E, Barugel M, Tronge J, Chacon R. Q-T interval prolongation and ventricular fibrillation with i.v. domperidone. Cancer Treat Rep. 1986; 70(4): 545-6. [ Links ]
10. Agencia Española de Medicamentos y Productos Sanitarios. Domperidona y riesgo cardíaco; 2 de diciembre de 2011. (acceso 4 de abril de 2014). Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2011/docs/NI-MUH_24-2011.pdf. [ Links ]
11. Health Canada. Government of Canada; 2012. Association of domperidone maleate with serious ventricular arrhythmias and sudden death. (acceso 27 de marzo 2014). Disponible en: http://www.healthycanadians.gc.ca/recall-alert-rappel-avis/hc-sc/2012/14118a-eng.php. [ Links ]
12. Department of Health and Ageing. Australian Government. Domperidone (Motilium)-serious ventricular arrhythmias and sudden cardiac death. Australian Prescriber. 2012; 35(6):199. [ Links ]
13. European Medicines Agency; 2014. CMDh confirms recommendations on restricting use of domperidone-containing medicines. (acceso 29 de mayo de 2014). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/Referrals_document/Domperidone_31/Position_provided_by_CMDh/WC500165647.pdf. [ Links ]
14. Medicines and Healthcare Products Regulatory Agency (MHRA); 2012. Domperidone: small risk of serious ventricular arrhythmia and sudden cardiac death. (acceso 27 de marzo de 2014). Disponible en: http://www.mhra.gov.uk/Safetyinformation/DrugSafetyUp-date/CON152725. [ Links ]
15. Medicines Control Council. Interaction between ketoconazole and domperidone and the risk of QT prolongation - important safety information. S Afr Med J 2006; 96(7): 596. [ Links ]
16. Food and Drug Administration. U.S. Protecting and Promoting your heath; 2009. FDA Talk Paper: FDA Warns Against Women Using Unapproved Drug, Domperidone, to Increase Milk Production. (acceso 8 de abril de 2014). Disponible en: http://www.fda.gov/Drugs/DrugSafety/InformationbyDrugClass/ucm173886.htm. [ Links ]
17. Confederación Médica de la República Argentina. Medicamentos que afectan el Sistema Gastrointestinal. En: Formulario Terapéutico Nacional. Buenos Aires, Argentina: Editorial COMRA, 11ava edic. 2010. p. 247-72. [ Links ]
18. Comisión de Medicamentos Fundación CONAMED. Aparato Digestivo. En: Formulario Terapéutico Conamed. Buenos Aires, Argentina: Editorial Biotecnológica S.R.L, 6ta edic. 2011. p. 691-718. [ Links ]
19. Hegar B, Alatas S, Advani N, Firmansyah A, Vandenplas Y. Domperidone versus cisapride in the treatment of infant regurgitation and increased acid gastro-oesophageal reflux: a pilot study. Acta Paediatr. 2009 ; 98(4):750-5. [ Links ]
20. Djeddi D, Kongolo G, Lefaix C, Mounard J, Léké A. Effect of Domperidone on QT Interval in Neonates. J Pediatr. 2008; 153(5): 663-6. [ Links ]
21. Gunlemez A, Babaoglu A, Arisoy AE, Türker G, Gökalp AS. Effect of domperidone on the QTc interval in premature infants. J Perinatol. 2010; 30(1): 50-3. [ Links ]
22. Meuldermans W, Hurkmans R, Swysen E, Hendrickx J, Michiels M, Lauwers W, Heykants J, et al. On the pharmacokinetics of domperidone in animals and man III. Comparative study on the excretion and metabolism of domperidone in rats, dogs and man. Eur J Drug Metab Pharmacokinet. 1981; 6(1): 49-60. [ Links ]
23. Ward BA, Morocho A, Kandil A, Galinsky RE, Flockhart DA, Desta Z. Characterization of human cytochrome P450 enzymes catalyzing domperidone N-dealkylation and hydroxylation in vitro. Br J Clin Pharmacol. 2004;58(3):277-87. [ Links ]
24. Flores AA, Rodríguez GT, Valles RR, Ramírez ES. Utilización de cisaprida y su relación con arritmia cardiaca. Estado actual en la literatura médica. An Med Asoc Med Hosp ABC 2001; 46 (4): 183-92. (acceso 24 de Julio de 2014). Disponible en: http://www.medigraphic.com/pdfs/abc/bc-2001/bc014f.pdf. [ Links ]
25. Boyce MJ, Baisley KJ, Warrington SJ. Pharmacokinetic interaction between domperidone and ketoconazole leads to QT prolongation in healthy volunteers: a randomized, placebo-controlled, double-blind, crossover study. Brit J Clin Pharmacol. 2012; 73 (3): 411-21. [ Links ]
26. De Bruin ML, Langendijk PN, Koopmans RP, Wilde AA, Leufkens HG, Hoes AW. In-hospital cardiac arrest is associated with use of non-antiarrhythmic QTc-prolonging drugs. Brit J Clin Pharmacol. 2006; 63 (2): 216-23. [ Links ]
27. Michalets EL, Williams CR. Drug interactions with cisapride: clinical implications. Clin Pharmacokinet. 2000; 39(1): 49-75. [ Links ]
28. Drolet B, Rousseau G, Daleau P, Cardinal R, Turgeon J. Domperidone should not be considerd a non-risk alternative to cisapride in the treatment of gastrointestinal motility disorders. Circulation 2000; 102(16):1883-5. [ Links ]
29. Hondeghem LM. Low safety index of domperidone: mechanism for increased odds ratio for sudden cardiac death. Acta Cardiol. 2011; 66(4): 421-5. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: mmarzi@fbioyf.unr.edu.ar
(Marta M. Marzi).
Recibido el 17 de agosto de 2014
Aceptado el 2 de septiembre de 2014.