Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.39 no.3 Toledo may./jun. 2015
https://dx.doi.org/10.7399/fh.2015.39.3.8814
ORIGINALES
Análisis coste-efectividad de Belimumab en pacientes con lupus eritematoso sistémico en España
Cost-effectiveness analysis of Belimumab in patients with systemic lupus erythematosus in Spain
Silvia Díaz-Cerezo1, Ángel María García-Aparicio2, Javier Parrondo1 y Laura Amanda Vallejo-Aparicio1
1Departamento de Evaluación de Medicamentos, GSK España, Tres Cantos.
2Hospital Virgen de la Salud, Toledo. España.
Este estudio (código HO-14-14928) está financiado por GlaxoSmithKline (GSK).
Dirección para correspondencia
RESUMEN
Objetivo: Estimar el coste-efectividad (CE) de belimumab en aquellos pacientes con biomarcadores positivos y enfermedad activa a pesar del tratamiento estándar (TE) desde la perspectiva social española.
Métodos: A partir de un modelo de microsimulación, que permite simular la evolución natural de la enfermedad, se estimó el CE de belimumab + TE vs. TE. Se consideró una duración del tratamiento de dos años y un horizonte temporal de toda la vida. La extrapolación de eficacia a largo plazo se basó en los ensayos clínicos de belimumab y en la cohorte de pacientes John Hopkins de Estados Unidos; los datos de utilidades se obtuvieron de la literatura. Se calcularon costes directos e indirectos en base a datos españoles publicados (€, 2014), aplicando una tasa de descuento (TD) del 3% tanto a costes como a efectos. Los resultados se expresaron como ratio coste-efectividad incremental (ICER) en términos de años de vida ganados (AVG) y años de vida ajustados por calidad (AVAC). Se realizaron análisis de sensibilidad determinísticos (TD al 0% y 5%, duración de tratamiento 5 años y exclusión de costes indirectos) así como probabilísticos (PSA).
Resultados: El ICER de belimumab + TE vs. TE fue de 16.647€/ AVG y 23.158€/AVAC respectivamente. La variación de la TD supuso la mayor variación de los resultados respecto al escenario base. En el 68% de los escenarios simulados en el PSA, belimumab fue una alternativa coste-efectiva considerando como umbral 30.000€/AVAC.
Conclusiones: Belimumab puede considerarse una alternativa coste-efectiva desde la perspectiva social española.
Palabras clave: Coste-efectividad; Modelo económico; Belimumab; Lupus eritematoso sistémico.
ABSTRACT
Objective: To estimate the cost-effectiveness of belimumab in patients with systemic lupus erythematosus (SLE) presenting positive biomarkers and active disease despite standard treatment (ST), from the Spanish social perspective.
Methods: A microsimulation model was used to estimate the cost-effectiveness of belimumab plus ST versus ST alone. A treatment duration of two years with a life-time horizon were considered. Efficacy data were obtained from belimumab clinical trials and the evolution of the disease was simulated from John Hopkins' patient cohort data in the United States. Utility data were obtained from literature review. Direct and indirect costs were calculated based on Spanish published data (€, 2014), applying a discount rate (DR) of 3% to both costs and effects. Results were expressed as incremental cost-effectiveness ratio (ICER) in terms of gained life years (LY) and quality of life adjusted life years (QALYs). Probabilistic (PSA) and deterministic sensitivity analyses (DR of 0% and 5%, 5-years treatment duration and excluding indirect costs) were performed to determine the robustness of the model.
Results: The incremental cost-effectiveness ratio (ICER) was 16,647€ per life year gained, with an incremental cost-utility ratio (ICUR) of 23,158€ per additional QALY gained. In 68% of the scenarios simulated in the PSA, belimumab was found to be a cost-effective alternative, considering a threshold of 30,000€/QALY.
Conclusion: Belimumab can be regarded as a cost-effective alternative from the Spanish social perspective.
Key words: Cost-effectiveness; Economic model; Belimumab; Systemic lupus erythematosus.
Introducción
El lupus eritematoso sistémico (LES) es una enfermedad inflamatoria de origen autoinmune, que afecta en el 90% de las ocasiones a mujeres en edad fértil, aunque también se puede presentar en la infancia, en décadas tardías y en hombres. Se calcula que en España hay aproximadamente unos 40.000 pacientes afectados, si bien los datos epidemiológicos son variables y sitúan la prevalencia entre los 34 y 91 casos/ 100.000 habitantes1,2. Se trata de una enfermedad multisistémica, muy variable de un paciente a otro, tanto por los síntomas como por su grado de intensidad y respuesta a los tratamientos.
El pronóstico y supervivencia de los pacientes ha mejorado drásticamente en las últimas décadas, pasándose de una tasa de supervivencia a 5 años del 50% durante los años cincuenta, a unos valores del 90% o superiores en la actualidad3. Sin embargo, los pacientes tienen una calidad de vida inferior a la de la población general y comparable o peor a la de otras patologías crónicas como la artritis reumatoide, la diabetes, la insuficiencia cardiaca o la EPOC4,5,6. El LES afecta a todas las esferas de la vida, incluyendo salud física y mental, vitalidad, dolor, aspectos sociales y emocionales. Factores como la fatiga, el dolor, la depresión y ansiedad afectan a la capacidad para afrontar actividades de la vida diaria, sociales y laborales7,8,9,10.
En la actualidad, el LES carece de un tratamiento curativo definitivo. La mayoría de pacientes sigue una evolución crónica y presentan exacerbaciones de la enfermedad, intercalados con períodos de inactividad. El objetivo de los tratamientos del LES es controlar la actividad de la enfermedad, evitar la aparición de brotes y el daño orgánico irreversible derivado de la enfermedad11. El tratamiento se ha basado clásicamente en el uso de glucocorticoides, ácido acetilsalicílico, antiinflamatorios no esteroideos, antipalúdicos y diversos inmunosupresores. Estos tratamientos han mejorado notablemente el pronóstico de la enfermedad, aunque no todos los pacientes responden y pueden conllevar una importante toxicidad12.
En 2011, la Agencia Europea del Medicamento aprobó el uso de belimumab como "tratamiento adyuvante en pacientes adultos con LES activo, con autoanticuerpos positivos, con un alto grado de actividad de la enfermedad (p.ej. anti-ADNdc positivo y bajo nivel de complemento) a pesar del tratamiento estándar" (TE)13, convirtiéndose en el primer tratamiento específico para esta patología en más de 50 años. Se trata de un anticuerpo monoclonal humano que se une específicamente a la forma soluble de la proteína estimuladora de linfocitos B humanos (BLyS, por su sigla en inglés), un factor de supervivencia de la célula B. Belimumab bloquea la unión de la forma soluble de BLyS a su receptor en las células B; este bloqueo inhibe la supervivencia de las células B, incluyendo las células B autorreactivas, y reduce la diferenciación de células B a células plasmáticas productoras de inmunoglobulinas. Los niveles de BLyS se encuentran elevados en los pacientes con LES y se han correlacionado con la actividad lúpica14.
La eficacia y seguridad de belimumab ha sido investigada en dos ensayos clínicos, aleatorizados, controlados con placebo, que incluyeron más de 1.600 pacientes con enfermedad activa. Después de 52 semanas de tratamiento, belimumab en una dosis de 10 mg/kg añadido a la TE, demostró superioridad vs. placebo más TE, en la variable principal eficacia, valorado mediante el índice de respuesta en LES (SRI). Así mismo, se observaron otros beneficios en otros criterios de valoración clínicos, como la reducción en la actividad de la enfermedad medida con la Escala de Actividad de la Enfermedad (Systemic Lupus Erythematosus Disease Activity Index, SLEDAI) en su versión modificada SELENA (Safety of Estrogen in Lupus Erythematosus National Assessment) (SELENA-SLEDAl), los brotes graves y el uso de esteroides. El tratamiento con belimumab fue generalmente tolerado, con tasas de acontecimientos adversos, similares a las observadas en el grupo tratado con placebo15,16.
Un análisis post-hoc posterior17, realizado a requerimiento de la Agencia Europea del Medicamento, mostró que las mayores tasas de respuesta se obtienen en aquellos pacientes serológicamente activos y con alto nivel de actividad, lo cual condujo a la actual aprobación en ficha técnica autorizada a nivel europeo13.
El objetivo de este estudio es estimar el coste-efectividad de belimumab añadido a la TE vs TE en pacientes con LES activo, con alto grado de actividad de la enfermedad, desde la perspectiva de la sociedad española, con la finalidad de facilitar la toma de decisiones.
Métodos
La presente evaluación económica se realizó mediante la adaptación de un modelo económico previamente empleado para evaluar la eficiencia de belimumab en otros países18,19,20, cuyo diseño permite simular la evolución de la enfermedad en pacientes tratados con belimumab + TE vs. TE. El escenario base considera un horizonte temporal de toda la vida del paciente y la perspectiva de la sociedad española.
Estructura del modelo
Con el objetivo de reflejar de forma adecuada la complejidad y la heterogeneidad de los pacientes con LES, se diseñó un modelo de microsimulación. Las metodologías de simulación a nivel de paciente, como la microsimulación, permiten considerar las múltiples interdependencias existentes entre las variables que alimentan el modelo. La figura 1 esquematiza cómo interactúan entre si las variables asociadas a cada paciente y que determinan su evolución a lo largo del tiempo: características del paciente, actividad de la enfermedad, uso de corticoesteroides, riesgo para desarrollar daño orgánico y de mortalidad. Esta información se determina basalmente para cada paciente, que evoluciona en paralelo por los dos brazos de tratamiento evaluados (Figura 2). Una vez que cada paciente recorre el flujo del modelo, la información se actualiza en ciclos anuales hasta su fallecimiento. Se realizó una microsimulación de 50.000 pacientes.
Población
La población analizada representa al subgrupo de pacientes incluido en los dos ensayos clínicos pivotales de belimumab (BLISS-52 y 76), que presentaba alto grado de actividad de la enfermedad y que coincide con la reflejada en la indicación aprobada de belimumab13.
Datos de de eficacia
Datos de eficacia durante el tratamiento
Los datos de eficacia a corto plazo, proceden de los ensayos clínicos de belimumab BLISS-52 y BLISS-76 (de 52 y 76 semanas de duración respectivamente). La variable de eficacia primaria fue una variable compuesta, el índice SRI, que define la respuesta como cumplimiento de cada uno de los siguientes criterios en la semana 52 en comparación con los valores iniciales:
• Reducción de >4 puntos en la escala SELENA-SLEDAI y
• no nuevas puntuaciones en los dominios orgánicos British Isles Lupus Assessment Group (BILAG) A ó 2 nuevos BILAG B y
• no empeoramiento (aumento >0,30 puntos) en la escala de Evaluación Global del Médico (PGA)
A pesar de que la variable principal en estos estudios fue el índice SRI, en el modelo se consideró la respuesta al tratamiento en función de la reducción de puntos observada en la escala SELENA-SLEDAI (>4), dado que su relación con el resto de covariables a incluir en el modelo (daño orgánico, uso de esteroides, etc) ha sido mucho más estudiada y esta aproximación permite predecir la evolución de los pacientes con mayor precisión.
El análisis de los datos agrupados de los estudios BLISS-52 y BLISS-76 mostró que el porcentaje de pacientes respondedores según la escala SELENA-SLEDAI fue de 52,6% vs. 40,7% en el grupo de belimumab + TE vs. placebo + TE (p<0,0001)21.
Para el análisis del escenario base se ha considerado una duración de tratamiento de dos años y se ha asumido que el efecto absoluto de belimumab sobre la actividad de la enfermedad observado en los estudios BLISS-52 y 76 se va a mantener durante la duración del tratamiento. Se ha elegido esta duración de tratamiento ya que se aproxima bastante a la media de tratamiento observada en nuestro país en el momento de realizarse este análisis.
Efectos a largo plazo (post-tratamiento)
Para poder vincular los efectos a corto plazo obtenidos con ambas alternativas de tratamiento con los efectos derivados de las mismas a largo plazo se construyeron diferentes modelos que representan la historia natural de la enfermedad y su relación con las diferentes covariables (grado de actividad de la enfermedad, uso de esteroides...).
Si bien los estudios BLISS no estaban diseñados para poder medir el efecto de belimumab a largo plazo, la relación de la actividad de la enfermedad (medida con la escala SELENA-SLEDAI) con el daño orgánico acumulado y con las tasas de mortalidad permiten realizar esta aproximación22. La evolución de los pacientes se modelizó en base al análisis de la cohorte de los pacientes con lupus de Maryland, Baltimore,US (Cohorte Johns Hopkins), por ser una de las cohortes más estudiadas y con mayor número de pacientes con LES23.
Como se ha comentado previamente, en esta base de datos no estaban disponibles los tres componentes del índice SRI, si bien si se disponía de las puntuaciones en la escala SELENA-SELEDAI que permiten estimar la probabilidad de respuesta para cada uno de los pacientes simulados.
Datos de seguridad
Dado que los efectos adversos en ambas alternativas de tratamiento fueron similares en los estudios BLISS, se asumió que su influencia en los resultados incrementales era nula, pues su peso en una rama de tratamiento se vería compensado por el de la otra rama, tanto a nivel de costes como de efectos. Por este motivo y con el fin de eliminar complejidad innecesaria del modelo, se decidió no incluir los efectos adversos en el análisis.
Datos de calidad de vida
Para transformar los años de vida ganados (AVG) en años de vida ajustados por calidad (AVAC), se emplearon las utilidades recogidas en los estudios BLISS a través del cuestionario EQ-5D. Para que estas utilidades reflejaran mejor la calidad de vida en pacientes españoles se ajustaron siguiendo el algoritmo de Dolan24 de UK, ya que según un estudio de Badía et al.,las utilidades de Reino Unido son equiparables a las españolas25.
Se calculó un modelo de regresión lineal para determinar los valores de utilidad de cada paciente en función de su valor en la escala SELENA-SLEDAI, edad y raza. Una vez determinado este valor de utilidad, se aplicaban adicionalmente en cada ciclo del mismo, las disutilidades asociadas a la aparición de los 12 tipos de daño orgánico acumulado recogidos en el modelo y definidos por la escala SLICC/ACR (Systemic Lupus International Collaborating Clinics/American College of Rheumatology) Damage Index for Systemic Lupus Erythematosus).
Estimación de los costes
Se incluyeron tanto los costes directos sanitarios como los costes indirectos derivados de las pérdidas de productividad laboral, expresados en euros (Enero, 2014).
Costes directos sanitarios (Tablas 1 y 2)
Costes farmacológicos: se consideró la posología recomendada (10 mg/kg los días 0, 14 y 28, y posteriormente en intervalos cada 4 semanas), una duración de tratamiento de 2 años, y un peso medio de 65,3 Kg22. Se tuvieron en cuenta las interrupciones de tratamiento debidas a respuesta insuficiente o discontinuación natural (falta de cumplimiento, solicitud del paciente, etc), datos extraídos de los estudios BLISS. No se tuvieron en cuenta las pérdidas de producto debidas al sobrante de los viales.
Costes de administración: se consideró el coste medio de una visita al hospital de día.
Costes de seguimiento del LES: se calcularon en función de la puntuación del paciente en la escala SELENA SELEDAI26.
Costes asociados al daño orgánico: se tuvieron en cuenta los diferentes eventos recogidos en la escala SLICC/ACR para cada tipo daño.
Costes indirectos
Para calcular los costes indirectos se utilizó el método del capital humano, por el que la pérdida de productividad de un individuo procede tanto de sus periodos de incapacidad temporal, como de la muerte prematura. Los datos empleados para realizar esta aproximación se resumen en la tabla 3. La relación entre los costes indirectos y la actividad de la enfermedad ha sido descrita por Sutcliffe et al.27 En su trabajo presentaron un modelo de regresión logística sobre los costes indirectos del LES basado en la actividad de la enfermedad, medida por la escala SLAM (Systemic Lupus Activity Measure). Dado que a su vez, diversos estudios han establecido la correlación existente entre la escala SLAM y SLEDAI, se calculó el ratio SLAM/SLEDAI para poder estimar posteriormente las horas pérdidas de trabajo por unidad de puntuación de la escala SLEDAI (Tabla 4).
Tasa de descuento
Según recomiendan las principales guías de evaluación económica españolas se aplicó una tasa de descuento del 3% tanto para costes como para efectos28.
Expresión de los resultados
Los resultados del escenario base se expresaron como razón coste-efectividad incremental por AVG (ICER) y por AVAC (ICUR). Para el cálculo de ambos se utilizó la siguiente fórmula matemática:
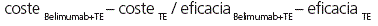
Análisis de sensibilidad
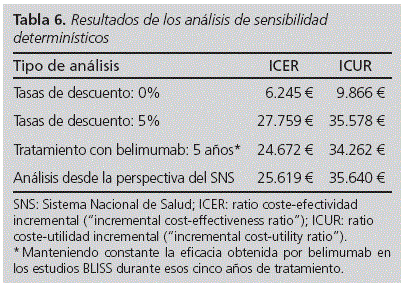
Se llevaron a cabo cuatro análisis de sensibilidad determinísticos para evaluar la robustez del modelo: variación de la tasa de descuento (0% y 5%), duración máxima del tratamiento con belimumab (5 años) y exclusión de los costes indirectos para explorar la perspectiva del Sistema Nacional de Salud (SNS). Adicionalmente, se realizó un análisis probabilístico (PSA) con 1.000 simulaciones del escenario base.
Resultados
Los resultados del escenario base mostraron que belimumab + TE logra un beneficio incremental vs. TE de 0,5 AVG y 0,4 AVACs, con un coste incremental de 8.485 €. Lo que supone un ICER de 16.647 €/AVG y de 23.158 €/ AVAC adicional ganado (Tabla 5). Los resultados de los análisis de sensibilidad mostraron que la máxima variación de los datos de ICER e ICUR se produce cuando se modifican los valores de la tasa de descuento entre un 0% (valores mínimos) y 5% (valores máximos). El resto de escenarios planteados se recogen en la tabla 6.
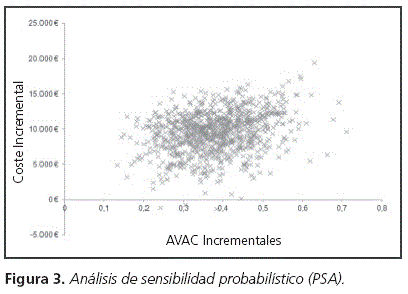
Por su parte, el PSA mostró que en el 68% de las simulaciones realizadas belimumab es un tratamiento coste-efectivo, si se establece un umbral de 30.000€/ AVAC (Figura 3)29,30.
Discusión
Los resultados del presente trabajo muestran que belimumab puede considerarse una terapia coste-efectiva en pacientes con LES, con alto grado de actividad de la enfermedad, a pesar de TE, desde la perspectiva de la sociedad española. Adoptar esta perspectiva es especialmente relevante en enfermedades como el LES, que afectan fundamentalmente a pacientes jóvenes en edad laboral y cuyos costes indirectos suponen alrededor de dos tercios del coste global de la enfermedad25,31,32.
El modelo utilizado en el presente estudio ha sido presentado para la evaluación de belimumab por parte de diferentes agencias evaluadoras (Portugal, Polonia, Bélgica, etc), las cuales concluyeron que el modelo es robusto y captura adecuadamente las consecuencias clínicas y económicas del LES. Una de sus fortalezas fundamentales es la utilización de datos a nivel de paciente que alimentan el modelo de microsimulación; este tipo de enfoque permite describir con mayor detalle el transcurso de la enfermedad.
Con el objetivo de llevar a cabo un análisis conservador, los datos de eficacia procedieron únicamente de los estudios BLISS, cuyo objetivo primario se medía a las 52 semanas de tratamiento18,19. No obstante, ya se dispone de resultados de un estudio abierto a largo plazo. Los pacientes de este estudio fueron aquellos que completaron el ensayo clínico fase II de 52 semanas, doble ciego, controlado con placebo, así como su extensión de 24 semanas y continuaron recibiendo belimumab de forma abierta. Los resultados mostraron que el índice SRI aumenta progresivamente desde el 46% a las 52 semanas hasta el 65% a los 7 años33. Así mismo, los estudios realizados en práctica clínica habitual (estudios OBSErve) muestran una reducción sostenida en la puntuación de la escala SELENA-SLEDAI y la dosis y uso de esteroides, desde el inicio del tratamiento con Belimumab, hasta los 24 meses de terapia34,35.
La utilización de datos procedentes del estudio post-hoc realizado a requerimiento de la EMA20, si bien pudiera considerarse otra limitación, fue necesaria para adecuarse a la indicación de belimumab aprobada.
La falta de datos españoles, tanto para modelizar la enfermedad, como para estimar las utilidades y el absentismo laboral son otras de las limitaciones del presente estudio. Los estudios epidemiológicos en marcha en la actualidad, como el Registro nacional de pacientes con LES de la Sociedad Española de Reumatología (estudio RELESSER), podrían suponer un importante avance para evaluaciones futuras36.
Los valores del ICUR de belimumab obtenidos en el presente estudio se encuentran dentro del rango de valores publicado en otros países europeos (Italia, Polonia y Portugal), que oscilaron entre los 20.649€ y 28.754€ desde una perspectiva social y los 25.430€ y 36.335€ desde la perspectiva de sus respectivos sistemas sanitarios18,19,20.
En el futuro sería recomendable la realización de análisis coste-efectividad basados en datos de efectividad de belimumab en práctica clínica habitual y datos reales sobre costes directos e indirectos asociados al tratamiento.
Agradecimientos
A Maarten Treur, de Pharmerit International, quien desarrolló el modelo económico original y revisó los resultados del presente estudio.
A Isabel Pérez Escolano, del departamento de Evaluación de Medicamentos de GSK España, por su ayuda y valiosos comentarios al presente artículo.
Conflicto de intereses
Silvia Díaz, Javier Parrondo y Laura A. Vallejo son empleados de GSK España. Angel M. García Aparicio recibió honorarios por consultaría durante su participación en el estudio.
Todos los autores cumplen con los criterios de autoría especificados en los "Requisitos de uniformidad para manuscritos enviados a revistas biomédicas: escribir y editar para publicaciones Biomédicas", por lo que han contribuido de forma sustancial al desarrollo del trabajo:
Silvia Díaz, Javier Parrondo y Laura A. Vallejo han participado en la recopilación de datos, adaptación del modelo, análisis e interpretación de los datos y elaboración del artículo final.
Angel M. Aparicio ha participado en la validación de los datos y asunciones consideradas en el modelo, análisis e interpretación de los datos y elaboración del artículo final.
Bibliografía
1. Carmona L, Ballina J, Gabriel R, Laffon A on behalf of the EPISER Study Group. The burden of musculoskeletal diseases in the general population of Spain: results from a national survey. Rev Esp Reumatol 2001;60:1040-45. [ Links ]
2. López P, Mozo L, Gutiérrez C, Suárez A. Epidemiology of systemic lupus erythematosus in a northern Spanish population: gender and age infuence on immunological features. Lupus 2003;12:860-5. [ Links ]
3. Mak A, Cheung MW, Chiew HJ, Liu Y, Ho RC. Global trend of survival and damage of systemic lupus erythematosus: meta-analysis and meta-regression of observational studies from the 1950s to 2000s. Semin Arthritis Rheum. 2012;41:830-9. [ Links ]
4. Jolly M. How does quality of life of patients with systemic lupus erythematosus compare with that of other common chronic illnesses? J Rheumatol.2005;32:1706-8. [ Links ]
5. Schmeding A, Schneider M. Fatigue, health-related quality of life and other patient-reported outcomes in systemic lupus erythematosus. Best Practice & Research Clinical Rheumatology 2013;27:363-75. [ Links ]
6. Wolfe F, Michaud K, Li T, Katz RS. EQ-5D and SF-36 quality of life measures in systemic lupus erythematosus: comparisons with rheumatoid arthritis, noninflammatory rheumatic disorders, and fibromyalgia. J Rheumatol. 2010;37:296-304. [ Links ]
7. Campbell R Jr, Cooper GS, Gilkeson GS. Two Aspects of the Clinical and Humanistic Burden of Systemic Lupus Erythematosus: Mortality Risk and Quality of Life Early in the Course of Disease. Arthritis Rheum. 2008;59:458-64. [ Links ]
8. Alarcon GS, McGwin G, Jr., Uribe A, Friedman AW, Roseman JM, Fessler BJ, et al. Systemic lupus erythematosus in a multiethnic lupus cohort (LUMINA). XVII. Predictors of self-reported health-related quality of life early in the disease course. Arthritis Rheum 2004;51:465-74. [ Links ]
9. Almehed K, Carlsten H, Forsblad-d'Elia H. Health-related quality of life in systemic lupus erythematosus and its association with disease and work disability. Scand J Rheumatol 2010;39:58-62. [ Links ]
10. Rinaldi S, Doria A, Salaffi F, Ermani M, Iaccarino L, Ghirardello A, et al. Health-related quality of life in Italian patients with systemic lupus erythematosus. I. Relationship between physical and mental dimension and impact of age. Rheumatology (Oxford) 2004;43:1574-9. [ Links ]
11. Grupo de estudio de Enfermedades Autoinmunes Sistémicas, Sociedad Española de Medicina Interna. Lupus Eritematoso Sistèmico. Guías Clínicas de Enfermedades Autoinmunes Sistémicas, 2011. [ Links ]
12. Calvo-Alén J, Silva-Fernández L, Úcar-Angulo E, Pego-Reigosa JM, Olivé A, Martínez-Fernández C, et al. Consenso de la Sociedad Española de Reumatologia sobre el uso de terapias biológicas en el lupus eritematoso sistémico. Reumatol. Clin 2013;9:281-96. [ Links ]
13. Ficha Técnica Benlysta® (belimumab). Disponible en: http://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=detalleForm Consultado: Enero 2015. [ Links ]
14. Ramos-Casals M, Ruiz-Irastorza G, Jiménez-Alonso J, Khamashta MA, en nombre del Comité de Consenso sobre el uso de belimumab, Grupo de Trabajo de Enfermedades Autoinmunes Sistémicas (GEAS) de la Sociedad Española de Medicina Interna (SEMI). Recomendaciones sobre el uso de belimumab en el lupus eritematoso sistémico. Guía de Práctica Clínica GEAS-SEMI. Rev Clin Esp.2013;213:42-58. [ Links ]
15. Navarra SV, Guzman RM, Gallacher AE, Hall S, Levy RA, Jimenez RE, et al. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet 2011;26:721-31. [ Links ]
16. Furie R, Petri M, Zamani O, Cervera R, Wallace DJ, Tegzová D, et al. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum. 2011;63:3918-30. [ Links ]
17. Van Vollenhoven RF, Petri MA, Cervera R, Roth DA, Ji BN, Kleoudis CS, et al. Belimumab in the treatment of systemic lupus erythematosus: high disease activity predictors of response. Ann Rheum Dis. 2012;71:1343-9. [ Links ]
18. Gouveia M, Borges M, Augusto M, Costa J, Treur M, Lopes S. Cost-effectiveness and cost-utility analysis of belimumab for the treatment of patients with Systemic Lupus Erithematosus in Portugal. Value in Health 2013;16:A384. [ Links ]
19. Specchia ML, de Waure C, Gualano MR, Doria A, Turchetti G, Pippo L, et al. Health technology assessment of belimumab: a new monoclonal antibody for the treatment of systemic lupus erythematosus. Biomed Res Int. 2014;17;704207. [ Links ]
20. Walczak J, Kopel J, Sottys E, Dziurda D. Cost-utlity analysis of belimumab in the treatment of adult patientes with active, autoanti-body-positive Systemic Lupus Erithematousus (SLE). Value in Health 2013;16:A385. [ Links ]
21. Manzi S, Sanchez-Guerrero J, Merrill JT, et al. Effects of belimumab, a B lymphocyte stimulator-specific inhibitor, on disease activity across multiple organ domains in patients with systemic lupus erythematosus: combined results from two phase III trials. Ann Rheum Dis 2012;71:1833-1838. [ Links ]
22. Ibanez D, Urowitz MB, Gladman DD. Summarizing disease features over time: I. Adjusted mean SLEDAI derivation and application to an index of disease activity in lupus. J Rheumatol. 2003;30:1977-82. [ Links ]
23. Petri M. Lupus in Baltimore: evidence-based 'clinical pearls' from the Hopkins Lupus Cohort. Lupus. 2005;14(12):970-73. [ Links ]
24. Dolan P. Modeling valuations for EuroQoL health states. Med Care 1997;35:1095-1108. [ Links ]
25. Badia X, Roset M, Monserrat S, Herdman M. The Spanish VAS tariff based on valuation of EQ-5D health states from the general population. In: Rabin RE, et al, editors. EuroQol Plenary meeting Rotterdam 1997, 2-3 October. Discussion papers. Centre for Health Policy & Law, Erasmus University, Rotterdam, 1998:93-114. [ Links ]
26. Cervera R, Rúa-Figueroa I, Gil-Aguado A, Sabio JM, Pallarés L, Hernández-Pastor LJ, et al. Coste económico directo del control y el tratamiento del lupus eritematoso sistémico activo y sus brotes en España: estudio LUCIE. Rev Clin Esp. 2013;213:127-37. [ Links ]
27. Sutcliffe N, Clarke AE, Taylor R, Frost C, Isenberg DA. Total costs and predictors of costs in patients with systemic lupus erythematosus. Rheumatology (Oxford) 2001;40:37-47. [ Links ]
28. López Bastida J, Oliva J, Antoñanzas F, García-Altés A, Gisbert R, Mar J, et al. Propuesta de guía para la evaluación económica aplicada a las tecnologías sanitarias. Gac Sanit. 2010;24:154-70. [ Links ]
29. Sacristán JA, Oliva J, Del Llano J, Prieto L, Pinto JL. ¿Qué es una tecnología sanitaria eficiente en España? Gac Sanit. 2002;4:334-43. [ Links ]
30. De Cock E, Miravitlles M, González JR, Azanza-Perea JR. Valor umbral del coste por año de vida ganado para recomendar la adopción de tecnologías sanitarias en España: evidencias procedentes de una revisión de la literatura. Pharmacoeconomics. Spanish Research Articles 2007;4:97-107. [ Links ]
31. Lau CS, Mak A. The socioeconomic burden of SLE. Nat Rev Rheumatol 2009;5:400-4. [ Links ]
32. Huscher D, Merkesdal S, Thiele K, et al. Cost of illness in rheumatoid arthritis, ankylosing spondylitis, psoriatic arthritis and systemic lupus erythematosus in Germany. Ann Rheum Dis 2006;65:1175-83. [ Links ]
33. Ginzler EM, Wallace DJ, Merrill JT, Furie RA, Stohl W, Chatham WW, et al. Disease control and safety of belimumab plus standard therapy over 7 years in patients with systemic lupus erythematosus. J Rheumatol. 2014;41:300-9. [ Links ]
34. Collins C.E., Kan H., Dall'era M., Macahilig C., Pappu R., Molta C.T., et al. 24-month outcomes associated with belimumab in patients with systemic lupus erythematosus in clinical practice settings. Arthritis and Rheumatology 2014;66:S291. [ Links ]
35. Cortes J., Marras C., Luis Andreu J., Calvo-Alen J., Garcia-Aparicio A.M., Alvarez E.D., et al. Evolution of patients with systemic lupus erythematous treated with belimumab in clinical practice settings. Arthritis and Rheumatology 2014; 66: S291-S292. [ Links ]
36. Rúa-Figueroa I, López-Longo FJ, Calvo-Alén J, Galindo-Izquierdo M, Loza E, García de Yebenes MJ, et al. Registro nacional de pacientes con lupus eritematoso sistémico de la Sociedad Española de Reumatología: objetivos y metodología. Reumatol Clin. 2014;10:17-24. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: silvia.c.diaz@gsk.com
(Silvia Díaz Cerezo).
Recibido el 7 de febrero de 2015
Aceptado el 31 de marzo de 2015