Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.40 no.1 Toledo Jan./Fev. 2016
https://dx.doi.org/10.7399/fh.2016.40.1.8918
ORIGINALES
Quimioterapia al final de la vida; análisis de la práctica clínica en pacientes adultos onco-hematológicos con cáncer
Chemotherapy near the end of life; assessment of the clinical practise in onco-hematological in adult patients
Pilar Taberner Bonastre1, María Teresa Taberner Bonastre2, Enrique Soler Company1 y María Dolores Pérez-Serrano Lainosa1
1Hospital Arnau de Vilanova, Valencia.
2Hospital Universitario de la Ribera, Alzira. Spain.
Dirección para correspondencia
RESUMEN
Objetivo: garantizar una buena calidad de vida en la última fase de los pacientes onco-hematológicos debería ser nuestro principal objetivo; a pesar de ello, disponemos de pocos datos a nivel europeo y los estudios publicados son contradictorios. No obstante, la mayoría coinciden en que administrar quimioterapia en la etapa final de la vida impacta de forma negativa en la calidad de vida del paciente. El objetivo principal del estudio es analizar los indicadores de no agresividad del tratamiento en pacientes onco-hematológicos. Como objetivo secundario, realizar un estudio descriptivo de las variables clínicas de los pacientes a los que se les administra quimioterapia en la fase final de la vida y los esquemas más utilizados.
Método: se realizó un estudio observacional retrospectivo en un hospital de tercer nivel. Se incluyeron todos los pacientes oncológicos y hematológicos que recibieron quimioterapia (oral o intravenosa) entre enero y diciembre de 2013, a los que se les administró la última quimioterapia en los 90 días previos al fallecimiento.
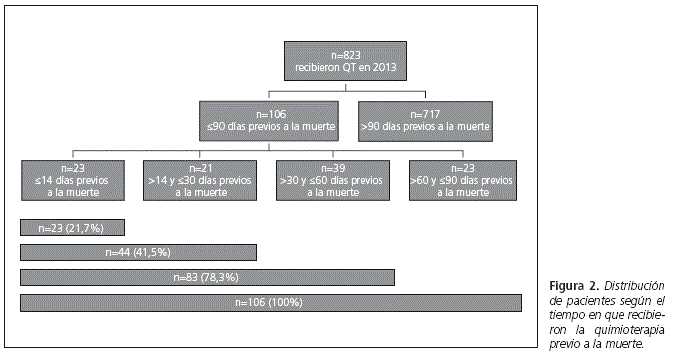
Resultados: se analizaron 823 pacientes que recibieron tratamiento entre enero y diciembre de 2013. De ellos, 106 (13%) cumplían los criterios de inclusión. Un 14,1% (n = 93) de los pacientes oncológicos y un 8,4% (n = 13) de los hematológicos que habían recibido quimioterapia durante el último año de vida lo seguían haciendo en los últimos tres meses. Un 21,7% (n = 23) de los pacientes recibieron quimioterapia en las dos últimas semanas, 41,5% (n = 44) en los últimos 30 días y 78,3% (n = 83) en los últimos dos meses de vida. El 67,9% (n = 72) de los pacientes ingresaron en el hospital durante los últimos tres meses de vida, el 47,2% (n = 50) lo hicieron durante el último mes, el 33% (n = 35) durante las dos últimas semanas y el 10,4% (n = 11) durante los últimos tres días de vida. El 25,5% (n = 27) de los pacientes ingresaron en más de una ocasión durante los 90 días previos al fallecimiento.
Conclusiones: según los criterios establecidos por Earle et al, la población del estudio se trató de manera agresiva al final de la vida. Es necesario disponer de una evidencia científica, que todavía en la actualidad carece de una base consolidada, con la que establecer criterios para la selección de pacientes con cáncer en estadios avanzados que puedan beneficiarse de recibir tratamientos antineoplásicos.
Palabras clave: Quimioterapia; Neoplasia; Muerte; Hospitalización.
ABSTRACT
Objective: ensure a good quality of life in the last phase of onco-hematological patients should be the primary goal, despite this, we have little data at European level and published studies are contradictory. Nevertheless, most of them agree saying that administrating chemotherapy near the end of life impacts negatively in the patients quality of life. The main objective of this study is to analyze the treatment non-aggressiveness parameters in onco-hematological patients. The secondary objective is to do a describing study of the clinical variables of the patients who receive chemotherapy at the end of life and the treatments more used.
Methods: a retrospective observational study was conducted in a tertiary hospital. Both, oncological and hematological patients receiving chemotherapy (oral or intravenous) between January and December 2013 who were receiving chemotherapy in the last 90 days before death, were included.
Results: there were 823 patients that were threated between January and December of 2013. Of these 106 (13%) met the inclusion criteria to be analyzed. There were a 14.1% (n = 93) of oncological and a 8.4% (n = 13) of hematologic patients that maintained the antineoplasic treatment during the last three months before death. A 21.7% (n = 23) of the patients received chemotherapy in the last two weeks of life, 41.5% (n = 44) in the last 30 days and 78.3% (n = 83) in the last two months of life. There was a 67.9% (n = 72) of patients that had hospital admissions during their last three months of life, 47,2% (n = 50) during the last month, 33% (n = 35) during the last two weeks and 10,4% (n = 11) during the last three days of life. A 25,5% (n = 27) of patients had more than one hospital admission during their last 90 days.
Conclusions: according to the Earle et al. criteria, our population had been treated aggressively. We need more scientific evidence with consolidate date that allows us to establish a unified criteria for the selection of patients with advanced cancer who may benefit from receiving antineoplasic treatments.
Key words: Chemotherapy; Neoplasm; Death; Hospitalization.
Aportación a la literatura científica
La calidad de vida en los pacientes con cáncer continúa siendo uno de los pilares fundamentales en la investigación para el tratamiento de pacientes onco-hematológicos. A pesar de ello, en la actualidad se dispone de pocos datos a nivel europeo sobre la calidad de vida en la última etapa de la enfermedad en pacientes con cáncer. Este estudio lleva a cabo el análisis de unos parámetros de intensidad terapéutica con agentes antineoplásicos al final de la vida. En el análisis se incluyen tanto los tratamientos antineoplásicos intravenosos como orales. La inclusión de los tratamientos de administración oral constituye un punto diferencial con la mayoría de estudios planteados hasta el momento que se centran en los tratamientos intravenosos. El resultado obtenido de nuestro estudio, demuestra que los pacientes de nuestra población reciben, en su mayoría, un tratamiento agresivo que está lejos de conseguir el objetivo principal de mejorar la calidad de vida de los pacientes.
A pesar de que el resultado obtenido en el estudio no se puede hacer extensivo a otras poblaciones de pacientes, los datos aportados consiguen evidenciar la necesidad de una mayor implicación por parte del equipo asistencial en la toma de decisiones terapéuticas. Para ello, es necesario disponer de una evidencia científica, que todavía en la actualidad carece de una base consolidada, con la que establecer criterios para la selección de pacientes con cáncer en estadios avanzados que puedan beneficiarse de recibir tratamientos antineoplásicos. El primer paso para conseguir esto es desbancar la idea mal concebida de que los tratamientos antineoplásicos contribuyen bajo cualquier circunstancia a mejorar la calidad de vida de los pacientes con cáncer en estadios avanzados.
Introducción
En las últimas décadas, han aparecido nuevos agentes antineoplásicos que han contribuido a aumentar las alternativas terapéuticas y la esperanza de vida de los pacientes con neoplasias. Adquieren especial relevancia los tratamientos de administración oral tanto por constituir una alternativa terapéutica en sí misma como por la simplificación en su administración. A pesar de estos avances, los tumores son actualmente la primera causa de muerte en los hombres, la segunda en mujeres y responsables del 27,5% de las defunciones en España según los datos publicados en enero de 2014 por el Instituto Nacional de Estadística1.
Alrededor del 70% de los pacientes con enfermedad diseminada reciben quimioterapia con intención paliativa2 . La decisión de iniciar quimioterapia depende principalmente del estado del paciente3, el estadio de la enfermedad4 y de la quimiosensibilidad5 del tumor. La interrupción del tratamiento en las etapas finales de la vida está considerada como un factor determinante de buena práctica clínica6,7. Esto es debido, entre otras causas, a la disminución del impacto sobre la supervivencia global tras varias líneas de tratamiento en pacientes con estadios avanzados8,9, la aparición de efectos adversos derivados del tratamiento y el coste para el sistema sanitario.
Garantizar una buena calidad de vida en la última fase de los pacientes onco-hematológicos debería ser el principal objetivo y, a pesar de ello, disponemos de pocos datos a nivel europeo5,8,10, los estudios publicados son contradictorios, la mayoría coinciden en que administrar quimioterapia en la etapa final de la vida impacta de forma negativa en la calidad de vida del paciente9.
Los estudios publicados hasta la actualidad, utilizan como indicadores de la calidad de vida el número de ingresos y tratamientos recibidos en las semanas previas al fallecimiento del paciente5,11. Earle et al.7, define el concepto de no agresividad de tratamiento como una administración de quimioterapia inferior al 10% en los últimos 14 días de vida y menos de un 4% de pacientes ingresados en más de una ocasión durante el mes previo al fallecimiento.
Otros estudios12-15 utilizan criterios como ingresos en unidades de cuidados intensivos, visitas a urgencias, hospitalizaciones o inclusión en ensayos clínicos fase I-II.
El objetivo principal del estudio es analizar los indicadores de no agresividad de tratamiento en pacientes onco-hematológicos. Como objetivo secundario, realizar un estudio descriptivo de las variables clínicas de los pacientes a los que se les administra quimioterapia en la fase final de la vida y los esquemas más utilizados.
Material y métodos
Se realizó un estudio observacional retrospectivo en un hospital de tercer nivel cuya área constituye una población de 310.000 habitantes aproximadamente. Se incluyeron todos los pacientes oncológicos y hematológicos que recibieron quimioterapia (oral o intravenosa) entre enero y diciembre de 2013 a los que se les administró la última quimioterapia en la fase final de la vida. A efectos de análisis, se consideró el periodo de tiempo que comprende los 90 días previos al fallecimiento. El seguimiento de los pacientes incluidos se continuó hasta marzo de 2014.
La recogida de datos se realizó a partir de los programas informáticos empleados en el Servicio de Farmacia para la atención a pacientes onco-hematológicos Farmasyst® y Farmis-Oncofarm® y los programas de historia clínica informatizada OrionClinic® y Abucasis®. Se recogieron las variables sexo, edad, servicio prescriptor, diagnóstico, estadio de la enfermedad, performance status, fecha de los últimos ingresos y causa de fallecimiento. Las variables recogidas relacionadas con el tratamiento incluyeron: tiempo desde la última administración hasta el fallecimiento, líneas de tratamiento recibidas y fármacos incluidos en el último tratamiento administrado.
Con el objetivo de valorar la situación funcional del paciente, se recogió la puntuación en la escala Eastern Cooperative Oncologic Group (ECOG) registrada en la historia clínica el día de la última quimioterapia administrada previa al fallecimiento. También se evaluó el número de ingresos hospitalarios en los últimos tres meses y el tiempo transcurrido desde el último ingreso hospitalario hasta la muerte de los pacientes.
Para el análisis descriptivo utilizamos el programa estadístico Stata® versión 12.1.
Resultados
En el 2013 fueron atendidos 2.758 pacientes en el Servicio de Oncología y 949 en el Servicio de Hematología. De ellos, el 24,3% (n = 669) y el 16,2% (n = 154), respectivamente recibieron quimioterapia. Por tanto, se analizaron 823 pacientes que recibieron tratamiento entre enero y diciembre de 2013. De ellos 106 (13%) cumplían los criterios de inclusión.
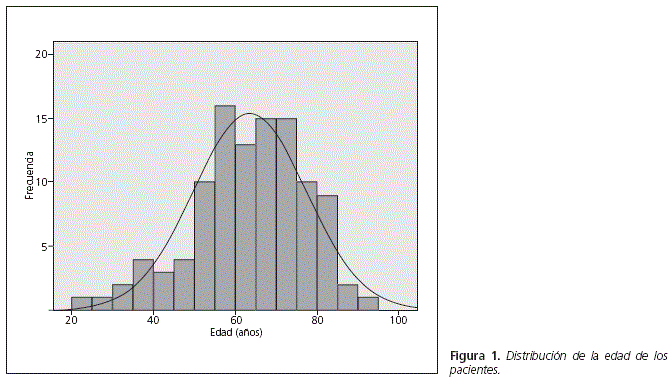
La mediana de edad de los pacientes incluidos fue 64,6 años (rango 21,9-92,5) (Fig. 1). El 68,9% (n = 73) eran varones y el 31,1% (n = 33) eran mujeres.
El servicio de procedencia de dichos pacientes era hematología en un 12,3% (n = 13) y oncología en un 87,7% de los casos (n = 93).
En el tratamiento se incluyeron tanto los fármacos de administración intravenosa como oral. Un 14,1% (n = 93) de los pacientes oncológicos y un 8,4% (n = 13) de los hematológicos que habían recibido quimioterapia durante el último año de vida, lo seguían haciendo en los últimos tres meses.
La distribución de los pacientes que recibieron fármacos antineoplásicos en los últimos 90 días de vida se muestra en la figura 2.
Se disponía del registro de los valores de la puntación de la escala ECOG al inicio del tratamiento en un 87,7% de los pacientes analizados. La mayoría (67% n = 71), presentaban una puntuación en la escala ECOG 0-1. Un 18,9% (n = 20) presentaba una puntuación de 2 y una minoría (1,9%, n = 2) un ECOG 3.
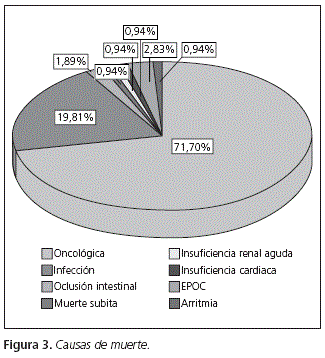
La mayoría de los pacientes (77,6%, n = 76) presentaban un estadio IV en el momento del fallecimiento y la muerte fue secundaria a su enfermedad de base. El 28,3% de los pacientes (n = 30) presentaron complicaciones secundarias al tratamiento como causa de la muerte (Fig. 3).
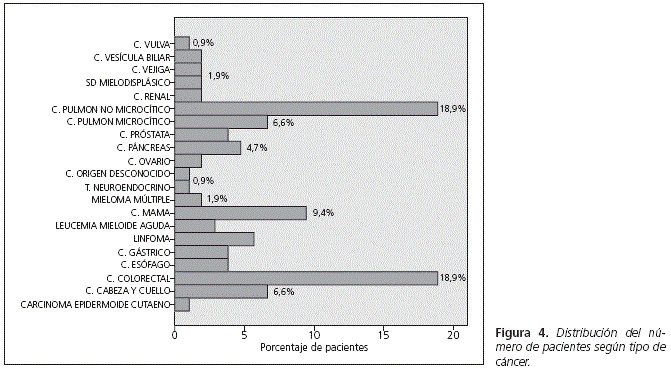
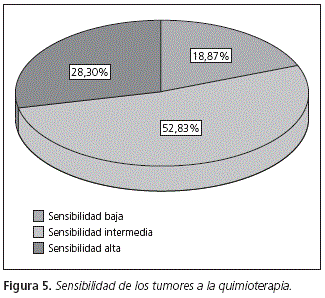
La distribución de los tumores que presentaban los pacientes incluidos en el estudio se muestran en la figura 4. El mayor porcentaje de tumores tienen una sensibilidad al tratamiento media según la clasificación de Martoni et al.5 (Fig. 5)
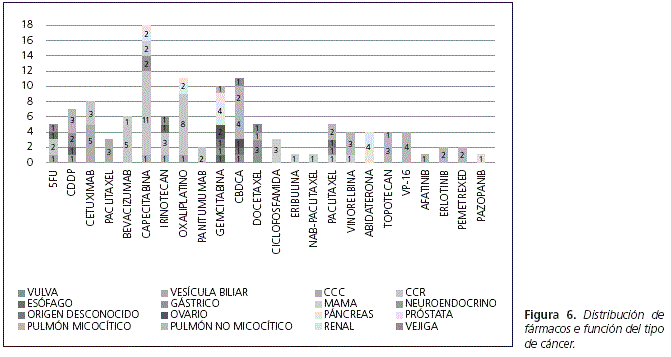
El esquema terapéutico más utilizado fue capecitabina en monoterapia administrado en 6 pacientes al igual que la combinación capecitabina, oxaliplatino. El topotecán se dispensó a 5 pacientes. Los siguientes tratamientos los recibieron cada uno de ellos 4 pacientes: abiraterona, docetaxel, gemcitabina, azacitidina, cetuximab, doxorrubicina, erlotinib y también las combinaciones bevacizumab, capecitabina, oxaliplatino; carboplatino, etopósido; carboplatino, paclitaxel y cetuximab, paclitaxel. La capecitabina fue el fármaco que recibió mayor número de pacientes 18,9% (n = 20) seguido del oxaliplatino 12,2% (n = 13) y la gemcitabina 9,4% (n = 10) (Fig. 6).
La mediana del número de esquemas recibidos fue de 2 (rango 1-7). Fueron 10 pacientes los que recibieron más de 3 esquemas diferentes.
El 67,9% (n = 72) de los pacientes ingresaron en el hospital durante los últimos tres meses de vida, 47,2% (n = 50) lo hicieron durante el último mes, 33% (n = 35) durante las dos últimas semanas y el 10,4% (n = 11) durante los últimos 3 días de vida. El 25,5% (n = 27) de los pacientes ingresaron en más de una ocasión a lo largo de los 90 días previos al fallecimiento.
Discusión
El empleo de quimioterapia en las últimas etapas de vida de los pacientes con cáncer es un tema controvertido que Emanuel et al.11. trataron hace más de una década y que continúa analizándose actualmente. Los resultados de nuestro estudio muestran que el porcentaje de pacientes del Servicio de Oncología que reciben quimioterapia en la última fase de vida es similar al de Earle et al.13
En cuanto a la utilización de quimioterapia en las últimas etapas de la vida respecto al total de pacientes que son tratados con este tipo de fármacos, el 5,8% recibieron quimioterapia en el último mes de vida. Este valor está próximo al 6,2% publicado por Wright et al.16, pero se aleja del 22,7% publicado por Angelo et al.5
Los últimos estudios publicados sobre el uso de quimioterapia en la fase final de vida9 y de la enfermedad, demuestran un perjuicio sobre la calidad de vida de los pacientes que la reciben con independencia del estado funcional al inicio del tratamiento. Las reacciones adversas derivadas del tratamiento pueden contribuir a empeorar la calidad de vida de los pacientes con tratamiento antineoplásico. Probablemente, la prescripción de capecitabina en lugar de 5-fluorouracilo se planteó en los pacientes del estudio con el fin de minimizar la aparición de reacciones adversas17,18.
En relación con los ingresos al final de la vida, nuestros pacientes ingresaron en un mayor porcentaje que los de otros estudios19,20. Según los criterios de Earle et al.7, nuestros pacientes recibieron un trato agresivo al final de su vida. Con el fin de mejor la práctica clínica y la toma de decisiones en relación con la administración de quimioterapia al final de la vida, se considera necesario la realización de más estudios que definan unos criterios según los cuales se establezcan las condiciones en las que se asegure una mejoría de la calidad de vida de los pacientes con cáncer en estadios avanzados.
La inclusión de los tratamientos de administración oral constituye un punto diferencial con la mayoría de estudios planteados hasta el momento que se centran en los tratamientos intravenosos. El resultado obtenido de nuestro estudio, demuestra que los pacientes de nuestra población reciben, en su mayoría, un tratamiento agresivo que está lejos de conseguir el objetivo primordial de mejorar la calidad de vida de los pacientes.
La necesidad de una mayor implicación por parte del equipo asistencial en la toma de decisiones terapéuticas. Para ello, es necesario disponer de una evidencia científica, que todavía en la actualidad carece de una base consolidada21, con la que establecer criterios para la selección de pacientes con cáncer en estadios avanzados que puedan beneficiarse de recibir tratamientos antineoplásicos. El primer paso para conseguir esto es desbancar la idea mal concebida de que los tratamientos antineoplásicos contribuyen bajo cualquier circunstancia a mejorar la calidad de vida de los pacientes con cáncer en estadios avanzados9.
Las limitaciones de este estudio vienen dadas por ser un estudio retrospectivo que analiza la muestra de un único centro durante un año, por lo que no puede hacerse extensivo a otras poblaciones.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: pitabo@hotmail.com
(Pilar Taberner Bonastre).
Recibido: el 7 de marzo de 2015;
Aceptado: el 2 de octubre de 2015.
Bibliografía
1. INE: Defunciones según la causa de muerte (Internet). Madrid: Instituto Nacional de Estadística. (Actualizado 31-01-2014; citado 7-08-2014). Disponible en: http://www.ine.es/prensa/np830.pdf. [ Links ]
2. Kim MK, Lee JL, Hyun MS, Do YR, Song HS, Kim JG, et al. Palliative chemotherapy preferences and factors that influence patient choice in incurable advanced cancer. Jpn J Clin Oncol. 2008;38:64-70. [ Links ]
3. Schnipper LE, Smith TJ, Raghavan D, Blayney DW, Ganz PA, Mulvey TM, et al. American Society of Clinical Oncology identifies five key opportunities to improve care and reduce costs: the top five list for oncology. J Clin Oncol. 2012;30:1715-24. [ Links ]
4. NCI: Cáncer de seno (mama): Tratamiento para profesionales de salud (Internet). EE.UU: Instituto Nacional del Cáncer. (Revisada 08-2014, citado: 15-09-2014). Disponible en: http://www.cancer.gov/espanol/pdq/tratamiento/seno/HealthProfessional. [ Links ]
5. Angelo Martoni A, Tanneberger S, Mutri V. Cancer chemotherapy near the end of life: the time has come to set guidelines for its appropriate use. Tumori. 2007;93:417-22. [ Links ]
6. Zhang B, Nilsson ME, Prigerson HG. Factors important to patients' quality of life at the end of life. Arch Intern Med. 2012;172:1133-42. [ Links ]
7. Earle CC, Neville BA, Landrum MB, Souza JM, Weeks JC, Block SD, et al. Evaluating claims-based indicators of the intensity of end-of-life cancer care. Int J Qual Health Care. 2005;17:505-9. [ Links ]
8. Adam H, Hug S, Bosshard G. Chemotherapy near the end of life: a retrospective single-centre analysis of patients' charts. BMC Palliat Care. 2014,22;13-26. [ Links ]
9. Prigerson HG, Bao Y, Shah MA, Paulk ME, LeBlanc TW, Schneider BJ, et al. Chemotherapy use, performance status, and quality of life near death chemotherapy at the end of life. JAMA Oncol. (revista en Internet). 2015 (citado 20/8/2015). Disponible en: http://oncology.jamanetwork.com/article.aspx?articleid=2398177. [ Links ]
10. Näppä U, Lindqvist O, Rasmussen BH, Axelsson B. Palliative chemotherapy during the last month of life. Ann Oncol. 2011;22:2375-80. [ Links ]
11. Emanuel EJ, Young-Xu Y, Levinsky NG, Gazelle G, Saynina O, Ash AS. Chemotherapy use among Medicare beneficiaries at the end of life. Ann Intern Med. 2003;138:639-43. [ Links ]
12. Kao S, Shafiq J, Vardy J, Adams D. Use of chemotherapy at the end of life in oncology patients. Ann Oncol. 2009;20:1555-59. [ Links ]
13. Earle CC, Neville BA, Landrum MB, Ayanian JZ, Block SD, Weeks JC. Trends in the aggressiviness of cancer care near the end of life. J Clin Oncol. 2004;22:315-21. [ Links ]
14. Earle CC, Park ER, Lai B, Weeks JC, Ayanian JZ, Block SD. Identifying potential indicators of the quality of en-of-life cancer care from administrative data. J Clin Oncol. 2003;21:1133-38. [ Links ]
15. Enzinger AC, Zhang B, Weeks JC, Prigerson HG. Clinical trial participation as part of end-of-life cancer care: associations with medical care and quality of life near death. J Pain Symptom Manage. 2013;47:1078-90. [ Links ]
16. Wright AA, Zhang B, Keating NL, Weeks JC, Prigerson HG. Associations between palliative chemotherapy and adult cancer pantients' end of life care and place of death: prospective cohort study. Br Med J. 2014;348:g1219. [ Links ]
17. Walko CM, Lindley C. Capecitabine: a review. Clin Ther. 2005;27:23-44. [ Links ]
18. Hoff P.M, Ansari R, Batist G., et al. Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: Results of a randomized phase III study. J Clin Oncol. 2001;19:2282-92. [ Links ]
19. Zerillo JA, Stuver SO, Fraile B, Dodek AD, Jacobson JO. Understanding oral chemotherapy prescribing patterns at the end of life at a comprehensive cancer center: analysis of a Massachusetts payer claims database. JOP (revista en Internet). 2015 (citado 22/8/2015). Disponible en: http://jop.ascopubs.org/content/early/2015/08/04/JOP.2015.003921.abstract. [ Links ]
20. Keam B, Oh Dy, Lee SH, Kim DW, Kim MR, Im SA, et al. Aggressiveness of cancer-care near the end-of-life in Korea. Jpn J Clin Oncol. 2008;38:381-6. [ Links ]
21. Hong JH, Rho SY, Hong YS. Trends in the aggressiveness of end-of-life cancer for advanced stomach cancer patients. Cancer Res Treat. 2013;45:270-75. [ Links ]











 texto em
texto em