Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.40 no.2 Toledo mar./abr. 2016
https://dx.doi.org/10.7399/fh.2016.40.2.9268
Prescripción hospitalaria de medicamentos en condiciones fuera de ficha técnica
Off-label prescription of drugs at hospital
Vicente Arocas Casañ1, Jaime Mateo Carmona1, Olga García Molina1, M.a Ángeles Fernández de Palencia Espinosa1, M.a José Blázquez Álvarez1, M.a Amelia de la Rubia Nieto1 and Jesús del Río García2
1Pharmacy Unit, Hospital Clínico Universitario Virgen de la Arrixaca, Murcia.
2Pharmacology Section, Universidad de Murcia.
Dirección para correspondencia
RESUMEN
Objetivos: Desarrollar un proceso de gestión de medicamentos en condiciones fuera de ficha técnica y analizar los tratamientos, indicaciones y unidades clínicas que los solicitan, qué variables influyen en la decisión de autorización y su impacto económico.
Métodos: Se diseñó un procedimiento según el cual los clínicos cumplimentarían las solicitudes, el Servicio de Farmacia redactaría los informes valorando su eficacia, seguridad, conveniencia y coste, y la dirección médica tomaría la decisión de aceptar o no su uso. Se analizaron las solicitudes de los últimos cinco años.
Resultados: Se recibieron 834 solicitudes, autorizándose el 88,1%. Las tasas de autorización fueron mayores para los Servicios Pediátricos (95,7% frente a 86,6%; p < 0,05). Las razones por las que las prescripciones se consideraron fuera de ficha técnica fueron: diferente indicación (73,2%), combinación diferente (10,2%), línea diferente (8,6%) y edad diferente (8%). El 73,4% de las solicitudes fueron de antineoplásicos, siendo rituximab (120) y bevacizumab (103) los más prescritos. La calidad de la evidencia que avalaba las prescripciones fue moderada-baja, aunque sin demostrar relación directa con la probabilidad de aprobación (p = 0,413). El coste de los medicamentos aprobados fue de 8.567.537 € y el ahorro teórico de los denegados 2.268.642 €. El porcentaje de autorización disminuyó según aumentó el gasto de manera estadísticamente significativa (p < 0,05, test t de Student).
Conclusiones: La responsabilidad de evaluación de las prescripciones fuera de ficha técnica ha recaído en los Servicios de Farmacia. La calidad de la evidencia no ha demostrado ser una variable decisiva para la aprobación de los tratamientos. En cambio, la edad y el coste sí que han demostrado influir significativamente.
Palabras clave: Usos fuera de lo indicado; Prescripciones de medicamentos; Ensayos de uso compasivo.
ABSTRACT
Objectives: To develop a procedure for management of off-label medications, and to analyze the treatments, indications, and hospital units which will request them more frequently, as well as which variables will have an impact on the authorization decision, and its economic impact.
Methods: A procedure was designed where clinicians would complete request forms and the Hospital Unit would prepare reports assessing their efficacy, safety, convenience, and cost. The request forms for the past five years were analyzed.
Results: A total of 834 applications were received, and 88.1% of these were accepted. The authorization rates were higher for Paediatric Units (95.7% vs. 86.6%; p<0.05). The reasons for considering prescriptions as off-label were: different indication (73.2%), different combination (10.2%), different line of treatment (8.6%) and different age (8%). A 73.4% of requests were for antineoplastic drugs, and the most frequently prescribed were rituximab (120) and bevacizumab (103). The quality of evidence supporting the prescriptions was moderate-low, though no direct relationship with the likelihood of approval was demonstrated (p = 0.413). The cost of the approved medications was 8,567,537 €, and the theoretical savings for those drugs rejected was of 2,268,642 €. There was a statistically significant decrease in the authorization rate (p < 0.05, Student's t test) when spending increased.
Conclusions: The responsibility for assessing off-label prescriptions has fallen on the Pharmacy Unit. It has not been demonstrated that the quality of evidence represents a decisive variable for approval of treatment; on the other hand, age and cost have demonstrated a significant impact.
Key words: Off-Label Use; Medication prescriptions; Compassionate Use Trials.
Aportación a la literatura científica.
Ésta es la serie más completa sobre la prescripción de medicamentos en condiciones fuera de ficha técnica. A diferencia de otras publicaciones anteriores, en la nuestra se incluyen todos los grupos de edad y especialidades médicas.
Nuestra experiencia puede ayudar a que más Servicios de Farmacia participen en procesos orientados a impulsar la farmacoterapia basada en la evidencia, como propone la iniciativa 2020 de la Sociedad Española de Farmacia Hospitalaria.
Introducción
El Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales, reglamenta el acceso en España a medicamentos en condiciones fuera de ficha técnica (FFT)1.
El uso FFT ocurre en todas las especialidades, pero es más común en aquellas donde es menos probable que se incluyan pacientes en los ensayos clínicos (pediatría, psiquiatría, obstetricia-ginecología)2,3. En un estudio norteamericano, el 21% de las prescripciones de los 160 medicamentos más usados fueron FFT4. En pediatría se ha observado hasta un 80%5,6, en oncología hasta un 50%7-11 y en psiquiatría hasta el 76%12,13. La mayoría presentaron poca o ninguna evidencia científica que los apoyara14. En España existen pocos estudios, observándose en una reciente publicación un 22,3% de prescripciones FFT15.
Hasta la aprobación del RD 1015/2009, el procedimiento para utilizar los medicamentos en condiciones FFT era claro y uniforme, teniendo la Agencia Española del Medicamento y Productos Sanitarios la responsabilidad para autorizar el empleo de los medicamentos de uso compasivo16-18.
Desde la entrada en vigor del RD 1015/2009, esta responsabilidad ha sido transferida a las comisiones u órganos colegiados equivalentes de cada comunidad autónoma, iniciando un proceso de adaptación que ha originado la pérdida de esta uniformidad19,20.
En nuestra comunidad, hasta 2013 no se creó una comisión regional que pudiera hacerse responsable de esta nueva situación, por lo que cada hospital tuvo que idear un procedimiento propio de actuación21.
El objetivo principal de este proyecto fue desarrollar un proceso de gestión de los medicamentos en condiciones FFT dentro del hospital para adecuarnos al RD 1015/2009 y, a su vez, cumplir el objetivo 2.3 de la iniciativa 2020 de la Sociedad Española de Farmacia Hospitalaria (SEFH): el Servicio de Farmacia (SF) participará activamente en programas orientados a que los pacientes reciban una farmacoterapia basada en la evidencia22.
Como objetivos secundarios nos planteamos, en primer lugar, analizar cuáles eran los tratamientos e indicaciones más habituales y las unidades clínicas que los solicitaban con más frecuencia; en segundo lugar, investigar qué variables del paciente o de los tratamientos influían en la decisión de autorización de un fármaco; y por último cual era el impacto económico de los fármacos autorizados y el gasto teórico que hubiera supuesto utilizar los denegados.
Métodos
Para adaptarnos al RD 1015/2009, se diseñó un Procedimiento Normalizado de Trabajo (PNT) basado en el publicado por el grupo GENESIS (Grupo de Evaluación de Novedades, EStandarización e Investigación en Selección de medicamentos) de la SEFH23. Este PNT fue aprobado por la Comisión de Farmacia y Terapéutica (CFT) y la Dirección Médica del hospital, que asumió la responsabilidad de autorización de los tratamientos con el apoyo técnico del Área de Evaluación y Selección de Medicamentos (AESM) del SF.
Según este PNT, el clínico debería cumplimentar un impreso de solicitud con datos de filiación, tratamientos anteriores, tratamientos alternativos y razones que justificaran el tratamiento solicitado, adjuntando las referencias bibliográficas disponibles.
El AESM dispondría de siete días para elaborar un informe de evaluación con un análisis de eficacia, seguridad, conveniencia y coste del tratamiento solicitado y de sus alternativas en las condiciones específicas del paciente, con una propuesta de aprobación o denegación por la Dirección del Hospital.
Este análisis incluye las solicitudes individualizadas recibidas en los últimos cinco años, desde el 1 de octubre de 2009 hasta el 30 de septiembre de 2014, tanto para pacientes ingresados, como para ambulatorios y externos.
Fueron excluidos de este análisis los tratamientos sujetos a protocolos FFT desde el momento de su aprobación por la CFT del hospital, así como los tratamientos FFT individualizados desde el momento en que recibieron la indicación por parte de las Agencias Reguladoras. Para este análisis se revisaron los impresos de solicitud recibidos, los informes de evaluación individualizados realizados por el AESM del SF y las historias clínicas cuando fue necesario.
La tasa de autorización de los tratamientos se consideró la variable principal, y se analizó en función de los datos demográficos de los pacientes (edad y sexo), el servicio clínico solicitante, el fármaco o combinaciones de fármacos, la indicación para la que se solicitaba el tratamiento, la razón por la que el tratamiento se consideraba FFT, las evidencias de eficacia y seguridad disponibles en el momento de la redacción del informe y el coste del tratamiento.
Las causas que motivaron la consideración de los tratamientos como FFT se dividieron en cuatro grupos:
1. Indicación no aprobada en la ficha técnica (FT). Cuando la patología concreta solicitada no coincidía con la descrita en la FT.
2. Indicación no aprobada para la edad del paciente. Cuando el paciente no pertenecía al grupo de edad específico al que iba dirigido el tratamiento según la indicación descrita en la FT o cuando este grupo de edad había sido excluido de forma explícita.
3. Indicación en una línea de tratamiento diferente a la aprobada en la FT. Cuando en la FT se especificaba una línea de tratamiento concreta que no coincidía con la línea solicitada.
4. Prescripción en una combinación de fármacos diferente a la aprobada en la FT. Cuando en la FT se especificaba una combinación de fármacos concreta que no coincidía con la solicitada.
Las evidencias se clasificaron según el sistema GRADE (Grading of Recomendations, Assesment, Development and Evaluation) en evidencia alta, moderada, baja y muy baja24.
• Evidencia alta: meta-análisis, ensayo clínico aleatorizado, revisión sistemática de ensayos clínicos aleatorizados.
• Evidencia moderada: ensayos clínicos controlados bien diseñados pero no aleatorizados, ensayos aleatorizados en otra línea de tratamiento extrapolables, ensayos aleatorizados en otra población extrapolables, estudios de cohortes o de casos y controles de alta calidad y multicéntricos.
• Evidencia baja: estudios de cohortes o de casos y controles, múltiples series comparadas en el tiempo.
• Evidencia muy baja: series de casos, opinión de expertos.
Para calcular el coste se consideró la duración del tratamiento según los estudios disponibles y el coste de adquisición del hospital. Para duraciones mayores a 12 meses se estimó exclusivamente el coste del primer año. En los cálculos se empleó el precio real de adquisición del hospital (PVL - descuentos + IVA). No se cuantificaron otros costes médicos directos asociados, como costes de administración, estancias hospitalarias, ni indirectos, aunque todos ellos se tuvieron en cuenta de forma cualitativa en la toma de decisiones.
Los datos fueron analizados utilizando el programa SPSS para Windows versión 19.0. La relación estadística entre la evidencia científica y la decisión de la Dirección Médica, y la relación entre la tasa de autorización entre unidades clínicas de adultos y pediátricas se calcularon mediante el test de Χ2. La relación entre el coste y la decisión de la Dirección Médica se calculó según el test t de Student. Se tomó como valor estadísticamente significativo p<0,05, corrigiendo el alfa por Bonferroni para comparación de subgrupos, evitando los falsos positivos. Para ello se tomó como significación estadística p<0,05/ no de comparaciones.
Resultados
El PNT diseñado fue seguido ampliamente en el hospital, recibiéndose en el periodo estudiado 834 solicitudes individualizadas de tratamientos FFT. De ellas, se autorizó el 88,1%. El 51,3% fueron para pacientes varones. La mediana de edad de los pacientes fue de 50 años (Tabla 1).
Según la razón que motivó que el tratamiento se considerara FFT, fueron mayoritarias las peticiones que se debieron a indicación no aprobada en la FT con un 73,2% de las peticiones, aprobándose el 87,5%. Cuando la solicitud se realizó porque la edad del paciente era distinta a la recogida en la ficha técnica (8% de las solicitudes) se autorizaron el 100%. El porcentaje más bajo de autorizaciones se produjo en las peticiones en las que se solicitaba un tratamiento en una línea diferente a la autorizada (8,6% de las solicitudes y 75% de autorizaciones (Tabla 2).
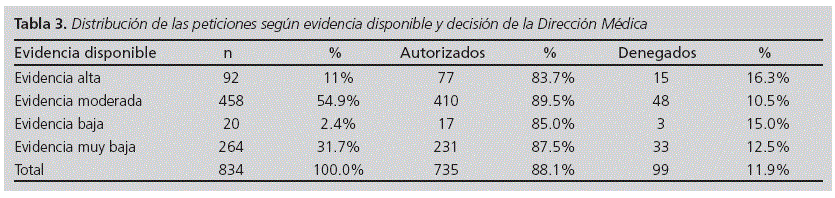
Respecto a la evidencia disponible en el momento de realizarse la solicitud, la tabla 3 resume su distribución. Se compararon los niveles de evidencia respecto a las decisiones de autorización o denegación, no observándose diferencias significativas (p=0,413, test de Χ2).
Se realizó la distribución de medicamentos solicitados según la clasificación ATC (Tabla 4). Se observó que el grupo de medicamentos más solicitados fueron los anti-neoplásicos con un 73,4% (612). Los fármacos con mayor número de peticiones fueron: rituximab (120), bevacizumab (103), y bendamustina (65) (Figura 1).
Las indicaciones más repetidas fueron gliomas (72), linfoma de células B (46) y carcinoma epitelial de ovario (33).
En la tabla 5 se describen las indicaciones más frecuentes con la correspondiente decisión de la dirección médica.
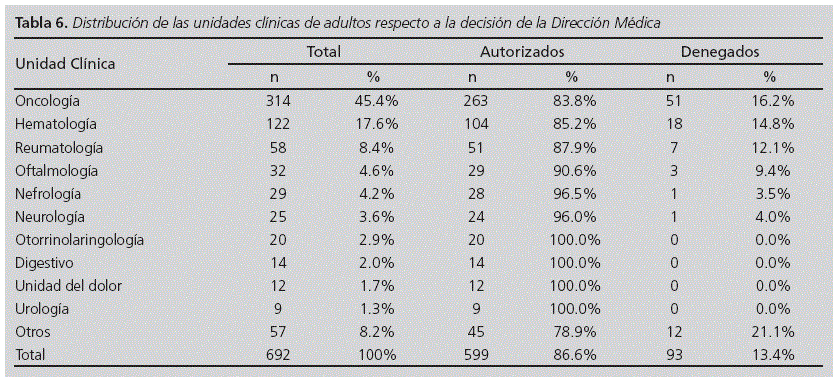
El 83,0% de las solicitudes procedieron de unidades clínicas de adultos y el 17% de pediátricas. La distribución de las solicitudes por unidades clínicas se desglosa en las tablas 6 y 7.
La tasa de autorización de las solicitudes de las unidades pediátricas (95,7%) fue superior a la de las de adultos (86,6%) (p<0,05, test de Χ2).
Se calculó el coste teórico que suponían los medicamentos aprobados alcanzándose un gasto total de 8.567.537 €. El gasto total de farmacia en el periodo estudiado (octubre de 2009 a septiembre de 2014) ascendió a 250.702.423 €. Por lo tanto, el gasto en fármacos FFT supuso un 3,42% del gasto total de farmacia. La mediana del coste por paciente fue de 8.544 € [1.970, 16.101]. Se pudo observar como los tratamientos cuyos costes estaban comprendidos entre 0 y 1.000 € fueron autorizados en un 96,8% (123), mientras que entre 50.000 y 100.000 € solo lo fueron en el 50% de las ocasiones (12) (Tabla 8).
El porcentaje de autorización disminuyó según aumentó la franja de gasto de manera estadísticamente significativa (p<0,05, test t de Student).
Los tratamientos denegados, en el caso de que se hubieran aprobado, hubieran ocasionado un gasto de 2.268.642 € con una mediana de coste por paciente de 14.010 € [4.684, 35.935]. Esto hubiera supuesto un 0,90% del gasto de medicamentos en ese periodo.
Discusión
Creemos que éste es el estudio más completo y amplio realizado desde el cambio de legislación aprobado en septiembre de 2009. Abarca un periodo de cinco años e incluye información de más de 800 solicitudes de tratamientos en condiciones FFT.
En nuestro país existen pocos estudios sobre el uso FFT15,25. Existen trabajos descriptivos sobre las tasas de autorización de medicamentos FFT en hospitales pero con un bajo número de peticiones en estudio. Nuestras tasas de autorización son más altas que las descritas por Pérez-Moreno en el Hospital Virgen del Rocío (88,1% frente al 60,8%) aunque en aquel caso se trataba de un estudio de menos de 2 años de duración y solo 51 solicitudes. Respecto a las unidades clínicas que más solicitudes presentan, los resultados son similares, siendo éstas las unidades onco-hematológicas en ambos estudios20.
Aunque se han publicado varios trabajos en otros países, éstos no contemplan la legislación española4. En otras ocasiones, los estudios han recogido aspectos parciales de la terapéutica, como tratamientos oncológicos26, tratamientos en población pediátrica27,28 o solo algunos grupos de fármacos29,30. Nuestro trabajo incluye todas las especialidades médicas y grupos poblacionales atendidos en un hospital clínico universitario de tercer nivel.
A pesar del elevado número de solicitudes tramitadas en este periodo, este procedimiento solo ha podido aplicarse a los medicamentos sobre los que el Servicio de Farmacia tiene un mayor control: medicamentos de uso restringido, citostáticos de alto impacto económico, medicamentos dispensados a pacientes externos y fármacos no incluidos en la Guía Farmacoterapéutica. Ésta es una limitación importante, ya que se tiene constancia por la bibliografía publicada que, por ejemplo, la prescripción en pediatría es mayoritariamente fuera de ficha técnica6,31. Otro ejemplo lo encontramos en la prescripción de tratamientos quimioterápicos, ya que, según la Sociedad Americana del Cáncer, hasta la mitad de las prescripciones de medicamentos citostáticos no se ajustan a su FT10.
Contrariamente a lo que cabría esperar, en nuestro estudio no se demuestra una relación directa entre la calidad de la evidencia publicada y la probabilidad de aprobación de un tratamiento. Una explicación razonable la encontramos en el hecho de que en muchas ocasiones, a pesar de que un tratamiento esté avalado por estudios importantes, existen otros tratamientos con la misma evidencia de eficacia y seguridad a un coste menor. En otras ocasiones, por el contrario, a pesar de que las evidencias eran escasas, la falta de otras alternativas terapéuticas hizo que se aceptaran tratamientos avalados únicamente por pequeñas series de casos o incluso por casos aislados. Por otro lado, en algunas indicaciones, como vejiga hiperactiva, se autorizaron todos los tratamientos solicitados, ya que las evidencias disponibles eran sólidas. En otros casos, la necesidad de iniciar el tratamiento lo antes posible por la gravedad del cuadro clínico, hizo que se aprobaran todos los casos por vía urgente (neuromielitis óptica, rechazo agudo humoral).
Por el contrario, el coste sí ha demostrado tener una relación directa con la probabilidad de aprobación. Esta relación es lógica, ya que, a mayor coste, mayor probabilidad hay de que el coste eficacia incremental esté por encima de los umbrales habitualmente aceptados.
Otra variable que ha demostrado tener mucha influencia en la decisión de la dirección médica es el hecho de que la causa que determinara que el tratamiento se considerara FFT fuera la edad del paciente. Habitualmente los ensayos clínicos se realizan predominantemente en pacientes adultos. Por lo tanto, tratamientos con gran experiencia de utilización en adultos no disponen de indicación aprobada en la población pediátrica. En nuestra serie, todos los tratamientos de este tipo fueron aprobados, independientemente de la calidad de la evidencia disponible en población pediátrica. Por otro lado, esta aprobación masiva de los tratamientos no supuso un impacto económico importante ya que, aunque en número de solicitudes alcanzó un 8,0% del global, el coste se limitó a 254.870 €, el 2,97% del importe teórico de los tratamientos autorizados.
Por el contrario, cuando la causa de que el fármaco se considerara FFT fue su utilización en una línea diferente a la autorizada, la tasa de denegaciones fue significativamente mayor que para el resto de situaciones. Destaca el alto número de tratamientos denegados en cáncer de mama debido, en su mayoría, a la existencia de otros tratamientos más coste-efectivo con indicación aprobada en FT.
Otro problema con el que nos encontramos fue el de clasificar la evidencia disponible. El hecho de no disponer de indicación aprobada está directamente relacionado con la escasez de estudios bien diseñados que avalen la eficacia y seguridad de un tratamiento. La ausencia de grandes estudios randomizados fue una constante habitual. Finalmente nos decidimos por emplear el sistema GRADE23, que consideramos que era el que más se ajustaba a nuestras necesidades.
Además, la evidencia fue cambiante, ya que durante el periodo de cinco años que ocupa nuestro análisis, continuamente fueron apareciendo nuevas evidencias. Algunos tratamientos, que en principio fueron tramitados como FFT, posteriormente recibieron la indicación por la EMA. Esto ocurrió, por ejemplo con everolimus en cáncer de mama, con la toxina botulínica en incontinencia urinaria o con bevacizumab en cáncer de ovario.
También ha habido otras variables de difícil control que han influido y que no se han registrado en este estudio, como disponibilidad de alternativas terapéuticas al tratamiento solicitado, situación clínica del paciente, presión familiar, insistencia del facultativo prescriptor, urgencia de los tratamientos, etc.
A pesar de que se ha intentado que el procedimiento de elaboración de los informes de utilidad terapéutica fuera lo más homogéneo y reproducible posible, hay que tener en cuenta la variabilidad personal de los autores de cada uno de los informes. En su redacción han participado todos los residentes que han realizado rotación por el AESM desde octubre de 2009 hasta septiembre de 2014. Aunque todos los informes han sido revisados por el facultativo responsable del área antes de ser derivados a la Dirección Médica, el hecho de haber sido redactados por varios autores diferentes ha podido influir en su homogeneidad.
Otra de las posibles limitaciones de nuestro estudio puede ser la falta de registro de los resultados clínicos alcanzados con los tratamientos administrados, lo que ayudaría a valorar su eficiencia.
En nuestro SF, el cambio de normativa en 2009 ha aumentado notablemente la actividad del AESM. El ahorro de 2,2 millones de € que se ha dejado de emplear en tratamientos poco eficientes o que disponían de alternativas terapéuticas más adecuadas demuestra, una vez más, el alto valor añadido del SF en conseguir una terapéutica individualizada de calidad, segura y eficiente, dando así cumplimiento a la misión de los SF de hospital.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: vicentearocas@hotmail.com
(Vicente Arocas Casañ).
Recibido el 14 de mayo de 2015;
aceptado el 9 de diciembre de 2015.
Bibliografía
1. Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales. Boletín Oficial del Estado, no 174, (20 de julio de 2009). [ Links ]
2. Wittich CM, Burkle CM, Lanier WL. Ten common questions (and their answers) about off-label drug use. Mayo Clin Proc. 2012;87(10):982-90. [ Links ]
3. Danes Carreras I, Vallano Ferraz A, de la Cruz Sugranes G, Juarez Giménez JC, Arnau de Bolos JM. Utilización de medicamentos y condiciones de uso recomendadas en pediatría. An Esp Pediatr. 2002;57(5):414-9. [ Links ]
4. Radley DC, Finkelstein SN, Stafford RS. Off-label prescribing among office-based physicians. Arch Intern Med. 2006;166(9):1021-6. [ Links ]
5. Shah SS, Hall M, Goodman DM, Feuer P, Sharma V, Fargason C Jr, et al. Off-label drug use in hospitalized children. Arch Pediatr Adolesc Med. 2007;161(3):282-90. [ Links ]
6. Pandolfini C, Bonati M. A literature review on off-label drug use in children. Eur J Pediatr. 2005;164 (9):552-8. [ Links ]
7. Leveque D. Off-label use of anticancer drugs. Lancet Oncol. 2008;9(11):1102-7. [ Links ]
8. Roila F, Ballatori E, Labianca R, De Braud F, Borgonovo K, Martelli O, et al. Off-label prescription of antineoplastic drugs: an Italian prospective, observational, multicenter survey. Tumori. 2009;95(6):647-51. [ Links ]
9. Pearson SA, Ringland CL, Ward RL. Trastuzumab and metastatic breast cancer: trastuzumab use in Australia-monitoring the effect of an expensive medicine access program. J Clin Oncol. 2007;25(24):3688-93. [ Links ]
10. The American Cancer Society. Off-label drug use. (Página Web). Estados Unidos. (Consultado 15/05/2015). Disponible en: http://www.cancer.org/Treatment/TreatmentsandSideEffects/Treatment-Types /Chemotherapy/off-label-drug-use [ Links ]
11. Kalis JA, Pence SJ, Mancini RS, Zuckerman DS, Ineck JR. Prevalence of off-label use of oral oncolytics at a community cancer center. J Oncol Pract. 2015;11(2):e139-43. [ Links ]
12. Martínez-Lazcano MT, Esplá-González S, Herraiz-Robles P, Hernández-Pérez P, Chillerón-Cuenca R, Pol-Yanguas E. Use of valproic acid in long stay units of psychiatry. Farm Hosp. 2015;39(2):92-101. [ Links ]
13. Kharadi D, Patel K, Rana D, Patel V. Off-label drug use in Psychiatry Outpatient Department: A prospective study at a Tertiary Care Teaching Hospital. J Basic Clin Pharm. 2015; 6(2):45-9. [ Links ]
14. Mellor JD, Van Koeverden P, Yip SW, Thakerar A, Kirsa SW, Michael M. Access to anticancer drugs: many evidence-based treatments are off-label and unfunded by the Pharmaceutical Benefits Scheme. Intern Med J. 2012;42(11):1224-9. [ Links ]
15. García-Sabina A, Rabunal Rey R, Martínez-Pacheco R. Revisión sobre el uso de medicamentos en condiciones no incluidas en su ficha técnica. Farm Hosp. 2011;35(5):264-77. [ Links ]
16. Monedero MA. Uso compasivo. En: Suñé JM, Bel E. Formación Continuada para Farmacéuticos de Hospital. 1a Ed. Barcelona: Ferrer Grupo; 2001. p. 109-16. [ Links ]
17. Real Decreto 223/2004, de 6 de febrero, por el que se regulan los ensayos clínicos con medicamentos. Boletín Oficial del Estado, no 33 (7 de febrero de 2004). [ Links ]
18. Ley 29/2006, de 26 de julio, de Garantías y Uso Racional de los Medicamentos y Productos Sanitarios. Boletín Oficial del Estado, no 178 (27 de julio de 2006). [ Links ]
19. Delgado O, Puigventós F, Clopés A. Position of the hospital pharmacist regarding the use of medication in non-authorised conditions. Farm Hosp. 2009;33(5):237-9. [ Links ]
20. Pérez-Moreno MA, Villalba-Moreno AM, Santos-Ramos B, Marín-Gil R, Varela-Aguilar JM, Torello-Iserte J, et al. Off-label approval of drug use in a tertiary hospital. Rev Calid Asist. 2013;28(1):12-8. [ Links ]
21. Orden de 26 de julio 2012 de la Consejería de Sanidad y Política Social por la que se crean y se establece la composición, organización y funcionamiento del Comité Regional de Evaluación de Tecnologías Sanitarias y de la Comisión Regional de Farmacia. Boletín Oficial de la Región de Murcia, no 182 (7 de agosto de 2012). [ Links ]
22. Grupo 2020. Objetivos 2020. (Monografía en internet). Madrid. Sociedad Española de Farmacia Hospitalaria; (citado 15/04/2015). Disponible en: http://gruposdetrabajo.sefh.es/2020/index.php?option=com_wrapper&view=wrapper&Itemid=2 [ Links ]
23. Grupo GENESIS. Propuesta GENESIS de PNT para la utilización en el hospital de medicamentos fuera de indicación, fuera de ficha técnica u off label. (Monografía en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 2009 (Consultado 15/04/2015). Disponible en: http://gruposdetrabajo.sefh.es/genesis/genesis/Enlaces/PNT_FFT_GENESIS_Borrador_07 _11_2009.pdf [ Links ]
24. GRADE working group. GRADE. (Página Web). (Consultada 10/04/2015). Disponible en: http://www.gradeworkinggroup.org/ [ Links ]
25. Lozano Ortiz R. Drug use in off-label dosage regimes. Farm Hosp. 2015;39(2):122-6. [ Links ]
26. Conti RM, Bernstein AC, Villaflor VM, Schilsky RL, Rosenthal MB, Bach PB. Prevalence of off-label use and spending in 2010 among patent-protected chemotherapies in a population-based cohort of medical oncologists. J Clin Oncol. 2013;31(9):1134-9. [ Links ]
27. Morales-Carpi C, Estan L, Rubio E, Lurbe E, Morales-Olivas FJ. Drug utilization and off-label drug use among Spanish emergency room paediatric patients. Eur J Clin Pharmacol. 2010;66(3):315-20. [ Links ]
28. Ruiz-Antorán B, Pineiro R, Avendano C, Roman E, Cilleruelo ML, Gutierrez-Junquera C, et al. Drug utilization and off-label drug use in Spanish pediatric gastroenterology outpatients. J Pediatr Gastroenterol Nutr. 2013;56(2):173-7. [ Links ]
29. Porta A, Espósito S, Menson E, Spyridis N, Tsolia M, Sharland M, et al. Off-label antibiotic use in children in three European countries. Eur J Clin Pharmacol. 2010;66(9):919-27. [ Links ]
30. Fukada C, Kohler JC, Boon H, Austin Z, Krahn M. Prescribing gabapentin off label: Perspectives from psychiatry, pain and neurology specialists. Can Pharm J (Ott). 2012;145(6):280-4. [ Links ]
31. Bazzano AT, Mangione-Smith R, Schonlau M, Suttorp MJ, Brook RH. Off-label prescribing to children in the United States outpatient setting. Acad Pediatr. 2009;9(2):81-8. [ Links ]











 texto en
texto en