Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.40 no.2 Toledo Mar./Abr. 2016
https://dx.doi.org/10.7399/fh.2016.40.2.9753
Evaluación de la calidad del etiquetado de muestras para investigación clínica
Assessment of the quality of sample labelling for clinical research
Pablo Pérez-Huertas1, María Tordera-Baviera1, Concepción Martínez-Nieto2, Natalia Benito-Zazo1, Ana García-Robles1 and José Luis Poveda-Andrés1
1Pharmacy Service, Hospital Universitario y Politécnico La Fe, Valencia.
2Pharmacy Service, Hospital Universitario de la Princesa, Madrid.
Dirección para correspondencia
RESUMEN
Objetivo: Evaluar la calidad de las etiquetas de muestras para ensayos clínicos mediante la normativa vigente y analizar su posible correlación con las características específicas de cada muestra.
Método: Estudio transversal multicéntrico en el que se analizaron las muestras de ensayos clínicos de dos hospitales de tercer nivel. Se estudió la presencia de los once ítems de la Directiva 2003/94/CE, el nombre del ensayo y la dosis en la portada de la etiqueta como variables de calidad del etiquetado. Se analizó la influencia de las características propias de la muestra con la calidad del etiquetado.
Resultado: Se analizaron un total de 503 muestras de 220 ensayos. La calidad media del etiquetado, entendido como el porcentaje de ítems del Anexo 13, fue del 91,9%. El 6,6% no contenía el nombre de la muestra en la cara externa de la etiqueta, mientras que a un 9,7% les faltaba la dosis. Las muestras con presentación de tipo ensayo clínico presentaron mayor calidad (p < 0,049), el enmascaramiento disminuía la calidad (p = 0,017) y la identificación por número de kit o por paciente la aumentaban (p < 0,01). La variable promotor fue la que más variabilidad introdujo en el análisis.
Conclusiones: La calidad media del etiquetado es adecuada en la mayoría de las muestras del ensayo clínico. Resulta preocupante la ausencia de información esencial, como el código del ensayo clínico y el período de validez, en algunas muestras que pueden ser fuente potencial de errores de dispensación o de administración.
Palabras clave: Etiqueta de medicamentos; Ensayo clínico; Errores médicos.
ABSTRACT
Objective: To assess the quality of the labels for clinical trial samples through current regulations, and to analyze its potential correlation with the specific characteristics of each sample.
Method: A transversal multicenter study where the clinical trial samples from two third level hospitals were analyzed. The eleven items from Directive 2003/94/EC, as well as the name of the clinical trial and the dose on the label cover, were considered variables for labelling quality. The influence of the characteristics of each sample on labelling quality was also analyzed.
Outcome: The study included 503 samples from 220 clinical trials. The mean quality of labelling, understood as the proportion of items from Appendix 13, was of 91.9%. Out of these, 6.6% did not include the name of the sample in the outer face of the label, while in 9.7% the dose was missing. The samples with clinical trial-type samples presented a higher quality (p < 0.049), blinding reduced their quality (p = 0.017), and identification by kit number or by patient increased it (p < 0.01). The promoter was the variable which introduced the highest variability into the analysis.
Conclusions: The mean quality of labelling is adequate in the majority of clinical trial samples. The lack of essential information in some samples, such as the clinical trial code and the period of validity, is alarming and might be the potential source for dispensing or administration errors.
Key words: Drug labelling; Clinical trials; Medical errors.
Aportación a la literatura científica
El presente artículo estudia un aspecto poco común pero de gran trascendencia, la calidad del etiquetado dentro de los ensayos clínicos. No hay ningún artículo publicado en la literatura que refleje la calidad y cantidad de información disponible en la etiqueta y su posible relación con errores de dispensación y administración. Por tanto, este trabajo supone la primera publicación sobre la calidad del etiquetado en investigación clínica.
Introducción
Los fármacos que pertenecen a ensayos clínicos son más complejos de dispensar y administrar que los medicamentos convencionales1. Además, las consecuencias de un error son más peligrosas y difíciles de detectar1. En este sentido, cada vez más muestras requieren una preparación previa a la dispensación/administración en el servicio de farmacia lo que aumenta el riesgo de error2. El etiquetado correcto de las muestras para investigación clínica es un aspecto fundamental para evitar los errores de medicación tanto por parte de los pacientes como de los profesionales sanitarios3,4,5. Por ello, en las etiquetas debe aparecer la máxima información posible de una forma clara, concisa y facilitando la búsqueda y transmisión de la información.
A esta mayor complejidad se le suma la dificultad a la hora de buscar información por parte de los pacientes. Éstos no van a poder acceder a los medios habituales de comunicación como su médico de familia o el farmacéutico comunitario. Sólo pueden resolver sus dudas si están recogidas en la hoja de información al paciente o contactando con el investigador principal o con la unidad de ensayos clínicos del servicio de farmacia hospitalario donde recogen su medicación. De esta forma, la etiqueta de la propia muestra de ensayo clínico se convierte en la fuente de información inmediata y en algunas ocasiones la única disponible.
Para que un medicamento en investigación clínica pueda llegar a los pacientes debe pedir su aprobación a las agencias reguladoras. Entre toda la información que el laboratorio debe enviar se encuentra una copia de la etiqueta que va a llevar adherida el fármaco1. Según el Anexo 13 de la Directiva 2003/94/CE, esta etiqueta debe llevar incluidos hasta once ítems (Tabla 1) para cumplir con la normativa. Sin embargo, en la propia directiva especifica que se puede obviar cualquiera de estos ítems siempre y cuando esté debidamente justificado. Esta afirmación es una puerta abierta para que los laboratorios puedan reducir la información disponible en las etiquetas sin que por ello dejen de cumplir con la normativa. En la Directiva se pone como ejemplo de justificación la gestión mediante un sistema electrónico centralizado de aleatorización (IVRS o IWRS). El IVRS/IWRS es un sistema interactivo de respuesta de voz vía telefónica o por web utilizado para controlar gestiones telemáticas de los ensayos cliínicos, como la gestión de stocks o la aleatorización de pacientes.
Uno de los aspectos que genera un mayor obstáculo tanto para pacientes como para los profesionales sanitarios es el enmascaramiento de los fármacos a estudio1. Para identificar correctamente el fármaco en la dispensación es fundamental que la información más importante como es el nombre del medicamento y la dosis esté presente en la portada de la etiqueta, es decir, en la cara más externa de la etiqueta. Estos dos datos destacables pueden verse obviados en un mayor porcentaje en las muestras enmascaradas, haciéndolas más susceptibles a los errores de dispensación.
El objetivo principal de este estudio es evaluar la calidad del etiquetado de muestras para ensayos clínicos entendido como el porcentaje de ítems del Anexo 13 presentes en la etiqueta de la muestra y el porcentaje de muestras con el nombre y la dosis en el exterior del etiquetado. Además nos planteamos analizar como influían las características propias de cada muestra en dicha calidad. Como objetivos secundarios nos planteamos estudiar la relación entre la calidad de la etiqueta y la gestión mediante un sistema IVRS/IWRS y la relación entre el enmascaramiento de muestras y la presencia de nombre y dosis de la muestra en la portada de la etiqueta.
Métodos
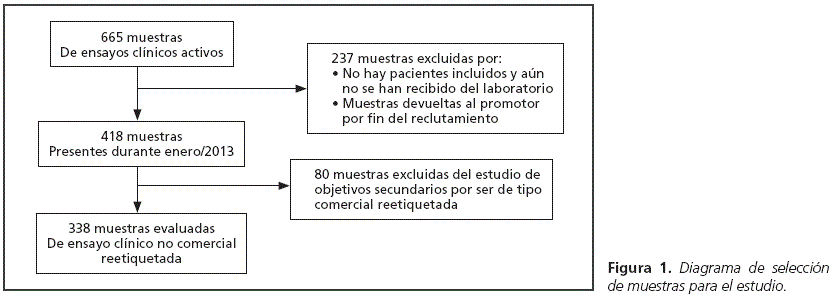
Estudio transversal multicéntrico en el que se analizó la calidad del etiquetado de las muestras en investigación clínica de la Unidad de Ensayos Clínicos del Hospital Universitario y Politécnico La Fe y del Hospital La Princesa de Madrid. Se recogieron datos desde el 1 de enero hasta el 31 de enero de 2013 en ambos hospitales. Los criterios de inclusión fueron que el ensayo clínico al que perteneciera estuviera activo y que la muestra estuviera presente en la unidad durante el tiempo del estudio (Figura 1).
Las variables recogidas se clasifican en dos grupos: datos de la muestra y datos de calidad del etiquetado. Los datos de la muestra incluyen: nombre de la muestra, ensayo clínico al que pertenece, promotor, ubicación en el almacén de ensayos clínicos, tipo de presentación (muestra de ensayo clínico o comercial reetiquetada), identificación (por número de kit, número de aleatorización, nombre de paciente o sin identificar), enmascaramiento y si está gestionada a través de un sistema IVRS/ IWRS. Para determinar la calidad del etiquetado, medimos el porcentaje de ítems del Anexo 13 citados en la Directiva 2003/94/CE presentes en cualquier lugar de la etiqueta (Tabla 1). Los ítems compuestos por varios apartados diferentes se evaluaron también por separado.
Por otro lado, se estudió la proporción de estos ítems en el acondicionamiento primario de la muestra, es decir, la parte del envase en contacto directo con el medicamento (blísters, viales, etc.). Se realizó debido a que en algunos casos la dispensación al paciente se realiza tras el fraccionamiento de un envase, mientras que la preparación en farmacia siempre se realiza a partir de este acondicionamiento primario.
Además, se recogió el número de muestras que contenían en la cara más externa de la etiqueta el nombre de la muestra y la dosis. Dado que las muestras comerciales reetiquetadas no se gestionan en su mayoría mediante IVRS/IWRS se decidió excluirlas del análisis de los objetivos secundarios para evitar el falseamiento de los datos.
La recogida de datos de las muestras se realizó por dos evaluadores independientes. Ante una discrepancia la muestra fue reevaluada por un tercero. Ante una discrepancia en la información sobre una misma muestra entre los dos centros se evaluó también por un tercer agente. Se midió la cantidad de discrepancias para muestras similares entre los dos hospitales para medir el grado de subjetividad.
Para la recogida de datos se extrajo del programa EnsayosPK® en el caso de La Fe y el programa oficial de ensayos clínicos en el de La Princesa un listado con las muestras registradas en la unidad y se creó una hoja de recogida de datos. Toda la información se informatizó en una base de datos Access®. El análisis estadístico se llevó a cabo utilizando modelos de regresión logística, siendo la variable dependiente la calidad y las independientes las características de las muestras. Este análisis se realizó mediante el programa R® versión 3.1.2.
Resultados
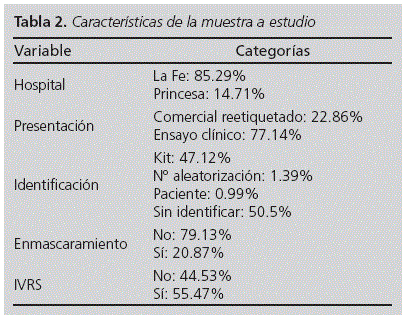
Se analizaron un total de 503 muestras, 429 del Hospital La Fe y 74 del Hospital de La Princesa, pertenecientes a 220 ensayos clínicos y 94 promotores diferentes. En la Tabla 2 se muestran las características de las muestras a estudio. No se encontraron diferencias estadísticamente significativas (p=0.378) en cuanto a la recogida de datos por los dos centros participantes para muestras similares.
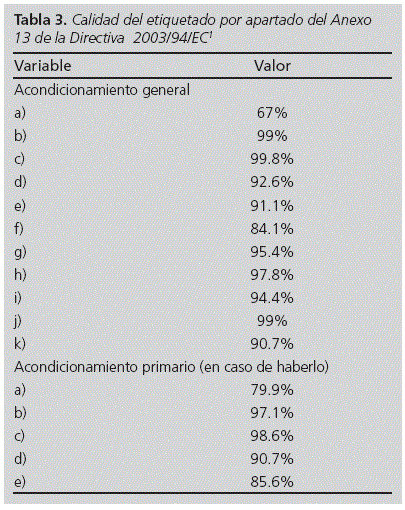
La calidad media del etiquetado, entendido como el porcentaje de ítems del Anexo 13, fue del 91.9%. En la Tabla 3 se detallan los porcentajes obtenidos por apartados. Los ítems a) y b) que no estaban completamente presentes en la etiqueta se evaluaron por separado. De esta manera, al 6.2% de las muestras no presenta el nombre del promotor, al 10.9% le faltaba la dirección del promotor, y al 37.8% les faltaba el teléfono. Respecto a las muestras que no tenía completo el ítem b), al 0.2% les faltaba la forma farmacéutica, al 0.8% la vía de administración y al 0.2% el número de unidades. De las 503 muestras estudiadas un 6.6% no contenía el nombre de la muestra en la cara externa de la etiqueta, mientras que un 9.7% les faltaba la dosis. Además, había un 5.8% de muestras que no contenían ni nombre de la muestra ni la dosis.
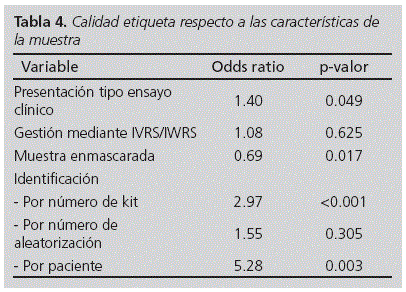
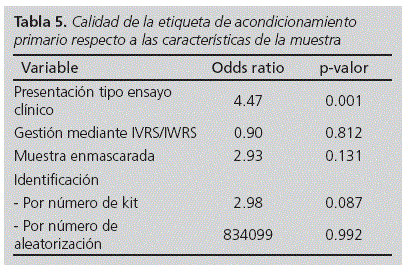
Debido a la escasez de casos para algunas variables estudiadas se creó una variable resumen de la calidad, representada por el porcentaje medio de presencia de los 11 ítems del Anexo 13, para medir la influencia de las características de la muestra sobre la calidad del etiquetado. Como se puede observar en la Tabla 4 la presentación de tipo ensayo clínico aumenta la calidad de manera significativa (p = 0.049), el enmascaramiento disminuye la calidad (p = 0.017), y la identificación por número de kit o por paciente aumentan la calidad de la etiqueta (p < 0.001 y p = 0.003). Además se estudió la influencia de estas características de la muestra sobre los ítems del Anexo 13 en las muestras con etiqueta en el acondicionamiento primario (Tabla 5). En este caso, sólo la presentación de tipo ensayo clínico aumenta la calidad del etiquetado con significación estadística. Por otro lado, se estudió el efecto del promotor sobre la calidad de la etiqueta encontrando que es el factor que aporta mayor variabilidad a la calidad.
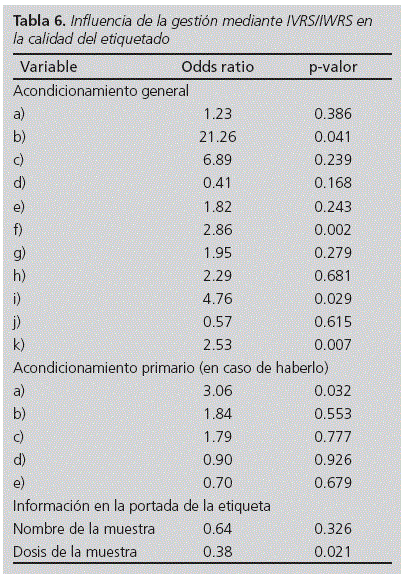
El 69.6% de las muestras con presentación de ensayo clínico se gestionaban mediante un sistema IVRS/IWRS. El análisis estadístico mediante regresión logística señala que los ítems b), f), i) y k) están más presentes cuando se gestiona la muestra mediante este sistema con significación estadística. Por el contrario, parece que el nombre y la dosis está menos presente el exterior de la etiqueta en las muestras IVRS/IWRS, aunque solo de manera estadísticamente significativa para la dosis (Tabla 6). Por otro lado, las muestras pertenecientes a ensayos clínicos enmascarados tienen un porcentaje inferior de información, nombre de la muestra y dosis, en la portada de la etiqueta (Tabla 7).
Discusión
Los errores de medicación han sido extensamente estudiados durante los últimos años constatando su importancia en número y repercusión clínica. Sin embargo, los errores asociados a los fármacos en fase experimental no han sido evaluados debido a que al estar más regulados e individualizados se ocasionan en un menor porcentaje. Los pocos estudios publicados revelan que los errores de medicación se producen durante los ensayos clínicos en porcentajes nada despreciables5. Incluso hay experiencias donde los errores de medicación llegan a condicionar los resultados de eficacia del ensayo clínico7 o errores que han ocasionado muertes en los participantes8.
En un estudio reciente se realizó un análisis modal de fallos y errores (AMFE) en el área de ensayos clínicos donde se observó que los procesos con mayor riesgo de error eran la dispensación y la preparación de las muestras2. Para evitar errores en la preparación de muestras citostáticas de ensayo clínico se han utilizado sistemas integrales de trazabilidad automatizado desde la unidad de ensayos clínicos hasta la administración9.
La labor de análisis del etiquetado es una competencia exclusiva de las agencias reguladoras previa a la distribución de los medicamentos experimentales. Los profesionales sanitarios tenemos la obligación de corroborar el cumplimiento de la normativa y asegurar que la etiqueta contiene una cantidad y calidad de información suficiente para reducir al mínimo los errores en la dispensación y administración de estos medicamentos10,11. De acuerdo con la Royal Pharmaceutical Society británica12, los servicios de farmacia hospitalaria debe asegurar que la muestra en investigación tenga la suficiente calidad antes de realizar la primera dispensación. Por lo tanto, es obligación de todos los profesionales sanitarios involucrados en ensayos clínicos comunicar a las agencias reguladoras cualquier etiquetado de mala calidad aunque ésta cumpla con la normativa vigente.
Aunque la calidad media de todas las muestras estudiadas haya resultado alta, con porcentajes mayores al 90% en casi todas las variables, sorprende la ausencia en algunas muestras de información esencial para cualquier medicamento. Por ejemplo, el 7.4% de las muestras no contenía el código del ensayo o contenía varios códigos diferentes, facilitando la confusión del personal sanitario encargado de dispensar muestras similares de ensayos diferentes. El 5.6% no especificaba las condiciones en las que debe conservarse el fármaco, dando lugar a que el paciente en casa no tenga la certeza de si debe guardar el medicamento en nevera o a temperatura ambiente. Además, el 1% no contenía algo tan básico y necesario para asegurar la eficacia y seguridad de un fármaco como la fecha de caducidad. Pese a que la ausencia de estos ítems sea minoritaria constituye una importante fuente de errores que pueden alcanzar al paciente.
La gestión mediante IVRS/IWRS es una de las excepciones por la cual los laboratorios están exentos de facilitar toda la información recogida en el Anexo 13 por lo que a priori teníamos la hipótesis de que la calidad de estas etiquetas sería menor. Por el contrario, estas etiquetas presentan una mayor calidad media en términos estadísticos. No obstante, se puede observar una tendencia que no llega a ser significativa estadísticamente hacia la ausencia de los ítems más importantes: código del ensayo clínico y período de validez. Sí que parece haber una clara relación negativa estadísticamente significativa entre la gestión mediante IVRS/IWRS y la cantidad de información en la portada de la etiqueta. En otro sentido, hemos demostrado que la portada de las etiquetas de muestras enmascaradas tiene una menor calidad. Este hecho puede suponer una mayor probabilidad de errores en la dispensación por lo que se deberían implantar medidas para evitarlos, como separar físicamente muestras enmascaradas de dosis diferentes.
No hay artículos similares publicados que evalúen la calidad del etiquetado de muestras en investigación clínica. En una comunicación a un congreso de Rabuñal13 estudiaron la adaptación de la información del etiquetado de las muestras para ensayo clínico a la normativa vigente. Obtuvieron porcentajes muy similares a los nuestros en los 11 ítems del Anexo 13 en las 204 muestras que evaluaron.
En nuestro estudio encontramos que la variable promotor aporta una gran variabilidad en el análisis estadístico. Sin embargo, el elevado número de promotores diferentes hace que resulte muy complicado encontrar diferencias significativas entre ellos, haría falta aumentar el tamaño muestral para poder sacar conclusiones. De la misma forma, sería necesario un amplio estudio multicéntrico para poder encontrar diferencias significativas en aquellas tendencias que se han observado pero que no llegan a mostrar significación estadística.
En cuanto a las limitaciones del estudio, pese al elevado número de muestras estudiadas no se pudo conseguir la suficiente potencia estadística para detectar diferencias significativas por el bajo número de eventos en cada variable y por el elevado número de variables estudiadas. Por otro lado, aunque se realizó una doble evaluación independiente de las muestras existe un grado de subjetividad que se debe tener en consideración.
En conclusión, la calidad media del etiquetado es adecuada en la mayoría de muestras de ensayo clínico estudiadas. Sin embargo, resulta preocupante la ausencia de información esencial, como el código del ensayo clínico y el período de validez, que puede ser una fuente potencial de errores de dispensación o de administración. Se requiere una mayor implicación de los profesionales sanitarios y más estudios que evalúen la calidad del etiquetado y su asociación con los errores de medicación.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: perez_pabhue@gva.es
(Pablo Pérez Huertas).
Recibido el 10 de agosto de 2015;
aceptado el 25 de enero de 2016.
Bibliografía
1. Comisión Europea. Normas de Correcta Fabricación de Medicamentos en Investigación (Monografía de internet). 2003 (Citado 10-08-2015). p. 1-20. Disponible en: http://www.aemps.gob.es/investigacionClinica/medicamentos/docs/anexo-13_EC.pdf [ Links ]
2. Alfaro ER, Sánchez MI, Desongles T, Santos MD. Análisis modal de fallos y efectos aplicado al área de ensayos clínicos. O.F.I.L. 2015, 25;3:145-153. [ Links ]
3. Hellier E, Edworthy J, Derbyshire N, Costello A. Considering the impact of medicine label design characteristics on patient safety. Ergonomics. 2006;49(5-6):617-30. [ Links ]
4. Vredenburgh AG, Zackowitz IB. Drug labeling and its impact on patient safety. Work. 2009;33(2):169-74. [ Links ]
5. Bohand X, Simon L, Perrier E, Mullot H, Lefeuvre L, Plotton C. Frequency, types, and potential clinical significance of medication-dispensing errors. Clinics (Sao Paulo). 2009;64(1):11—6. [ Links ]
6. Alexander JH, Levy E, Lawrence J, Hanna M, Waclawski AP, Wang J, et al. Documentation of study medication dispensing in a prospective large randomized clinical trial: experiences from the ARISTOTLE Trial. Am Heart J. 2013;166(3):559-65. [ Links ]
7. Richards CF, Cannon CP. Reducing medication errors: potential benefits of bolus thrombolytic agents. Acad Emerg Med. 2000;7(11):1285-9. [ Links ]
8. Sanks RJ. A pharmacy manager's perspective on a serious adverse drug event. Am J Health Syst Pharm. 1999;56(9):907-9. [ Links ]
9. De Pedro Ambrosio V, Frias Lopez Carme. Seguridad desde la recepción a la administración de citotóxicos y ensayos clínicos mediante un sistema de trazabilidad integral automatizado. Hospital ParcTauli, Sabadell. 58o Congreso Nacional de la Sociedad Española de Farmacia Hospitalaria y Encuentro Iberoamericano de Farmacéuticos de Hospital. Málaga, Octubre 2013. [ Links ]
10. Quevedo de Torres A, Pérez Bravo L, Fernández-Fernández A. Participación del farmacéutico de hospital en la investigación clínica. Farm Hosp. 1999;23:24-41. [ Links ]
11. Generalitat. Conselleria de Sanitat. Estudios Clínicos y Observacionales de Productos Farmacéuticos de la Comunitat Valenciana no 07 (Monografía de internet). 2011 (Citado 10-08-2015). p. 1-16. Disponible en: http://www.san.gva.es/documents/152919/170020/RevistaEstudiClinic07.pdf [ Links ]
12. Royal Pharmaceutical Society of Great Britain. Professional Guidance on Pharmacy Services for Clinical Trials Version 1 (Monografía de internet).2013 (Citado 10-08-2015). p. 1-19. Disponible en: http://www.rpharms.com/support-pdfs/professional-guidance--n-pharmac y-services-for-clinical-trials-141013.pdf [ Links ]
13. Sociedad Española de Farmacia Hospitalaria. 57 Congreso Nacional de la Sociedad Española de Farmacia Hospitalaria. Comunicaciones científicas (Monografía de internet). 2012 (Citado 10-08-2015). p. 88. Disponible en: http://www.sefh.es/sefhpublicaciones/documentos/57-congreso/Congreso-SEFH-comuni caciones-2012.pdf [ Links ]











 texto em
texto em