Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.40 no.6 Toledo nov./dic. 2016
https://dx.doi.org/10.7399/fh.2016.40.6.9103
Evidencia de la exposición a fármacos citostáticos del personal sanitario: revisión de la literatura reciente
Evidence of exposure to cytostatic drugs in healthcare staff: a review of recent literature
Pablo Martín Lancharro1, Nuria de Castro-Acuña Iglesias2, Francisco-Javier González-Barcala3 y José Domingo Moure González4
1 Occupational Risk Prevention Unit. Complejo Hospitalario Universitario de Santiago de Compostela.
2 Central Department for Occupational Risk Prevention. Galician Health System.
3 Pulmonology Department. Complejo Hospitalario Universitario de Santiago de Compostela.
4 Paediatrics Department. Complejo Hospitalario Universitario de Santiago de Compostela. Spain.
Dirección para correspondencia
RESUMEN
Objetivo: Disponer de la evidencia más actual y conocer las medidas a aplicar para evitar la exposición laboral a citostáticos.
Método: Se realizó una búsqueda bibliográfica en las bases de datos MEDLINE, COCHRANE PLUS y WEB OF SCIENCE con los términos "surface contamination", "antineoplastic drug", "drug preparation", "occupational exposure", "safe handling" y "closed-system transfer device" para el periodo 2010-2015.
Resultados: Se seleccionaron 13 artículos para la revisión. Estos artículos corresponden a hospitales de USA, Canadá, Japón, Australia, España, Portugal y Alemania. En todos ellos se ha encontrado contaminación por fármacos citostáticos en más de 15 superficies distintas con concentraciones que van desde los 1,69 ng/cm2 hasta 4,784 μg/cm2. Los fármacos determinados han sido ciclofosfamida, ifosfamida, 5-fluorouracilo, metotrexato, paclitaxel, cisplatino, gemcitabina y docetaxel. El sistema cerrado reduce la contaminación de las superficies de trabajo significativamente, pero no la elimina.
Conclusiones: Se verifica la presencia de contaminación por fármacos citostáticos en numerosos hospitales de los 5 continentes. En todos los casos se ha encontrado contaminación en la cabina, en el suelo frente a la cabina y en otros lugares de la farmacia. El fármaco más frecuentemente encontrado es la ciclofosfamida. El sistema empleado más eficaz para reducir la contaminación es el uso de dispositivos cerrados de transferencia (CSTD-closed system transfer device).
Palabras clave: Fármacos citostáticos; Contaminación superficial; Exposición laboral; Manipulación segura.
ABSTRACT
Objective: Provide updated evidence and learn about the actions that must be implemented in order to prevent the occupational exposure to cytostatic drugs.
Method: A bibliographic search was carried out on the MEDLINE, COCHRANE PLUS and WEB OF SCIENCE databases, with the terms "surface contamination", "cytostatic drug", "drug preparation", "occupational exposure", "safe handling" and "closed-system transfer device", within the 2010-2015 period.
Results: Thirteen articles were selected for review. These articles are from hospitals in U.S.A., Canada, Japan, Australia, Spain, Portugal and Germany. In all of them, surface contamination by cytostatic agents was found in over 15 different surfaces, with concentrations ranging from 1.69 ng/cm2 to 4-784 μg/cm2. The specific drugs were cyclophosphamide, ifosfamide, 5-fluorouracil, methotrexate, paclitaxel, cisplatin, gemcitabine, and docetaxel. Closed-system transfer devices can reduce the contamination in work surfaces significantly, but do not eliminate it.
Conclusions: Presence of contamination by cytostatic drugs was confirmed in many hospitals across all 5 continents. In all cases, contamination was found in the cabinet, on the floor in front of the cabinet, and in other places of the Hospital Pharmacy. The drug most frequently found was cyclophosphamide. The most effective action used to reduce contamination was the closed-system transfer devices (CSTDs).
Key words: Cytostatic drugs; Surface contamination; Occupational exposure; Safe handling.
Con este artículo se pretende actualizar el nivel de evidencia existente relativo a la presencia de contaminación por fármacos citostáticos en el ámbito hospitalario en general y en la farmacia hospitalaria en particular, lo cual se asocia con un riesgo para la salud de los trabajadores relacionados. Al mismo tiempo se pretende determinar cuáles son las medidas más eficaces que reducen esta contaminación.
Este artículo es un texto original y no se encuentra en proceso de evaluación por otra revista, no se trata de publicación redundante, y no existe ningún tipo de conflicto de intereses ni de de relación económica por parte de ninguno de sus autores.
Se cede a la revista FARMACIA HOSPITALARIA de los derechos exclusivos para editar, publicar, reproducir, distribuir copias, preparar trabajos derivados en papel, electrónicos o multimedia e incluir el artículo en índices nacionales e internacionales o bases de datos.
Introducción
Los fármacos citostáticos son sustancias citotóxicas diseñadas y utilizadas para causar disfunción celular, inhibiendo el crecimiento de las células cancerosas mediante la alteración del metabolismo y el bloqueo de la división y la reproducción celular. Este daño no es selectivo para las células tumorales, sino que afecta a todas las células del organismo, resultando efectos tóxicos adversos principalmente hematopoyéticos, renales, hepáticos, digestivos y dérmicos.
Su uso se inició en la década de los 50 tras la observación de aplasias medulares en militares expuestos a gas mostaza durante la segunda guerra mundial, lo que propició la utilización de mostazas nitrogenadas en el tratamiento de la enfermedad de Hodgkin1.
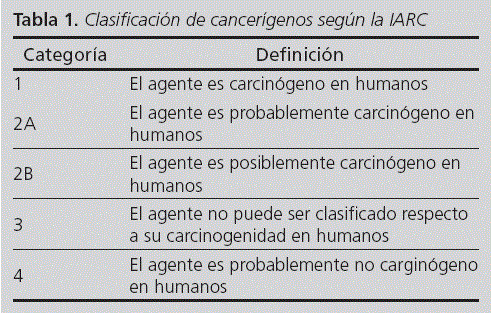
La International Agency for Research on Cancer (IARC) ha clasificado a muchos de estos fármacos como cancerígenos, mutagénicos y/o tóxicos para la reproducción. En las Monografías 262 y 763, ambas disponibles en la web de la IARC, se pueden consultar los citostáticos incluidos y su clasificación, la cual se muestra en la tabla 1.
Actualmente, once fármacos y ciertas terapias combinadas pertenecen al grupo 1 (azatioprina, busulfan, ciclofosfamida, clorambucilo, clornafacina, dietilestilbestrol, melfalán, semustina, tamoxifeno, tiotepa, treosulfán y MOPP), doce fármacos pertenecen al grupo 2A (adriamicina, azacitidina, carmustina, ciclosporina, cisplatino, clorozotocina, etopósido, lomustina, mecloretamina, procarbacina, tenipósido y testosterona) y once fármacos pertenecen al grupo 2B.
En el año 1979 aparece la primera publicación en relación a la exposición laboral a citostáticos y su relación con los riesgos para la salud en el estudio de Falck et al.4. En dicho estudio, mediante el test de Ames, se analizó la acción mutágena en la orina de enfermeras que preparaban y administraban fármacos citostáticos, sin medidas de protección. Se puso en evidencia la existencia de riesgos para la salud en casos de exposición crónica a algunos de estos fármacos en pequeñas cantidades.
Estudios posteriores han manifestado la posibilidad de daños a los trabajadores expuestos a citostáticos, afectando a la gestación5,6,7,8,9,10 (abortos, malformaciones), efectos crónicos11,12 y efectos agudos13,14,15,16.
A partir de la exposición laboral, diversos autores estudiaron la posible relación con efectos oncogénicos17,18,19,20,21. Aunque no se ha podido establecer claramente una relación entre la exposición prolongada a niveles bajos (caso de la actividad laboral) y un efecto oncogénico, se consideran un factor de riesgo potencial, por lo que deben emplearse todas las medidas disponibles para minimizar el riesgo de exposición.
Aquellos trabajadores que entren en contacto con citostáticos podrían estar expuestos a un riesgo para su salud. Esta exposición puede ocurrir durante todo el ciclo del fármaco que va desde su manufacturación y distribución hasta la preparación, administración y eliminación de los residuos. Así pues, los trabajadores expuestos pueden ser tanto de la industria farmacéutica como personal sanitario (médicos, farmacéuticos, personal de enfermería, técnicos sanitarios y celadores) encargados de la preparación, administración, transporte y eliminación de residuos.
La preocupación en torno a la manipulación de citostáticos ha supuesto que diferentes países y organizaciones elaboren Guías para su correcta manipulación. En la tabla 2 se presentan algunas de las Guías significativas22-40 y recientes que están publicadas.
Una vía de exposición a citostáticos podría producirse a través de la contaminación de los lugares de trabajo. Por lo tanto, es de gran importancia determinar la presencia de citostáticos en superficies de trabajo y, sobre todo, las posibles medidas a aplicar para eliminar o reducir dicha contaminación.
El objetivo de esta revisión bibliográfica es disponer de la evidencia más actual respecto de la exposición a citostáticos en el ámbito laboral y conocer las posibles medidas preventivas que se puedan aplicar para evitar la exposición laboral a citostáticos.
Material y métodos
Se realizó una revisión bibliográfica utilizando como fuentes de información las siguientes bases de datos: MEDLINE, COCHRANE PLUS y WEB OF SCIENCE.
Se estableció el periodo de estudio de los últimos 5 años.
La búsqueda se estableció en base a las palabras clave siguientes: surface contamination, antineoplastic drug, hazardous drug, drug preparation, occupational exposure, safe handling, closed-system transfer device. Después se llevó a cabo una combinación de dichas palabras clave (ejemplo: surface contamination AND hazardous drug, safe handling AND antineoplastic, surface contamination AND antineoplastic) en las diferentes bases de datos definiendo la búsqueda según los siguientes criterios:
Criterios de inclusión
1. Estudios que describan la relación entre la manipulación de citostáticos y la exposición laboral.
2. Humanos.
3. Año de publicación: entre 2010 y 2015.
4. Artículos publicados en inglés y español.
Criterios de exclusión
1. Artículos redundantes.
2. No originales o revisiones (ejemp: cartas al director, editoriales).
Se obtuvo una colección de 91 artículos, de la cual se eliminaron los duplicados o redundantes y se procedió a realizar un análisis de pertinencia revisando los títulos y los resúmenes de los artículos, quedando seleccionados un total de 13 artículos que conforman la base del estudio.
Resultados
En la tabla 3 se presentan las principales características de los 13 artículos que componen el estudio, tales como: autores, título, año, aspecto estudiado y resultados principales del estudio.
A continuación se describen los principales resultados de cada uno de los artículos seleccionados, los cuales se han agrupado geográficamente.
Sessink PJ et al.41 (2013) publicaron un estudio donde midieron la contaminación superficial por ciclofosfamida en 30 farmacias hospitalarias de Estados Unidos durante los años 2004 al 2010 y compararon los resultados cuando se emplean las técnicas estándar de preparación de citostáticos (uso de cabinas de seguridad biológica clase II, guantes, batas desechables, técnicas de presión negativa con filtros de venteo) frente a cuando se utiliza un sistema cerrado (PhaSeal®). Las muestras fueron tomadas en las superficies interiores de la cabina de seguridad biológica, suelos y mesas de la sala de preparación.
Entre sus resultados encontraron contaminación en todas las superficies estudiadas, tanto en los casos de empleo de técnicas estándar como cuando se utilizó el sistema cerrado. Se observó una reducción en los niveles de contaminación con ciclofosfamida del 86% con el uso del sistema cerrado en comparación con las técnicas de preparación estándar (diferencia de medias de 0,22 a 0,03 ng/cm2, p < 0,001).
Previamente, Sessink PJ et al.42 (2010) publicaron los resultados de otro estudio con un diseño similar donde se midió la contaminación superficial en 22 farmacias hospitalarias de Estados Unidos (del 2000 al 2005) originada por ciclofosfamida, ifosfamida y 5-fluorouracilo. Inicialmente se realizó la toma de muestras en todas las superficies con los trabajadores utilizando técnicas estándar. Después se introdujo un sistema cerrado (PhaSeal®) para la preparación de citostáticos y algunos meses después se volvió a muestrear otra vez las mismas superficies.
Los resultados mostraron que el 78%, 54% y 33% de las muestras dieron positivo para ciclofosfamida, ifosfamida y 5-fluorouracilo. Posteriormente el 68%, 45% y 20% de las muestras volvieron a dar positivo para los mismos fármacos. Nuevamente se obtuvo una reducción estadísticamente significativa en las concentraciones de ciclofosfamida (p < 0,001), ifosfamida (p < 0,001) y 5-fluorouracilo (p < 0,01) del 95%, 90% y 65% respectivamente.
Hay una serie de estudios en Canadá sobre contaminación en los que han participado un número importante de hospitales. El primero de estos estudios fue el de Bussières et al.43 (2012) en el que participaron 25 hospitales de 68 que fueron invitados a participar. Se establecieron las mismas 12 zonas y los mismos fármacos obteniéndose un total de 147 muestras de farmacia de los 25 hospitales y 112 muestras de zonas asistenciales de 24 hospitales. Los resultados mostraron un 52% de muestras positivas para ciclofosfamida, 20% para ifosfamida y 3% para metotrexato. Este primer estudio fue el que propuso realizar mediciones periódicas para asegurar una práctica correcta que reduzca la exposición a citostáticos.
El más reciente es el de Berruyer M et al.44 (2014) que estudiaron la contaminación en 36 hospitales, estableciendo 6 zonas de la farmacia y 6 zonas de atención a pacientes. Los fármacos estudiados fueron ciclofosfamida, ifosfamida y metotrexato. Se analizaron 422 muestras de las cuales el 47% dieron positivo para ciclofosfamida, 18% para ifosfamida y 3% para metotrexato.
En el estudio de Merger D et al.45 (2014) participaron 33 hospitales de Canadá. Se muestreó en las mismas 12 zonas (6 de farmacia y 6 de pacientes) y con los mismos fármacos durante el año 2012. En este caso se analizaron 363 muestras con resultados positivos en el 40% de los casos a ciclofosfamida, 18% para ifosfamida y 5% para metotrexato.
En estos estudios realizados en Canadá no se emplearon sistemas cerrados, tanto en la preparación como en la administración, mostrando resultados de contaminación en ambos lugares con porcentajes mayores para la preparación. En todos los casos, se contactó con la jefatura de Farmacia de hospitales de al menos 50 camas, invitándoles a participar en el estudio, obteniendo cada vez un mayor grado de participación aplicando la misma metodología.
En España, González Alvarez A et al.46 (2012) midieron la contaminación de 5-fluorouracilo, gemcitabina y ciclofosfamida en las superficies de la cabina de seguridad biológica, mesa de preparación de tratamientos en antecámara y mesa de la sala de administración en hospital de día, tomando 30 muestras por cada superficie. Los resultados muestran las mayores concentraciones en la cabina de seguridad biológica, y el fármaco con mayor concentración fue la gemcitabina a pesar de realizar menos preparaciones por día (1,75) que el 5-fluorouracilo (6,5). Las concentraciones menores correspondieron a la mesa de la sala de administración en hospital de día.
En Portugal, Viegas S et al.47 (2014) analizaron la contaminación superficial en 2 hospitales durante el año 2013, para lo que se seleccionaron 5 lugares relacionados con la preparación y 5 lugares de administración, y tomaron 327 muestras en las que analizaron la presencia de ciclofosfamida (CP), 5-fluorouracilo (5FU) y paclitaxel (PTX). En ambos hospitales se empleaban técnicas estándar para la preparación en cabinas de seguridad biológica clase II y equipos de protección personal. Los resultados mostraron que un 37% de las muestras superaron el límite de cuantificación y dieron positivo a uno o varios fármacos. Un 35,8% adicional dieron positivo a uno o varios fármacos superando el límite de detección (LOD) pero no el de cuantificación (LOD CP = 0,10 μg/ cm2; 5FU = 3,30 ng/cm2 y PTX = 0,167 ng/cm2). En los 2 hospitales se observó que los valores más altos de concentración se dieron en los lugares de administración debido a que la preparación está más controlada por parte de las autoridades sanitarias portuguesas.
Kopp B et al.48 (2012) inicialmente enviaron cuestionarios a 137 hospitales de día de Alemania de los cuales 39 eran públicos y 98 privados, respondiendo 96 de ellos. De éstos, sólo 28 estuvieron interesados en participar en un muestreo de superficies para detectar la presencia de 5-fluorouracilo, cisplatino, gemcitabina, ciclofosfamida, ifosfamida, metotrexato, docetaxel y paclitaxel. Un 60,9% de las muestras (153 para 5-fluorouracilo, 172 para cisplatino y 73 para el resto de fármacos) dieron positivas, siendo los fármacos más frecuentemente encontrados el 5-fluorouracilo (93,5%) y el cisplatino (88,4%), y los menos frecuentes el metrotexato (6,8%) y la ifosfamida (26%). No encontraron relación entre la cantidad de fármaco manipulado y el nivel de contaminación, pero sí observaron que determinadas prácticas de trabajo, como el uso de sistemas cerrados multicanal para la infusión y sistemas de administración purgados y conectados en farmacia, dieron un menor número de muestras positivas.
Miyake T et al.49 (2013) llevaron a cabo un estudio en el hospital japonés "Ise Red Cross Hospital" para valorar cuál sería el efecto del empleo de un sistema cerrado (PhaSeal®) en la preparación de citostáticos sobre la contaminación superficial y la exposición laboral. Para ello seleccionaron 6 lugares del área de preparación donde muestrear y tomaron muestras de orina de 24 h a 4 farmacéuticos. Los resultados mostraron que 4 de las 6 superficies dieron positivo a ciclofosfamida antes de la introducción del sistema cerrado y 7 meses después de comenzar a trabajar con él sólo 1 de la 6 superficies dio positivo. En cuanto a la orina, se tomaron 34 muestras de las que 26 dieron positivo a ciclofosfamida (77,9% de las muestras) antes de utilizar el sistema cerrado y nuevamente 7 meses después se tomaron 31 muestras de las que 2 dieron positivo (6,3% de los casos).
Sugiura S et al.50 (201 1) evaluaron la presencia de ciclofosfamida en el hospital universitario de Nagoya, también en Japón, en 2 departamentos: hematología y oncología pediátrica, que disponía de cabina de seguridad biológica, y hematología y oncología de adultos, que no disponía de cabina de seguridad biológica. Se tomaron muestras de superficie y de orina, resultando que todas la muestras superficiales dieron positivo a ciclofosfamida menos una (93,75% de los casos), siendo mayores las concentraciones en el departamento sin cabina de seguridad biológica. En el caso de las muestras de orina, de las 62 muestras sólo 11 dieron positivo (17,7% de los casos). Los valores obtenidos fueron más altos para aquellos trabajadores que administraban que los que preparaban, probablemente debido a que la administración se realizó sin guantes, lo que favoreció la absorción dérmica.
Siderov J et al.51 (2010) estudiaron la contaminación superficial de ciclofosfamida en 2 hospitales públicos de Australia. Se determinaron 12 lugares de la zona de preparación donde realizar los muestreos y éstos se llevaron a cabo antes de la introducción del sistema cerrado (PhaSeal®), así como a los 5 meses y a los 12 meses después de su introducción, aunque uno de los hospitales abandonó el ensayo después de los 5 primeros meses. Los resultados muestran que a los 5 meses la contaminación por ciclofosfamida se redujo un 24% (de 82,28 a 62,55 ng/cm2) y a los 12 meses la reducción fue del 68% (80,65 a 25,98 ng/cm2).
El artículo de Hon C-Y et al.52 (2014) lleva a cabo una revisión de la literatura a modo comparativo entre Europa y América del Norte para el periodo 2004-2012. Seleccionaron un total de 71 artículos de los que 55 correspondieron a Europa y 16 a América del Norte, siendo el término "contaminación superficial" el que más veces apareció (50 de los 71 artículos). Los autores establecen que la mayoría de los resultados de los artículos europeos no serían extrapolables a América del Norte debido a la diferente normativa y prácticas de trabajo. También concluyen que en América del Norte existe un déficit de publicaciones donde se estudie la exposición laboral a citostáticos en muestras biológicas.
Contemplando las nuevas posibilidades tecnológicas, Sessink PJ et al.53 (2015) midieron la contaminación cuando se prepara la medicación en bolsas mediante un sistema robótico (CytoCare) muestreando ciclofosfamida, hallándose contaminación en el interior del robot antes y después de la preparación. Concretamente se encontró contaminación en los viales reconstituidos y en las bolsas después de la preparación (pero no antes de la preparación), al igual que en las conexiones. Hubo también contaminación en los guantes usados para la preparación y la limpieza. Por el contrario no se detectó contaminación en los viales con polvo, en las muestras ambientales y en las orinas de los trabajadores.
Discusión
Estudios anteriores a 2010 mostraron la existencia de contaminación en distintas superficies del área de preparación y administración de citostáticos. Sessink et al.54. En el año 1992 ya publicaron sobre la presencia de citostáticos en superficies de trabajo y en orina de trabajadores al medir la presencia de varios fármacos (4 en total). Muchos más estudios han sido publicados desde entonces midiendo en farmacias y áreas de administración de hospitales de todos los continentes y la gran mayoría han indicado la existencia de contaminación de diversos tipos.
Los estudios más recientes siguen demostrando la presencia de diferentes fármacos tanto en superficies como en orina de manipuladores. Nuestro análisis sugiere que, a pesar de las numerosas Guías editadas en numerosos países, y el uso más o menos general de medidas de protección, se sigue produciendo una liberación de citostáticos al exterior cuando se reconstituyen, se preparan y se administran citostáticos en muchas farmacias hospitalarias, plantas de hospitalización onco-hematológicas y hospitales de día de numerosos hospitales de los 5 continentes.
En relación a las superficies analizadas indicar que Sessink41,42, en sus 2 estudios, muestreó las superficies y perfiles de la cabina, el suelo frente a la cabina y el mostrador donde se deposita la medicación. Berruyer44, Merger45 y Bussiéres43 ampliaron el número de superficies a muestrear incluyendo el mostrador de recepción de envíos, los estantes de almacenamiento de fármacos, la rejilla delantera interior de la campana, el suelo frente a la cabina, el mostrador donde se deposita la medicación y la bandeja utilizada para el transporte del fármaco a la zona de administración. Además incluyeron 6 superficies de áreas de administración, como estantes de almacenamiento, el mostrador donde se purgan los sueros, el brazo del sillón de administración, las mesillas de las habitaciones de los pacientes, la mesa de recepción de fármacos y el exterior de las bolsas o jeringas de administración.
González Álvarez et al.46 midieron en las superficies de la cabina de seguridad biológica, mesa de preparación de tratamientos en antecámara y mesa de la sala de administración en hospital de día. Viegas47 eligió para muestrear 4 zonas de la preparación: manillas de puertas y estanterías de la zona de servicio; encimeras, bandejas y manillas de la sala blanca; encimeras y bandejas de la antesala y estanterías y pomos del armario de almacenamiento. Muestreó también las encimeras, bombas de infusión y mostrador de recepción de las áreas de administración. Aunque Kopp48 hace una definición menos exacta de los lugares donde muestreó, hace referencia a que se seleccionaron las ubicaciones de manera que todo el circuito de trabajo quedase representado, desde el desembalaje de los fármacos, las preparaciones, la administración hasta la eliminación de los residuos. Explica que se recogieron muestras de suelo de las habitaciones, salas de terapia y aseos. Además, se muestrearon las áreas de trabajo, donde se reciben los fármacos y verifican, y donde se realiza la purga del sistema. También hay que señalar que fueron muestreados los porta sueros, las bombas de infusión, los apoyabrazos de las sillas de tratamiento y las tapas de los contenedores de residuos.
Siderov51 definió 12 lugares de la preparación en farmacia oncológica donde muestreó: el espacio de trabajo de la cabina, la rejilla del filtro HEPA, la rejilla delantera, alrededor del colector de aire de la cabina, por debajo de la zona de trabajo, suelo frente a la cabina, suelo de la sala blanca pegado a la antecámara, en el centro de la antecámara, zonas de verificación, dispositivo de mezcla y bandejas de preparación y almacenamiento. En este estudio también se muestrearon los viales.
El conjunto de los estudios revisados nos muestra la importante diversidad de lugares y material donde se ha buscado y encontrado contaminación, tanto en preparación como administración.
Los estudios donde se determina la presencia de citostáticos en orina son mucho menores si los comparamos con aquellos donde se muestrean superficies. Tan solo los estudios de Miyake49, Sugiura50 y Sessink53, éste último con sistema robótico, estudiaron la presencia de ciclofosfamida en orina, siendo positivo en los dos estudios de Japón y no así con el sistema robótico. Esto podría deberse a la acción conjunta de la utilización de doble par de guantes y bata junto con la menor manipulación del fármaco, ya que lo realiza el robot. Es importante señalar que desde un punto de vista de consecuencias legales, la presencia de contaminación en superficies supone la probabilidad de que el trabajador se exponga al fármaco mientras que la presencia en orina supone que el trabajador entró en contacto con el fármaco, lo metabolizó y finalmente lo excretó.
En relación con los fármacos determinados por el muestreo, el más habitual es la ciclofosfamida ya que está presente en todos los artículos estudiados. Además de la ciclofosfamida también se determinaron la ifosfamida42,43,44,45,51, el 5-fluorouracilo42,46,51, metotrexato43,44,45,51, paclitaxel46,51, cisplatino51, gemcitabina46 y docetaxel51. Los sistemas para el muestreo empleados fueron los descritos por Schamus et al.55 y por Larson et al. 56, así como el Cyto Wipe Kit (Exposure Control Sweden AB, Bohus-Bjórkó, Sweden), siendo este último el que se usó con más frecuencia pero con una menor variedad de fármacos. Este sistema dispone de la ventaja de poder disponer de todo el material en un kit y enviar las muestras en frío a un laboratorio predeterminado.
La mayoría de los estudios, salvo González Álvarez et al. 46, no definen las dosificaciones empleadas ni las dosis manipuladas ni tampoco el volumen de trabajo realizado. Esto implica que al analizar las concentraciones observadas en distintos estudios no se puedan extraer conclusiones. Sólo a modo de ejemplo si observamos el fármaco más frecuente (ciclofosfamida) encontramos los valores más altos en el interior de las cabinas (3,86 ng/ cm2 en Sessink41) y fuera de ellas (60,5 ng/cm2 y 7,18 ng/cm2 en mostradores de administración en Viegas47 y Sugiura50 respectivamente). El sistema robótico también mostró niveles de contaminación significativos en los viales y bolsas de preparación (4,78 μg/cm2 y 1,1 μg/cm2 respectivamente).
Analizando el porcentaje de muestras que dan positivo a contaminación superficial, se observa que la mayoría de fármacos estudiados dan porcentajes muy altos como la ciclofosfamida (93,75%, 78% y 52%), el 5-fluorouracilo (93,5% y 33%), ifosfamida (54%, 26% y 20%) o cisplatino (88,4%). Tales porcentajes evidencian que los procedimientos de trabajo empleados en los distintos hospitales estudiados por todo el mundo suponen la contaminación por diversos fármacos de los lugares donde se manipulan, tanto en la farmacia como en las áreas donde se administra, con el riesgo que esto conlleva para la salud de los trabajadores e incluso los acompañantes de los pacientes.
Algunos de los trabajados revisados41,42,49,51 valoran el uso de sistemas cerrados para reducir la contaminación superficial y/o en fluidos biológicos de manipuladores. Los 2 trabajos de Sessink, sin contar su trabajo sobre los robots, en hospitales estadounidenses muestran una reducción de la contaminación. En el año 2010 la reducción obtenida fue del 95%, 90% y 65% para ciclofosfamida, ifosfamida y 5-fluorouracilo respectivamente, mientras que en 2013 la reducción en los niveles de contaminación fue del 86% para ciclofosfamida después de 6 meses de emplear el sistema cerrado. El trabajo de Miyake obtiene una reducción del 91,9% de positivos en las muestras de orina de los trabajadores expuestos a ciclofosfamida después de 7 meses de uso de sistemas cerrados. Los resultados del trabajo de Siderov muestran una reducción de un 24% a los 5 meses y del 68% a los 12 meses para ciclofosfamida. En el trabajo se Kopp no se establece un porcentaje de reducción aunque si se calcula una correlación entre el empleo de sistemas cerrados y la reducción de la contaminación superficial (p = 0,01). Estos resultados permiten decir que el sistema cerrado redujo significativamente, pero no eliminó totalmente, la contaminación de las superficies de trabajo.
En el año 2000, la NIOSH (National Institute for Occupational Safety and Health) creó un equipo que revisase los estudios sobre fármacos peligrosos. Este trabajo dio como resultado el documento del 2004 "Alert: Preventing Occupational Exposure to Antineoplastic and Other Hazardous Drugs in Health Care Settings"57 donde se define por primera vez un sistema cerrado (closed system). Esta definición fue posteriormente modificada creándose el término CSTD (closed system drug transfer device) como un sistema de transferencia de fármacos que prohíbe mecánicamente el paso de contaminantes al interior del sistema y la fuga de fármacos peligrosos o concentraciones de vapor fuera del sistema. Esta definición fue adaptada por la ISOPP51, estableciendo la división entre contaminación microbiológica y contaminación química.
La interpretación que se ha hecho de esta definición ha generado discusión sobre qué se entiende por sistema cerrado58. Afortunadamente, la FDA (U.S. Food and Drug Administration) estableció en el año 2012 una nueva categoría para los CSTD bajo el código ONB59, definiéndolo como: reconstituir y transferir citostáticos y otros fármacos peligrosos en el ámbito sanitario, estando indicado para reducir la exposición del personal sanitario a los agentes quimioterápicos del ámbito sanitario. Este nuevo código ONB nos da una especificación adicional sobre los sistemas cerrados en relación con la protección de los trabajadores.
A modo de conclusión podemos decir que se observa en la literatura más reciente la existencia de contaminación superficial en diferentes espacios y por diferentes fármacos citostáticos. Existen un número menor de estudios dónde también se ha hallado presencia de citostáticos en orina de manipuladores. Esta contaminación se ha verificado en muchos hospitales de diferentes países y en diferentes continentes, incluido España, mostrando la globalidad del problema.
La contaminación de los espacios de trabajo se produce en numerosos y diferentes sitios, tanto en la preparación como en la administración, siendo habitualmente mayor en la preparación. En todos los casos estudiados se ha encontrado contaminación en la cabina, en el suelo frente a la cabina, en diferentes mesas donde se depositan temporalmente los fármacos, en la antecámara y en las zonas de almacén. También se han estudiado diferentes fármacos, siendo el más frecuente la ciclofosfamida.
La introducción de un sistema cerrado de transferencia41,42,49,51 (CSTD) disminuyó los niveles de contaminación, con reducciones de hasta el 95%, aumentando estos porcentajes de reducción conforme más tiempo se usa el sistema cerrado.
No hay conflicto de intereses por parte de los autores (recogido en los documentos Coi-Disclosure).
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: pablo.martin.lancharro@sergas.es
(Pablo Martín Lancharro).
Recibido el 12 de abril de 2016;
aceptado el 8 de agosto de 2016.
Bibliografía
1. Goodman LS, Wintrobe MM, et al. Nitrogen mustard therapy. Use of methylbis (beta-chloroethyl) amine hydrochloride and tris (beta-chloroethyl) amine hydrochloride for Hodgkin's disease, lymphosarcoma, leukemia and certain allied and miscellaneous disorders. J Am Med Assoc. 1946 Sep 21:132:126-32. [ Links ]
2. International Agency for Research on Cancer. Improving Evaluation of the Carcinogenic Risk of Chemicals to Humans, Vol. 26, Sorne Antineoplastic and Immunosuppressive Agents (monografia en Internet). Lyon: IARC Press; 1981 (citado 09-04-2015). Disponible en: http://monographs.iarc.fr/ENG/Monographs/vol1-42/mono26.pdf. [ Links ]
3. International Agency for Research on Cancer. IARC Monographs on the Evaluation of the Carcinogenic Risk to Humans: Some antiviral and antineoplastic drugs, and other pharmaceutical agents, Vol. 76 (monografia en Internet). Lyon;2000 (citado 09-04-2015). Disponible en http://monographs.iarc.fr/ENG/Monographs/vol76/mono76.pdf. [ Links ]
4. Falck, K., Grohn, P., Sorsa, M., Vainio, H., Heinonen, E., Holsti, L.R., 1979. Mutagenicity in urine of nurses handling cytostatic drugs. Lancet. 1979 Jun 9;1(8128):1250-1. [ Links ]
5. Dranitsaris G, Johnston M, Poirier S, Schueller T, Milliken D, Green E and Zanke B. Are health care providers who work with cancer drugs at an increased risk for toxic events? A systematic review and meta-analysis of the literature. J Oncol Pharm practice. 2005: 11:69-78. [ Links ]
6. Bouyer J, Saurel-Cubizolles M-J, Grenier C, Aussel L and Job-Spira N. Ectopic pregancy and occupational exposure of hospital personnel. Scand J Work Environ Health. 1998; 24:98-103. [ Links ]
7. Hoffman DM. Reproductive risks associated with exposure to antineoplastic agents: a review of the literature. Hosp Pharm.1986;21: 930-932. [ Links ]
8. McDonald AD, McDonald JC, Armstrong B, Cherry NM, Côté R, Lavoie J, Nolin AD and Robert D. Congenital defects and work in pregnancy. Br J Ind Med. 1988;45:581-588. [ Links ]
9. Peelen S, Roeleveld N, Heederik D, Krombout H and de Kort W. Toxic effects on reproduction in hospital personnel. 1999; Dutch Ministry of Social Affairs and Employment. [ Links ]
10. Valanis B, Vollmer W, Labuhn K and Glass A. Occupational exposure to antineoplastic agents and self-reported infertility among nurses and pharmacists. J Occup Environ Med. 1997; 39:574-580. [ Links ]
11. Lassila O, Toivanen A and Nordman E. Immune function in nurses handling cytostatic drugs. Lancet. 1980; 2:482. [ Links ]
12. Sessink PJM, Verplanke AJW, Herber RFM and Bos RP. Occupational exposure to antineoplastic agents and parameters for renal dysfunction. Int Arch Occup Environ Health. 1997; 69:215-218. [ Links ]
13. McDiarmid M and Egan T. Acute occupational exposure to antineoplastic agents. J Occup Med. 1988; 30:984-987. [ Links ]
14. Valanis BG, Vollmer WM, Labuhn KT and Glass AG. Acute symptoms associated with antineoplastic drug handling among nurses. Cancer Nurs. 1993; 16:288-295. [ Links ]
15. Jochimsen PR, Corder MP, Lachenbruch AP and Spaight ME. Preparation and administration of chemotherapy: Haematological consequences for hospital-based nurses. Med Toxicol. 1988; 3:59-63. [ Links ]
16. Valanis BG, Vollmer WM, Labuhn KT and Glass AG. Association of antineoplastic drug handling with acute adverse effects in pharmacy personnel. Am J Hosp Pharm. 1993; 50:455-462. [ Links ]
17. Blair A, Zheng T, Linos A, Stewart PA, Zhang YW and Cantor KP. Occupation and leukemia: A population-based case-control study in Iowa and Minnesota. Am J Ind Med. 2001; 40: 3-14. [ Links ]
18. Skov T, Maarup B, Olsen J, Rørth M, Winthereik H and Lynge E. Leukaemia and reproductive outcome among nurses handling antineoplastic drugs. Brit J Ind Med. 1992;49:855-861. [ Links ]
19. Sessink PJM, Kroese ED, van Kranen HJ and Bos RP. Cancer risk assessment for health care workers occupationally exposed to cyclophosphamide. Inter Arch Occup Environ Health. 1993; 67:317-323. [ Links ]
20. Gunnarsdottir HK, Aspelund T, Karlsson T and Rafnsson V. Occupational risk factors for breast cancer among nurses. Int J Occup Environ Health.1997; 3: 254-258. [ Links ]
21. Hansen, J and Olsen JH. Cancer morbidity among Danish female pharmacy technicians. Scand J Work Environ Health. 1994; 20:22-26. [ Links ]
22. Jacobson JO, et al. American Society of Clinical Oncology/Oncology Nursing Society chemotherapy administration safety standards. Oncol Nurs Forum. 2009 Nov;36(6):651-8. [ Links ]
23. American Society of Health-System Pharmacists. ASHP Guidelines on Handling Hazardous Drugs: Am J Health-Syst Pharm. 2006; 63:1172-1193. [ Links ]
24. Alexander M, et al. Australian consensus guidelines for the safe handling of monoclonal antibodies for cancer treatment by healthcare personnel. Intern Med J. 2014; (Epub ahead of print) DOI: 10.111/imj.12564. [ Links ]
25. Brown KA, Esper P, Kelleher LO, O'Neill JEB, Polovich M and White JM (eds.) 2001. Chemotherapy and biotherapy guidelines and recommendations for practice. Pittsburgh, PA: Oncology Nursing Society. [ Links ]
26. OSHA (1999). OSHA technical manual, TED 1-0.15A, Sec VI, Cap II: Controlling occupational exposure to hazardous drug. (citado 15-04-2015). [ Links ]
27. Occupational Safety and Health Service. Department of Labour. Guidelines for the safe handling of cytotoxic drugs and related waste. Wellington. New Zealand Publisher: The Service. 1997. [ Links ]
28. Chaffee BW, Armistead JA, Benjamin BE, Cotugno MC, Forrey RA, Hintzen BL, Pfeiffenberger T and Stevenson JG. Guidelines for the safe handling of hazardous drugs: consensus recommendations. Am J Health-Syst Pharm. 2010; 67:1545-1546. [ Links ]
29. The Joint Commission. Improving Patient and Worker Safety: Opportunities for Synergy, Collaboration and Innovation. The Joint Commission Monograph. Oakbrook Terrace, IL: The Joint Commission, 2012 Nov; :1-162. [ Links ]
30. International Society of Oncology Pharmacy Practitioners. Standards of Practice: Safe Handling of Cytotoxics. J Oncol Pharm Pract. 2007; 13:1-81. [ Links ]
31. Gamundi MC, coord. Medicamentos Citostáticos. 3a edición. Madrid: Sociedad Española de Farmacia Hospitalaria; 2003. [ Links ]
32. NIOSH. Preventing Occupational Exposure to Antineoplastic and Other Hazardous Drugs in Health Care Settings (citado 15-042015). Disponible en: http://www.cdc.gov/niosh/docs/2004-165/. [ Links ]
33. Eisenberg, S. Safe handling and administration of antineoplastic chemotherapy. J Infus Nurs. 2009; 32:23-32. [ Links ]
34. Health and Safety Executive. Safe handling of cytotoxic drugs in the workplace (citado 15-04-2015). Disponible en: http://www.hse.gov.uk/healthservices/safe-use-cytotoxic-drugs.htm. [ Links ]
35. PAHO/WHO. Safe handling of hazardous chemotherapy drugs in limited-resource settings: Washington, DC: PAHO 2013. [ Links ]
36. Oncology Nursing Society. Safe handling of hazardous drugs. En: Polovich M, editor. 2nd ed. Oncol Nurs Soc. 2011. [ Links ]
37. Power LA and Polovich M. Safe handling of hazardous drugs: reviewing standards for worker protection. Pharm Practice News. March 2012; 1-12. [ Links ]
38. Power LA and Polovich M. Safe handling of hazardous drugs: reviewing standards for worker protection. Pharm Pract News (special edition). 2012; 31-42. [ Links ]
39. Goodin S, et al. Safe handling of oral chemotherapeutic agents in clinical practice: recommendations from an international pharmacy panel. J Oncol Prac. 2011; 7:7-12. [ Links ]
40. International Society of Oncology Pharmacy Practitioners. Standards of Practice: Safe Handling of Cytotoxics. J Oncol Pharm Pract. 2007; 13:1-81. [ Links ]
41. Sessink PJ, Trahan J, Coyne JW. Reduction in Surface Contamination with Cyclophosphamide in 30 US Hospital Pharmacies Following Implementation of a Closed-System Drug Transfer Device. Hosp Pharm. 2013 Mar;48(3):204-12. [ Links ]
42. Sessink PJ, Connor TH, Jorgenson JA, Tyler TG. Reduction in surface contamination with antineoplastic drugs in 22 hospital pharmacies in the US following implementation of a closed-system drug transfer device. J Oncol Pharm Pract. 2011 Mar;17(1):39-48. [ Links ]
43. Bussières JF, Tanguay C, Touzin K, Langlois E, Lefebvre M. Environmental contamination with hazardous drugs in Quebec hospitals. Can J Hosp Pharm. 2012 Nov;65(6):428-35. [ Links ]
44. Berruyer M, Tanguay C, Caron NJ, Lefebvre M, Bussières JF. Multicenter study of environmental contamination with antineoplastic drugs in 36 Canadian hospitals: a 2013 follow-up study. J Occup Environ Hyg. 2015;12(2):87-94. [ Links ]
45. Merger D, Tanguay C, Langlois E, Lefebvre M, Bussières JF. Multicenter study of environmental contamination with antineoplastic drugs in 33 Canadian hospitals. Int Arch Occup Environ Health. 2014 Apr;87(3):307-13. [ Links ]
46. González Álvarez A, López-Montenegro Soria M.A., Albert Marí A., Martínez Gómez M.A., Porta Oltra B., Jiménez Torres N.V. Exposición a fármacos citotóxicos en el personal sanitario. Farmacia Hospitalaria. 2012 Sept-Oct: 36(5):368-373. [ Links ]
47. Viegas S, Pádua M, Veiga AC, Carolino E, Gomes M. Antineoplastic drugs contamination of workplace surfaces in two Portuguese hospitals. Environ Monit Assess. 2014 Nov;186(11):7807-18. [ Links ]
48. Kopp B, Schierl R, Nowak D. Evaluation of working practices and surface contamination with antineoplastic drugs in outpatient oncology health care settings. Int Arch Occup Environ Health. 2013 Jan;86(1):47-55. [ Links ]
49. Miyake T, Iwamoto T, Tanimura M, Okuda M. Impact of closed-system drug transfer device on exposure of environment and healthcare provider to cyclophosphamide in Japanese hospital. Springer Plus. 2013;2:273. [ Links ]
50. Sugiura S, Asano M, Kinoshita K, Tanimura M, Nabeshima T. Risks to health professionals from hazardous drugs in Japan: a pilot study of environmental and biological monitoring of occupational exposure to cyclophosphamide. J Oncol Pharm Pract. 2011 Mar;17(1):14-9. [ Links ]
51. Siderov J, Kirsa S, McLauchlan R. Reducing workplace cytotoxic surface contamination using a closed-system drug transfer device. J Oncol Pharm Pract. 2010 Mar;16(1):19-25. [ Links ]
52. Hon C-Y, Barzan C, Astrakianakis G. Identification of Knowledge Gaps Regarding Healthcare Workers' Exposure to Antineoplastic Drugs: Review of Literature, North America versus Europe. Safety and Health at Work. 2014;5(4):169-174. [ Links ]
53. Sessink PJ, Leclercq GM, Wouters DM, Halbardier L, Hammad C, Kassoul N. Environmental contamination, product contamination and workers exposure using a robotic system for antineoplastic drug preparation. J Oncol Pharm Pract. 2015 Apr;21(2):118-27. [ Links ]
54. Sesink, PJ., Boer, KA., Schefhals, AP., Anzion, RB.y Bos RP. Occupational exposure to antineoplastic agents at several departments in a hospital. Environmental contamination and excretion of cyclophosphamide and ifosfamide in urine of exposed workers. Int Arch Occup Environ Health, 1992; 64(2):105-112. [ Links ]
55. Schmaus G, Schierl R, Funck S (2002) Monitoring surface contamination by antineoplastic drugs using gas chromatography-mass spectrometry and voltammetry. Am J Health Syst Pharm 59(10):956-961. [ Links ]
56. Larson RR, Khazaeli MB, Dillon HK (2002) Monitoring method for surface contamination caused by selected antineoplastic agents. Am J Health Syst Pharm 59(3):270-277. [ Links ]
57. Centers for Disease Control and Prevention. Preventing occupational exposure to antineoplastic and other hazardous drugs in health care settings. Sept 2004. DHHS (NIOSH) publication no. 2004-165. [ Links ]
58. Nygren O, Olofsson E, Johannson L. NIOSH Definition of Closed-System Drug-Transfer Devices. Annals of Occupational Hygiene. 2009;53(5):549. [ Links ]
59. U.S. Food and Drug Administration. Silver Spring (citado 15-042015). FDA Office of Device Evaluation. Disponible en: https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpcd/classification.cfm?ID=ONB . [ Links ]











 texto en
texto en