My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.41 n.2 Toledo Mar./Apr. 2017
https://dx.doi.org/10.7399/fh.2017.41.2.10533
Revisión
Óxido nítrico inhalado en pacientes adultos con síndrome de distrés respiratorio agudo
1Anesthesiology and Recovery Department. Albacete University Hospital Complex. Integrated Healthcare Management Office for Albacete. Calle Hermanos Falcó 37, Albacete. Spain.
2Hospital Pharmacy Department. Albacete University Hospital Complex. Integrated Healthcare Management Office for Albacete. Calle Hermanos Falcó 37, Albacete. Spain.
3Pulmonology Department. Albacete University Hospital Complex. Integrated Healthcare Management Office for Albacete. Calle Hermanos Falcó 37, Albacete. Spain.
En algunos pacientes, el síndrome de distrés respiratorio agudo (SDRA) provoca el desarrollo de una hipoxemia refractaria que compromete la vida. En este contexto pueden considerarse terapias de rescate en un intento de mejorar la oxigenación mientras los pacientes permanecen en ventilación mecánica. El uso de óxido nítrico inhalado (NOi) en el SDRA ha sido una de las terapias farmacológicas más estudiadas en las últimas dos décadas. Diversos ensayos clínicos y metaanálisis han evaluado su eficacia, y aunque se ha demostrado un aumento en la oxigenación, no se ha podido demostrar un descenso en la mortalidad o una mejora en el pronóstico. La evidencia actual sugiere que aunque el NOi no debe usarse de forma rutinaria en pacientes con SDRA, puede considerarse su uso para mejorar la oxigenación en pacientes severamente hipoxémicos.
Esta revisión examina la aplicación terapéutica del NOi en pacientes adultos con SDRA. Se propone un esquema con diversas recomendaciones para su uso como terapia de rescate frente a la hipoxemia refractaria.
PALABRAS CLAVE: Síndrome de distrés respiratorio agudo; Lesión pulmonar aguda; Hipoxemia; Óxido nítrico
Introducción
El síndrome de distrés respiratorio agudo (SDRA) se define por un comienzo agudo de hipoxemia (PaO2/FiO2 ratio ≤ 300 mm Hg) junto con la presencia de infiltrados pulmonares bilaterales no debidos a insuficiencia cardiaca o edema hidrostático. Esta hipoxemia ocurre como resultado de una alteración en la relación ventilación perfusión, tanto por la inflamación alveolar como por la alteración de la reactividad vascular pulmonar, que en ocasiones se convierte en refractaria, cuando se mantiene una insuficiencia respiratoria persistente bajo medidas neumoprotectoras, con una PaO2/FiO2 < 100 mm Hg o una presión plateau > 30 cm H2O21.
A pesar de los avances en el manejo de los pacientes con SDRA, su mortalidad sigue siendo elevada. Desde que la ventilación de protección pulmonar revolucionara la estrategia ventilatoria de pacientes con SDRA, numerosas terapias se han estudiado para corregir la hipoxemia, y aunque muchas de estas intervenciones mejoran la oxigenación arterial, desafortunadamente muy pocas se asocian con un beneficio en la supervivencia1.
Desde el descubrimiento del papel del óxido nítrico (nitric oxide, NO) en la biología vascular, su administración en forma inhalada fue incorporada al tratamiento del SDRA debido a la creencia de que la vasodilatación pulmonar selectiva en los alveolos ventilados mejoraría el intercambio gaseoso y por tanto el pronóstico de los pacientes. Su eficacia ha sido evaluada por numerosos ensayos clínicos aleatorizados y ha sido objeto de varios metaanálisis, habiendo demostrado su efecto en el incremento transitorio de la oxigenación arterial, aunque hasta la fecha no se ha demostrado un beneficio clínicamente relevante en parámetros pronósticos como por ejemplo en la supervivencia o en días libres de ventilación mecánica. No obstante, el óxido nítrico inhalado (NOi) se sigue utilizando en pacientes críticos adultos con SDRA, y aunque su uso rutinario no está recomendado, parece razonable su uso como terapia de rescate en pacientes con hipoxemia refractaria severa.
El objetivo de esta revisión es la evaluación clínica del papel del NOi en el SDRA, exponiendo la evidencia actual disponible, las controversias de su empleo, y las recomendaciones actuales de uso. Se expone un esquema para su empleo como terapia de rescate frente a la hipoxemia refractaria, que incluye aspectos como la indicaciones de administración y retirada, dosificación y monitorización.
Metodología
Se desarrolló una búsqueda no sistemática de artículos en la base PubMed/MEDLINE, limitada a los idiomas inglés y castellano, sin límite de tiempo, utilizando los términos MesH: “Respiratory Distress Syndrome, Adult/ therapy” y “Nitric Oxide”. Se seleccionaron los más relevantes por su relación con el tema expuesto. Adicionalmente se realizó una búsqueda manual en las referencias de los artículos seleccionados.
Biología del óxido nítrico
El NO es el monóxido de nitrógeno, uno de los óxidos del nitrógeno, junto con el dióxido de nitrógeno (NO2), tetróxido de nitrógeno (N2O4) y protóxido de nitrógeno (N2O), este último con propiedades anestésicas. En condiciones atmosféricas es un gas que se produce en los procesos de combustión y forma parte de la polución ambiental, y que fue considerado como una mera sustancia tóxica hasta el descubrimiento su papel como regulador de la fisiología animal. En el cuerpo humano el NO es sintetizado en el endotelio vascular a partir del aminoácido L-arginina por medio de una enzima denominada óxido nítrico sintetasa (NOS), de las cuales han sido caracterizadas e identificadas varios tipos en diversas células del organismo además de en el endotelio vascular2. Es una molécula inestable con un tiempo de vida media muy corto (3-5 segundos), y muy lipofílica, lo que le confiere especial capacidad para atravesar membranas. Cuando se administra vía inhalatoria, atraviesa la barrera de la célula epitelial alveolar y entra en la célula muscular lisa donde estimula directamente a la enzima guanil ciclasa creando guanosin monofosfato cíclico (GMPc), que es el mediador de la relajación del músculo liso y de la dilatación vascular2,3.
A su vez el NO difunde a través de la célula endotelial hacia la luz del vaso donde se combina con gran afinidad con la hemoglobina y desaparece su acción, formando metahemoglobina, que es reducida por la metahemoglobina reductasa de los eritrocitos4. El NOi fluye sólo en las regiones del pulmón bien ventiladas, y esta inactivación al difundir a la sangre es lo que permite causar una vasodilatación pulmonar selectiva sin causar vasodilatación sistémica. Otras dos reacciones principales derivan de la reacción del NO con el oxígeno en la sangre formando la molécula tóxica dióxido de nitrógeno (NO2), y de la reacción con las proteínas plasmáticas para formar S-nitrosotioles o tionitritos, con propiedades vasodilatadoras y posibles efectos extrapulmonares2-4.
También se ha observado una modulación del tono bronquial con el NOi, aunque incluso a altas dosis (80 partes por millón (ppm)) la respuesta broncodilatadora es menor que la de la inhalación de un agonista beta-2 estándar5. El NOi también puede tener otros efectos pulmonares (propiedades proinflamatorias o antiinflamatorias) y extrapulmonares, aunque su relevancia clínica debe ser investigada2-4.
Óxido nítrico inhalado en el SDRA
Perspectiva histórica y evidencia actual
En 1980 se descubrió que la estimulación de receptores endoteliales por acetilcolina desencadenaba la producción de una sustancia que difundía a las células del músculo liso vascular y provocaba vasodilatación, sustancia que fue denominada factor relajante derivado del endotelio o endothelium-derived relaxing factor (EDRF). Unos años después, en 1987, se demostró que esta molécula era NO6,7, y los autores de dichos trabajos fueron apremiados en 1998 con el Premio Nobel por sus descubrimientos con esta molécula.
Tras los esperanzadores resultados de estudios sobre el uso de NOi en animales y posteriormente en humanos con hipertensión pulmonar8, se extendió su uso a pacientes con SDRA. Rossaint et al.9 fueron los primeros en estudiar los efectos del NOi en pacientes con SDRA, objetivando una disminución de la presión arterial pulmonar y un aumento de la oxigenación a dosis de 18 y 36 ppm. A pesar de las limitaciones del estudio, sus hallazgos justificaron la difusión de numerosos trabajos para evaluar el NOi en el SDRA, que tuvieron su auge en la década de los 90, demostrando que cuando se inhalaba a bajas dosis (5-80 ppm), rápidamente producía una vasodilatación pulmonar selectiva de los alveolos ventilados, y con ello una mejoría de la hipertensión pulmonar y aumento en la oxigenación arterial10-12. Estos hallazgos proporcionaron un nuevo impuso a investigadores como Gerlach et al.31 que evaluaron la respuesta de sujetos con SDRA grave al NOi mediante curvas de dosis respuesta. Los resultados mostraron una mejora de la oxigenación y una reducción en el uso de oxigenación por membrana extracorpórea en el grupo de NOi, aunque sin diferencias en la duración de la ventilación mecánica.
No obstante la creencia de que la mejora del intercambio gaseoso tendría repercusión en el pronóstico de los pacientes fomentó el desarrollo posterior de diversos ensayos clínicos aleatorizados13-22 (Tabla 1). Estos trabajos demostraron que la inhalación de NO en el SDRA mejora la oxigenación arterial de forma transitoria, aunque fallaron en confirmar una mejora en la supervivencia o en la morbilidad de pacientes críticos. Diversos metaanálisis y revisiones sistemáticas también han confirmado el incremento en la oxigenación pero no han evidenciado una reducción de la mortalidad o de los días libres de ventilación mecánica23-30.
Tabla 1 Características de los principales ensayos clínicos de óxido nítrico inhalado (NOi) en pacientes adultos con lesión pulmonar aguda (LPA) y síndrome de distrés respiratorio agudo (SDRA)
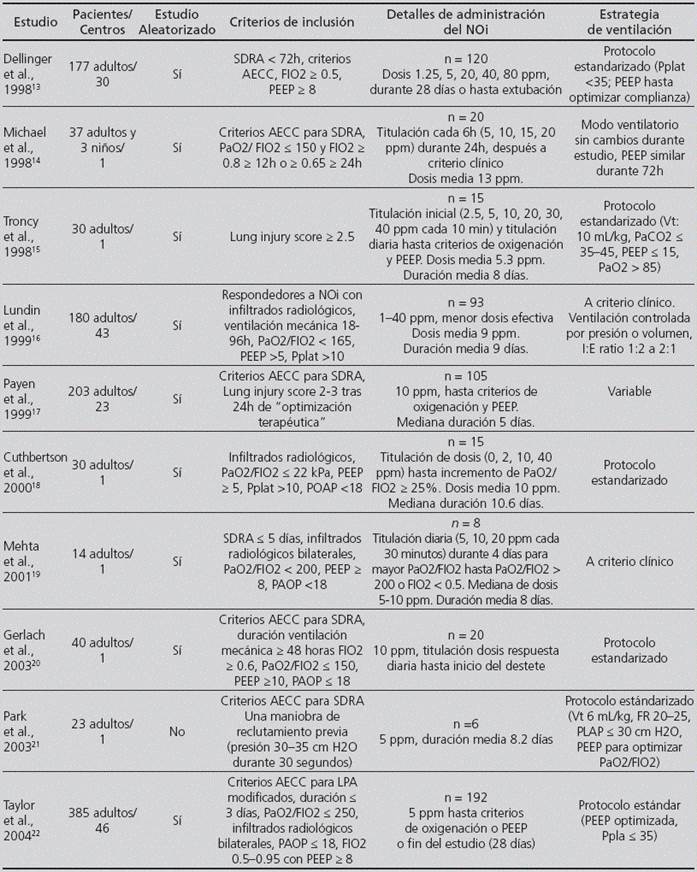
LPA: lesión pulmonar aguda, Pplat: presión plateau o presión media en la vía aérea, AECC: American European Consensus Conference, POAP: presión de oclusión de la arteria pulmonar (en cm H2O), PEEP: presión positiva al final de la espiración (en cm H2O), PaO2/FiO2: ratio presión arterial de oxígeno/fracción inspiratoria de oxígeno (en mm Hg), Vt: volumen tidal, FR: frecuencia respiratoria
Limitaciones de la evidencia disponible
El aumento en la oxigenación objetivado con el NOi no se ha traducido en una mejora en el pronóstico en términos clínicamente relevantes como en la supervivencia. Algunos autores afirman que estos resultados obtenidos de ensayos clínicos pequeños de poca potencia pueden tener limitaciones significativas, y sus resultados pueden servir más para generar hipótesis que para confirmarlas4. De hecho, la mayor crítica a estos estudios es que no distinguen entre SDRA severo o moderado, bajo la creencia de que el mayor beneficio se obtiene en pacientes con hipoxemia severa, y que este subgrupo ha sido pobremente representado en los ensayos clínicos32,33. Sin embargo, recientemente un metaanálisis30 examinó el efecto del NOi en la mortalidad por subgrupos definidos por la severidad de la hipoxemia sobre 9 ensayos clínicos y 1142 pacientes, sin encontrar beneficio según la severidad del grupo. El análisis de subgrupos mostró que la terapia con NOi no reduce la mortalidad en pacientes con PaO2/FiO2 basal ≤ 100 mm Hg (RR 1.01 (IC 95%, 0.78-1.32); p = 0.93; n = 329; 6 ensayos) o aquéllos con una PaO2/FiO2 basal > 100 mm Hg (RR 1.12 (IC 95%, 0.89-1.42); p = 0.33; n = 740; 7 ensayos). Tampoco se identificó ningún umbral de PaO2/ FiO2 (incrementos de 10 mm Hg entre 70 y 200 mm Hg) en el que los pacientes tratados con NOi tuvieron menor mortalidad respecto a los controles. Una limitación de este estudio según los autores es que incluyó sólo 329 pacientes en el subgrupo SDRA severo, lo que limita el poder estadístico para detectar verdaderas diferencias de mortalidad entres subgrupos.
Otras limitaciones de estas revisiones derivan de la falta de homogeneidad de los pacientes incluidos entre los diferentes ensayos, en parte debido a la carencia, hasta hace relativamente pocos años, de una definición universal de SDRA que mejorara la coherencia entre la investigación y la práctica clínica. Además existe una falta de homogeneidad en la indicación y en el tratamiento, con diferentes métodos de administración del NOi y diferentes dosis entre los ensayos3, lo que complica su comparación para la extracción de conclusiones significativas (Tabla 1). Además, en la actualidad se sabe que la estrategia ventilatoria empleada para el manejo del paciente con insuficiencia respiratoria aguda influye significativamente en la evolución de la enfermedad, si bien este hallazgo se descubrió posteriormente a la realización de muchos de estos estudios, en los que los pacientes fueron ventilados con un volumen tidal por encima del recomendado de 6 ml kg-1. Las pequeñas mejoras en la oxigenación debido al NOi pueden estar enmascaradas por los efectos deletéreos de una estrategia ventilatoria no protectora, usada en la mayoría de los ensayos, y que no limita volumen tidal o presión en vía aérea. Quizás una ventilación protectora en el contexto del uso del NOi hubiera ofrecido unos resultados más positivos en cuanto a parámetros pronósticos4,34.
Por otro lado, la mortalidad de los pacientes con SDRA está más relacionada con eventos como sepsis o disfunción multiorgánica que con la propia hipoxemia35. El hecho de que la mejora en la oxigenación objetivada con el uso del NOi no se haya traducido en una mejora en la mortalidad puede estar influenciada por este motivo4. Además la mayoría de los tratamientos investigados para el SDRA se focalizan en parámetros pronósticos a corto plazo como la mortalidad. Sin embargo, los pacientes que sobreviven al SDRA pueden tener secuelas pulmonares a largo plazo como trastornos obstructivos, restrictivos y alteraciones en el intercambio gaseoso, que pueden comprometer su calidad de vida. No está claro el verdadero impacto que puede tener el NOi en estos parámetros36. En 2004, Taylor et al.22 evaluaron la eficacia de bajas dosis de NOi (5 ppm) en 385 pacientes críticos con lesión pulmonar aguda moderada/severa (PaO2/ FiO2 ≤ 250) de 46 hospitales encontrando un transitorio aumento de la PaO2 sin beneficio en la mortalidad o días libres de ventilación mecánica. Sin embargo, un seguimiento posterior desarrollado como parte del estudio original, mostró a los 6 meses en los supervivientes del SDRA que habían sido tratados con NOi mejores valores en pruebas funcionales respiratorias que los tratados con placebo36. No obstante, la validez del estudio se limita por la pérdida de seguimiento de la mayoría de los supervivientes y la falta de información acerca del consumo de tabaco. Está por determinar los efectos del NOi en la función pulmonar a largo plazo de pacientes con SDRA, y por tanto en su morbilidad y calidad de vida. No obstante, la mejora en la oxigenación demostrada con el uso del NOi podría justificar por sí misma su empleo en algunos pacientes con SDRA severamente hipoxémicos34.
Uso y recomendaciones actuales
Tras el auge de los numerosos trabajos publicados acerca del NOi a mediados de la década de los 90, comenzó a extenderse la terapia con NOi a diversas patologías como la hipertensión pulmonar persistente neonatal, la cirugía cardiaca infantil y adulta, o el SDRA34. De hecho, a finales de la década de los 90, un grupo de trabajo del NOi en la UCI de la European Society of Intensive Care Medicine (ESICM) exploraron la práctica clínica del uso de NOi en UCI a través de un cuestionario, que respondieron 310 facultativos de 21 países37. De éstos, más de un 60% declararon usar la terapia con NOi (63.2%), entre cuyos especialistas predominaban intensivistas, pediatras y anestesiólogos.
Sin embargo, en pacientes con SDRA, su repercusión clínica y pronóstica no ha alcanzado el éxito esperado. En 2005 un grupo de expertos organizados por la EISCM y por la Sociedad Europea de anestesiólogos cardiotorácicos establecieron unas recomendaciones acerca de la terapia con NOi en adultos en el ámbito perioperatorio y cuidados críticos. En el caso concreto del SDRA, mencionan que su uso rutinario no puede ser recomendado si bien considera que es razonable su uso como tratamiento de rescate en pacientes con hipoxemia refractaria severa32. La reciente publicación de los resultados de un metaanálisis que parecen desestimar la creencia de que el mayor beneficio se obtiene en pacientes con hipoxemia severa30, continúan fomentando la idea de relegar el uso del NOi en pacientes con SDRA a situaciones extremas1,30.
Las indicaciones terapéuticas aprobadas por la Agencia Española del Medicamento para el uso del NOi son el tratamiento de neonatos de más de 34 semanas de gestación con insuficiencia respiratoria hipóxica asociada a evidencia clínica o ecocardiográfica de hipertensión pulmonar, y el tratamiento de la hipertensión pulmonar peri y postoperatoria en cirugía cardiaca38. En la actualidad no existe indicación aprobada para su uso en pacientes adultos con SDRA, por lo que su utilización precisa de un consentimiento informado (Figura 2). A pesar de ello, se sigue usando de forma extensa (indicación off-label) como terapia de rescate frente a la hipoxemia refractaria. Por ejemplo, se usó en más de un 20% de los pacientes incluidos en un gran ensayo clínico publicado en 2010 sobre el uso de relajantes neuromusculares en pacientes con SDRA39. Así mismo, se utilizó como tratamiento durante la pandemia del virus Influenza A (H1N1) de 2009 en el 32% de los pacientes con hipoxemia refractaria antes de la administración del ECMO en Australia y Nueva Zelanda40 y como terapia de rescate en hasta 14% de pacientes críticos en Canadá41, si bien se documentó un escaso uso en España y algunas series de Latinoamérica42.

Figura 2 Propuesta de modelo de consentimiento informado para el uso compasivo de óxido nítrico inhalado (NOi) en pacientes adultos con síndrome de distrés respiratorio agudo (SDRA) con hipoxemia refractaria severa.
En base a lo anterior, parece razonable la terapia con óxido nítrico inhalado como medicamento de uso compasivo en forma de alternativa terapéutica fuera de indicación habitual, en pacientes con SDRA que presentan una hipoxemia refractaria severa.
Tratamiento combinado
El NOi mejora la relación ventilación perfusión en las regiones pulmonares aireadas, por lo que el uso de maniobras de reclutamiento para conseguir la apertura de unidades alveolares terminales previamente atelectásicos mejora su utilidad con un efecto sinérgico en el incremento de la PaO243. Entre estas maniobras de reclutamiento se encuentran la utilización de niveles de PEEP (presión positiva al final de la espiración) adecuados (permite convertir los pacientes no respondedores al NOi en respondedores)44, la ventilación en posición decúbito prono45, y la ventilación de alta frecuencia46. Si bien no se ha evaluado la repercusión de este sinergismo en el pronóstico de los pacientes con SDRA, es relevante la importancia de las maniobras que permitan evitar atelectasias para permitir al NOi mejorar el intercambio gaseoso mediante una vasodilatación pulmonar selectiva en el mayor número posible de alveolos aireados.
Con respecto al uso de catecolaminas, se ha hipotetizado que los pacientes sépticos pueden tener una inadecuada respuesta al NOi debido a la influencia de las catecolaminas endógenas y exógenas sobre la vasculatura pulmonar, si bien en algunos estudios se ha puesto de manifiesto que la condición de sepsis no modifica la respuesta del NOi en la PaO2/FiO214, y que el efecto del NOi no se ve influenciado por la administración de vasopresores como la noradrenalina47.
Dosificación
En adultos para el tratamiento de la hipertensión pulmonar asociada a cirugía cardiaca la dosis inicial de NOi recomendada en ficha técnica es de 20 ppm de gas inhalado. Esta dosis puede aumentarse hasta 40 ppm como dosis máxima si la dosis mínima no ha producido suficientes efectos clínicos38. Sin embargo, en el caso de pacientes con SDRA la dosificación es controvertida. En este contexto diversos trabajos han estudiado la respuesta en la oxigenación tras la administración de diferentes concentraciones de NOi. Los resultados contrastan entre sí, de manera que la respuesta observada (aumento de la oxigenación o disminución de la presión arterial pulmonar) varía ampliamente con distintas dosis y tiempos de tratamiento evaluados11,20,31,48-52.
El máximo beneficio en la oxigenación se ha documentado con dosis entre 0.1 a 2 ppm48-49 y con dosis menores de 20 ppm31 o menores de 40 ppm11,50. Por otro lado también se ha objetivado un empeoramiento de la oxigenación con dosis por encima de 20 ppm52 o incluso de 10 ppm20,31. Tampoco es concordante la relación entre la dosis del NOi y la respuesta en la oxigenación (curva dosis respuesta), que contrasta en pequeños ensayos en los que se ha descrito tanto un efecto dosis dependiente48,49, no dosis dependiente con una mejoría en la oxigenación variable11,50, o con diferencias interindividuales51,52. Gerlach et al.20 objetivaron un desplazamiento progresivo de la curva de dosis-respuesta hacia la izquierda en pacientes con SDRA que recibieron NOi continuamente durante varios días. Un pequeño porcentaje pacientes con SDRA son no respondedores al NOi al no incrementar la oxigenación de forma relevante con dosis de hasta 20 ppm52.
Además, no queda claro en la literatura el parámetro que debe considerarse como respuesta favorable, que varía desde un descenso en la FiO2 del 15%14, un aumento de pO2 superior al 10%3 o al 20%13, o un incremento de la PaO2/FiO2 de al menos un 20%33. No obstante, teniendo en cuenta su rápido comienzo de acción, esta mejora clínicamente significativa en la oxigenación debe demostrarse en la primera hora de la terapia para justificar continuar con su uso33.
Esta falta de concordancia en la búsqueda de la óptima dosificación del NOi en pacientes con SDRA queda patente en un metaanálisis recientemente publicado que evalúa el efecto del NOi en la mortalidad hospitalaria de pacientes con SDRA grave30. Los 9 ensayos clínicos analizados muestran variabilidad de las dosis de NOi utilizadas. Cuatro ensayos usaron una dosis fija de 521,22 y 1017,20 ppm, un ensayo randomizó pacientes a diferentes dosis (1.25-80 ppm)13, y el resto de trabajos usaron la dosis más baja con la que se lograba una respuesta en la oxigenación (dosis media de 5.315, 916, 1314, o 5-1019 ppm).
Resulta por tanto complicado extraer conclusiones acerca de la dosis ideal de NOi en pacientes con SDRA, que debería titularse diariamente en cada paciente33, administrándose la dosis mínima eficaz mediante disminuciones lentas siempre que la oxigenación arterial sistémica siga siendo adecuada con cada reducción32,53.
Seguridad
La administración de dosis terapéuticas de NOi parece segura en términos de formación de NO2 y toxicidad por metahemoglobinemia. No hay evidencia de toxicidad directa por NOi ni de efectos secundarios graves a dosis clínicamente relevantes27-29. No obstante, deben tenerse unas precauciones de seguridad, y la técnica de administración debe minimizar la cantidad de NO2 administrado al paciente y la exposición ambiental a los trabajadores sanitarios32,49.
Metahemoglobina
En voluntarios sanos la inhalación de NOi a dosis muy superiores a las terapéuticas (hasta 128 ppm) no se asoció con niveles de metahemoglobinemia clínicamente significativas (superiores al 5%), objetivándose la elevación de los máximos niveles a las 3-5 horas del comienzo del NOi54. En pacientes críticos con SDRA, pueden detectarse niveles de metahemoglobina superiores al 5% con altas concentraciones de NOi (40 y 80 ppm), siendo extremadamente rara una metahemoglobinemia severa, que no se ha objetivado con dosis terapéuticas (< 20 ppm) en revisiones Cochrane27-29. Debe evitarse el uso de NOi en pacientes con déficit de metahemoglobina reductasa, y monitorizarse la metahemoglobinemia basal y a las 4-6 horas del comienzo de la terapia y de forma diaria, disminuyendo la dosis en caso de objetivarse una metahemoglobinemia > 5% (32,38,49). La metahemoglobinemia que no desaparezca tras la reducción o inte rrupción de la terapia o que comprometa la oxigenación puede tratarse con vitamina C, N-acetilcisteína, tocoferol, azul de metileno o exanguinotransfusión en función de la situación clínica38.
Dióxido de nitrógeno (NO2)
NO se oxida en presencia de oxígeno para formar NO2, un gas altamente tóxico, cuyos niveles por encima de 2 ppm pueden incrementar la permeabilidad alveolar, y por encima de 10 ppm producir daño pulmonar severo3. La tasa de conversión de NO en NO2 es directamente proporcional a la concentración del NO, a la concentración del O2, y al tiempo de contacto entre NO y O2, por lo que la administración de NOi debe realizarse con un sistema de liberación continua o sincronizada con la inspiración, cerca del circuito del paciente (en la rama inspiratoria), y de forma monitorizada distalmente al punto de administración32,55.
En un ensayo clínico se objetivó un aumento de las concentraciones de NO2 en tres pacientes que habían recibido concentraciones superiores a 80 ppm durante varios días13. No obstante, en recientes metaanálisis y revisiones Cochrane no se ha observado riesgo aumentado de formación de NO2 con dosis por debajo de 80 ppm en recientes metaanálisis y revisiones Cochrane27-29.
En tratamientos prolongados se aconseja reducir la concentración de NOi a 10 ppm o menos para reducir la exposición al potencial tóxico NO232. Según la ficha técnica el límite superior de exposición (exposición media) al NO del personal determinado por la legislación laboral es de 25 ppm durante 8 horas (30 mg m3-1) en la mayoría de los países y el límite correspondiente para NO2 es de 2-3 ppm (4-6 mg m3-1)38.
Insuficiencia renal
Dos metaanálisis mostraron un riesgo aumentado de disfunción renal con el uso de NOi27,29. No obstante los propios autores indican que se carecía de una clasificación uniformemente aceptada como RIFLE o AKIN que hubiera incrementado la validez de los resultados, y que la interpretación debe ser cautelosa en base a que el resultado deriva de una análisis post hoc y a que es potencialmente objeto de un sesgo de publicación al no haberse obtenido datos de función renal en algunos de los ensayos analizados.
Coagulopatía
Aunque se ha documentado alteración del tiempo de hemorragia con el uso del NOi56, así como una atenuación de la agregación plaquetaria en pacientes con SDRA (que no cambió el tiempo de sangrado incluso con fracciones de NOi por encima de 100 ppm)57, los datos en humanos adultos son contradictorios y no se ha encontrado un aumento del riesgo de sangrado ni de eventos hemorrágicos en recientes metaanálisis y revisiones Cochrane27-29.
Fenómeno de rebote
Debe evitarse la retirada súbita del NOi32, ya que se han observado en algunos pacientes un fenómeno de rebote con hipertensión pulmonar aguda, colapso hemodinámico y empeoramiento de la oxigenación58, que es debido a una inhibición reversible de la NOS endotelial por el NOi3. La retirada debe realizarse por tanto de forma gradual, al menos cada 12 horas, una vez que la oxigenación haya mejorado y el paciente esté estable, con una dosis baja de NOi (5 ppm). Posteriormente la dosis debe reducirse progresivamente durante 6-12 horas hasta 1 ppm, que se mantendrá durante 30 minutos vigilando continuamente la tensión arterial, la frecuencia cardiaca y la SatO2, para después realizar la desconexión38 (Figura 1).

Figura 1 Esquema de recomendaciones propuesto para el uso de óxido nítrico inhalado (NOi) en pacientes adultos con síndrome de distrés respiratorio agudo (SDRA) con hipoxemia refractaria severa.
Otros
Aunque no se han llevado a cabo estudios de interacción, no se puede descartar una interacción clínicamente significativa con sustancias donantes de NO (anestésicos locales, nitroprusiato, nitroglicerina, etc.) o con otros vasodilatadores que actúan a través de los sistemas GMPc o AMPc, que deben utilizarse con precaución38.
El tratamiento con NOi puede elevar el gradiente transpulmonar en determinadas situaciones y agravar la insuficiencia cardiaca en situaciones de derivación sanguínea izquierda-derecha, por lo que debe ser utilizado con precaución en estos pacientes y en aquéllos con deterioro de la función ventricular izquierda y una presión capilar pulmonar basal elevada4,32,38. continúan investigando para el tratamiento de pacientes con SDRA, en el caso del NOi, a tenor de la evidencia disponible con ausencia de beneficio en parámetros como mortalidad o duración de ventilación mecánica23-30, su alto coste (marcadamente incrementado tras su aprobación como producto farmacéutico y su patente por la industria)60, posible riesgo asociado de disfunción renal27,29, el pequeño número de pacientes con hipoxemia severa como para detectar un tratamiento efectivo30, y la existencia de alternativas terapéuticas que claramente han demostrado beneficios clínicos como la ventilación protectora o la ventilación en prono1, es improbable que se desarrollen futuros ensayos clínicos que evalúen estrategias de dosificación y duración del NOi en pacientes severamente hipoxémicos, si no es en conjunción con otras intervenciones que claramente han demostrado beneficio en el SDRA30,34.
Esquema propuesto de uso
En base a la evidencia actual, actualmente no se recomienda el uso rutinario del NOi en pacientes adultos con SDRA. Debería considerarse su uso en determinadas circunstancias en las que el paciente tiene un alto riesgo de muerte o perjuicio por hipoxemia a pesar de otros tratamientos disponibles (30,32,34). El beneficio en el aumento de la oxigenación puede proporcionar un valioso tiempo que sea necesario para la resolución del proceso que generó el daño, para optimizar la estrategia ventilatoria o para instaurar otras modalidades de tratamiento como la oxigenación por membrana extracorpórea. Además, existen determinados pacientes con hipoxemia grave refractaria que también podrían beneficiarse de un aumento en la oxigenación mediante tratamientos como el NOi, en los que no se pueden implementar algunas terapias que mejoran el intercambio gaseoso (PEEP, posición prona) por estar contraindicadas o suponer un riesgo excesivo (por ejemplo hipertensión intracraneal o inestabilidad de la columna cervical). Su utilización para esta indicación, como terapia de rescate frente a la hipoxemia refractaria en pacientes adultos con SDRA óptimamente ventilados, precisa de un consentimiento informado (Figura 2).
En la Figura 1 se expone un esquema de recomendaciones para el uso de NOi en pacientes con SDRA con hipoxemia refractaria severa que incluye aspectos como la indicaciones de administración y retirada, dosificación y monitorización. La implementación de un protocolo de uso y retirada puede reducir los costes directos asociados con su empleo59.
Perspectiva futura de investigación
Las perspectivas para la búsqueda de futuros ensayos clínicos que evalúen la terapia con NOi en el SDRA no son buenas30. Si bien numerosas terapias farmacológicas se continúan investigando para el tratamiento de pacientes con SDRA, en el caso del NOi, a tenor de la evidencia disponible con ausencia de beneficio en parámetros como mortalidad o duración de ventilación mecánica23-30, su alto coste (marcadamente incrementado tras su aprobación como producto farmacéutico y su patente por la industria)60, posible riesgo asociado de disfunción renal27,29, el pequeño número de pacientes con hipoxemia severa como para detectar un tratamiento efectivo30, y la existencia de alternativas terapéuticas que claramente han demostrado beneficios clínicos como la ventilación protectora o la ventilación en prono1, es improbable que se desarrollen futuros ensayos clínicos que evalúen estrategias de dosificación y duración del NOi en pacientes severamente hipoxémicos, si no es en conjunción con otras intervenciones que claramente han demostrado beneficio en el SDRA30,34.
Conclusiones
El NOi en pacientes con SDRA causa una inmediata vasodilatación pulmonar selectiva mejorando la oxigenación arterial, aunque no ha demostrado una mejora en la supervivencia o en la morbilidad de pacientes críticos. Si bien su uso rutinario no puede ser recomendado, continua siendo usado como una opción segura y es razonable su administración como tratamiento de rescate en pacientes con hipoxemia refractaria severa.
References
Delgado Martín M, Fernández Fernández R. Estrategias frente a la hipoxemia refractaria en el síndrome de dificultad respiratoria del adulto. Med Intensiva. 2013;37(6):423-30. [ Links ]
Griffiths MJ, Evans TW. Inhaled nitric oxide therapy in adults. N Engl J Med 2005;353(25):2683-95. [ Links ]
Puri N, Dellinger RP. Inhaled nitric oxide and inhaled prostacyclin in acute respiratory distress syndrome: what is the evidence? Crit Care Clin. 2011;27(3):561-87. [ Links ]
Creagh-Brown BC, Griffiths MJ, Evans TW. Bench-to-bedside review: Inhaled nitric oxide therapy in adults. Crit Care. 2009;13(3):221. [ Links ]
Hogman M, Frostell CG, Hedenstrom H, Hedenstierna G. Inhalation of nitric oxide modulates adult human bronchial tone. Am Rev Respir Dis 1993;148(6 Pt 1):1474-8 [ Links ]
Palmer RM, Ferrige AG, Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 1987;327(6122):524-6. [ Links ]
Ignarro LJ, Byrns RE, Buga GM, Wood KS. Endothelium-derived relaxing factor from pulmonary artery and vein possesses pharmacologic and chemical properties identical to those of nitric oxide radical. Circ Res. 1987;61(6):866-79. [ Links ]
Pepke-Zaba J, Higenbottam TW, Dinh-Xuan AT, Stone D, Wallwork J. Inhaled nitric oxide as a cause of selective pulmonary vasodilatation in pulmonary hypertension. Lancet. 1991;338(8776):1173-4. [ Links ]
Rossaint R, Falke KJ, López F, Slama K, Pison U, Zapol WM. Inhaled nitric oxide for the adult respiratory distress syndrome. N Engl J Med. 1993;328(6):399-405. [ Links ]
Gerlach H, Pappert D, Lewandowski K, Rossaint R, Falke KJ. Longterm inhalation with evaluated low doses of nitric oxide for selective improvement of oxygenation in patients with adult respiratory distress syndrome. Intensive Care Med. 1993;19(8):443-9. [ Links ]
Bigatello LM, Hurford WE, Kacmarek RM, Roberts JD Jr, Zapol WM. Prolonged inhalation of low concentrations of nitric oxide in patients with severe adult respiratory distress syndrome. Effects on pulmonary hemodynamics and oxygenation. Anesthesiology. 1994;80(4):761-70. [ Links ]
Young JD, Brampton WJ, Knighton JD, Finfer SR. Inhaled nitric oxide in acute respiratory failure in adults. Br J Anaesth. 1994;73(4):499-502. [ Links ]
Dellinger RP, Zimmerman JL, Taylor RW, Straube RC, Hauser DL, Criner GJ, et al. Effects of inhaled nitric oxide in patients with acute respiratory distress syndrome: results of a randomized phase II trial. Inhaled Nitric Oxide in ARDS Study Group. Crit Care Med. 1998;26(1):15-23. [ Links ]
Michael JR, Barton RG, Saffle JR, Mone M, Markewitz BA, Hillier K, et al. Inhaled nitric oxide versus conventional therapy: effect on oxygenation in ARDS. Am J Respir Crit Care Med. 1998;157(5 Pt 1):1372-80. [ Links ]
Troncy E, Collet JP, Shapiro S, Guimond JG, Blair L, Ducruet T, et al. Inhaled nitric oxide in acute respiratory distress syndrome: a pilot randomized controlled study. Am J Respir Crit Care Med. 1998;157(5 Pt 1):1483-8. [ Links ]
Lundin S, Mang H, Smithies M, Stenqvist O, Frostell C. Inhalation of nitric oxide in acute lung injury: results of a European multicenter study. The European Study Group of Inhaled Nitric Oxide. Intensive Care Med. 1999;25(9):911-9. [ Links ]
Payen D, Vallet B, Group d’étude du NO dans l’ARDS. Results of the French prospective multicentric randomized double-blind placebo-controlled trial on inhaled nitric oxide (NO) in ARDS (abstract). Intensive Care Med 1999;25(Suppl 1):S166 [ Links ]
Cuthbertson BH, Galley HF, Webster NR. Effect of inhaled nitric oxide on key mediators of the inflammatory response in patients with acute lung injury. Crit Care Med. 2000;28(6):1736-41. [ Links ]
Mehta S, Simms HH, Levy MM, Hill NS, Schwartz W, Nelson D, et al. Inhaled nitric oxide improves oxygenation acutely but not chronically in acute respiratory distress syndrome: a randomized, controlled trial. J Appl Res Clin Exp Ther 2001;1(2):73-84 [ Links ]
Gerlach H, Keh D, Semmerow A, Busch T, Lewandowski K, Pappert DM, et al. Dose-response characteristics during long-term inhalation of nitric oxide in patients with severe acute respiratory distress syndrome: a prospective, randomized, controlled study. Am J Respir Crit Care Med. 2003;167(7):1008-15. [ Links ]
Park KJ, Lee YJ, Oh YJ, Lee KS, Sheen SS, Hwang SC. Combined effects of inhaled nitric oxide and a recruitment maneuver in patients with acute respiratory distress syndrome. Yonsei Med J. 2003;44(2):219-26. [ Links ]
Taylor RW, Zimmerman JL, Dellinger RP, Straube RC, Criner GJ, Davis K Jr, et al; Inhaled Nitric Oxide in ARDS Study Group. Low-dose inhaled nitric oxide in patients with acute lung injury: a randomized controlled trial. JAMA. 2004;291(13):1603-9. [ Links ]
Sokol J, Jacobs SE, Bohn D. Inhaled nitric oxide for acute hypoxic respiratory failure in children and adults: a meta-analysis. Anesth Analg. 2003;97(4):989-98. [ Links ]
Sokol J, Jacobs SE, Bohn D. Inhaled nitric oxide for acute hypoxemic respiratory failure in children and adults. Cochrane Database Syst Rev. 2003;(1):CD002787. [ Links ]
Adhikari N, Burns KE, Meade MO. Pharmacologic therapies for adults with acute lung injury and acute respiratory distress syndrome. Cochrane Database Syst Rev. 2004;(4):CD004477. [ Links ]
Adhikari N, Burns KE, Meade MO. Pharmacologic treatments for acute respiratory distress syndrome and acute lung injury: systematic review and meta-analysis. Treat Respir Med. 2004;3(5):307-28. [ Links ]
Adhikari NK, Burns KE, Friedrich JO, Granton JT, Cook DJ, Meade MO. Effect of nitric oxide on oxygenation and mortality in acute lung injury: systematic review and meta-analysis. BMJ. 2007;334(7597):779. [ Links ]
Afshari A, Brok J, Møller AM, Wetterslev J. Inhaled nitric oxide for acute respiratory distress syndrome (ARDS) and acute lung injury in children and adults. Cochrane Database Syst Rev. 2010;(7):CD002787. [ Links ]
Afshari A, Brok J, Møller AM, Wetterslev J. Inhaled nitric oxide for acute respiratory distress syndrome and acute lung injury in adults and children: a systematic review with meta-analysis and trial sequential analysis. Anesth Analg. 2011;112(6):1411-21. [ Links ]
Adhikari NK, Dellinger RP, Lundin S, Payen D, Vallet B, Gerlach H, et al. Inhaled nitric oxide does not reduce mortality in patients with acute respiratory distress syndrome regardless of severity: systematic review and meta-analysis. Crit Care Med. 2014;42(2):404-12. [ Links ]
Gerlach H, Rossaint R, Pappert D, Falke KJ. Time-course and dose-response of nitric oxide inhalation for systemic oxygenation and pulmonary hypertension in patients with adult respiratory distress syndrome. Eur J Clin Invest. 1993;23(8):499-502. [ Links ]
Germann P, Braschi A, Della Rocca G, Dinh-Xuan AT, Falke K, Frostell C, et al. Inhaled nitric oxide therapy in adults: European expert recommendations. Intensive Care Med. 2005;31(8):1029-41. [ Links ]
Roch A, Hraiech S, Dizier S, Papazian L. Pharmacological interventions in acute respiratory distress syndrome. Ann Intensive Care. 2013;3(1):20. [ Links ]
Rossaint R, Lewandowski K, Zapol WM. Our paper 20 years later: Inhaled nitric oxide for the acute respiratory distress syndrome-discovery, current understanding, and focussed targets of future applications. Intensive Care Med. 2014;40(11):1649-58. [ Links ]
Stapleton RD, Wang BM, Hudson LD, Rubenfeld GD, Caldwell ES, Steinberg KP. Causes and timing of death in patients with ARDS. Chest. 2005;128(2):525-32. [ Links ]
Dellinger RP, Trzeciak SW, Criner GJ, Zimmerman JL, Taylor RW, Usansky H, et al. Association between inhaled nitric oxide treatment and long-term pulmonary function in survivors of acute respiratory distress syndrome. Crit Care. 2012;16(2):R36. [ Links ]
Beloucif S, Payen D. A European survey of the use of inhaled nitric oxide in the ICU. Working Group on Inhaled NO in the ICU of the European Society of Intensive Care Medicine. Intensive Care Med. 1998;24(8):864-77. [ Links ]
Ficha técnica de óxido nítrico INOmax 400 ppm mol/mol, gas para inhalación. Centro de Información online de Medicamentos de la Agencia española de medicamentos y productos sanita rios (AEMPS-CIMA); (citada 30 Noviembre 2014). Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000337/WC500032784.pdf [ Links ]
Papazian L, Forel JM, Gacouin A, Penot-Ragon C, Perrin G, Loundou A, et al; ACURASYS Study Investigators. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med. 2010;363(12):1107-16. [ Links ]
Davies A, Jones D, Bailey M, Beca J, Bellomo R, Blackwell N, et al. Australia and New Zealand Extracorporeal Membrane Oxygenation (ANZ ECMO) Influenza Investigators. Extracorporeal Membrane Oxygenation for 2009 Influenza A(H1N1) Acute Respiratory Distress Syndrome. JAMA. 2009;302(17):1888-95. [ Links ]
Kumar A, Zarychanski R, Pinto R, Cook DJ, Marshall J, Lacroix J, et al; Canadian Critical Care Trials Group H1N1 Collaborative. Critically ill patients with 2009 influenza A(H1N1) infection in Canada. JAMA. 2009;302(17):1872-9. [ Links ]
Rodríguez A, Socías L, Guerrero JE, Figueira JC, González N, Maraví-Poma E, et al; Grupo Español de Trabajo de Gripe A Grave/Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias. Gripe A pandémica en una unidad de cuidados intensivos: experiencia en España y Latinoamérica (Grupo Español de Trabajo de Gripe A Grave/Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias). Med Intensiva. 2010;34(2):87-94. [ Links ]
Park KJ, Lee YJ, Oh YJ, Lee KS, Sheen SS, Hwang SC. Combined effects of inhaled nitric oxide and a recruitment maneuver in patients with acute respiratory distress syndrome. Yonsei Med J. 2003;44(2):219-26. [ Links ]
Johannigman JA, Davis K Jr, Campbell RS, Luchette FA, Frame SB, Branson RD. Positive end-expiratory pressure and response to inhaled nitric oxide: changing nonresponders to responders. Surgery. 2000;127(4):390-4. [ Links ]
Germann P, Pöschl G, Leitner C, Urak G, Ullrich R, Faryniak B, et al. Additive effect of nitric oxide inhalation on the oxygenation benefit of the prone position in the adult respiratory distress syndrome. Anesthesiology. 1998;89(6):1401-6. [ Links ]
Mehta S, MacDonald R, Hallett DC, Lapinsky SE, Aubin M, Stewart TE. Acute oxygenation response to inhaled nitric oxide when combined with high-frequency oscillatory ventilation in adults with acute respiratory distress syndrome. Crit Care Med. 2003;31(2):383-9. [ Links ]
Papazian L, Bregeon F, Gaillat F, Kaphan E, Thirion X, Saux P, et al. Does norepinephrine modify the effects of inhaled nitric oxide in septic patients with acute respiratory distress syndrome? Anesthesiology. 1998;89(5):1089-98. [ Links ]
Puybasset L, Rouby JJ, Mourgeon E, Stewart TE, Cluzel P, Arthaud M, et al. Inhaled nitric oxide in acute respiratory failure: dose-response curves. Intensive Care Med. 1994;20(5):319-27. [ Links ]
Lu Q, Mourgeon E, Law-Koune JD, Roche S, Vézinet C, Abdennour L, et al. Dose-response curves of inhaled nitric oxide with and without intravenous almitrine in nitric oxide-responding patients with acute respiratory distress syndrome. Anesthesiology. 1995;83(5):929-43. [ Links ]
McIntyre RC Jr, Moore FA, Moore EE, Piedalue F, Haenel JS, Fullerton DA. Inhaled nitric oxide variably improves oxygenation and pulmonary hypertension in patients with acute respiratory distress syndrome. J Trauma. 1995;39(3):418-25. [ Links ]
Lundin S, Westfelt UN, Stenqvist O, Blomqvist H, Lindh A, Berggren L, et al. Response to nitric oxide inhalation in early acute lung injury. Intensive Care Med. 1996;22(8):728-34. [ Links ]
Hsu CW, Lee DL, Lin SL, Sun SF, Chang HW. The initial response to inhaled nitric oxide treatment for intensive care unit patients with acute respiratory distress syndrome. Respiration. 2008;75(3):288-95. [ Links ]
Cuthbertson BH, Dellinger P, Dyar OJ, Evans TE, Higenbottam T, Latimer R, et al. UK guidelines for the use of inhaled nitric oxide therapy in adult ICUs. American-European Consensus Conference on ALI/ARDS. Intensive Care Med. 1997;23(12):1212-8. [ Links ]
Young JD, Dyar O, Xiong L, Howell S. Methaemoglobin production in normal adults inhaling low concentrations of nitric oxide. Intensive Care Med. 1994;20(8):581-4. [ Links ]
Francoe M, Troncy E, Blaise G. Inhaled nitric oxide: technical aspects of administration and monitoring. Crit Care Med. 1998;26(4):782-96. [ Links ]
Högman M, Frostell C, Arnberg H, Hedenstierna G. Bleeding time prolongation and NO inhalation. Lancet. 1993;341(8861):1664-5. [ Links ]
Samama CM, Diaby M, Fellahi JL, Mdhafar A, Eyraud D, Arock M, et al. Inhibition of platelet aggregation by inhaled nitric oxide in patients with acute respiratory distress syndrome. Anesthesiology. 1995;83(1):56-65. [ Links ]
Christenson J, Lavoie A, O’Connor M, Bhorade S, Pohlman A, Hall JB. The incidence and pathogenesis of cardiopulmonary deterioration after abrupt withdrawal of inhaled nitric oxide. Am J Respir Crit Care Med. 2000;161(5):1443-9. [ Links ]
Todd Tzanetos DR, Housley JJ, Barr FE, May WL, Landers CD. Implementation of an Inhaled Nitric Oxide Protocol Decreases Direct Cost Associated With Its Use. Respir Care. 2015;60(5):644-50. [ Links ]
Pierce CM, Peters MJ, Cohen G, Goldman AP, Petros AJ. Cost of nitric oxide is exorbitant. BMJ. 2002;325(7359):336. [ Links ]
Recibido: 03 de Abril de 2016; Aprobado: 07 de Noviembre de 2016











 text in
text in 


