Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.41 no.4 Toledo jul./ago. 2017
https://dx.doi.org/10.7399/fh.2017.41.4.10562
Originales
Evaluación de las prescripciones fuera de ficha técnica: perfil, evidencia y evolución
1Pharmacology Department, Universidad de Málaga, IBIMA (Institute of Biomedical Research in Málaga), Málaga. Spain.
2Medical Research Centre (CIMES), Málaga. Spain.
3Hospital Pharmacy CMU (Clinical Management Unit), H. Reina Sofía, Córdoba. Spain.
Introducción
El documento oficial de información de un medicamento es su ficha técnica, elaborada por la compañía farmacéutica que lo comercializa, una vez ha sido evaluada y aprobada por las Autoridades Sanitarias. Este documento constituye la base de información, destinada a los profesionales de la salud, sobre cómo usar de forma eficaz y segura el medicamento. El principal sustento de esta autorización sanitaria se basa en la valoración de los datos aportados por los ensayos clínicos para una o varias indicaciones terapéuticas, por lo que el uso de fármacos bajo las condiciones que se describen en la ficha técnica cuenta con el aval de que su eficacia y seguridad han sido evaluados científicamente. Sin embargo, esto no puede garantizarse cuando se prescribe fuera de lo contemplado en dicho documento.
El uso de medicamentos en indicaciones diferentes a las reflejadas en la ficha técnica constituye una práctica no infrecuente, tanto a nivel ambulatorio1, como sobre todo a nivel hospitalario, especialmente en áreas como oncología2 y psiquiatría3. Estas prescripciones fuera de ficha técnica (FFT), denominadas off-label en la literatura internacional, incluyen también las realizadas en grupos poblacionales diferentes a los contemplados en la ficha técnica, como fundamentalmente son los niños4,5. Son varias las razones que pueden justificar estos usos off-label: la existencia de lagunas terapéuticas, la pujanza investigadora de determinadas áreas y, por otro lado, la falta de interés de algunas compañías en ampliar las indicaciones terapéuticas, sobre todo si se trata de medicamentos antiguos con escaso margen comercial.
Esta práctica puede entrañar beneficios, pero también riesgos; de hecho, se han publicado estudios que reflejan una mayor tasa de reacciones adversas cuando los medicamentos se usan off-label6-8. Además, no siempre el empleo de medicamentos en indicaciones no autorizadas se encuentra avalado por un buen nivel de evidencia1,9, lo que obliga a una cuidadosa valoración del balance beneficio/riesgo de los tratamientos.
Con la entrada en vigor del Real Decreto 1015/200910 por el que se regula la disponibilidad de medicamentos en situaciones especiales, se delimitan por primera vez en España tres situaciones: el uso compasivo de medicamentos en investigación, el uso de medicamentos en condiciones diferentes de las autorizadas y el acceso a medicamentos no autorizados en España. Con esta regulación se aclara la situación previa de solapamiento de solicitudes y se agiliza la gestión con una ordenación de los procedimientos específicos, estableciéndose que el empleo de un medicamento autorizado en condiciones diferentes de las autorizadas cae dentro de la esfera de la práctica clínica, sin necesitar a partir de este Real Decreto de ninguna autorización caso por caso por parte de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS)11. Previo a la publicación del citado Real Decreto se asimilaba el procedimiento para medicamentos en investigación y medicamentos ya autorizados, lo que generaba confusión en los profesionales sanitarios. Es importante recordar que con esta nueva legislación el médico responsable debe justificar en la historia clínica el uso FFT, respetar la autonomía del paciente solicitando el consentimiento informado y tener en cuenta las restricciones que estuviesen ligadas a la prescripción y/o dispensación del medicamento, así como la notificación de sospechas de reacciones adversas10.
Aunque teóricamente excepcionales, los usos off-label son frecuentes en muchos centros hospitalarios, y es también un hecho innegable que en determinadas áreas médicas se están desarrollando nuevas estrategias terapéuticas a un ritmo muy superior al de los cambios en la autorización de los medicamentos, por lo que nos propusimos el presente estudio con el objetivo de describir la magnitud y perfil de usos FFT en un hospital de tercer nivel, analizar el nivel de evidencia científica en el que se sustentan dichas indicaciones, valorar la actividad investigadora, y determinar los usos que finalmente se autorizan como nuevas indicaciones transcurridos cinco años desde la solicitud .
Métodos
Estudio transversal en el que se incluyeron todas las solicitudes de usos FFT realizadas durante el año 2010 en el Hospital Universitario Reina Sofía de Córdoba. La fuente de datos fue el registro de solicitudes de medicamentos en condiciones distintas a las autorizadas en ficha técnica recibidas en el servicio de Farmacia.
La tramitación y valoración de las solicitudes de los usos FFT se realizaba por la Comisión de Farmacia y Terapéutica (CFT) del hospital. Existía un listado con los usos off-label ya previamente valorados y aprobados, de modo que si una solicitud estaba incluida en dicho listado, se autorizaba automáticamente. Si la solicitud no estaba incluida o era nueva, el médico solicitante debía acompañar el informe clínico justificativo con apoyo bibliográfíco para ser todo ello evaluado por una SubCFT, que remitía el informe de evaluación a Dirección para aprobar o no el uso y, finalmente, a la siguiente reunión ordinaria de la CFT para su valoración definitiva. En caso de informe favorable, la indicación pasaba a engrosar el listado positivo. En el inicio del periodo de estudio el listado incluía 208 usos. Por otro lado, estaba establecido que la CFT podía requerir, cuando lo considerara oportuno, un seguimiento de los resultados clínicos y/o efectos adversos de usos FFT. Todo el procedimiento había sido difundido a los profesionales a través de la intranet del hospital junto con las recomendaciones indicadas en el RD 1015/2009.
Para cada solicitud se recogieron: área clínica, medicamento, año de autorización, grupo y subgrupo farmacológico según clasificación ATC (Anatomical Therapeutic Chemical Classification System), indicación o indicaciones FFT, nivel de evidencia para cada solicitud, ensayos clínicos en marcha para la indicación concreta, y variaciones en las fichas técnicas transcurridos cinco años. Valoración del Nivel de Evidencia. Para cada una de las indicaciones clínicas se realizó una búsqueda bibliográfica en la base de datos Pubmed. Posteriormente, la evidencia disponible fue clasificada en distintos niveles en función de los criterios publicados por SIGN (Scottish Intercollegiate Guidelines Network)12, utilizados también por el NICE (National Institute for Health and Care Excellence) para estudios de intervención. Asimismo se aplicaron los niveles de evidencia del CEBM (Centre for Evidence-based Medicine, Oxford)13, el otro criterio de referencia. Esta evaluación de la evidencia disponible se ha hecho en dos puntos cronológicos: año de la solicitud (2010) y año de finalización del estudio (2015), con el objetivo de valorar posibles cambios o mejoras a lo largo del tiempo. Finalmente, para operativizar y resumir de una forma más sencilla todos estos niveles de evidencia, secundariamente fueron agrupados en dos categorías: buen o aceptable nivel de evidencia (al menos un ensayo clínico) y bajo nivel de evidencia (resto de los diseños), estrategia de síntesis también empleada por otros autores1,14-15.
Existencia de ensayos clínicos. Para conocer si había ensayos clínicos en marcha sobre el uso del medicamento en la indicación solicitada se consultó el registro internacional ClinicalTrials.gov16.
Variaciones en ficha técnica. Para evaluar si los usos off-label finalmente eran autorizados se han venido consultando durante los 5 años de seguimiento las fichas técnicas17 de los medicamentos implicados, además de revisar periódicamente el Boletín Mensual de la AEMPS18.
De forma coherente con los objetivos del estudio, se realizó un análisis descriptivo de todas las variables recogidas. El proyecto contó con dictamen positivo del Comité Etico.
Resultados
Durante 2010 hubo un total de 190 solicitudes de usos de fármacos fuera de ficha técnica, que implicaron a un total de 44 medicamentos y hasta 82 indicaciones clínicas diferentes.
El servicio clínico que mayor número de peticiones realizó fue Neumología (32%), seguido de Pediatría (22%), Dermatología (10-5%) y Hematología (7,3%). El grupo farmacológico más solicitado como off-label fue el L (agentes antineoplásicos e inmunomoduladores), no sólo en cuanto al número de fármacos (n=28, 63%), sino también y principalmente en cuanto al número de indicaciones distintas (n=60, 73,2%) y de solicitudes (n=131, 69%). El resto de los grupos ATC contribuyó con menor proporción de solicitudes y menor variedad de medicamentos (Tabla 1). El medicamento que individualmente tuvo mayor número de solicitudes fue tacrolimus, seguido de micofenolato, colistimetato y everolimus.
La mayor parte de los medicamentos eran relativamente recientes, habiendo obtenido la autorización de comercialización posteriormente al año 2000 en el 66% de los casos (n=29).
El número de indicaciones fuera de ficha técnica para cada fármaco pudo oscilar desde una única patología (n=27, 61,3% de los medicamentos) hasta diez indicaciones distintas para el mismo medicamento, como ocurrió con micofenolato (Tabla 2). Por otro lado, también hubo cuadros clínicos para los que se solicitó más de un uso off-label (Tabla 3), si bien en la mayor parte de los casos (64,6%) sólo fue uno.
Valoración del Nivel de Evidencia
En el momento de la solicitud, algo más de la mitad (n=43, 52,4%) de los usos off-label se apoyaba en al menos un ensayo clínico, o lo que podría considerarse un buen nivel de evidencia (niveles 1++, 1+ y 1-, según la escala SIGN- NICE). Sin embargo, en un 47,6% de los mismos el nivel de evidencia era bajo, y gran parte de la información disponible era únicamente sobre casos y series de casos (Tabla 4). La situación más común fue la de indicaciones sustentadas por ensayos clínicos de baja calidad (por ejemplo, basiliximab en enfermedad injerto contra huésped o rituximab en síndrome de Sjögren). Un ejemplo muy representativo de estudios publicados con muy buena calidad metodológica fueron los de metotrexato para la artritis idiopática juvenil. Y en el polo opuesto, con prácticamente ninguna información previa disponible, se encontraban solicitudes como nilotinib para leucemia linfoide aguda y sirolimus para fístula arteriovenosa pulmonar, ambos en pacientes pediátricos; o como topotecan y ustekinumab para dermatitis atópica refractaria en pacientes adultos
Tabla 4 Nivel de evidencia de los usos off-label en el momento de su solicitud (2010) y cambios (nuevos niveles alcanzados) tras 5 años (2015)
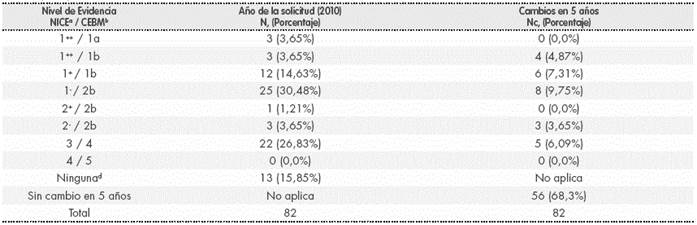
a SIGN-NICE niveles de evidencia para estudios de intervención: 1++ (metaanálisis de gran calidad, revisiones sistemáticas de ensayos clínicos aleatorizados -ECA-, o ECA con muy bajo riesgo de sesgos); 1+ (igual que 1++ con bajo riesgo de sesgos); 1- (igual que 1++ con alto riesgo de sesgos); 2++ (revisiones sistemáticas de alta calidad de estudios de cohortes o de casos-controles, o cohortes o casos-controles de alta calidad, con muy bajo riesgo de confusion, sesgos o azar y una alta probabilidad de que la relación sea causal); 2+ (estudios de cohortes o de casos-controles bien realizados, con bajo riesgo de confusion, sesgos o azar y una moderada probabilidad de relación causal); 2- (cohortes o casos-controles con alto riesgo de sesgo); 3 (estudios no analíticos: casos y series de casos); 4 (opinion de expertos) b CEBM, Oxford: 1a (revisión sistemática de ECA, con homogeneidad: resultados comparables y en la misma dirección); 1b (ECA individual); 1c (eficacia demostrada por la práctica clínica y no por la experimentación); 2a (revisión sistemática de estudios de cohortes, con homogeneidad); 2b (estudio de cohortes individual y ECA de baja calidad); 2c (investigación de resultados en salud); 3a (revisión sistemática de casos-controles, con homogeneidad); 3b (casos-controles individuales); 4 (serie de casos y estudios de cohortes y casos-controles de baja calidad); 5 (opinión de expertos). c Número de solicitudes que alcanzan a los 5 años el nivel de evidencia concreto que se señala (partían de niveles inferiores en 2010) d No se ha encontrado evidencia alguna, incluyendo series de casos publicadas en revistas indexadas
Revisada la evidencia 5 años después de la solicitud, las dos terceras partes de los usos off-label no han incorporado estudios de mejor calidad (n=56, 68,3%). No obstante, hubo 26 de estos usos (31,7%) que han mejorado su nivel de evidencia (Tabla 4), destacando cuatro indicaciones que pasaron a tener un nivel 1++ (como everolimus para trasplante hepático, o rituximab para linfoma de células del manto).
Centrándonos en los medicamentos más solicitados, tacrolimus y micofenolato, se encontraron niveles de evidencia muy diferentes según la indicación para la que se prescribieron (Tabla 5). Para tacrolimus hubo muy buen nivel de evidencia cuando se trataba de su empleo en trasplante pulmonar, pero no fue así para su uso en lupus eritematoso sistémico (LES). En el caso de micofenolato, fue elevada para su utilización en nefritis lúpica (1++) y muy escasa o nula para neumonitis intersticial en niños.
Tabla 5 Detalle de los Niveles de evidencia para cada indicación de los dos medicamentos con mayor nº de solicitudes (tacrolimus y micofenolato)

s.c.: sin cambios. (-): sin datos disponibles publicados.
Existencia de ensayos clínicos
En el 33% de las indicaciones no se encontró ningún estudio en el registro internacional ClinicalTrials.gov. En el resto de usos off-label se han encontrado ensayos clínicos registrados y en marcha. Habitualmente entre 2-4 estudios, salvo para algunos casos excepcionales en los que se han podido detectar alrededor de 25-30 ensayos clínicos; ejemplos de esto último fueron el uso de bevacizumab para cáncer ovárico y glioblastoma, lenalinomida para síndrome mielodisplásico, o rituximab para linfoma de células del manto.
Variaciones en ficha técnica
Se han autorizado como nuevas indicaciones el 11% de los usos off-label (Tabla 6), habiéndose reflejado dicha ampliación en la ficha técnica. Estas nueve indicaciones tenían un buen nivel de evidencia ya en el momento de la solicitud para la indicación solicitada, excepto en los casos de sildenafilo y raltegravir, que lo han alcanzado posteriormente.
Discusión
Investigar la utilización de medicamentos, especialmente de algunos grupos como los biológicos, es de interés, máxime si se emplean en condiciones o indicaciones no recogidas en sus fichas técnicas y, en ocasiones, de manera no bien fundamentada. Por otro lado, a través de este tipo de estudios podemos conocer y aproximarnos a enfoques terapéuticos novedosos, que surgen de la necesidad de ofrecer a los pacientes algún tratamiento en caso de enfermedades con escasas alternativas, y a veces poco prevalentes. Valorar los niveles de evidencia científica de estos usos, aportando un seguimiento de la actividad investigadora, y analizar la inclusión o no finalmente de la nueva indicación en ficha técnica, suponen un enfoque novedoso.
De acuerdo con otros autores, opinamos que este tipo de estudios puede comportarse como claro identificador de múltiples y futuras iniciativas de investigación, centradas fundamentalmente en aquellos usos off-label con limitado sustento científico19.
En cuanto a las limitaciones, pensamos que los resultados del presente estudio pueden no ser generalizables, principalmente por tratarse de un procedimiento de una enorme variabilidad, la cual es inherente no sólo a las propias decisiones médicas, sino atribuible también a las diferencias existentes entre centros y al distinto nivel de complejidad que éstos tengan. Sin embargo, opinamos que pueden suponer un buen reflejo de lo que ocurre en el entorno hospitalario. Por otro lado, no disponemos de datos de efectividad, de toxicidad, ni de costes, porque no fueron los objetivos principales del estudio y principalmente porque no se disponía de informe clínico de seguimiento en el año de corte del estudio. Parece complicado hacer una óptima trazabilidad de los resultados del uso de los medicamentos FFT, y en la mayor parte de publicaciones esta información es escasa o incompleta. Sería deseable poder disponer de una buena información de seguimiento clínico e incluir este aspecto en estudios posteriores. El volumen de solicitudes de usos FFT durante un año en este centro puede considerarse importante y superior al detectado en otros estudios9,15,20,21. Aún así, es probable que las cifras estén infraestimadas si algunos profesionales no eran conocedores de la naturaleza off-label de ciertas prescripciones y no realizaban consecuentemente la solicitud, quizás por formar ya parte de práctica clínica habitual o también por tratarse de un periodo aún muy cercano a los cambios administrativos impuestos por el RD 1015/2009.
El elevado uso de los inmunosupresores está probablemente relacionado con el amplio abanico de enfermedades que tienen una base inmunitaria como denominador común, pudiendo ser solicitados para diferentes indicaciones dermatológicas, oftalmológicas, vasculitis, sarcoidosis, o LES, entre otras. En el caso del lupus se han venido empleando diferentes fármacos biológicos de forma off-label, si bien ninguno de ellos ha logrado demostrar eficacia en ensayos clínicos de calidad, algo que parcialmente puede entenderse por la dificultad que entraña el carácter heterogéneo de su presentación clínica22. En nuestra opinión, el motivo para prescribir algunos de estos medicamentos en indicaciones no autorizadas puede estar relacionado con un presumible efecto de clase, o por extensión a indicaciones relacionadas en su base fisiopatológica, o incluso ante procesos que tienen en común algunos síntomas. El medicamento con mayor número de peticiones fue precisamente el inmunosupresor tacrolimus, fundamentalmente a expensas de su empleo en la profilaxis de rechazo de trasplante pulmonar, indicación para la que el Hospital Reina Sofía es centro de referencia.
El empleo off-label de los antineoplásicos puede entenderse teniendo en cuenta que el área de oncohematología es una de las que tiene mayores necesidades terapéuticas. Hay datos publicados que estiman que la tercera parte de los pacientes oncológicos reciben al menos un tratamiento off-label de antineoplásicos, y que el 27% de éstos se prescriben para indicaciones distintas de las aprobadas23.
Este perfil, con especial protagonismo de inmunosupresores y terapia biológica, se asemeja al de publicaciones recientes20,21, pero dista mucho del encontrado en los primeros estudios realizados sobre usos off-label, en los que los grupos terapéuticos de los sistemas cardiovascular y nervioso (gabapentina y amitriptilina, fundamentalmente) fueron los más relacionados con estas prescripciones1; si bien debe tenerse en cuenta que esos trabajos iniciales se realizaron sobre prescripciones de médicos generales a nivel comunitario, y no por especialistas dentro el entorno hospitalario. Cuando comparamos los fármacos individualmente, y no por grupos, es cuando se evidencia que la variabilidad en este tipo de prescripciones es muy amplia. De hecho, en nuestro trabajo los medicamentos más solicitados fueron tacrolimus, micofenolato, colistimetato y everolimus, mientras que en un relevante estudio realizado en varios centros los más empleados fueron rituximab, toxina botulínica, omalizumab y anakinra9. Y las diferencias van más allá, puesto que en algunos casos ni las indicaciones coinciden para el mismo medicamento, por ejemplo tacrolimus (solicitado para urticaria crónica en este estudio catalán9, y para trasplante pulmonar, LES, y nefropatía membranosa en Reina Sofía) o ustekinumab (para Enfermedad de Crohn y para dermatitis atópica refractaria, respectivamente). Más recientes son los datos aportados por una amplia serie que cubre un periodo de 5 años, en la que los más solicitados fueron rituximab y bevacizumab24.
En cualquier caso, es importante señalar que muchos de estos fármacos son de reciente comercialización, sofisticados, caros, y de mayor complejidad de uso, lo que obliga a una evaluación cuidadosa del balance beneficio/riesgo/coste, principalmente para los nuevos biológicos25.
En cuanto al sustento científico de todas estas indicaciones, el nivel de evidencia fue bajo en casi la mitad de los casos (47,6%), cifras que no difieren mucho de las de trabajos similares (51,8%)9. Es cierto que no hay una homogeneidad total a la hora de categorizar los niveles de evidencia como elevado y bajo; en nuestro caso, de acuerdo con otras publicaciones1,14,15, se simplificó como buen o aceptable nivel de evidencia todo aquel uso que contaba con al menos un ensayo clínico en el momento de la solicitud. Según un estudio canadiense realizado a nivel de atención primaria, parece ser que los médicos con formación orientada por la medicina basada en la evidencia es menos probable que prescriban off-label14. Pero es bastante discutible que este resultado se pueda extrapolar al ámbito hospitalario, en el que los escenarios clínicos y, sobre todo, los requerimientos terapéuticos son completamente diferentes.
Querer conocer los cambios en los niveles de evidencia y las posibles mejoras en el sustento de estas indicaciones a lo largo del tiempo nos parecía una forma indirecta de valorar la actividad científica en estas áreas, algo que ocurrió en aproximadamente la tercera parte de los usos off-label. Paralelamente, buscar la puesta en marcha de ensayos clínicos también podía reflejar cierto dinamismo investigador, algo que se constató en el 67% de los usos, habiéndose detectado el mayor número de ensayos registrados en enfermedades oncológicas como cáncer de ovario, glioblastoma, linfoma de células del manto y melanoma.
Finalmente, la ampliación del uso como nueva indicación sólo ocurrió en el 11% de los casos. Puede parecer un porcentaje bajo, pero no hay ningún estudio que haya explorado este aspecto con el que poder compararnos. Podríamos interpretar la autorización de estas variaciones en ficha técnica como la culminación de un proceso en el que se van sumando pruebas que refrendan dicho uso. De hecho, existe muy buena correlación entre las indicaciones aprobadas y los elevados niveles de evidencia que estos usos tuvieron en el momento de su solicitud. Sin embargo, hay usos off-label apoyados en estudios de buena calidad que no han visto ampliada la indicación (por ejemplo micofenolato para nefritis lúpica, tacrolimus para trasplante de pulmón y toxina botulínica para acalasia). Este hecho puede estar relacionado con cierta disociación entre la calidad metodológica de los estudios y ciertos resultados de eficacia discutibles o no concluyentes, pero también con otra serie de factores entre los que pueden encontrarse las exigencias de las autoridades sanitarias de cara a autorizar la nueva indicación, o la falta de interés de las compañías farmacéuticas por solicitarla.
Los usos FFT, por su frecuencia y trascendencia, son una importante área de la práctica clínica en la que las lagunas de evidencia deberían poner en marcha una mayor reflexión atendiendo a una serie de señales como: fármacos recientes, nuevos usos off-label, medicamentos con reacciones adversas importantes y los de elevado coste26. Y su uso debería ser guiado utilizando los principios y el sustento de la medicina basada en la evidencia27. No obstante, podrían reconocerse una serie de ventajas derivadas de estos usos, como son el carácter innovador en la práctica clínica, el acceso a terapias de evidencia emergente y la posibilidad de tratar ciertas condiciones huérfanas28. En este sentido, según la propia Declaración de Helsinki, la necesidad de tratar se impone y “el médico, con el consentimiento informado del paciente, puede permitirse usar intervenciones no comprobadas, si, a su juicio, ello da alguna esperanza de salvar la vida, restituir la salud o aliviar el sufrimiento”29.
Pero, por otro lado, la implicación de estos usos en la política farmacéutica y gestión sanitaria resulta obvia si tenemos en cuenta los costes y también el perfil de seguridad de los medicamentos detectados como de mayor uso off-label. Por tanto, es necesaria una buena colaboración entre administraciones sanitarias y centros asistenciales de cara a garantizar el uso óptimo de los mismos. Así, diversas Comunidades Autónomas están estableciendo una normativa propia30 en la que se plantean cuestiones como la creación de Comités Técnicos para la evaluación de determinados medicamentos a utilizar en situaciones especiales, cuando éstos tengan un elevado impacto sanitario o económico. A nivel hospitalario son las Comisiones de Farmacia y Terapéutica las encargadas de evaluar las solicitudes de medicamentos en situaciones especiales. Pero es una realidad que existen diferencias entre las Comisiones de los distintos centros, tanto en la gestión como en los criterios a aplicar en las evaluaciones, lo que podría favorecer diferencias en las posibilidades de acceso a determinados tratamientos. Parece ser además que la calidad de la evidencia no demuestra ser una variable decisiva para la aprobación del uso de estos tratamientos, sobre la que sí parecen influir de forma clara la edad de los pacientes y el coste farmacéutico24. Esto se comprende si incorporamos en este escenario la existencia de tratamientos alternativos con similar perfil de eficacia-seguridad pero a un menor coste. Se trata por tanto de conciliar la valoración de aspectos como el nivel de evidencia del uso FFT propuesto, el coste, la existencia de alternativas válidas, las características del paciente y la gravedad o urgencia del proceso.
Se ha detectado un importante volumen de usos off-label en ausencia de buena evidencia, lo que identifica a estas indicaciones y medicamentos como líneas de investigación interesantes pero con necesidad de seguimiento de efectividad y costes. Debe prestarse especial atención al grupo de inmunosupresores, no sólo por el elevado número de solicitudes que han supuesto, sino también por la variedad de indicaciones en las que son empleados.
Bibliography
Radley DC, Finkelstein SN, Stafford RS. Off-label prescribing among Office-based Physicians. Arch Int Med. 2006;166:1021-6. [ Links ]
American Society of Clinical Oncology. Reimbursement for cancer treatment: coverage of off-label drug indications. J Clin Oncol. 2006;24(19):3206-8. [ Links ]
Martin-Latry K, Ricard C, Verdoux H. A one-day survey of characteristics of off-label hospital prescription of psychotropic drugs. Pharmacopsychiatry. 2007;40(3):116-20. [ Links ]
Blanco-Reina E, Vega-Jiménez MA, Ocaña-Riola R, Márquez-Romero EI, Bellido-Estévez I. Drug prescriptions study in the outpatient setting: assessment of off-label uses in children. Aten Primaria. 2015;47(6):344-50. [ Links ]
Lass J, Käär R, Jögi K, Varendi H, Metsvanht T, Lutsar I. Drug utilisation pattern and off-label use of medicines in Estonian neonatal units. Eur J Clin Pharmacol. 2011;67:1263-71. [ Links ]
Bellis JR, Kirkham JJ, Nunn AJ, Pirmohamed M. Adverse drug reactions and off-label and unlicensed medicines in children: a prospective cohort study of unplanned admissions to a paediatric hospital. Br J Clin Pharmacol. 2014;77(3):545-53. [ Links ]
Carmona L, Descalzo MA, Ruiz-Montesinos D, Manero-Ruiz FJ, Perez-Pampin E, Gomez-Reino JJ. BIOBADASER 2.0 Study Group. Safety and retention rate of off-label uses of TNF antagonists in rheumatic conditions: data from the Spanish registry BIOBADASER 2.0. Rheumatology (Oxford). 2011;50:85-92. [ Links ]
Melis M, Cupelli A, Sottosanti L, Buccellato E, Biagi C, Vaccheri A, et al. Off-label use of nicardipine as tocolytic and acute pulmonary oedema: a post-marketing analysis of adverse drug reaction reports in EudraVigilance. Pharmacoepidemiol Drug Saf. 2015. doi:10.1002/pds.3782. Epub 2015 Apr 2. [ Links ]
Danés I, Agustí A, Vallano A, Alerany C, Martínez J, Bosch JA, et al. Outcomes of off-label drug uses in hospitals: a multicentric prospective study. Eur J Clin Pharmacol. 2014;70(11):1385-93. [ Links ]
Boletín Oficial del Estado. Real Decreto 1015/2009, de 19 de Junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales. BOE nº 174, de 20 de Julio de 2009. Sec. I. P. 60904. Disponible en:http://www.boe.es/boe/dias/2009/07/20/pdfs/BOE-A-2009-12002.pdf [ Links ]
Avendaño C. Uso compasivo de medicamentos: un cambio necesario en España. Med Clin (Barc). 2009;133(11):425-6. [ Links ]
SIGN Grading System 1999-2012. Levels of Evidence.SING’s methodology.Scottish Intercollegiate Guidelines Network. Disponible en http://www.sign.ac.uk/guidelines/fulltext/50/annexoldb.html [ Links ]
Oxford Centre for Evidence-based Medicine (2009) Levels of evidence. Disponible en:http://www.cebm.net/oxford-centre-evidence-based-medicine-levels-evidencemarch-2009/ [ Links ]
Eguale T, Buckeridge DL, Winslade NE, Benedetti A, Hanley JA, Tamblyn R. Drug, patient, and physician characteristics associated with off-label prescribing in primary care. Arch Intern Med. 2012;172(10):781-8. [ Links ]
Martín González A, Abajo Del Álamo C, Catalá Pindado MA, Godoy Díez M. Quality of off-label prescriptions in advanced oncologic diseases. Med Clin (Barc). 2015 Aug 21;145(4):178-9. doi: 10.1016/j.medcli.2014.09.020. Epub 2014 Nov 26. [ Links ]
U.S. National Institutes of Health. Clinicaltrials.gov. Disponible en: https://clinicaltrials.gov/ [ Links ]
Centro de Información online de Medicamentos de la AEMPS - CIMA. Disponible en: http://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=detalleForm [ Links ]
Boletines Mensuales de la Agencia Española de Medicamento y Productos Sanitarios Disponible en: http://www.aemps.gob.es/informa/boletinMensual/home.htm [ Links ]
Walton SM, Schumock GT, Lee KV, Alexander GC, Meltzer D, Stafford RS. Prioritizing future research on off-label prescribing: results of a quantitative evaluation.Pharmacotherapy. 2008;28(12):1443-52. [ Links ]
Pérez-Moreno MA, Villalba-Moreno AM, Santos-Ramos B, Marín-Gil R, Varela-Aguilar JM, Torelló-Iserte J, et al. Off-label approval of drug use in a tertiary hospital. Rev Calid Asist. 2013;28(1):12-8. [ Links ]
Danés I, Alerany C, Ferrer A, Vallano A. Utilización hospitalaria de medicamentos en condiciones diferentes a las aprobadas en la ficha técnica. Med Clin 2014;143(7):327-9. [ Links ]
Gatto M, Kiss E, Naparstek Y, Doria A.In-/off-label use of biologic therapy in systemic lupus erythematosus. BMC Med. 2014;12:30. [ Links ]
Joerger M, Schaer-Thuer C, Koeberle D, Matter-Walstra K, Gibbons-Marsico J, Diem S, et al. Off-label use of anticancer drugs in eastern Switzerland: a population-based prospective cohort study. Eur J Clin Pharmacol. 2014;70(6):719-25. [ Links ]
Arocas Casañ V, Mateo Carmona J, García Molina O, Fernández de Palencia Espinosa MA, Blázquez Alvarez MJ, de la Rubia Nieto MA, del Rio García J. Off-label prescription of drugs at hospital. Farm Hosp. 2016;40(2):63-78. [ Links ]
Gillick MR.Controlling off-label medication use. Ann Intern Med. 2009;150(5):344-7. [ Links ]
Largent EA, Miller FG, Pearson SD.Going off-label without venturing off-course: evidence and ethical off-label prescribing. Arch Intern Med. 2009;169(19):1745-7. [ Links ]
Skledar SJ, Corman SL, Smitherman T.Addressing innovative off-label medication use at an academic medical center.Am J Health Syst Pharm. 2015;72(6):469-77. [ Links ]
Stafford RS.Regulating off-label drug use--rethinking the role of the FDA.N Engl J Med. 2008;358(14):1427-9. [ Links ]
Principios Eticos para las investigaciones médicas en seres humanos.Declaración de Helsinki de la Asociación Médica Mundial.Adoptada por la 64ª Asamblea General, Fortaleza, Brasil. Octubre 2013. [ Links ]
Resolución SA 0081/15 de 13 de abril de 2015 sobre Instrumentos y procedimientos para una más adecuada, eficiente y homogénea selección y utilización de los medicamentos en el ámbito de la prestación farmacéutica del Sistema Sanitario Público de Andalucía. Servicio Andaluz de Salud. 13 de abril de 2015 [ Links ]
Recibido: 09 de Marzo de 2016; Aprobado: 20 de Octubre de 2016











 texto en
texto en 






