My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.41 n.4 Toledo Jul./Aug. 2017
https://dx.doi.org/10.7399/fh.2017.41.4.10709
Originales
Impacto de un programa de optimización de antimicrobianos sobre el paciente crítico hematológico
1Pharmacy Unit. La Fe Healthcare Research Institute (IIS). Hospital Universitario y Politécnico La Fe, Valencia. Spain.
2Microbiology Unit. Hospital Universitario y Politécnico La Fe, Valencia. Spain.
3Pharmacy Unit. Hospital Universitario y Politécnico La Fe, Valencia. Spain.
4Infectious Disease Unit. Hospital Universitario y Politécnico La Fe, Valencia. Spain.
5Intensive Care Unit. Hospital Universitario y Politécnico La Fe, Valencia. Spain.
Aportación a la literatura científica
El manejo de la infección en el paciente hematológico que ingresa en una unidad de pacientes críticos constituye una desafío de gran complejidad. Las graves implicaciones de un tratamiento inapropiado sobre el pronóstico hace que en este grupo de pacientes sea frecuente la prescripción de múltiples antimicrobianos durante largos periodos de tiempo. No obstante, esta situación no esta exenta de riesgos, entre los que se encuentran la aparición de eventos adversos y la selección de cepas multirresistentes. En este artículo mostramos nuestra experiencia tras la implantación de un programa tipo “antimicrobial stewardship” en este grupo de pacientes de gran complejidad y sin experiencia previa descrita. Nuestro resultados muestran que en este grupo de pacientes la prescripción de antimicrobianos está sujeta un número importante de oportunidades de mejora y refuerza a necesidad de implantación de este tipo de programas en estas unidades.
Introducción
En los pacientes con enfermedad hematológica, la infección bacteriana o fúngica es una causa frecuente de morbi-mortalidad, especialmente durante los episodios de neutropenia1. De hecho, entre un 20-30% de estos pacientes desarrolla cuadros de sepsis grave durante su enfermedad2,3 y hasta 7% de los pacientes pueden desarrollara una infección fúngica invasora4.
El número de pacientes con inmunosupresión se ha incrementado notablemente durante los últimos años, debido el aumento en el número de tratamientos agresivos para la curación de la enfermedad, el aumento en el número trasplantes y el aumento de la edad de la población que recibe dichos tratamientos5. La aplicación de estas terapias agresivas, la toxicidad de la quimioterapia, la profunda inmunosupresión inducida durante periodos prolongados de tiempo y la aparición de enfermedad injerto contra huésped conducen a complicaciones graves que conllevan al ingreso de estos pacientes en las unidades de cuidados intensivos (UCI).
Durante las últimas décadas, el aumento de resistencias bacterianas a antimicrobianos se ha incrementado de forma notable, siendo particularmente importante en los pacientes oncohematológicos. En estas unidades ha sido especialmente relevante el incremento de resistencias de enterobacterias a antibióticos betalactámicos y las resistencias a múltiples antimicrobianos de Pseudomonas aeruginosa( 6-8.
En este contexto, durante los últimos años se ha potenciado el desarrollo de programas de optimización de antimicrobianos (PROA), destinados a optimizar y reducir el consumo de antimicrobianos, presentándose como una herramienta con impacto potencial para reducir o limitar el avance de las resistencias a los mismos9-11. No obstante, los estudios publicados sobre el papel de este tipo de programas sobre el paciente hematológico aún son limitados.
El propósito del presente estudio es evaluar el impacto clínico de un PROA sobre la evolución clínica de los pacientes hematológicos ingresados en una unidad de pacientes críticos.
Métodos
Se diseñó un estudio cuasi-experimental pre-post intervención. La UCI en donde se instauró el programa es una UCI médica de 24 camas, de un hospital terciario con 961 camas, recibiendo una media anual de 1.735 ingresos en el periodos 2013-2015. Para el presente estudio, se incluyeron aquellos pacientes con enfermedad hematológica que ingresaron en la unidad de pacientes críticos durante el periodo Octubre de 2013 a Septiembre de 2016.
Metodología de trabajo del PROA
En Octubre de 2013, se instauró un programa PROA en la unidad. En resumen, el PROA está formado por una intensivista experta en el manejo de la infección en el paciente crítico y un farmacéutico clínico, con el apoyo de un microbiólogo evaluaban tres veces por semana todos los pacientes en tratamiento antibiótico de la unidad. En el caso de encontrar alguna incidencia en la prescripción, se realizó una intervención cara a cara con el prescriptor (auditoría prospectiva)12, siguiendo la evolución del paciente implicado tras modificación consensuada.
De los pacientes incluidos en el estudio, se registraron datos demográficos, enfermedad hematológica de base, motivo de ingreso en la unidad, escala de gravedad al ingreso (APACHE II), así como necesidad de fármacos vasoactivos. En aquellos pacientes que ingresaron por causa infecciosa o que desarrollaron infección durante el ingreso, se registró el agente infeccioso responsable del mismo.
Para analizar el impacto del programa sobre la evolución clínica de los pacientes hematológicos en la unidad se comparó en el periodo previo a la intervención (Octubre 2012-Septiembre 2013) y el periodo intervención (Octubre 2013-Septiembre 2016) la mortalidad intra UCI, los días de estancia en la unidad, el porcentaje de reingresos los 30 días posteriores al alta de la unidad, así como los día de ventilación mecánica en los pacientes intubados.
Así mismo, en aquellos pacientes en los que se realizó intervención, se determinó el número de recaídas del proceso infeccioso posteriores a la intervención. Se describió como recaída del proceso infeccioso como la reaparición del cuadro infeccioso que requirió la re-introducción del antimicrobiano retirado o modificación de la pauta realizada tras la intervención del PROA durante las 72 h posteriores a la intervención.
Para determinar el impacto del programa sobre la colonización e infección por bacterias multirresistentes (BMR), se determinó la evolución del número de pacientes con nueva colonización por BMR durante su estancia en la unidad (definida como aparición de una nueva BMR tras > 48h de estancia en la unidad), así como el número de infecciones nosocomiales causadas por los mismos durante el mismo periodo. El análisis de vigilancia epidemiológica para detectar colonización por BMR se realizó dos veces por semana, mediante cultivos rectal, y orofaríngeo y cultivo de aspirado bronquial en los pacientes intubados. Así mismo, se recogió el consumo anual de antimicrobianos en la unidad durante el periodo de estudio.
El análisis estadístico se llevó a cabo a través del programa Stata v.13.0. La comparación de las variables entre el grupo pre y post intervención se llevó a cabo mediante pruebas paramétricas (Fischer, t de Student) o no paramétricas (χ2, U de Mann-Whitney) de acuerdo al análisis de normalidad de la muestra. La mortalidad a los 30 días de ingreso en la unidad se analizó mediante regresión de Cox.
El estudió contó con la aprobación del Comité de Ética de del Hospital.
Resultados
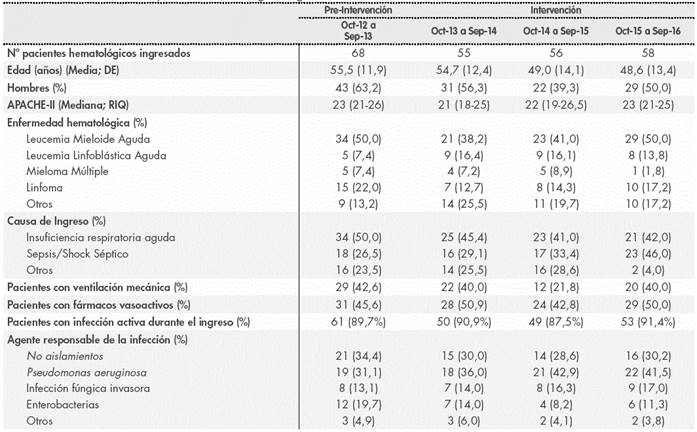
Durante el periodo de estudio, 324 antimicrobianos de 169 pacientes hematológicos fueron evaluaron por equipo PROA. Las características de los pacientes revisados se encuentran definidos en la Tabla 1.
Tras la revisión de tratamiento, se produjeron 121 modificaciones en el tratamiento. Las recomendaciones dadas por el equipo PROA se incluyen en la Tabla 2. La mayoría de las recomendaciones (82,6%) fueron aceptadas por los médicos responsables. Únicamente en tres pacientes (2,5%) se observó una recaída del proceso infecciosos tras la retirada propuesta del antimicrobianos, debiéndose reinstaurar el tratamiento. La evolución del consumo de antimicrobianos tras la implantación del PROA en la unidad de se muestra en la Figura 1.
La evolución clínica de los pacientes durante los periodos pre y post-intervención se encuentran reflejados en la Tabla 3. No se observaron diferencias significativas en la estancia media, mortalidad intra-UCI o en el porcentaje de reingresos de pacientes hematológicos en la unidad. Así mismo, no se observó una reducción significativas en la mortalidad a los 30 días de ingreso durante el periodo de intervención (HR:0,893; p = 0.669). Tampoco se encontraron diferencias en la duración de ventilación mecánica en aquellos pacientes hematológicos intubados.
Tabla 3 Impacto del programa PROA sobre el resultado clínica de los pacientes.

1En pacientes con ventilación mecánica; 2BMR=Bacteria Multirresistente
Respecto al periodo previo de intervención, no observamos una reducción significativa en el porcentaje de nuevas colonizaciones por BMR durante su estancia en la unidad. Tampoco se observaron diferencias significativas en el número de infecciones nosocomiales en este grupo de pacientes entre ambos periodos.
Discusión
Los resultados del presente estudio muestran que la implantación de un PROA basado en auditoría prospectiva en una unidad de pacientes críticos conllevan a un número relevante de intervenciones sobre la prescripción de antimicrobianos, incluyendo un importante número de suspensiones de tratamiento, sin que esto suponga un impacto negativo sobre la evolución clínica de los pacientes hematológicos ingresados en la unidad.
El manejo de la infección en el paciente hematológico constituye uno de los grandes retos para los intensivistas. El impacto de una adecuada elección del antimicrobiano sobre la supervivencia de estos pacientes así como elevado porcentaje de episodios sin aislamiento microbiológico hacen que la utilización de antimicrobianos de amplio espectro sean una práctica habitual en este grupo de pacientes13. No obstante, en muchas ocasiones la selección o duración del tratamiento no se corresponde con la evidencia clínica disponible y contribuye a un aumento del riesgo de toxicidad, costes y selección de BMR. Es ampliamente conocido que el empleo de antimicrobianos conlleva un incremento en la selección e infección por cepas multirresistentes14-16. En el paciente hematológico, la necesidad de utilización frecuente de antimicrobianos ha conducido a un incremento preocupante de la resistencia a antimicrobianos, especialmente para las bacterias Gram negativas8. De hecho, varios autores han relacionado la infección por cepas multirresistentes y un mal pronósticos en estos pacientes17,18.
Al igual que en otras experiencias publicados sobre la implantación de programas PROA en las unidades de críticos19-22, la intervención más frecuentemente realizada fue la suspensión de antimicrobianos pautados de forma empírica. En el paciente neutropénico, la posibilidad de infección por cepas multirresistentes así como la dificultad para identificar el germen responsable de la misma obliga a la utilización de una cobertura antimicrobiana de amplio espectro, en muchas ocasiones durante periodos prolongados. En estos pacientes la suspensión de tratamientos una vez identificado el germen responsable de la infección, así como una vez recuperados de la neutropenia resulta clave para evitar la selección y colonización cepas multirresistentes.
Por otro lado, cabe destacar la labor realizada en al ajuste de dosificaciones y monitorización farmacocinética de los antimicrobianos. Se ha demostrado que la optimización de los parámetros pk/pD resulta clave para asegurar una adecuada exposición del antimicrobianos, minimizando la posibilidad de fracaso terapéutico, génesis de resistencias y aparición de efectos adversos asociados al tratamiento23.
En este estudio, no se ha observado que la introducción de un PROA en la unidad ha disminuido el número de pacientes colonizados por BMR. La implantación de este tipo de programas supone una reducción considerable del consumo de antimicrobianos, lo que podría afectar considerablemente a la presión de colonización por BMR y otros patógenos oportunistas24,25. No obstante, se ha de considerar que la transmisión de BMR entre pacientes a través de los profesionales sanitarios constituye la principal fuente de colonización en los pacientes ingresadas en las unidades de críticos26. El no poder identificar qué pacientes presentaron colonización por transmisión es una limitación de este estudio. A pesar de ello, varios autores han relacionado la implantación de estos programas con una menor incidencia de colonización por BMR27. Dada la relación existente entre colonización e infección en las unidades de críticos14,16, consideramos que este tipo de programas, en coordinados con los programas de prevención de infección nosocomial, resultan imprescindibles para minimizar la incidencia de infecciones por cepas multirresistentes. Por otro lado, el reducido número de casos de infección nosocomial en este grupo de pacientes ha impedido evaluar el impacto del programa la sobre la incidencia de infección nosocomial. Son necesarios estudios comparativos con un mayor número de pacientes para evaluar correctamente esta hipótesis. Cabe destacar que, a diferencia de lo publicado para otros grupos de pacientes9,28 la implantación del programa PROA no ha supuesto una disminución en la estancia media o en la mortalidad. Hasta las fecha, son reducidos los estudios que han analizado el impacto de este tipo de programas sobre la evolución clínica de los pacientes críticos. Elliggsen y cols29, un estudio prospectivo de un año de intervención observó que la implantación de programa PROA centrado en ciertos grupos de antimicrobianos conseguía reducir el consumo de los mismos, así como la incidencia de infección por C difficile, pero no se encontró reducción en la estancia hospitalaria ni en la mortalidad. Taggart y cols30 también describieron el impacto de un programa PROA en una UCI médica quirúrgica. Tras un año intervención, no observaron diferencias significativas en la estancia media y mortalidad. En este estudio, los autores concluyeron que es necesario estudios más duraderos para evaluar el impacto del PROA sobre la evolución clínica y las resistencias.
Por otro lado, el paciente hematológico que ingresa en UCI es un paciente de gran complejidad en el manejo, y su pronóstico depende en gran medida de una rápida intervención de los especialistas31, por lo que resulta complicado que este tipo de programas puedan tener un efecto sobre la evolución clínica de este grupo de pacientes a corto plazo. Sin embargo, si hemos observado una tendencia al reducción en el número de reingresos en la unidad a partir de la implantación del programa, lo que nos mueve a pensar que una adecuada selección y ajuste de dosificación de tratamiento podría tener un impacto positivo en su evolución a medio-largo plazo.
El estudio presenta ciertas limitaciones. En primer lugar, los resultados de los análisis pre y post-intervención pueden verse influenciados por otros factores además de la propia intervención que pueden modificar la evolución de los pacientes en la unidad, incluyendo cambios en los criterios de admisión, implementación de nuevos programas de control de la infección nosocomial o modificaciones en los protocolos de tratamiento. A lo largo del periodo de intervención, varias estrategias se han puesto en marcha con el objetivo de reducir la diseminación de BMR, incluyendo programas de vigilancia activa de lavado de manos, incorporación de clorhexidina al lavado diario de pacientes así como el uso de parabanes impregnando en ion plata. No obstante, ninguna de estas estrategias ha demostrado tener un impacto clínico sobre los pacientes de nuestra unidad, más allá de reducir la incidencia de colonización por BMR. Las medidas incluidas dentro de los programas Bacteremia Zero y Neumonía Zero32 si han demostrado tener un impacto positivo en los pacientes admitidos en las UCIs españolas. No obstante, estas medidas se implementaron en la unidad antes del periodo de estudio. Cabe destacar que en nuestra unidad, durante el periodo de intervención no se han producido cambios sustanciales en los criterios de ingreso ni en los protocolos de tratamiento de infección en este tipo de pacientes ni hemos encontrado cambios significativos en los criterios de gravedad de los pacientes hematológicos admitidos en la unidad. Por otro lado, se han encontrado pequeñas variaciones en el tipo de enfermedad hematológica de base en los pacientes que ingresan en nuestra unidad. No obstante, como se ha comentado anteriormente, el pronósticos del paciente hematológico que ingresa en una unidad de críticos depende en gran medida de una rápida y adecuada intervención clínica30, más allá de la propia enfermedad hematológica.
En resumen, la intervención de un PROA sobre el paciente crítico hematológico consigue optimizar el tratamiento antimicrobiano sin repercusiones negativas sobre la evolución del paciente, mostrándose como una herramienta de gran valor para reducir la selección de cepas multirresistentes.
Bibliography
Klastersky J, Ameye L, Maertens J, Georgala A, Muanza F, Aoun M, et al. Bacteraemia in febrile neutropenic cancer patients. Int J Antimicrob Agents. 2007;30. [ Links ]
Kang C-I, Song J-H, Chung DR, Peck KR, Ko KS, Yeom J-S, et al. Risk factors and pathogenic significance of severe sepsis and septic shock in 2286 patients with gram-negative bacteremia. J Infect. 2011;62(1):26-33. [ Links ]
Jeddi R, Achour M, Amor RB, Aissaoui L, Bouterâa W, Kacem K, et al. Factors associated with severe sepsis: prospective study of 94 neutropenic febrile episodes. Hematol Amst Neth. 2010;15(1):28-32. [ Links ]
Cornely OA, Maertens J, Winston DJ, Perfect J, Ullmann AJ, Walsh TJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356(4):348-59. [ Links ]
Maschmeyer G, Haas A, Cornely OA. Invasive aspergillosis: epidemiology, diagnosis and management in immunocompromised patients. Drugs. 2007;67(11):1567-601. [ Links ]
Tatarelli P, Mikulska M. Multidrug-resistant bacteria in hematology patients: emerging threats. Future Microbiol. 2016;11:767-80. [ Links ]
Pouch SM, Satlin MJ. Carbapenem-Resistant Enterobacteriaceae in Special Populations: Solid Organ Transplant Recipients, Stem Cell Transplant Recipients, and Patients with Hematologic Malignancies. Virulence. 2016;28:1-12. [ Links ]
Baker TM, Satlin MJ. The growing threat of multidrug-resistant Gram-negative infections in patients with hematologic malignancies. Leuk Lymphoma. 2016;57(10):2245-58. [ Links ]
Wagner B, Filice GA, Drekonja D, Greer N, MacDonald R, Rutks I, et al. Antimicrobial stewardship programs in inpatient hospital settings: a systematic review. Infect Control Hosp Epidemiol. 2014;35(10):1209-28. [ Links ]
Luyt C-E, Bréchot N, Trouillet J-L, Chastre J. Antibiotic stewardship in the intensive care unit. Crit Care Lond Engl. 2014;18(5):480. [ Links ]
Rodríguez-Baño J, Paño-Pardo JR, Alvarez-Rocha L, Asensio Á, Calbo E, et al; GEIHSEIMC; SEFH; SEMPSPH. Programs for optimizing the use of antibiotics (PROA) in Spanish hospitals: GEIH-SEIMC, SEFH and SEMPSPH consensus document. Farm Hosp 2012;36:33.e1-30. [ Links ]
Chung GW, Wu JE, Yeo CL, Chan D, Hsu LY. Antimicrobial stewardship: a review of prospective audit and feedback systems and an objective evaluation of outcomes. Virulence. 2013;4(2):151-7. [ Links ]
Baker TM, Satlin MJ. The growing threat of multidrug-resistant Gram-negative infections in patients with hematologic malignancies. Leuk Lymphoma. 2016;57(10):2245-58. [ Links ]
Falagas ME, Rafailidis PI, Kofteridis D, Virtzili S, Chelvatzoglou FC, Papaioannou V, et al. Risk factors of carbapenem-resistant Klebsiella pneumoniae infections: a matched case control study. J Antimicrob Chemother. 2007;60(5):1124-30. [ Links ]
Schwaber MJ, Klarfeld-Lidji S, Navon-Venezia S, Schwartz D, Leavitt A, Carmeli Y. Predictors of carbapenem-resistant Klebsiella pneumoniae acquisition among hospitalized adults and effect of acquisition on mortality. Antimicrob Agents Chemother. 2008;52(3):1028-33. [ Links ]
Patel G, Huprikar S, Factor SH, Jenkins SG, Calfee DP. Outcomes of carbapenemresistant Klebsiella pneumoniae infection and the impact of antimicrobial and adjunctive therapies. Infect Control Hosp Epidemiol. 2008;29(12):1099-106. [ Links ]
Gudiol C, Tubau F, Calatayud L, Garcia-Vidal C, Cisnal M, Sánchez-Ortega I, et al. Bacteraemia due to multidrug-resistant Gram-negative bacilli in cancer patients: risk factors, antibiotic therapy and outcomes. J Antimicrob Chemother. 2011;66(3):657-63. [ Links ]
Tumbarello M, Spanu T, Caira M, Trecarichi EM, Laurenti L, Montuori E, et al. Factors associated with mortality in bacteremic patients with hematologic malignancies. Diagn Microbiol Infect Dis. 2009;64(3):320-6. [ Links ]
Mertz D, Brooks A, Irfan N, Sung M. Antimicrobial stewardship in the intensive care setting--a review and critical appraisal of the literature. Swiss Med Wkly. 2015;145:w14220. [ Links ]
Tabah A, Cotta MO, Garnacho-Montero J, Schouten J, Roberts JA, Lipman J, et al. A Systematic Review of the Definitions, Determinants, and Clinical Outcomes of Antimicrobial De-escalation in the Intensive Care Unit. Clin Infect Dis. 2016;62(8):1009-17. [ Links ]
Katsios CM, Burry L, Nelson S, Jivraj T, Lapinsky SE, Wax RS, et al. An antimicrobial stewardship program improves antimicrobial treatment by culture site and the quality of antimicrobial prescribing in critically ill patients. Crit Care. 2012;16(6):R216. [ Links ]
Candeloro CL, Kelly LM, Bohdanowicz E, Martin CM, Bombassaro AM. Antimicrobial use in a critical care unit: a prospective observational study. Int J Pharm Pract. 2012;20(3):164-71. [ Links ]
Lodise TP, Drusano GL. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Crit Care Clin. 2011;27(1):1-18. [ Links ]
Maseda E, Salgado P, Anillo V, Ruiz-Carrascoso G, Gómez-Gil R, Martín-Funke C, et al. Risk factors for colonization by carbapenemase-producing enterobacteria at admission to a Surgical ICU: A retrospective study. Enferm Infecc Microbiol Clin. 2016;pii:S0213-005X(16)30002-7 [ Links ]
Vasudevan A, Mukhopadhyay A, Li J, Yuen EGY, Tambyah PA. A prediction tool for nosocomial multi-drug Resistant Gram-Negative Bacilli infections in critically ill patients - prospective observational study. BMC Infect Dis. 2014;14:615. [ Links ]
Russotto V, Cortegiani A, Raineri SM, Giarratano A. Bacterial contamination of inanimate surfaces and equipment in the intensive care unit. J Intensive Care 2015;3:54. [ Links ]
DiazGranados CA. Prospective audit for antimicrobial stewardship in intensive care: impact on resistance and clinical outcomes. Am J Infect Control. 2012;40(6):526- 9. [ Links ]
Güerri-Fernández R, Villar-García J, Herrera-Fernández S, Trenchs-Rodríguez M, Fernández-Morato J, Moro L, et al. An antimicrobial stewardship program reduces antimicrobial therapy duration and hospital stay in surgical wards. . Rev Esp Quimioter. 2016;29:119-21. [ Links ]
Elligsen M, Walker SA, Pinto R, Simor A, Mubareka S, Rachlis A et al. Audit and feedback to reduce broad spectrum antibiotic use among intensive care unit patients: a controlled interrupted time series analysis. Infect Control Hosp Epidemiol. 2012;33:354-61. [ Links ]
Taggart LR, Leung E, Muller MP, Matukas LM, Daneman N. Differential outcome of an antimicrobial stewardship audit and feedback program in two intensive care units: a controlled interrupted time series study. BMC Infect Dis. 2015;15:480. [ Links ]
Azoulay E, Mokart D, Pène F, Lambert J, Kouatchet A, Mayaux J, et al. Outcomes of Critically Ill Patients With Hematologic Malignancies: Prospective Multicenter Data From France and Belgium-A Groupe de Recherche Respiratoire en Réanimation Onco-Hématologique Study. J Clin Oncol. 2013;31:2810-8. [ Links ]
Montero JG, Lerma FÁ, Galleymore PR, Martínez MP, Rocha LÁ, Gaite FB, et al. Combatting resistance in intensive care: the multimodal approach of the Spanish ICU “Zero Resistance” program. Crit Care. 2015;16;19:114. [ Links ]
Recibido: 26 de Noviembre de 2016; Aprobado: 03 de Febrero de 2017











 text in
text in