Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.41 no.4 Toledo jul./ago. 2017
https://dx.doi.org/10.7399/fh.2017.41.4.10729
Originales
Grado de implantación tecnológica en el manejo de quimioterapia intravenosa en los hospitales de la Comunidad de Madrid
1Pharmacy Unit. Hospital Los Madroños, Madrid. Spain.
2Pharmacy Unit, Central Clinical Trials Unit. Hospital HM Sanchinarro, Madrid. Spain.
Aportación a la literatura científica
En el informe recientemente publicado por la Sociedad Española de Farmacia Hospitalaria “sobre la situación de los Servicios de Farmacia Hospitalaria en España: infraestructuras, recursos y actividad”, se reflejan diferentes aspectos relativos al grado de implantación de nuevas tecnologías en los Servicios de Farmacia. Con el estudio que a continuación se presenta, se intenta dar una visión más específica sobre los recursos materiales empleados en la elaboración de quimioterapia intravenosa en la Comunidad Autónoma de Madrid.
Las conclusiones de este estudio podrán servir de reflexión a los diferentes Servicios de Farmacia para que, a partir de la propia evaluación de sus recursos materiales y metodologías, puedan compararse con la finalidad de implantar una mejora asistencial.
Introducción
Los “medicamentos de alto riesgo” son aquellos que cuando no se utilizan correctamente presentan una mayor probabilidad de causar daños graves o incluso mortales a los pacientes. Los medicamentos citostáticos, tanto parenterales como orales, forman parte del listado de “medicamentos de alto riesgo” publicado por el Instituto para el Uso Seguro de los Medicamentos (ISMP)1. El Ministerio de Sanidad, Asuntos Sociales e Igualdad publicó, basándose en el “Cuestionario de autoevaluación de la cultura de seguridad en el uso de medicamento” de ISMP España2, los resultados del estudio “Evolución de la implantación de prácticas seguras de utilización de medicamentos en los hospitales españoles (2007-2011)”. En él se hace constancia de las deficiencias en la cultura de seguridad del medicamento, en lo que respecta a las tecnologías, en cuanto al acceso a la información básica de los pacientes durante la prescripción, dispensación y administración de los medicamentos, así como a la implantación del código de barras en la administración3. Aun así, la implantación de nuevas tecnologías en la elaboración de mezclas intravenosas (MIV) de quimioterapia (Qt) ha supuesto en los últimos años un aumento de la seguridad del paciente, del manipulador y de la calidad farmacoterapéutica.
Dentro de los objetivos específicos de la “Estrategia de Seguridad del Paciente del Sistema Nacional de Salud” en su última actualización (2015-2020)4, destaca el fomento de la prescripción electrónica asistida (PEA) con sistemas de ayuda a la decisión clínica de probada efectividad, la implantación de prácticas seguras con los medicamentos de alto riesgo y la promoción de la autoevaluación de la seguridad del sistema de utilización de medicamentos en los centros asistenciales.
En este sentido, el grupo “TECNO”, grupo de trabajo de Nuevas Tecnologías de la Sociedad Española de Farmacia Hospitalaria (SEFH), elaboró en el 2006 una encuesta para evaluar a nivel nacional el grado de implantación de sistemas informáticos, como la PEA, la administración por código de barras para identificar paciente/medicamento, etc.5. Además, recientemente se ha publicado el “Informe Sobre la situación de los Servicios de Farmacia hospitalaria en España: infraestructuras, recursos y actividad” también de la SEFH, en el que se realiza un análisis descriptivo de los sistemas de información y de la calidad y seguridad con la que se trabaja en los Servicios de Farmacia Hospitalaria6.
Por otro lado, la International Society of Oncology Pharmacy Practitioners (ISOPP) recomienda el uso de sistemas cerrados tanto en la preparación (reconstitución de liofilizados, dilución del contenido de los viales, y transferencia al recipiente final), como en la administración de la MIV al paciente, por la reducción del riesgo de derrames accidentales y la formación de aerosoles (MIV con carmustina, ciclofosfamida, ifosfamida, etc.). Los sistemas cerrados son dispositivos que mecánicamente no permiten la transferencia de contaminantes ambientales dentro del dispositivo, ni el escape de medicamentos de alto riesgo o sus vapores fuera del mismo7. La American Society of Health-System Pharmacists (ASHP), en sus guías para la manipulación de medicamentos peligrosos, concluye que los sistemas cerrados no pueden sustituir a las cabinas de seguridad biológica (CSB) y que deben demostrar su efectividad en estudios independientes8.
En nuestro entorno de trabajo se hace necesaria la evaluación continua de los procesos de elaboración y administración de MIV de Qt. Por ello, y con todo lo comentado anteriormente, nos propusimos conocer el grado de implantación tecnológica de los hospitales de la Comunidad de Madrid en estos ámbitos, a través de una encuesta que sirviera para agrupar el grado de desarrollo por tipo de hospital.
Por ello, planteamos este estudio cuyo objetivo es conocer el nivel actual de implantación de nuevas tecnologías en la seguridad del manipulador y del paciente en la preparación y administración de citostáticos en los diferentes hospitales de la Comunidad de Madrid.
Métodos
Se diseñó un estudio observacional descriptivo, mediante la elaboración de un cuestionario en formato Microsoft Word® formado por 22 preguntas, dividido en dos partes. En la primera se solicitó información demográfica del hospital (3 preguntas): número de camas, dependencia funcional y finalidad asistencial. En la segunda parte las preguntas estaban relacionadas con la implantación de nuevas tecnologías en los procesos de preparación y administración de citostáticos para su administración por vía parenteral (19 preguntas), siendo éstas: disponibilidad de PEA en Hospital de Día, disponibilidad de PEA en planta de Oncología, disponibilidad de PEA en planta de Hematología, programa PEA disponible en el hospital, Servicio elaborador de Qt intravenosa, existencia de CSB, utilización de equipos de protección individual (EPI), uso de sistemas cerrados en la reconstitución, transferencia y/o administración de citostáticos, reetiquetado de viales de citostáticos en su recepción e información incluida, control gravimétrico secuencial en la elaboración y empresa proveedora, control de elaboración por voz y empresa proveedora, lectura de código de barras y empresa proveedora, sistema de comunicación y análisis de errores. La mayoría de las preguntas fueron cerradas, pudiendo escoger entre varias opciones del desplegable, en los casos en los que la respuesta no se encontraba entre las múltiples opciones se disponía de un campo de texto libre.
La población de estudio fueron los hospitales de la Comunidad de Madrid que elaboraban citostáticos para su administración por vía parenteral (criterio de inclusión). Por tanto, se excluyeron los hospitales con finalidad asistencial tipo psiquiátrico, geriatría y/o larga estancia, maternidad, traumatología y/o rehabilitación. El periodo de recogida de datos fue de marzo a agosto de 2016. Para obtener un listado de hospitales, se consultó el “Catálogo Nacional de Hospitales 2015”9, actualizado el 31 de diciembre de 2014, seleccionándose los hospitales pertenecientes a la Comunidad Autónoma de Madrid.
Se mantuvo una conversación telefónica con el personal de los diferentes hospitales de la población a estudio que cumplían con el criterio de inclusión establecido (elaboradores de MIV de Qt) para corroborar este hecho. La encuesta fue dirigida al personal facultativo del Servicio de Farmacia de los hospitales (o en su defecto personal de enfermería), responsables de la elaboración de MIV de Qt. El envío de la encuesta se realizó por correo electrónico. A las personas que no respondieron en la primera ronda se contactó nuevamente por este medio y, en caso de no obtener respuesta, se llamó por teléfono a la persona de contacto. Por otro lado, y con el objetivo de resolver las incongruencias detectadas en las respuestas de algunas encuestas, se volvió a contactar con las personas que las cumplimentaron.
Para el registro y el procesamiento estadístico de los datos se desarrolló una base de cálculo Microsoft Excel® 2010 conteniendo los ítems recogidos en la encuesta.
El estudio no ha sido evaluado ni autorizado previamente por un Comité de Ética de la Investigación.
Resultados
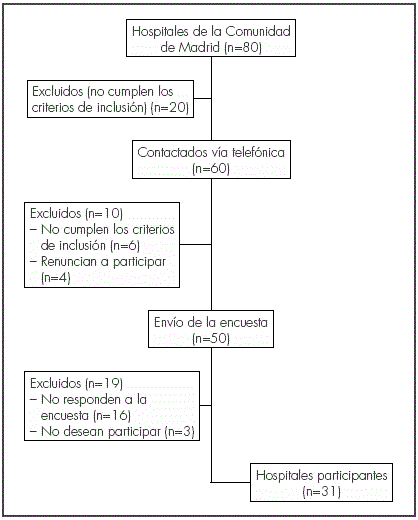
El flujo de hospitales participantes se puede observar en la Figura 1.
Los hospitales se agruparon por número de camas en: menos o igual a 99, de 100 a 199, de 200 a 499 y más de 500 camas. La distribución por número de camas y dependencia funcional de los hospitales que respondieron la encuesta se refleja en la Tabla 1. El porcentaje de hospitales que cumplimentaron la encuesta fue homogéneo por número de camas, además el 65% de los hospitales pertenecían al Servicio Madrileño de Salud y un 29% a una Sociedad Privada no benéfica.
Tabla 1 Análisis de los hospitales que responden la encuesta por número de camas y dependencia funcional

Por otro lado, las características de los hospitales que no contestaron a la encuesta tras su envío se recogen en la Tabla 2. Casi la mitad de ellos (48%) pertenecían a hospitales de 100-199 camas y sólo un hospital de más de 500 camas (5%) no contestó.
Tabla 2 Análisis de los hospitales que no responden a la encuesta por número de camas y dependencia funcional

Se observó que la mayoría de los hospitales grandes que respondieron la encuesta (más de 200 camas) disponían de PEA en los servicios de Hospital de Día y en plantas de Oncología y Hematología (Tabla 3). Asimismo se constató la variedad de programas de PEA que existían en la Comunidad de Madrid (Oncofarm®, SAP®, Farmatools®, FarHos®, SELENE®, Casiopea 2.0®, Hospiwin®).
Tabla 3 Grado de implantación de Prescripción Electrónica Asistida en función del número de camas

PEA: Prescripción Electrónica Asistida.
Prácticamente en la totalidad de centros encuestados (30 de 31 centros) las MIV de Qt se elaboraban en el Servicio de Farmacia, y todos los centros disponían de CSB y EPI. Aunque exclusivamente uno de los 31 hospitales encuestados reetiquetaba los viales de quimioterapia cuando se recepcionaban en el Servicio de Farmacia, lo que permite disponer de una mayor trazabilidad de las mezclas que se preparan de forma centralizada.
En lo que respecta al proceso de elaboración, el registro de los componentes utilizados mediante lectura de código de barras estaba implantado en 11 de los 31 centros (35,4%) y en fase de prueba en 6 centros (19,4%); la técnica de control por voz como ayuda en la elaboración no estaba implantada en ninguno de los 31 centros, aunque se encontraba en fase de prueba en 2 centros (6,4%); el examen final de los preparados por control gravimétrico fue muy bajo puesto que solo en 2 de los 31 centros (6,4%) estaba totalmente implantado y en 3 centros se encontraba en fase de prueba (9,6%).
La utilización de sistemas cerrados en los diferentes puntos del proceso de elaboración-administración se muestra en Tabla 4. Los sistemas cerrados más comúnmente usados fueron punzones para viales en la reconstitución, alargadera en la transferencia y sistema árbol en la administración. Cuando el sistema cerrado de administración de citostáticos es tipo árbol el sistema cerrado de transferencia es la alargadera, y en el caso de que la administración sea por sistema valvular el sistema cerrado de transferencia es el punzón a bolsa. Por último, los sistemas de comunicación y análisis de errores de medicación en la elaboración y dispensación de MIV de Qt estaban totalmente implantados en 24 de los 31 centros (67,8%). En un solo centro el establecimiento de estos indicadores estaba en fase de prueba.
Discusión
El índice de respuesta obtenido (62%) fue mayor que el alcanzado en un estudio similar de T. Bermejo Vicedo et al.5, que fue del 38,6%. Aunque podría existir un sesgo de selección dado que el 48% de los hospitales que no contestaron a la encuesta pertenecían a hospitales de 100-199 camas y uno (5%) a un hospital de más de 500 camas.
El volumen de trabajo en cuanto a número de MIV de quimioterapia suele ser directamente proporcional al tamaño del hospital, por lo que parece razonable pensar que los hospitales grandes (con mayor número de camas) dispongan de mayores sistemas de seguridad que los hospitales más pequeños. Aunque otra variable a estudiar como criterio de carga asistencial podría haber sido el número de mezclas intravenosas preparadas. Sin embargo, en el estudio se pudo comprobar que el 80% de los hospitales encuestados de tamaño medio-alto (200-499 camas) contaban con PEA en Hospital de Día y plantas de Oncología y Hematología (Tabla 3). Este porcentaje fue superior al de hospitales más grandes (>500 camas) con unas cifras del 57%, lo que puede deberse a la dificultad de los hospitales con alta actividad asistencial en la implantación de nuevas tecnologías. Por otro lado, se observó en los hospitales de pequeño tamaño (≤99 camas) un porcentaje mayor sin PEA implantados en Hospital de Día y plantas de Oncología y Hematología. Los datos están en línea con los del Informe Sobre la situación de los Servicios de Farmacia Hospitalaria en España6, ya que si agrupamos los hospitales de tamaño intermedio (de 100 a 499 camas) el 53% dispone de PEA, y considerado todos hospitales respondedores sin importar el grado de implantación vemos que el porcentaje ha aumentado de un 31,5% en 20065 a un 80,6%.
Si bien, el tamaño del hospital no debería justificar la falta de seguridad en el paciente y en el profesional sanitario elaborador de quimioterapia en los hospitales más pequeños, por lo que resulta fundamental la involucración del personal directivo de estos centros en el uso seguro de los medicamentos. Y es ahí donde cobra valor el papel del farmacéutico hospitalario, que debe ser capaz de potenciar políticas de calidad y seguridad en su ambiente de trabajo. El estudio demostró también la variedad de los PEA que existían en los diferentes centros encuestados de la Comunidad de Madrid. Cada centro negocia de forma autónoma la adquisición e implantación de estos programas, pero sería recomendable que existiera una normativa que obligara a las empresas que diseñan los programas a cumplir una serie de requisitos mínimos, como los que describe la “Red Española de Agencias de Evaluación de Tecnologías Sanitarias y prestaciones del Sistema Nacional de Salud”. A nivel europeo existen otras redes de tecnología sanitaria, como la EUnetHTA (European network for Health Technology Assessment), que pueden servir de referencia en la elaboración de estos requerimientos mínimos.
En cuanto al grado de cumplimiento de requisitos materiales de sociedades científicas reconocidas internacionalmente, como la NIOSH (National Institute for Occupational Safety and Health) y la ISOPP, así como de diferentes directivas europeas y nacionales, fue muy alto en el caso de la existencia de una unidad centralizada de elaboración de quimioterapia (97% Servicio de Farmacia), dotación de una CSB (100%) en ambiente controlado y EPI (100%). Cabe recordar en este punto que los medicamentos citotóxicos son sustancias potencialmente cancerígenas, mutagénicas y/o teratogénicas que además pueden producir irritación por contacto directo, ulceración e incluso necrosis tisular. De ahí la importancia de trabajar en un ambiente seguro cuando se manipulan este tipo de sustancias. Estos resultados están alineados con los obtenidos en el Informe nacional de 20156.
La elaboración centralizada de MIV en los Servicios de Farmacia ofrece por un lado ventajas técnicas, como la mayor garantía de estabilidad físico-química, asepsia, conservación y caducidad, y por otro lado ventajas de tipo asistencial, porque la normalización de la preparación de MIV conlleva una reducción del riesgo de aparición de problemas relacionados con medicamentos, y aumenta la participación del farmacéutico en la individualización posológica y su integración en el equipo asistencial10. De esta forma, es el farmacéutico el que asume la responsabilidad de la preparación de MIV de Qt11 en condiciones adecuadas de esterilidad, correcto etiquetado, almacenamiento y distribución12. Por último, la elaboración centralizada optimiza la utilización de recursos materiales y de personal, lo que supone un importante ahorro económico10.
En cuanto a los sistemas de transferencia, la gran mayoría de los hospitales utilizaban alargadera que, aunque es necesario realizar purga del sistema, presenta un menor riesgo de contaminación ambiental (formación de aerosoles, goteos o derrames) que el uso de punzones a bolsa. Por otra parte, no existe un registro nacional oficial de estos sistemas cerrados de transferencia de medicación, ni se han determinado los requisitos específicos que deben cumplir estos sistemas cerrados para obtener su certificación.
Con respecto a la implantación de sistemas de control gravimétrico, control de la elaboración por voz y lectura de código de barras, se observó que, a excepción de la lectura de código de barras, la mayoría de los hospitales carecían de esta tecnología. La principal dificultad en la implantación de estas tecnologías es la inversión económica que supone su puesta en marcha. Dentro de la CSB se debería disponer de un sistema de reconocimiento de voz con auriculares y micrófono (para el control de la elaboración por voz), lectores de código de barras (CB) o data matrix, balanza, etc. Asimismo, para el control de la administración, se requiere de un sistema de identificación (etiqueta con CB) del producto terminado, en los diferentes puntos de administración (camas, sillones) y en los equipos de administración (bombas), así como identificadores del personal de enfermería (tarjetas con CB) y un sistema WiFi con PDA que lea los CB de los diferentes elementos citados.
Además de la inversión económica que supone todo lo anteriormente comentado, también nos encontramos con la necesidad de reetiquetar los viales de citostáticos y los sueros utilizados con la información del producto (descripción), lote y caducidad, lo que supone un tiempo de trabajo extra para el personal de Farmacia. Este problema podría solventarse si la industria farmacéutica se implicara más en la seguridad del paciente incorporando en cada unidad del producto un CB con la información necesaria.
La evidencia científica demuestra reducción de errores de dispensación utilizando lectura de CB (control cualitativo del proceso), que puede llegar en algunos casos al 85%13,14, así como la disminución de acontecimientos adversos potenciales15. De igual forma, mediante el control gravimétrico secuencial se detecta si el peso del producto acabado está comprendido dentro del margen de error establecido, que suele ser entre un 5-10%. Se trata por tanto de un control cuantitativo del proceso. Por otro lado, suelen ser las mismas empresas que diseñan los programas de PEA los que desarrollan estas nuevas tecnologías.
Sólo en uno de los centros encuestados las MIV de Qt eran elaboradas por un robot de forma automatizada. El uso de robot presenta una serie de ventajas, como la integración de todas las nuevas tecnologías que se han mencionado (código de barras, métodos gravimétricos, etc.), así como su mayor precisión y fiabilidad16. Como inconvenientes hay que destacar su elevado precio, restricciones de tamaño y volumen de determinados productos (p. ej. porque sean muy voluminosos), y que un error en la base de datos da lugar a muchas MIV afectadas.
Como en todo proceso es importante la medida de la calidad de los resultados obtenidos, utilizando para ello indicadores de calidad de los procedimientos de elaboración. Las sociedades internacionales anteriormente citadas (NIOSH, ISOPP) han publicado criterios y estándares en la manipulación de citostáticos que pueden ser utilizados para describir indicadores de su cumplimiento.
La seguridad del paciente y del profesional sanitario en la preparación y administración de medicación ha aumentado en los últimos años, debido a la evolución de los sistemas de información (PEA, uso de robots elaboradores de quimioterapia, etc.) y a la elaboración de guías técnicas y protocolos en los diferentes servicios (p.ej. la Guía de Buenas Prácticas para trabajadores profesionalmente expuestos a agentes citostáticos, de A.M.M.T.A.S. (Asociación Madrileña de Medicina del Trabajo en el Ámbito Sanitario))17. Además, se han desarrollado diferentes normativas tanto a nivel europeo como nacional en cuanto a la exposición a agentes cancerígenos o mutágenos en el trabajo, como la directiva europea 2004/37/EC, el RD 665/1997, la nota técnica de prevención del Instituto Nacional del Trabajo: NTP-740, y la orden ESS/1451/2013 de “Prevención de las lesiones causadas por instrumentos cortantes y punzantes en el sector hospitalario y sanitario” así como la reciente publicación del Instituto Nacional de Seguridad e Higiene en el Trabajo (INS-HT): Medicamentos peligrosos. Medidas de prevención para su preparación y administración18.
La SEFH también se ha posicionado firmemente en este aspecto, como puede verse en varios puntos del “Plan Estratégico 2020”, donde se establecen varios objetivos sobre el desarrollo organizativo y las prácticas de seguridad en el manejo de estos tratamientos para lograr una mayor calidad asistencial. Estos objetivos y líneas estratégicas contemplan incorporar las nuevas tecnologías para mejorar la organización y calidad del servicio de farmacia, así como implantar mejoras en el sistema de utilización de medicamentos. Todo ello mediante sistemas informáticos de gestión de procesos integrados, PEA y sistemas de administración conectados y/o integrados en la historia clínica que incluya bases de datos de información de medicamentos y apoyo a la administración, sistemas que faciliten el control, la trazabilidad y la seguridad en el proceso de preparación, manipulación y administración de medicamentos de riesgo o sistemas de gestión de riesgos y procedimientos normalizados para el manejo seguro de los medicamentos.
Dado que en los hospitales de la Comunidad de Madrid elaboradores de Qt el grado de implantación de tecnología de lectura de código de barras es medio y bajo en reetiquetado de viales y control gravimétrico y por voz de la elaboración, existe un amplio margen de mejora en lo que se refiere a la trazabilidad del proceso de elaboración y administración de MIV de Qt. Por tanto, se debería de trabajar de manera conjunta en la consecución de estos objetivos, al menos en lo que respecta a los hospitales dependientes del Servicio Madrileño de Salud.
Bibliography
Institute for Safe Medication Practices. ISMP List of High-Alert Medications in Acute Care Settings (monografía en Internet). Huntingdon Valley (PA):ISMP;2014 (fecha de consulta 08/02/2017). Disponible en: http://www.ismp.org/Tools/highalertmedications.pdf [ Links ]
Instituto para el Uso Seguro de los Medicamentos (ISMP-España). Cuestionario de autoevaluación de la seguridad del sistema de utilización de los medicamentos en los hospitales (monografía en Internet). Madrid: Ministerio de Sanidad y Consumo. Secretaría General Técnica; 2006 (fecha de consulta 08/02/2017). Disponible en: http://www.msssi.gob.es/organizacion/sns/planCalidadSNS/pdf/excelencia/cuestionario_seguridad_sistema_medicamentos_hospitales.pdf [ Links ]
Ministerio de Sanidad, Servicios Sociales e Igualdad. Evolución de la implantación de prácticas seguras de utilización de medicamentos en los hospitales españoles (2007/2011) (monografía en Internet). Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad, Secretaría General Técnica, Centro de publicaciones; 2012 (fecha de consulta 08/02/2017). Disponible en: http://www.ismp-espana.org/ficheros/evolucion_practicas_seguras_medicamentos_2007_2011.pdf [ Links ]
Ministerio de Sanidad, Servicios Sociales e Igualdad. Estrategia Seguridad del Paciente 2015-2020 (página Web). España: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2005 (fecha de consulta 08/02/2017). Disponible en: http://www.seguridaddelpaciente.es/es/informacion/publicaciones/2015/estrategia-seguridad-del-paciente-2015-2020/ [ Links ]
Bermejo Vicedo T, Pérez Menéndez Conde C. Aplicación de las nuevas tecnologías a la farmacia hospitalaria en España. Farm Hosp. 2007;31:17-22. [ Links ]
Junta de Gobierno de la Sociedad Española de Farmacia Hospitalaria. Informe 2015 sobre la situación de los Servicios de Farmacia Hospitalaria en España: Infraestructuras, recursos y actividad (monografía en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 2015 (fecha de consulta 08/02/2017). Disponible en: http://www.sefh.es/bibliotecavirtual/informe-situacion-sfh-2015/libroblanco_sefhFIN.pdf [ Links ]
Gómez-Álvarez S, Porta-Oltra B, Hernández-Griso M, Pérez-Labaña F, Climente-Martí M. Evaluación de dos sistemas cerrados en el proceso de elaboración de quimioterapia parenteral. Farm Hosp. 2016;40(1):36-43. [ Links ]
American Society of Health-System Pharmacists. ASHP guidelines on handling hazardous drugs. Am J Health-Syst Pharm. 2006;63:1172-93. [ Links ]
Ministerio de Sanidad, Servicios Sociales e Igualdad. Catálogo Nacional de Hospitales 2015 (página Web). Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad, Secretaria General Técnica, Centro de Publicaciones; 2005 (fecha de consulta 08/02/2017). Disponible en: https://www.msssi.gob.es/ciudadanos/prestaciones/centrosServiciosSNS/hospitales/aniosAnteriores.htm [ Links ]
Inaraja MT, Castro I, Martínez MJ. Formas farmacéuticas estériles: mezclas intravenosas, citostáticos, nutrición parenteral (monografía en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 2002 (fecha de consulta 08/02/2017). Disponible en: http://www.sefh.es/sefhdescargas/archivos/Formasfarmaceuticasesteriles.FarmaciaHospitalaria2002capitulo2.7.2487_506.pdf [ Links ]
Subdirección General de Calidad de Medicamentos y Productos Sanitarios. Guía de buenas prácticas de preparación de medicamentos en servicios de farmacia hospitalaria. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2014. [ Links ]
SEFH. Recomendaciones para la elaboración de medicamentos en el hospital (monografía en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 2001 (fecha de consulta 08/02/2017). Disponible en: http://www.sefh.es/normas/elaboracion.pdf [ Links ]
Douglas J, Larrabee S. Bring barcoding to the bedside. Nurs Manag. 2003;34(5):36-40. [ Links ]
Poon EG, Cina JL, Churchill W, Patel N, Featherstone E, Rothschild JM et al. Medication dispensing errors and potential adverse drug events before and after implementing bar code technology in the pharmacy. Ann Intern Med. 2006;145(6):426-34. [ Links ]
Maviglia SM, Yoo JY, Franz C, Featherstone E, Churchill W, Bates et al. Costbenefit analysis of a hospital pharmacy bar code solution. Arch Intern Med. 2007 Apr 23;167(8):788-94. [ Links ]
Pacheco Ramos M L, Arenaza Peña AE, Santiago Pérez A, Bilbao Gómez-Martino C, Zamora Barrios MD, Arias Fernández ML. Implantación de un robot para la elaboración de antineoplásicos. Farm Hosp. 2015;39(3):137-146. [ Links ]
Instituto de Salud Carlos III - Ministerio de Economía y Competitividad. Guía de buenas prácticas para trabajadores profesionalmente expuestos a agentes citostáticos (monografía en Internet). Madrid: Instituto de Salud Carlos III, Escuela Nacional de Medicina del Trabajo; 2014 (fecha de consulta 08/02/2017). Disponible en: http://www.ammtas.com/images/stories/recursos/noticias/2014/Guia.pdf [ Links ]
Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT). Medicamentos peligrosos. Medidas de prevención para su preparación y administración (monografía en Internet). Barcelona: Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT), 2016 (fecha de consulta 08/02/2017). Disponible en: http://www.insht.es/InshtWeb/Contenidos/Documentacion/FICHAS%20DE%20PUBLICACIONES/EN%20CATALOGO/Higiene/2016%20medicamentos%20peligrosos/Medicamentos%20peligrosos.pdf [ Links ]
Recibido: 12 de Diciembre de 2016; Aprobado: 27 de Febrero de 2017











 texto en
texto en