My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.41 n.4 Toledo Jul./Aug. 2017
https://dx.doi.org/10.7399/fh.2017.41.4.10747
Originales
Calidad del registro de problemas relacionados con los medicamentos en una base de datos de notificación voluntaria de eventos adversos
1Hospital Universitario de Sant Joan, Pharmacy Unit, Alicante. Spain.
Introducción
La seguridad del paciente es un objetivo primordial en la asistencia sanitaria y los sistemas de notificación voluntaria de errores de medicación pueden ayudar evitar su recurrencia. Pero a pesar de las ventajas del sistema es necesario un trabajo de depuración de los datos.
En este artículo se analizan los errores notificados en una base de datos (BD) y las diferencias entre las bases de datos bruta y depurada, proponiendo mejoras que pueden ser útiles a la comunidad científica y en particular a la calidad de la asistencia sanitaria que se ofrece desde los centros sanitarios.
En el estudio nacional ENEAS de eventos adversos (EA) ligados a la asistencia1, se constató que el 37,4% de los eventos hallados estaban relacionados con los medicamentos, siendo evitables el 42,8%.
Los sistemas de notificación constituyen una estrategia clave para aprender de los errores y evitar su recurrencia2. Los que se enfocan hacia la mejora de la seguridad son de carácter voluntario3, centrados mayoritariamente en incidentes o en errores con daño mínimo aunque también detectan los errores más graves, permitiendo realizar análisis causa-raíz, y acumular casuística real de casi-errores o incidentes, para identificar puntos débiles del sistema y formar a los profesionales con el conocimiento extraído de múltiples casos4, ayudando a mejorar los puntos más críticos de las organizaciones.
Las limitaciones que se achacan a estos sistemas5,6 son fundamentalmente una infraestimación de la prevalencia (de hecho no sirven para establecerla) y sesgos variados de notificación, pero no suelen incluirse limitaciones o reservas debidas a la calidad de los datos de las notificaciones. Un informe exhaustivo sobre los sistemas de notificación de eventos adversos en el mundo: Sistemas de registro y notificación de incidentes y eventos adversos, del Ministerio de Sanidad7 no hace ninguna referencia a este particular en sus 149 páginas.
Nuestro hospital puso en marcha el sistema SINEA8,9 de notificación voluntaria de EA de la asistencia sanitaria en el año 2009, siendo adoptado posteriormente por todos los departamentos de salud de la Conselleria de Sanitat de la Comunidad Valenciana. SINEA es un sistema electrónico accesible para todos los profesionales del departamento de salud a través de la intranet. Ha recibido respaldo institucional al haberse incluido la notificación en SINEA dentro de los acuerdos de gestión del año 2014 para todos los departamentos10.
SINEA está diseñado para la captura directa on-line. Esto elimina el prerregistro de los datos e impide la falta de correspondencia entre el formato papel, que deja de existir, y el registro electrónico. Existe abundante investigación sobre la construcción de aplicaciones que mejoren los resultados en cuanto a errores de registro y faciliten el procesamiento de los datos11,12, aunque son raras cuando hablamos de bases de datos sanitarias y en particular en bases de datos para el registro de problemas relacionados con los medicamentos (PRM)13. A pesar de sus ventajas con respecto a la captura diferida, la captura directa no puede asegurar tampoco la consistencia de la información y por tanto no garantiza en si misma la calidad de los registros. Se define depuración14 como el proceso a realizar tras haber capturado los datos, para detectar y corregir los errores que contienen y se apunta como imprescindible si los datos se han grabado con un software que no tiene implementado el proceso de protecciones o éstas son incompletas15. En este escenario se plantea la validez de los datos contenidos en SINEA relativos a errores de medicación (EM) y reacciones adversas al medicamento (RAM).
El objetivo de este trabajo es determinar el número y tipo de errores que contiene la base de datos SINEA con el fin de plantear posibles mejoras en forma de protecciones en el proceso de captura para reducirlos, comprobar las diferencias en los resultados obtenidos a partir de la base de datos bruta y la depurada, ya que de no ser significativas podría evitarse la depuración que es un proceso largo y complicado, y considerar la necesidad de ampliar la formación de los notificadores en base al análisis de los resultados.
Métodos
Se obtuvo un fichero EXCEL de los EA notificados en el departamento entre el 1 de enero y el 30 de agosto de 2014. La base de datos SINEA tiene 212 campos, de los que se analizaron 121 relacionados con EA medicamentosos y se depuraron 49 considerados relevantes para este estudio, los correspondientes a servicio, clasificación del evento, fecha, codificación de la/s descripción/es del evento, de su repercusión en el paciente y en la asistencia, principio activo y medicamento implicado. Diez de estos campos fueron considerados clave para el análisis de conjunto: quién descubrió el error, categoría profesional del implicado y el notificante, qué y dónde ocurrió, nombre comercial, principio activo, servicio, descripción del error y causas.
Se revisaron manualmente todos los registros para establecer la consistencia entre lo reflejado en el campo de texto libre “describa_lo_que_pasó” que fue considerado gold standard y la catalogación como reacción adversa o error de medicación. Una vez codificados correctamente, se analizaron por separado los registros de RAM y EM. Se depuraron las variables del estudio, detectando las incidencias consecuencia de inconsistencias y valores desconocidos mediante análisis lógicos. Así se comprobó que la fecha de registro no fuera anterior a la del evento o la del incidente y que estas dos últimas no fueran anteriores a diciembre de 2013 ni posteriores a agosto de 2014. Se comprobó que los errores clasificados como potenciales tuvieran asociada una “no afectación de la asistencia” y una “ausencia de daño para el paciente”, y lo contrario en el caso de RAM. La mayoría de las variables tuvieron que ser depuradas manualmente, ya que la información valiosa se encontraba en campos de texto libre. Un farmacéutico experto en PRM y en sistemas de notificación se encargó de corregir las incidencias detectadas mediante la introducción del valor correcto siempre que fue posible y asignando un valor desconocido cuando no lo fue y por último se realizó una estadística descriptiva de los errores detectados tras la depuración y de los valores desconocidos en los datos finales. No se aplicaron controles probabilísticos.
Se compararon los valores obtenidos al analizar la base de datos bruta y la depurada para las variables: % de EM, % de EM potenciales y reales y % de RAM, distribución del efecto sobre el paciente, distribución de la repercusión en la asistencia, fármacos implicados más frecuentemente.
Se calculó el índice de concordancia kappa de Cohen entre los datos notificados y los depurados16 para la clasificación del EA (RAM, EM o evento no relacionado con los medicamentos) y para el tipo de EM (potencial o real).
Resultados
En los ocho meses del estudio se notificaron 364 EA, con un índice de no cumplimentación en alguno de los 10 campos considerados clave del 31,3%. En el proceso de depuración se realizaron 552 cambios en los 275 registros de eventos relacionados con la medicación (media de errores por registro 2,01 DS 2,11). Los 21 registros de reacciones adversas contenían más errores (media 4,57 DS 2,82) que los 254 registros de errores de medicación (media 1,80 DS 1,90).
241 EA fueron clasificados como EM (1 fue reclasificado a RAM), 8 como RAM y 2 como ambas cosas, reclasificados a EM ya que fueron reacciones alérgicas por administración de medicamentos con alergia documentada. Entre los 113 EA que no fueron identificados como PRM se encontraron durante la depuración 12 RAM y 12 EM.
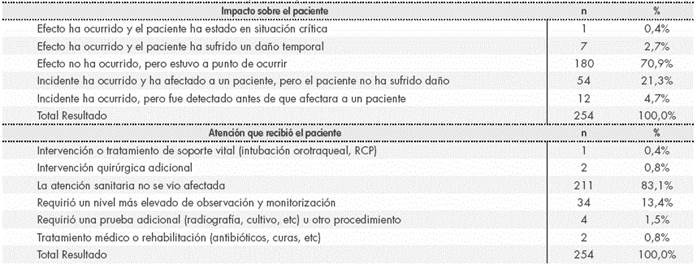
Tras la depuración de los 364 EA, se encontraron 254 EM (69,8 %), 21 RAM (5,8%) y 89 eventos no relacionados con medicamentos (24,4%). La base de datos bruta habría arrojado cifras de 66,7%, 2,7% y 31,0% respectivamente. Dado que dos eventos fueron clasificados simultánea y erróneamente en dos categorías, el porcentaje total supera el 100%.
Las fechas de comunicación son todas correctas ya que el sistema las introduce automáticamente. La hora en que se produjo el evento no es analizable, ya que el 92,5% se registró como sucedido a las 9.00h y no existen pistas para rectificar este dato.
El cálculo del coeficiente kappa para la asignación de tipo de EA se muestra en la Tabla 1.
Errores de medicación
73,6% de los errores fueron potenciales, 82,3% en la base de datos bruta debido a una mala codificación en 32 casos (12,6%). El cálculo del coeficiene Kappa se muestra en la Tabla 2.
Tabla 2 Cálculo coeficiente kappa de Cohen para la clasificación de errores de medicación potenciales y reales.

BD: base de datos. Emp: errores de medicación potenciales. Emr: Errores de medicación reales. Número de coincidencias observadas: 223 (87,80% de las observaciones). Número de coincidencias esperadas por azar: 164,3 (64,69% de las observaciones). Kappa = 0,654. DE de kappa = 0,056. 95% Intervalo confianza: 0,544-0,764. Concordancia obtenida puede considerarse BUENA.
En los 254 EM notificados se encontraron 76 registros (30,0%) que contenían errores en el campo fecha del evento o del incidente, 41 errores debidos a la introducción de fechas no válidas, y otros 35 por discrepancias entre la fecha del evento y del incidente.
La distribución del efecto sobre el paciente y la repercusión en la asistencia, se muestran en la Tabla 3, según las categorías predefinidas en SINEA. No existen elementos que permitan depurarlas.
En 133 casos de EM no figuraba el principio activo o estaba registrado el nombre comercial en su lugar, haciendo imposible el análisis directo de los fármacos implicados con mayor frecuencia. Tampoco fue posible realizar un análisis directo de los EM según el personal que los descubrió o la categoría del profesional implicado ya que se trata de campos de texto libre, que arrojaron datos no homogéneos. En la base de datos depurada, trastuzumab fue el medicamento implicado en errores con mayor frecuencia (20,9%), siempre potenciales. Una vez recodificados, el farmacéutico descubrió el 67,3% de todos los errores notificados, seguido del enfermero (19,3%).
Las frecuencias de los diferentes tipos de error identificados se muestran en la Tabla 4, para el total de errores y para los errores reales. La depuración disminuyó el porcentaje de errores clasificados como “otros“, por reclasificación a tipos de error ya definidos. En dicha tabla figura el total de errores detectados, que es superior al número de registros clasificados como EM pues cada registro puede contener más de un error.
Tabla 4 Tipos de error notificados totales y reales de la base de datos bruta y depurada.
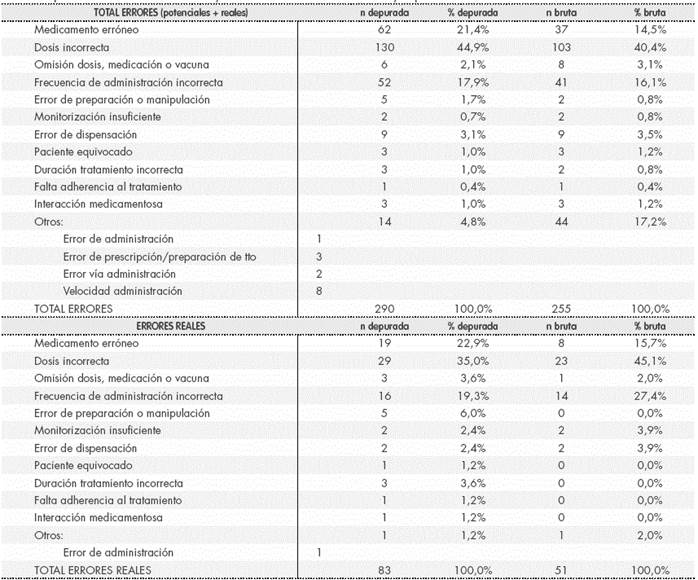
El número total de errores es superior al número de registros, pues cada registro puede contener más de un error.
RAM
Las fechas de las notificaciones de RAM eran correctas en el 100% de los casos. Fueron descubiertas en el 61,9% de los casos por el médico de Atención Primaria, seguido del personal de la Unidad de Hospitalización a Domicilio 9,5%. En la base de datos sin depurar se hallaron 11 inconsistencias (52,4%) en la afectación de la asistencia sanitaria y 13 (61,9%) en el efecto declarado de las RAM. Todas fueron recodificadas según el daño descrito en el campo “describa_lo_que_pasó”. De este mismo campo se recuperaron 16 de los 21 medicamentos causantes de la RAM. Los otros 5 no figuraban en ningún campo de la base original.
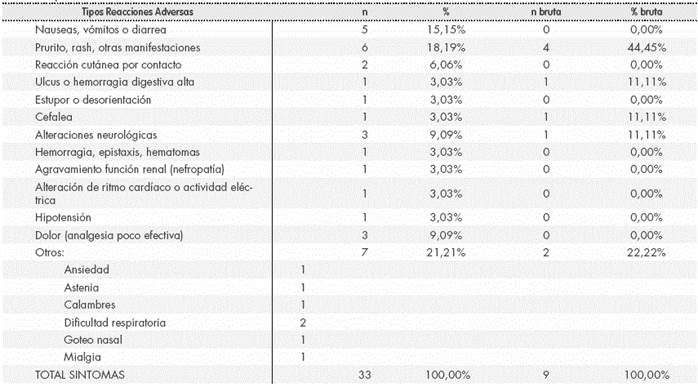
Los tipos de RAM estaban completamente codificados en 14 casos (66,7%), pero eran incompletos en el resto de ellos (Tabla 5).
Discusión
Hasta 2014 el número de notificaciones en SINEA fue reducido. La inclusión de un objetivo mínimo de notificaciones por servicio en los acuerdos de gestión ha permitido disponer de un número considerable (364 en los primeros 8 meses, objeto del estudio). El abordaje de los EA relacionados con el uso del medicamento puede realizarse desde una aproximación individual17, o desde una perspectiva colectiva que permita identificar los factores de riesgo y las características asociadas a los mismos en un grupo de pacientes. Este estudio se alineó en el segundo grupo1 aunque SINEA permite también que un equipo de revisores, a los que se envía un correo electrónico que alerta de cada nueva notificación, rastree en tiempo real la notificación de eventos centinela de forma individual (único análisis posible en años anteriores debido al bajo número de notificaciones).
El porcentaje de campos vacíos entre los 10 considerados clave que se encontró en este estudio es ligeramente superior (31,3%) al descrito por los centros de farmacovigilancia18, si bien una parte importante de la información se recuperó en el proceso de depuración de campos de texto libre. Los centros de farmacovigilancia tienen amplia experiencia en la validación de datos obtenidos por comunicación espontánea de eventos adversos. Entre un 20 y un 25%18 de todas las tarjetas amarillas requieren información adicional, que se recaba generalmente por teléfono. Esta depuración, sin embargo tiene lugar antes de la introducción de los datos en la base de datos. En un sistema de notificación voluntaria de EA evaluable localmente, sin dotación específica para depuración, es importante conocer la calidad de los datos brutos, e instaurar medidas para minimizar la necesidad de depuración manual. En este caso la calidad de los datos fue aparentemente mala, con desviaciones de hasta el 114% en algunas variables como el porcentaje de reacciones adversas identificadas antes y después de la depuración. Dado el reducido número de RAM, estas desviaciones pueden no reflejar la calidad real de los datos.
El coeficiente kappa fue propuesto originalmente por Cohen (1960) para el caso de dos evaluadores o dos métodos. Esta medida de concordancia está pensada para clasificaciones nominales, en las que no existe un orden de graduación entre las diferentes categorías, por lo que es idónea para este estudio19. Landis y Koch20 propusieron unos márgenes para valorar el grado de acuerdo en función del índice kappa, de forma que valores entre 0,4 y 0,6 indican un grado de acuerdo moderado, entre 0,6 y 0,8 bueno y entre 0,8 y 1 muy bueno.
Según estos márgenes, la concordancia obtenida en la clasificación del evento como RAM, EM o evento no relacionado con los medicamentos fue muy buena (kappa = 0,85 IC 95% 0,79-0,90), a pesar de la llamativa infraconsideración de RAM notificadas (2,7%) frente a reales (5,8%). Se evidenció la dificultad para distinguir RAM de otros eventos. La consideración de dos eventos como RAM y como EM simultáneamente permitió extraer dos conclusiones: la base de datos debería modificarse para hacer mutuamente excluyentes estas dos categorías y es necesaria una formación de los notificadores en la clasificación de eventos: una reacción anafiláctica a un medicamento puede ser considerada como reacción adversa, si no se dispone de datos que permitan anticiparla, pero se convierte en un error de medicación si se dispone de información previa sobre alergia declarada y ésta ha sido pasada por alto en el proceso de prescripción, validación y/o administración. En el caso de las RAM, por su propia definición, todas deben afectar al paciente y todos los pacientes sufren daño en mayor o menor grado, lo que debe afectar a la asistencia sanitaria. Este punto también necesita un refuerzo formativo pues el porcentaje de inconsistencias superó el 50% en ambos ítems. La categorización de un evento como RAM es relevante porque sólo cuando así sucede SINEA ofrece al final del proceso de notificación, la posibilidad de cumplimentar on-line la tarjeta amarilla para remitirla a los centros de farmacovigilancia. También se requiere mayor formación para distinguir entre EM reales y potenciales. La concordancia en este caso fue moderada-buena (kappa 0,65 IC 95% 0,54-0,76).
La depuración es un proceso costoso, realizado fundamentalmente a partir del campo de texto libre “describa_ lo_que_ pasó” que permite sin embargo disponer de abundantes datos de calidad para establecer mejoras en el proceso farmacoterapéutico. A pesar de los valores de concordancia obtenidos en las variables principales (tipo de evento adverso y tipo de error), el tedioso proceso de depuración no puede obviarse. Si no se hiciera, se perdería por ejemplo la capacidad de analizar los principios activos implicados con mayor frecuencia, ya que este campo estaba vacío o contenía errores en 133 casos (48,5%). La depuración permite conocer datos de gran importancia, como que el mayor número de errores notificados implica a la prescripción de trastuzumab, e investigar sus causas. Este error es debido a que la prescripción electrónica no permite la programación automática de diferentes dosis en diferentes ciclos, para lo que se requiere una modificación manual. Se han recomendado mecanismos de prescripción estructurados para trastuzumab y otros fármacos que también requieren una dosis de carga en el primer ciclo (cetuximab) para minimizar el riesgo de error, y se han implantado alertas en el segundo ciclo avisando de la necesidad de disminuir la dosis. La emergencia de nuevos errores, debida a la implantación de nuevas tecnologías está descrita21 y los relacionados con la prescripción electrónica22,23 son responsables de alrededor del 60% de ellos24. La literatura abunda en incidentes y alertas sobre la posibilidad de error debido a la confusión de trastuzumab con adotrastuzumab emtansina25, pero no se ha encontrado ninguno sobre errores de dosificación debido a la persistencia de las dosis de carga. Se ha demostrado26 que las variables que más influyen en la aceptación de un sistema de notificación voluntaria son la facilidad de utilización y la capacidad de extraer conclusiones que permitan aprender, y este caso es un buen ejemplo de lo segundo. Por otra parte, el gran número de errores relacionados con citostáticos se debe a que en el proceso de validación de la prescripción, el farmacéutico encargado del proceso notifica todos los errores encontrados, mientras que en otros ámbitos la notificación es menos exhaustiva. Como ya se ha comentado5, los sistemas de notificación voluntaria no sirven para establecer la prevalencia, precisamente por la ocurrencia de estos sesgos de notificación.
Los errores detectados en la introducción de fechas son subsanables a través de la recodificación siguiendo una secuencia lógica, pero sería preferible cambiar los campos de texto libre por campos fecha con el control lógico incorporado (la fecha del evento no puede ser posterior a la de notificación, por ejemplo). Se evidenció la importancia de instruir en la conveniencia de notificar la hora exacta del evento para poder hacer análisis de densidad de eventos por turnos de trabajo. Del mismo modo la utilización de una lista desplegable para categorizar al personal implicado y a quien descubrió el error se revela como una medida fácil de implantar con elevada repercusión en la facilidad de análisis.
Como conclusión se podría apuntar que parece inevitable por el momento la depuración de la base de datos antes de su análisis, y sería conveniente realizar unas sesiones prácticas formativas a los notificadores, así como introducir controles lógicos en los campos de clasificación del evento, fecha e impacto_sobre_el_paciente en el caso de RAM y transformar en campos desplegables con opciones cerradas los de quien_descubrió, categoría_ profesional y principio_ activo, aunque esta última transformación no está exenta de dificultades y habría que valorar su factibilidad.
Bibliography
Estudio Nacional sobre Efectos Adversos ligados a la Hospitalización (ENEAS). Madrid: Ministerio de Sanidad y Consumo; 2006 (citado 29 Septiembre 2014) Disponible en: http://www.errorenmedicina.anm.edu.ar/pdf/recursos/documentos/43_Estudio_ENEAS.pdf [ Links ]
Khon LT, Corrigan JM, Donaldson MS eds. To err is human: building a safer health system. Washington, DC: National Academy Press, 2000. [ Links ]
Cohen MR. Why error reporting systems should be voluntary: they provide better information for reducing errors. BMJ. 2000;320:728-9. [ Links ]
Bañeres J, Cavero E, López L, Orrego C, Suñol R. Sistemas de registro y notificación de incidentes y eventos adversos. Madrid: Ministerio de Sanidad y Consumo; 2006 (citado 10 Enero 2012) Disponible en: http://www.msc.es/organizacion/sns/planCalidadSNS [ Links ]
Jimenez Torres NV. Calidad Farmacoterapéutica. Publicaciones de la Universidad de Valencia, 2006, p 67. [ Links ]
Vargas Castrillón E. La notificación de los efectos adversos de los medicamentos. An Med Interna. 2002;19:273-4. [ Links ]
Sistemas de registro y notificación de incidentes y eventos adversos. Madrid: Ministerio de Sanidad y consumo;2010 (citado 4 Noviembre 2015) Disponible en: http://www.msssi.gob.es/organizacion/sns/planCalidadSNS/pdf/excelencia/opsc_sp3.pdf [ Links ]
Bujaldón-Querejeta N, Aznar-Saliente T, Esplá-González S, Ruíz-Darbonnéns S, Pons-Martínez L, Talens-Bolos A et al. Plan estratégico integral de seguridad en el uso de medicamentos en un departamento sanitario. Rev Calid Asist. 2014 (Citado 4 Noviembre 2015);29:43-50. [ Links ]
Generalitat valenciana. Conselleria de Sanitat. Cuidados 2.0.SINEA (Internet) (Citado 04 Noviembre 2015) Disponible en: http://cuidados20.san.gva.es/documents/16574/0/MANUAL+SINEA.pdf [ Links ]
Generalitat valenciana. Conselleria de Sanitat. Cuidados 2.0. Acuerdo de gestión 2014 (citado 04 Noviembre 2015). Disponible en: http://cuidados20.san.gva.es/documents/505369/3416745/1...AG+2014+DEPARTAMENTOS+DE+SALUD.pdf [ Links ]
Wallace MD, Anderson TJ. Approaches to interface design. Interacting with computers 1993;5:259-78. [ Links ]
Carrol JM. Creating a design science of human-computer interaction. Interacting with computers 1993;5:3-12. [ Links ]
Moritz TE, Ellis NK, Villanueva CB, Steeger JE, Ludwig ST, Deegan NI. Development of an interactive management system for capturing large volumes of data. Medical Care. 1995;33:102-6. [ Links ]
Bonillo Martín A. Sistematización del proceso de depuración de los datos en estudios con seguimientos (Tesis Doctoral en internet) Barcelona: Universidad Autónoma; 2003 (citada 04 Noviembre 2015). Disponible en: http://www.tdx.cat/bitstream/handle/10803/5481/abm1de1.pdf;jsessionid=20F1196F3D87E2DC07E37DA34CDFFD0C.tdx2?sequence=1 [ Links ]
Granero R, Domenech JM, Bonillo A. Captura de datos clínicos con verificación aleatoria: una nueva técnica para controlar y verificar la calidad del registro. Psichothema. 2001;13:166-72 [ Links ]
Graphpad software. Scientific software. Quickcalcs. (citado 04 Noviembre 2015) Disponible en: http://graphpad.com/quickcalcs/kappa2/ [ Links ]
Cohen MR, Smetzer JL. Risk analysis and treatment. En Cohen MR ed. Medication errors. Washington DC. American Pharmaceutical Association; 1999. [ Links ]
Capellà D, Laporte JR .Capitulo 8: La notificación espontánea de reacciones adversas a medicamentos. En JR Laporte y G Tognoni. Principios de epidemiología del medicamento 2 Ed. Barcelona. Mason Salvat Medicina. p147 (citado 4 Noviembre 2015) Disponible en: http://www.icf.uab.es/pem/libro.htm [ Links ]
Fleis JL.Statistical methods for rates and proportions. New York: Ed. John Wiley; 1981. [ Links ]
Landis JR, Koch GG .The measurement of the observer agreement for categorical data. Biometrics. 1977;33:159-74. [ Links ]
Berger RC, Kichak BA. Computerized physician order entry: helpful or harmful? J Am Med Inform Assoc. 2004;11:100-3. [ Links ]
Bradley VM, Steltenkamp CL, Hite KB. Evaluation of reported medication errors before and after implementation of computerized practitioner order entry. J Health Inf Manag. 2006;20:46-53. [ Links ]
Radley DC,Wasserman MR, Olsho LEW, et al. Reduction in medication errors in hospitals due to adoption of computerized provider order entry systems. J Am Med Inform Assoc. 2013;20:470-6. [ Links ]
Samaranayake NR, Cheung ST, Chui WC, Cheung BM. Technology-related medication errors in a tertiary hospital: a 5-year analysis of reported medication incidents. Int J Med Inform. 2012;81:828-33. [ Links ]
Kadcyla (adotrastuzumab emtansine): Drug Safety Communication - Potential Medication Errors Resulting from Name Confusion. FDA. (citado 4 Noviembre 2015). Disponible en: http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm350817.htm [ Links ]
Boyle TA, Scobie AC, Mackinnon NJ, Mahaffe T. Implications of process characteristics on quality-related event reporting in communit pharmacy. Res Social Admin Pharm. 2012;8:76-86. [ Links ]
Recibido: 12 de Enero de 2017; Aprobado: 24 de Febrero de 2017











 text in
text in