Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.41 no.4 Toledo jul./ago. 2017
https://dx.doi.org/10.7399/fh.2017.41.4.10742
Artículo Especial
Docetaxel en el cáncer de próstata avanzado hormonosensible; Informe de evaluación GENESIS-SEFH
Introducción
El cáncer de próstata (CP) es el tumor maligno urogenital más frecuente en hombres de edad avanzada y la segunda causa de muerte por cáncer en hombres en Europa. Se trata de un importante problema de salud, especialmente en países desarrollados, con mayor proporción de hombres de edad avanzada en la población general. En España, la incidencia y mortalidad estimada de cáncer de próstata según Globocan (año 2012) es de 27.853 nuevos casos al año (122,1 nuevos casos/100.000/año) y 5.481 muertes al año (24 muertes/100.000/año)2.
La práctica terapéutica actual considera como primera línea la hormonoterapia, con supresión androgénica mediante agonistas de la hormona liberadora de hormona luteinizante (LHRH) u orquiectomía, o bien bloqueo androgénico completo (agonista LHRH más antiandrógeno), tanto en el cáncer de próstata clínicamente localizado de alto riesgo como en el localmente avanzado o metástasico. La terapia combinada con la radioterapia se asoció consistentemente con una mejora específica de la enfermedad y la supervivencia en general, en comparación con el tratamiento de modalidad única en estudios aleatorizados en fase III3.
Los análogos de la LHRH (leuprorelina, goserelina y triptorelina) actúan reduciendo la cantidad de testosterona producida por los testículos. Al tratamiento con estos medicamentos se le denomina también castración química o castración médica. Para evitar el efecto de la exacerbación cuando éstos se administran por primera vez, la terapia antiandrógenica con flutamida o bicalutamida debe preceder o coadministrarse con el agonista de la LHRH durante al menos 7 días.
Los antagonistas de LHRH, como por ejemplo degarelix, inhiben rápida y directamente la liberación de los andrógenos, a diferencia de los agonistas, sin producir exacerbación. Por lo tanto, no requieren coadministración con un antiandrógeno. Esta terapia solo se utiliza en el caso de pacientes en los que se prevean complicaciones a corto plazo.
La combinación de radioterapia con la braquiterapia, con o sin ADT durante dos o tres años, es otra opción de tratamiento primario para pacientes de alto riesgo o localmente avanzados. No obstante, la duración óptima de la ADT en este entorno aún no está clara. La prostatectomía radical más disección de ganglios linfáticos pélvicos sigue siendo una opción en aquellos pacientes de alto riesgo que puedan beneficiarse de la cirugía y en pacientes con enfermedad localmente avanzada seleccionados, sin fijación a órganos adyacentes.
Si falla la primera línea hormonal, en ocasiones se puede intentar un segundo tratamiento hormonal: si la supresión androgénica pierde eficacia, se puede añadir un antiandrógeno a la terapia, o si lo que fracasa es el bloqueo androgénico completo, se retirará el antiandrógeno.
Si también falla esta segunda maniobra hormonal se dice que la enfermedad progresa hacia una situación conocida como carcinoma de próstata resistente a castración (CPRC). La definición de CPRC4 incluye niveles de testosterona bajo castración < 50 ng/dL y progresión bioquímica o radiológica:
- Progresión bioquímica: Niveles aumentados de antígeno prostático específico (PSA) en 3 mediciones, distanciadas al menos una semana entre sí, con 2 elevaciones superiores al 50% respecto del nadir y un PSA > 2 ng/mL;
- Progresión radiológica: Aparición o progresión de dos o más lesiones óseas o de tejidos blandos según criterios RECIST 1.1.
Recientemente se han publicado nuevas evidencias sobre el uso de docetaxel, un medicamento cuya patente ha caducado, que parecen mostrar beneficios en el contexto del paciente con cáncer de próstata hormonosensible, y que no son reflejadas en su ficha técnica5. Docetaxel en combinación con prednisona o prednisolona está indicado para el tratamiento de pacientes con cáncer de próstata hormonorefractario metastásico. Por tanto, el uso de docetaxel en esta nueva situación, sería en una indicación fuera de ficha técnica. Éste se acogería a lo establecido en el RD 1015/2009, de uso de medicamentos en situaciones especiales. Requiere el consentimiento informado del paciente y registrar dicho consentimiento en la historia clínica6.
Al igual que la introducción de docetaxel supuso un antes y un después en el tratamiento del CPRC, la introducción en el paciente hormono sensible debe considerarse como un importante avance terapéutico en el CP. Por ello, desde el grupo GENESIS-SEFH se procedió a realizar un informe de evaluación según la metodología MADRE que analizase la situación actual.
Eficacia
Los estudios que se analizaron para realizar la evaluación fueron: los ensayos clínicos CHAARTED7 y STAMPEDE8, ya que son los que aportan datos más maduros y con un mayor número de pacientes, y un metanálisis9, que incluye pacientes con estadios M0 y M1.
CHAARTED es un ensayo fase III, multicéntrico, abierto, en el que se aleatorizaron 790 pacientes con diagnóstico reciente de cáncer de próstata metastásico a recibir 6 ciclos de docetaxel más ADT o a recibir la ADT únicamente. El objetivo principal de este estudio fue determinar la supervivencia global (SG) y entre los objetivos secundarios se determinaron el tiempo hasta enfermedad resistente a la castración, el tiempo hasta progresión clínica, el tiempo hasta progresión serológica, respuesta del PSA medido a los 6 y 12 meses y la calidad de vida medida mediante el cuestionario FACT-P (Functional Assessment of Cancer Therapy-Prostate).
Se definió enfermedad metastásica de alto volumen si el paciente presentaba metástasis viscerales o ≥ 4 lesiones óseas y una de estas más allá de la columna vertebral o pelvis.
STAMPEDE es un ensayo fase III, multicéntrico, abierto y aleatorizado 2:1:1:1 en el que los pacientes recibieron, respectivamente, ADT (brazo control), ADT + ácido zoledrónico, ADT + docetaxel o ADT + docetaxel + ácido zoledrónico. Se incluyeron 2.962 pacientes recientemente diagnosticados de cáncer de próstata como metastásicos, nódulo positivo (N + ) o de alto riesgo-localmente avanzados, estos últimos siempre y cuando tuvieran al menos dos de los siguientes criterios: estadio T3/4, patrón de Gleason 8-10 o niveles de PSA ≥ 40 ng/ml. El objetivo principal del estudio fue determinar la SG y la supervivencia libre de progresión (SLP). Como objetivos secundarios se determinaron los eventos relacionados con el esqueleto y la calidad de vida medida por el cuestionario EORTC QLQ- C30 (European Organization for Research and Treatment of Cancer, quality life questionnaire).
Los resultados obtenidos en los ensayos CHAARTED y STAMPEDE se observan en la Tabla 1.
Tabla 1 Resultados de los ensayos clínicos CHAARTED y STAMPEDE

ADT: terapia de privación de andrógenos; ZA: ácido zoledrónico; DOC: docetaxel;
*Se utilizó un modelo para calcular la media truncada ajustada a los primeros 84 meses de la supervivencia libre de progresión, ya que se observó una importante evidencia de falta de proporcionalidad a lo largo de la curva con el uso del hazard ratio.
También se incluyó en la evaluación un metanálisis en el cual se buscaba ver el efecto de la adición de docetaxel y bifosfonatos a la ADT en términos de supervivencia global y supervivencia libre de progresión. Se incluyeron 7 ensayos clínicos controlados y aleatorizados de pacientes con cáncer de próstata hormono sensible de alto riesgo localizado o metastásico, en los que se comparaba docetaxel mas la terapia de cuidados estándares (hormonoterapia + /- Radioterapia) frente a la terapia estándar, de los cuales 3 eran en pacientes con estadio M1 (STAMPEDE, GETUG-15 y CHAARTED) y 4 en pacientes con estadio M0 (STAMPEDE, GETUG-12, TAX 3501 y RTOG 0521). En total, se incluían 3.206 con estadio M1 y 3.978 en pacientes con estadio M0.
También se presentan los resultados principales del metanálisis en la Tabla 2.
Tabla 2 Resultados del metaanálisis
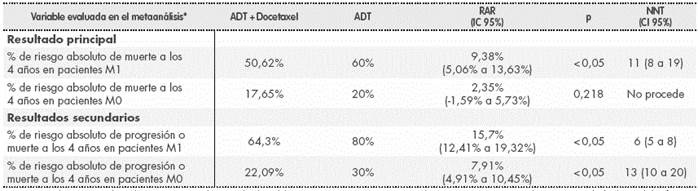
ADT: terapia de privación de andrógenos; RAR: reducción absoluta del riesgo; NNT: Número necesario de pacientes a tratar para obtener una unidad adicional de eficacia.
*Ya que no se pueden obtener las diferencias de medianas, se asume una supervivencia a los 4 años del 40% en el grupo de ADT en monoterapia. En pacientes M0 se asume un 80%. También se realiza la misma presunción en la supervivencia libre de progresión, 20% en pacientes M1 y 70% en M0.
Seguridad
Los eventos adversos relacionados con docetaxel son ampliamente conocidos y descritos en la literatura. Los eventos más comunes son: neutropenia, anemia, trombocitopenia, neuropatía sensorial periférica, neuropatía periférica motora, neutropenia febril, reacciones gastrointestinales (fatiga, diarrea, náuseas y vómitos), alopecia, reacciones cutáneas. Dentro de los más graves: reacciones de hipersensibilidad grado 4, neutropenia febril y hepatotoxicidad.
En el estudio CHAARTED el porcentaje de eventos grado 3-5 ocurrido en el brazo experimental fue de un 29% frente a un 3% en el brazo control. Los eventos más frecuentes fueron: neutropenia (12%), neutropenia febril (6%), fatiga (4%), leucopenia (5%), linfopenia (2%), reacción alérgica (2%), anemia (1%) y diarrea (1%). En la descripción del protocolo se especifica que los eventos adversos entre los pacientes del grupo control no serán documentados rutinariamente, de ahí que el porcentaje pudiese ser tan bajo.
En el estudio STAMPEDE el porcentaje de eventos grado 3-5 ocurrido en el brazo experimental ADT + docetaxel fue de un 52% frente a un 32% en el brazo control. Los eventos más frecuentes fueron: neutropenia febril (15%), neutropenia (12%), alteraciones endocrinas (10%), alteraciones gastrointestinales incluyendo diarrea, dolor abdominal, estreñimiento, vómitos (8%), alteraciones generales como astenia y fiebre (7%) y alteraciones musculo esqueléticas (6%).
Una muerte en el CHAARTED y ocho en el STAMPEDE (una por sepsis neutropénica en el brazo ADT + docetaxel y siete en el brazo de ADT + docetaxel + ácido zoledrónico, de las cuales 4 fueron por sepsis neutropénica, 1 por neumonía pneumocística, 1 por neumonitis intersticial y 1 por neumonía) pudieron estar relacionadas con docetaxel.
Aproximadamente el 86% en el grupo de intervención del estudio CHAARTED (N = 397) recibieron el tratamiento completo. De este porcentaje, aproximadamente el 74% recibieron los ciclos estipulados sin reducción de dosis alguna. En el estudio STAMPEDE, un 77% en el brazo de ADT + Docetaxel (N = 592) y un 71% en el brazo de ADT + Docetaxel + Zoledrónico (N = 593), completaron la administración de los 6 ciclos.
Las diferencias en resultados de seguridad entre ambos estudios podrían estar debidas a las diferencias en materia de población incluida en cada uno10. En ambos estudios, en el protocolo no se emitió recomendación alguna de cómo usar los factores estimulantes de colonias.
Debe tenerse en cuenta que el tratamiento con docetaxel podría implicar un detrimento en la calidad de vida de los pacientes, siendo este aspecto una clave importante a tener en cuenta a la hora de decidir la actitud terapéutica. Según datos del cuestionario de calidad de vida FACT-P recogidos en el CHAARTED, docetaxel aporta un mayor empeoramiento de la calidad de vida medida a los 3 meses desde el inicio del tratamiento. Aunque la medición que se realizó a los 12 meses arrojó unos mejores resultados que el brazo control, volviendo incluso los pacientes tratados con docetaxel a su estado basal11.
Área económica
Para el análisis económico solo se tuvieron en cuenta los costes derivados del precio de docetaxel, ya que a la terapia de referencia (terapia hormonal) se añade también el tratamiento con docetaxel. No se tuvieron en cuenta para la evaluación económica los costes indirectos asociados como podrían ser los derivados de los eventos adversos producidos o los test analíticos y/o radiológicos para el seguimiento del tratamiento quimioterápico. Para el cálculo del coste día en los medicamentos que se dosifican por Kg de peso, se toma como referencia un paciente estándar de 70 kg. Para los que se dosifican por superficie corporal, se toma como referencia un paciente estándar de 1,7 m2. El coste incremental respecto a la terapia de referencia sería de 3.196,98€.
Según los datos del estudio CHAARTED y STAMPEDE y el coste del tratamiento, por cada año de vida ganado, el coste adicional estimado es compatible con un CEI entre 2.267,36 € y 3.851,78 €. Se trataría, por tanto, de una terapia eficiente. Ver Tabla 3.
Tabla 3 Coste eficacia incremental

ADT: terapia de privación de andrógenos; SG: supervivencia global. *No se tuvieron en cuenta los costes indirectos asociados como podrían ser los derivados de los eventos adversos producidos o los test analíticos y/o radiológicos para el seguimiento del tratamiento quimioterápico.
Según el Instituto Nacional de Estadística, a Julio del 2016 la población masculina española (18-110 años) se cifra en 22.813.635 habitantes.
La incidencia de cáncer de próstata en España es de 122 casos por cada 100.000 habitantes. Si consideramos que aproximadamente el 5% de los diagnósticos de novo debutan como metastásicos. A nivel nacional, el número de pacientes candidatos a recibir docetaxel según criterios CHAARTED se podría estimar en 1.392 pacientes. Teniendo en cuenta el coste incremental de 3.196,98 € frente a la ADT en monoterapia, el impacto en España sería de 4.449.018,82 €.
Consideraciones adicionales
El comparador es el adecuado y el objetivo principal en ambos estudios es la variable de máxima relevancia clínica (supervivencia global). La diferencia de SG entre ambos estudios podría ser debida al porcentaje de pacientes no metastásicos incluidos en el estudio STAMPEDE y por tanto con mejor pronóstico de la enfermedad.
En ambos ensayos se observan diferencias estadísticamente significativas en las variables secundarias de mayor interés como la supervivencia libre de progresión o el tiempo hasta progresión clínica. Esto se muestra pese a que los pacientes incluidos tendrían posteriormente acceso a docetaxel, lo que indica un claro beneficio de adelantar el uso del fármaco a esta primera línea con ADT.
Existe duda en los pacientes sin metástasis. El estudio CHAARTED no los incluye. El estudio STAMPEDE sí, aproximadamente representan el 39% del total de los pacientes incluidos, pero los resultados no se confirman en estos pacientes, si bien es cierto que tampoco se presenta interacción significativa.
Atendiendo al análisis por subgrupos, el estudio CHAARTED, aunque presenta consistencia en todos los subgrupos, muestra interacción dudosa en el PS (ECOG). Pero con una p de interacción dudosa, aunque no desechable, en un análisis que fue pre especificado, con plausibilidad biológica, pero con inconsistencia con los resultados obtenidos en el estudio STAMPEDE, no parece que la evidencia sea suficiente para considerar que los pacientes con PS (ECOG) = 0 se beneficien menos que aquellos con PS (ECOG) = 1-2.
Por otro lado, el estudio STAMPEDE presenta consistencia en todos los subgrupos, excepto en uno de los análisis, en pacientes con enfermedad recurrente en el brazo de ADT + Docetaxel + zoledrónico, con una p significativa para interacción. Dado que el IC95% es extremadamente amplio por el bajo número de pacientes y que en el brazo de ADT + Docetaxel si existe consistencia entre enfermedad recurrente o no, en general no podemos asegurar que los pacientes con enfermedad recurrente vayan a beneficiarse de la terapia.
Es interesante consignar que la calificación de la escala Gleason no presenta interacción en ninguno de los estudios. Es decir, el aumento de supervivencia se daría tanto en pacientes con Gleason 8 o superior, como en los que tienen una puntuación inferior.
También cabe destacar en el CHAARTED que los IC95% entre los subgrupos con enfermedad de alto o bajo volumen se solapan totalmente entre sí y podríamos concluir que no existe indicio de que se comporten de forma diferente. Diríamos, por tanto, que no se encontró interacción. Al no existir interacción, el valor asignado al subgrupo de bajo volumen no debe ser otro que el del global del estudio, pues no hay evidencia de otra cosa12.
El metanálisis confirma el beneficio en supervivencia global en pacientes metastásicos. En pacientes no metastásicos, no disponemos de evidencia que nos permita suponer que el resultado es distinto, ya que no existe interacción en el análisis por subgrupos del STAMPEDE, y el metanálisis no consigue una muestra suficiente para afirmar o descartar el beneficio.
Conclusión-Posicionamiento terapéutico y condiciones de uso
A la vista de los resultados de eficacia y seguridad, el posicionamiento propuesto es considerarlo categoría D-1. Se incluye en la Guía Farmacoterapéutica con recomendaciones específicas: Adelantar el uso de docetaxel añadido a la terapia de privación de andrógenos a la primera línea del cáncer de próstata metastásico hormono sensible, independientemente del volumen metastásico, en aquellos pacientes que cumplan los criterios del estudio CHAARTED:
Diagnóstico de anatomía patológica de cáncer de próstata con evidencia radiológica de metástasis, ya sea en el contexto definido como enfermedad de alto o de bajo volumen*. Pacientes con ECOG 0, 1 o 2 con función orgánica adecuada para recibir quimioterapia.
Que no presenten neuropatía periférica > grado 1 ni historia de hipersensibilidad a docetaxel.
Sin antecedentes de enfermedades cardíacas tales como infarto de miocardio en los últimos 6 meses, angina activa o insuficiencia cardíaca congestiva.
Los pacientes con tratamiento previo con ADT cuya duración fue de 24 meses o menos y la progresión hubiese ocurrido tras 12 meses desde su finalización, podrían beneficiarse del tratamiento con docetaxel.
Los pacientes en tratamiento con ADT para enfermedad metastásica que
hayan comenzado el tratamiento en los últimos cuatro meses y sin evidencia de progresión, también podrían beneficiarse de la adición de docetaxel.
*Privar del importante beneficio en supervivencia a pacientes sin alto volumen no parece compatible con una interpretación correcta del análisis de subgrupos del estudio CHAARTED.
Se trataría de un uso fuera de ficha técnica, ya que docetaxel está indicado en cáncer de próstata metastásico “refractario a hormonas”. En consecuencia, es preceptivo el consentimiento informado y el registro de esta circunstancia en la historia clínica, tal y como se recoge en el art. 13.1 del Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales.
Bibliography
Marín R, Puigventós F, Fraga MD, Ortega A, López-Briz E, Arocas V, et al. Group for Innovation, Assessment, Standardisation and Research in the Selection of Drugs (GENESIS) of the Spanish Society of Hospital Pharmacy (SEFH). Support method for decision making in assessment and appraisal of medicines (MADRE). Version 4.0. Madrid: SEFH (ed.); 2013. Available at: http://gruposdetrabajo.sefh.es/genesis/genesis/Documents/MADRE%204_0_Procedures%20manual_Dec_2013.pdf [ Links ]
GLOBOCAN 2012. Estimated cancer incidence, mortality and prevalence worldwide in 2012. (Access February 2017). Available at: http://globocan.iarc.fr/Default.aspx [ Links ]
Malcolm D, Wendy RP, Matthew R, Brundage M, Kirkbride P, Gospodarowicz M, et al.: Final Report of the Intergroup Randomized Study of Combined Androgen Deprivation Therapy Plus Radiotherapy Versus Androgen-Deprivation Therapy Alone in Locally Advanced Prostate Cancer. J Clin Oncol. 2015;33:2143-50 [ Links ]
Guidelines EAU 2015. (Access (11/09/2016)). Available at: http://uroweb.org/wp-content/uploads/09-Prostate-Cancer_LR.pdf [ Links ]
European Public Assessment Report (EPAR): Taxotere®. (Access November 2016) Available at: http://www.ema.europa.eu/ema/ [ Links ]
RD 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales. Boletín oficial del Estado, núm. 174, Sec.I. pág. 60904. (Access November 2016) Available at: https://www.boe.es/boe/dias/2009/07/20/pdfs/BOE-A-2009-12002.pdf [ Links ]
Sweeney CJ, Chen YH, Carducci M, Liu G, Jarrard DF, Eisenberger M et al. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer. N Engl J Med. 2015; 373(8):737-46. [ Links ]
James ND, Sydes MR, Clarke NW, Mason MD, Dearnaley DP, Spears MR, et al. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet. 2016;387:1163-77. [ Links ]
Claire LV, Sarah B, Larysa HMR, Albiges L, Clarke NW, Fisher D, et al. Addition of docetaxel or bisphosphonates to standard of care in men with localized or metastatic, hormone-sensitive prostate cancer: a systematic review and meta-analyses of aggregate data. Lancet Oncol. 2016;78:243-56. [ Links ]
Omlin A, Sartor O, Rothermundt C, Cathomas R, De Bono JS, Shen L, et al. Analysis of Side Effect Profile of Alopecia, Nail Changes, Peripheral Neuropathy, and Dysgeusia in Prostate Cancer Patients Treated With Docetaxel and Cabazitaxel. ClinGenitourin Cancer. 2015;13(4):e205-8 [ Links ]
Patrick-Miller LJ, Chen Y, Carducci MA, Cella D, DiPaola RS, Gartrell BA, et al. Quality of life (QOL) analysis from E3805, chemohormonal androgen ablation randomized trial (CHAARTED) in prostate cancer (PrCa). J Clin Oncol. 2016;34(suppl 2S):286. [ Links ]
Sun X, Loannidis JP, Agoritsas T, Alba AC, Guyatt G. How to Use a Subgroup Analysis. Users’ Guides to the Medical Literature. JAMA. 2014;311(4):405-411. [ Links ]
Recibido: de 2016; Aprobado: de 2017











 texto en
texto en 


